Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Civciv Kraniyal Nöral Kret Hücre Kültürlerinin Hazırlanması ve Morfolojik Analizi
Bu Makalede
Özet
Bu çok yönlü protokol, civciv embriyolarından kraniyal nöral kıvrımların eksizyonu yoluyla göç öncesi nöral krest hücrelerinin (NCC'ler) izolasyonunu tanımlar. Kaplama ve inkübasyon üzerine, göçmen NCC'ler nöral kıvrım eksplantlarından ortaya çıkar ve basitleştirilmiş bir 2D ortamda hücre morfolojisinin ve göçünün değerlendirilmesine izin verir.
Özet
Omurgalı gelişimi sırasında, nöral krest hücreleri (NCC'ler) yoğun bir şekilde göç eder ve kraniyofasiyal iskelet ve periferik sinir sistemi gibi yapılara katkıda bulunan çeşitli hücre tiplerine farklılaşır. NCC göçünü bir 3D embriyo bağlamında anlamak kritik olsa da, 2D kültürde göçmen hücrelerin izole edilmesi, embriyonik çalışmaları tamamlayarak görselleştirmeyi ve fonksiyonel karakterizasyonu kolaylaştırır. Mevcut protokol, primer NCC kültürleri oluşturmak için civciv kraniyal nöral kıvrımlarını izole etmek için bir yöntem göstermektedir. Göçmen NCC'ler, fibronektin kaplı bir substrat üzerine kaplanmış nöral kıvrımlı eksplantlardan ortaya çıkar. Bu, boyama ve kantitatif morfolojik analizlerle değerlendirilebilen dağınık, yapışkan NCC popülasyonları ile sonuçlanır. Bu basitleştirilmiş kültür yaklaşımı son derece uyarlanabilir ve diğer tekniklerle birleştirilebilir. Örneğin, NCC göçü ve göç davranışları, hızlandırılmış görüntüleme ile değerlendirilebilir veya inhibitörler veya gen ekspresyonunun deneysel manipülasyonları (örneğin, DNA, morfolino veya CRISPR elektroporasyonu) dahil edilerek fonksiyonel olarak sorgulanabilir. Çok yönlülüğü nedeniyle, bu yöntem kraniyal NCC gelişimini araştırmak için güçlü bir sistem sağlar.
Giriş
Nöral krest hücreleri (NCC'ler) omurgalı embriyolarında geçici bir hücre popülasyonudur. NCC'ler nöral plakanın sınırlarında belirtilir ve dorsal nöral tüp1'den göç etmek için epitel-mezenkimal geçişe (EMT) uğrar. EMT'den sonra, NCC'ler embriyo boyunca yoğun bir şekilde dağılır, sonuçta kraniyofasiyal iskelet, kalbin çıkış yolu ve periferik sinir sisteminin çoğunluğu dahil olmak üzere çeşitli yapılara farklılaşır ve katkıda bulunur2. Hücre polaritesindeki, hücre iskeletindeki ve yapışma özelliklerindeki değişiklikler, bu göçmenlikten göçmen hücre popülasyonunageçişin altında yatmaktadır 3. NCC EMT ve göçün incelenmesi, hücre hareketliliğinin temel mekanizmaları hakkında fikir verir ve doğum kusurlarını ve kanser metastazını önleme ve tedavi etme çabalarını bilgilendirir.
İn vivo analiz, NCC gelişimsel süreçlerini embriyonik bir bağlamda anlamak için hayati önem taşırken, in vitro yöntemler ek deneysel yolları kolaylaştıran görsel ve fiziksel erişilebilirlik sunar. Basitleştirilmiş bir 2D ortamda, NCC morfolojisi, sitoiskelet yapıları ve göç edilen mesafe değerlendirilebilir. Ayrıca, genetik veya çözünür faktör pertürbasyonunun hareketli NCC'lerin göç davranışları üzerindeki etkileri analiz edilebilir 4,5,6,7,8,9,10. Ek olarak, izole edilmiş premigratory veya migratory NCC'ler toplanabilir, bir araya getirilebilir ve proteomik, transkriptomik ve epigenomik profilleme yoluyla NCC'lerin gelişimsel düzenlemesini incelemek için yüksek verimli metodolojiler için kullanılabilir 7,11. Çeşitli gelişimsel model organizmalardan12,13,14 kraniyal NCC'lerin hazırlanması için yöntemler mevcut olsa da, bu makale civciv embriyolarından kraniyal NCC kültürünü ilk öğrenenler için yaklaşımın mekaniğini göstermektedir.
Mevcut protokol, civciv kafatası NCC kültürlerini hazırlamak için çok yönlü bir tekniği tanımlamaktadır (Şekil 1). NCC'ler ekşi nöral kıvrımlardan bir kültür substratına kolayca göç ettiğinden, civciv NCC'ler doğal olarak embriyonik dokudan ayrılır ve birincil kültürler kolayca üretilir. Orta beyin NCC'leri kraniyal nöral kıvrımlardan toplu olarak göç ederken (gövde15'teki uzun süreli, hücre hücre delaminasyonunun aksine), bu kültürler esas olarak göçmen kraniyal nöral krest hücrelerinden oluşur ve ilk nöral kıvrım eksizyonu premigrasyon NCC'ler için bir toplama yöntemi sağlar. Civciv kraniyal nöral kıvrımlarının diseksiyonu ve kültürlenmesi için temel bir yöntem detaylandırılmıştır ve bu yöntemin farklı uygulamaları ve varyasyonları için öneriler sunulmaktadır.
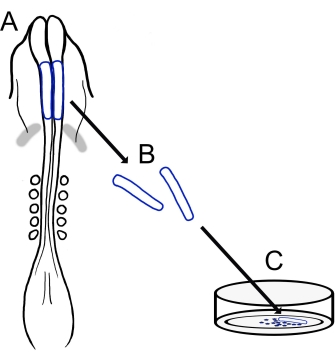
Şekil 1: Civciv kafatası nöral kıvrım kültürü protokolüne şematik genel bakış. (A,B) Kraniyal nöral kıvrımlar (mavi ile özetlenmiş) beş somitli bir civciv embriyosundan eksize edilir (A'da dorsal görünümde gösterilmiştir). Gri bantlar, kalp hilali. (C) Fibronektin üzerine kaplandığında, göçmen nöral krest hücreleri nöral kıvrımlardan ortaya çıkar ve substrat üzerine dağılır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
Beyaz Leghorn, Golden Sex Link veya Rhode Island Red dahil olmak üzere her türlü Gallus gallus ırkı kullanılabilir. Bu çalışmada kullanılan tavuk yumurtaları çeşitli ırklara aitti ve yerel çiftlikler ve kuluçkahaneler de dahil olmak üzere birçok kaynaktan elde edildi.
1. Çözeltilerin ve malzemelerin hazırlanması
- 123,3 mM NaCl, 1,53 mM CaCl 2, 4,96 mM KCl, 0,809 mM Na2 HPO 4 ve 0,147 mM KH2PO4'ü karıştırarak Ringer çözeltisini hazırlayın (bkz. PH'ı 7,4'e ayarlayın ve sterilize ederek 100 mL'lik şişelere filtreleyin. Temiz ve kuru bir yerde saklayın. Şişeleri sabunla yıkamayın (doku kültürü cam eşyası olarak kabul edilir).
- FN'yi steril Ringer çözeltisinde çözerek 1 mg / mL stok çözeltisi fibronektin (FN) hazırlayın ( Malzeme Tablosuna bakınız) ve -80 ° C'de (en az 4 yıl stabil) 100 μL alikotlarda saklayın.
- L15 ortamını% 0.8 L-glutamin,% 0.08 penisilin / streptomisin,% 10 FBS ve% 10 civciv embriyosu ekstresi12 ile destekleyerek tam kültür ortamı hazırlayın. 3 mL aliquot oluşturun ve -20 °C veya -80 °C'de saklayın.
NOT: Kültürler bir CO2 inkübatöründe inkübe edilirse, DMEM / F12'nin hava için tamponlanan L15 ile değiştirilmesi gerekir. - 1x PBS'de% 4 paraformaldehit çözeltisi hazırlayın. PH'ı 7,4'e ayarlayın. 10 mL aliquots oluşturun ve bunları -20 ° C'de saklayın.
DİKKAT: Paraformaldehit bir duman başlığında kullanılmalıdır. - Filtre kağıdı destek çerçeveleri hazırlayın (uzun eksen üzerinde üst üste binen iki veya üç delikli delikli yaklaşık 1 cm x 1,5 cm dikdörtgen kağıt).
- Standart üç delikli bir zımba kullanarak büyük bir filtre kağıdının kenarı boyunca delikler açın, delinmiş kenarı bir şerit halinde kesin / kesin ve ardından delikler arasındaki şeridi ~ 1,5 cm uzunluğunda dikdörtgenler halinde kesin. Kullanmadan önce otoklav filtre kağıtları (isteğe bağlı).
- İnce forseps, künt forseps, diseksiyon makasları, yaylı makas ve keskinleştirilmiş tungsten iğneleri dahil olmak üzere diseksiyon aletlerini toplayın16.
2. Embriyo inkübasyonu
- Döllenmiş yumurtaları yukarıda belirtilen kaynaklardan herhangi birinden elde edin.
- Döllenmiş yumurtaları dik bir konuma (yumurta dikeyinin uzun ekseni, sivri ucu aşağı/künt tarafı yukarı) nemlendirilmiş bir inkübatörün içine 38 ° C'de (100 ° F) yerleştirin.
- Dört ila yedi somit oluşana kadar kuluçkaya yatın (aşama 8 + -9)17, yaklaşık 35 saat sürer.
NOT: Kuluçka süresi, suşa, tavukların yaşına, mevsimine vb. bağlı olarak önemli ölçüde değişebilir ve deneysel olarak belirlenmelidir. Programlanabilir çıkış zamanlayıcıları, istenen zamanlamayı elde etmek için gece boyunca inkübasyonu başlatmak için kullanışlıdır. - Kuluçka makinesinden çıkardıktan sonra, yumurtaları% 70 etanol ile iyice püskürtün ve kabukları dezenfekte etmek için kurumaya bırakın.
NOT: Embriyolar hemen toplanabilir, ancak yumurtaların oda sıcaklığına soğumasına izin vermek, yumurta sarısının kırılganlığını ve toplama sırasında embriyo kaybını azaltır.
3. Kültür yemeklerinin hazırlanması
- Aşağı akış uygulaması için uygun nöral kıvrım kültürü çanaklarını seçin (bkz.
- Sabitlenecek ve lekelenecek kültürler için, çok kuyulu doku kültürü tabaklarına yerleştirilmiş cam kapaklar kullanın.
NOT: Kuyu boyutuna uyan kapaklar, sıvı karıştırma ile daha az hareket eder, bu da eksplantların kayma olasılığını azaltır ve çanak tabanı yerine kapak kaymasına yapışma olasılığını artırır. - Ters mikroskopla canlı görüntüleme için cam tabanlı tek odacıklı veya bölünmüş hazneli tabakları seçin (bkz.
- Dik veya stereo mikroskopta canlı görüntüleme için, optik olarak uygun 6, 12 veya 24 kuyu üstü doku kültürü plakaları kullanın.
- Yüksek verimli analizler için göçmen nöral krest hücrelerinin kütle toplanması için plastik doku kültürü tabaklarını seçin.
- Sabitlenecek ve lekelenecek kültürler için, çok kuyulu doku kültürü tabaklarına yerleştirilmiş cam kapaklar kullanın.
- 100 mL'lik steril Ringer çözeltisine 10 U / mL penisilin ve 10 μg / mL streptomisin ekleyin (örneğin, Ringer'ın P / S'sini yapmak için 100 μL 10.000 U / mL penisilin ve 10.000 μg / mL streptomisin). Ringer'ın P/S ürününü 1 hafta içinde kullanın.
- Buz üzerinde 1 mg / mL FN'lik bir aliquot çözün. Ringer'ın P/S değeri ile 10-100 μg/mL FN konsantrasyonuna kadar seyreltin.
- Pipet, kuyunun veya kabın dibini örtmek için yeterli FN çözeltisidir. Örneğin, 24 delikli bir plakada kuyu başına 100 μL, 35 mm'lik bir tabak için 500 μL.
- Nöral kıvrımları parçalara ayırırken kapağı ve tabakları FN çözeltisi ile nemlendirilmiş bir inkübatörde (veya damıtılmış suya batırılmış kağıt havluların bulunduğu kapalı bir tepside) 38 ° C'de (100 ° F) en az 1 saat boyunca inkübe edin.
4. Civciv embriyolarının izolasyonu
- Yumurtanın oryantasyonunu korumaya özen gösterin (embriyo kuluçka sırasında yumurta sarısının tepesine yüzer). Kabukta küçük bir delik açmak için makas veya künt forseps kullanın, yumurtanın uzunluğunun yaklaşık 1 / 4-1 / 3'ünü açın.
- Makasların veya künt forsepslerin ucunu dikkatlice küçük deliğe yerleştirin, yumurta sarısını bozmadığınızdan emin olun ve yumurta kabuğunun üstünü çıkararak yumurtanın etrafındaki yumurta kabuğunu kesin (Şekil 2A).
- Embriyoyu izolasyon için konumlandırın.
NOT: Embriyo ideal olarak kabuk kabına yerleştirilmemişse, yumurta sarısını dikkatlice çevirmek için künt forseps kullanın, böylece embriyo üstte olur. Alternatif olarak, yumurta sarısını eldivenli, kupalı bir ele dökün, sarısını kırmamaya dikkat edin ve albüminin boşalmasına izin verin (Şekil 2B). Daha sonra yumurta sarısı elden ele hareket ettirilerek embriyo konumlandırılabilir. - Embriyoyu kaplayan yumurta sarısının yüzeyinde kalan fazla albümini silmek için kapalı künt forsepslerin düz kenarını nazikçe kullanarak embriyoyu hazırlayın (Şekil 2C). Fazla albümin, hassas bir görev sileceği ile hafif bir basınç kullanılarak da çıkarılabilir.
NOT: Albümin temizlendikten sonra, yumurta sarısının yüzeyi pürüzsüz yerine dokulu görünmelidir. Yeterli albüminin silinmemesi, bölüm 4, adım 4'teki filtre kağıdı desteğinin yapışmasını engelleyecektir. - Embriyonun üzerine, embriyo çerçevenin penceresinde olacak şekilde bir filtre kağıdı destek çerçevesi yerleştirmek için forseps kullanın. Yumurta sarısına yapıştırmak için filtre kağıdına hafifçe bastırın.
- Filtre kağıdı çerçevesinin dışını diseksiyon makası ile kesin (Şekil 2D). Çerçevenin kenarını kavramak için forseps veya makas uçları kullanın ve embriyoyu yumurta sarısından yavaşça kaldırın (Şekil 2E). Bir açıyla kaldırmak, embriyonun yumurta sarısından temiz bir şekilde çıkarılmasına yardımcı olacaktır.
- Embriyoyu, kağıt çerçeve tarafı aşağı (embriyo ventral tarafı yukarı) olacak şekilde, Ringer'ın P/S ile doldurulmuş 60 mm veya 100 mm'lik bir Petri kabına yerleştirin (Şekil 2F). RNA veya proteine duyarlı bir aşağı akış uygulaması için toplanıyorsa, embriyo kabını buz üzerinde tutun.
NOT: Embriyoların ventral yana yerleştirilmemesi, onları kağıt çerçevelerinden ayırma riski taşır. Birden fazla embriyo, nöral kıvrım diseksiyon adımlarına geçmeden önce Ringer'ın P / S'sinde 1 saate kadar toplanabilir ve saklanabilir.
5. Nöral kıvrımların diseksiyonu
- Bir embriyoyu Ringer'ın P / S çözeltisini içeren temiz bir kaba aktarın ve filtre kağıdı çerçevesini forseps ile tutarak ve embriyonun görünümünü gizleyen yumurta sarısını temizlemek için hafifçe ileri geri sallayarak embriyoyu durulayın. Zil sesinin P/S'sini değiştirin veya bulutlu hale gelirse taze bir tabağa aktarın.
- Embriyo dorsal/çerçeve tarafını diseksiyon mikroskobu altında yukarı doğru konumlandırın. Embriyoyu gergin ve yerinde tutmak için kağıt çerçeve üzerinde bırakarak, nöral kıvrımları açığa çıkarmak için forseps kullanarak vitelin zarını çıkarın.
NOT: Embriyo kağıt çerçeveden düşerse, tabağa düz bir şekilde yerleştirilebilir veya diseksiyon için sylgard kaplı bir çanak18'e sabitlenebilir. - Yaylı makas veya keskinleştirilmiş bir tungsten iğne kullanarak, orta beyin nöral kıvrımlarını dikkatlice tüketin. Genişleyen optik veziküllere doku kaudalini ve eşkenar dörtgen daralmalarının yeni ortaya çıkmaya başladığı arka beyne rostral ekleyin (kalp hilali de yararlı bir göstergedir, Şekil 3B, C). Nöral kıvrımın dorsal yönünü minimal kirletici nöral tüp ve nöral olmayan ektoderm ile eksize etmeye özen gösterin (Şekil 3C).
- Nöral kıvrımları, bir P20 pipettörü veya sarısı gibi Ringer'ın P/S ile durulanmış steril, cam bir Pasteur pipeti kullanarak Ringer'ın P/S'sini içeren temiz bir kaba aktarın (bu, dokunun yapışmasını önlemek için plastik veya camı bloke eder). Ek kıvrımları parçalara ayırırken toplanan kıvrımları buz üzerinde saklayın.
6. Nöral kıvrımların kaplanması
- Tam kültür medyasının bir aliquot'unu çözün (bölüm 1, adım 3). 100 U/mL penisilin ve 100 μg/mL streptomisin ekleyin ve sterilize edin. Diğer adımları gerçekleştirirken hazır ortamları 37-38 °C'de tutun.
- Kültür tabaklarını inkübatörden çıkarın (bölüm 3, adım 5). Bir pipetör veya Pasteur pipet kullanarak FN solüsyonunu kapaklardan, tabaklardan veya kuyucuklardan çıkarın. FN kaplı substratı Ringer'ın P/S ile duruladıktan sonra, tabaklara veya kuyucuklara uygun miktarda komple kültür ortamı ekleyin (24 delikli bir tabaktaki kuyucuklar için 500 μL, 35 mm'lik bir tabak veya altı delikli bir tabak için 2 mL).
NOT: Daha küçük hacimler pahalı reaktifleri koruyabilir (örneğin, 24 delikli bir plaka için 200 μL kadar düşük), ancak kabın buharlaşmayı önlemek için yeterince nemlendirilmesini sağlar. - Bir p20 veya p200 pipetleyici kullanarak, önce pipet ucunu sarılı Ringer'ın P/S ile durulayarak plastiği bloke edin ve dokunun yapışmasını önleyin. Ardından, izole edilmiş nöral kıvrımları FN kaplı kapak kapaklarına aktarın ve mümkün olduğunca az Ringer P / S aktarmaya özen gösterin. Kıvrımları FN kaplamalı kapak kapağının ortasına doğru yerleştirin.
NOT: Bir veya birkaç nöral kıvrım, 19 mm'lik bir kuyucukta 12 mm'lik bir kapak kayması üzerine, 35 mm'lik bir plaka üzerinde 50'ye kadar kaplanabilir. - Eksplantların 10-15 dakika boyunca yerleşmesine izin verdikten sonra, kültür tabaklarını kaplamalı nöral kıvrımlarla yavaşça ve dikkatlice taşıyarak 38 ° C'de (100 ° F) nemlendirilmiş bir odaya yerleştirin. Bu, kuyucuklardaki nöral kıvrımların kaymasını en aza indirgeyerek dağınık kalmalarını ve herhangi bir kapak kaymasına yapışmalarını sağlayacaktır.
NOT: L15 (DMEM değil) kullanıldığında, eksplant kültür tabakları, nemlendirilmiş kağıt havlularla kaplı bir tepsi kullanılarak bir yumurta inkübatöründe de inkübe edilebilir. - Aktif migrasyon süresince nemlendirilmiş inkübatörde nöral kıvrım kültürlerini inkübe edin (yaklaşık 16-20 saat toplam, Şekil 4).
7. Morfolojik analiz için kültürlü göçmen NCC'lerin sabitlenmesi ve boyanması
- Kültür ortamını bir Pasteur pipetle çıkarın ve olukları, filtre ile sterilize edilmiş 1x PBS ile durulayın.
- Oda sıcaklığında 15 dakika boyunca% 4 paraformaldehit ekleyin.
NOT: Fiksasyon süresinin deneysel olarak belirlenmesi gerekebilir. Paraformaldehiti doğrudan ortama 10 dakika (50:50) eklemek, çıkarmak ve daha hassas hücresel yapıları korumak için 10 dakika boyunca seyreltilmemiş% 4 paraformaldehit ile değiştirmek de mümkündür. - Paraformaldehiti çıkarın ve 1x PBS ile üç kez durulayın.
- Morfolojik değerlendirme için uygun bir boya ile leke sabit NCC'ler. Örnek olarak, Oregon Green konjuge falloidin ile boyama burada detaylandırılmıştır.
NOT: Aktin sitoiskeletinin falloidin19 ile görselleştirilmesi, göçmen NCC'nin yapısal karmaşıklığını nispeten homojen boyama yoğunluğu ile ortaya koymaktadır; Bununla birlikte, falloidin tüm hücre alanlarını vurgulamayabilir. Plazma zarını (örneğin, buğday tohumu aglutinin veya DiI) veya sitoplazmayı etiketleyen boyalar da kullanılabilir, ancak parlak boyama yapan hücre gövdesine göre ince çıkıntıların görüntülenmesini zorlaştırır. Ek olarak, immünofloresan, nöral krest hücrelerini HNK-1 ile etiketlemek veya ilgilenilen bir proteinin hücre altı lokalizasyonunu belirlemek için eşzamanlı olarak yapılabilir 7,20.- Son PBS durulamasını çıkarın ve kapak kapaklarını örtmek için PBS +% 0.5 Triton X-100 (PBST) +% 5 serum (FBS veya bir antikor ile kostaining için uygun başka bir hayvandan) ekleyin ve oda sıcaklığında bir platform çalkalayıcıda 10 dakika boyunca inkübe edin.
- Pipet 200 nM Oregon Green konjuge falloidin (PBST + %5 serum içinde seyreltilmiş) her bir kapak kayması için pürüzsüz bir yüzeye (esnek parafin sızdırmazlık filmi gibi) yerleştirilir. 12 mm'lik bir kapak kapağı için, 30 μL'lik bir hacimde pipet yapın.
- Bir çift forseps kullanarak, kapak kaymasını PBST +% 5 serumdan çıkarın ve hücrelerin yukarı bakan yönünü korumanızı sağlayın. Fazla sıvıyı uzaklaştırmak için kapak kapağının kenarına hassas bir görev sileceğine kısaca dokunun.
- Her bir kapak kayması hücresini, seyreltilmiş falloidin damlasının üzerine yavaşça yerleştirin. Oda sıcaklığında 30 dakika inkübe edin. Boyama sırasında kapak kapaklarını karanlıkta tutun (alüminyum folyo kaplı bir tabakla örtün veya çekmeceye yerleştirin).
- Kuluçka sırasında, kültür kabının kuyularına PBST ekleyin (24 kuyucuklu bir plakanın her bir kuyucuğu için 750 μL PBST).
- Kuluçka döneminden sonra, örtüleri boyama çözeltisinden çıkarın ve tekrar kültür kabına yerleştirin, kapak kaymasını ters çevirerek hücre tarafı yukarı doğru çevirin. Kapak fişinin PBST ile kaplandığından emin olun ve 10 dakika boyunca bir platform çalkalayıcıya yerleştirin, kapak fişlerini kapalı ve karanlıkta tutun. PBST'yi çıkarın ve toplam üç 10 dakikalık yıkama için bu adımı iki kez tekrarlayın.
- Bir mikroskop slaytına bir damla (kapak kayması başına) montaj ortamı yerleştirin (bkz. 25 μL hacim, 12 mm'lik bir kapak kayması için iyi çalışır.
- PBST ile son yıkamadan sonra, fazla sıvıyı çıkarmak için kapak kapağının kenarına hassas bir görev sileceğine dokunun ve kapak kapağının hücre tarafını takip edin.
- Kabarcıklar oluşmasını önlemek için kapak kaymasını montaj ortamına bir açıyla yavaşça indirerek kapak kayması hücresini yan yana doğru monte edin. Görüntülemeden önce medyanın ayarlanmasına izin verin.
8. Kültürlü göçmen NCC'lerin morfolojik değerlendirmesi
- Lekeli hücreleri görüntüleyin ve .tiff dosyaları olarak dışa aktarın.
NOT: 40x hedefi görüntüleme kültürleri için iyi çalışır, ancak morfolojik değerlendirme için görüntü toplamak için 10x (tüm göçmen NCC alanını yakalamak için) ile 100x (tek NCC) arasında değişen hedefler kullanılabilir. Bu çalışmadaki görüntüler ters çevrilmiş multimodal görüntüleme platformu kullanılarak yakalanmıştır (bakınız Malzeme Tablosu). - Görüntüleri bir görüntü analiz yazılımına yükleyin (ImageJ21, bkz. Analiz için kullanmak üzere her görüntünün ikinci bir kopyasını oluşturmak için Resim > Çoğalt'a tıklayın, böylece çoğu görüntü işleme tersine çevrilemeyeceğinden orijinali düzenlenmemiş bırakın.
- Görüntü > > Parlaklığını / Kontrastını Ayarla'ya tıklayın ve görüntülerin parlaklığını veya kontrastını ayarlamak için kayan çubukları kullanın.
- Aşağıdaki adımları izleyerek görüntüleri gri tonlamaya dönüştürün.
- Görüntüler RGB olarak dışa aktarılırsa RGB'de birleştirilmiş bir kanal olarak yüklenir. Görüntüleri ayırmak için, tek kanallı gri tonlamalı görüntüler elde etmek üzere Görüntü > Renk > Kanalları Böl'e tıklayın.
- Görüntüler zaten ayrılmışsa, dosyayı gri tonlamaya dönüştürmek için Görüntü > Türü > 8 bit'e gidin.
- Piksellerin hücreler (ön plan; siyah) veya arka plan (beyaz) olarak tanımlandığı ikili bir görüntüye dönüştürmek için Resim > > Eşiğini Ayarla'ya tıklayın. Arka plandaki hücreleri net bir şekilde tanımlayan Eşik ayarını seçmek için kaydırma çubuğunu kullanın ve/veya Otomatik seçeneğine tıklayın.
- Hücreler üst üste biniyorsa veya lekelenme sürekli değilse, Havza veya Dolgu Delikleri işlevleri22 kullanılarak daha fazla işlem yapılması gerekebilir. Bu, hücreleri birbirinden ayıracak veya analiz edilecek hücrelerdeki boşlukları dolduracaktır. Görüntüyü önce 8 bitlik bir ikili biçime dönüştürmek için > İkili > İkili Yap'a tıklayın. Ardından İkili > Havzasını İşle veya Delikleri Doldur>a tıklayın.
NOT: Yazılım, sinyallerin ayrılması veya doldurulması gereken yerler için en uygun olanı yapar ve gerekirse eklentiler kullanılarak daha da ayarlanabilir.
- Hücreler üst üste biniyorsa veya lekelenme sürekli değilse, Havza veya Dolgu Delikleri işlevleri22 kullanılarak daha fazla işlem yapılması gerekebilir. Bu, hücreleri birbirinden ayıracak veya analiz edilecek hücrelerdeki boşlukları dolduracaktır. Görüntüyü önce 8 bitlik bir ikili biçime dönüştürmek için > İkili > İkili Yap'a tıklayın. Ardından İkili > Havzasını İşle veya Delikleri Doldur>a tıklayın.
- Yakalanacak ölçümleri seçin. Ölçümleri Analiz > Ayarla'ya tıklayın ve Döngüsellik (Dairesel), En Boy Oranı (AR), Yuvarlaklık (Yuvarlak) ve Sağlamlık analizi için Şekil Tanımlayıcıları kutularını işaretleyin.
NOT: Gerekli analiz türüne bağlı olarak Alan ve Çevre gibi diğer ölçümler de dahil edilebilir. - Parçacıkları Analiz Et > Analiz Et'e tıklayın ve parametreleri " Parçacıkları Analiz Et" menüsünden ayarlayın.
- "Boyut" altında, ilgilenilen hücrelerin veya parçacıkların piksel cinsinden ne kadar büyük olduğunu kabaca tahmin edin, çünkü Boyut parametresi 0-Sonsuzluk'ta (örneğin, Şekil 5'te 500-Sonsuz olarak ayarlanmış) kalırsa, arka plan sinyali veya daha küçük hücre kalıntıları da dahil edilecektir.
NOT: Boyut'u daha dar bir aralığa ayarlamak, analiz için gerekli olanlardan daha küçük veya daha büyük parçacıkları hariç tutabilir. - "Dairesellik" altında, görüntüdeki tüm hücre şekillerini ölçmek için 0-1.0'da bırakın.
- "Göster" altında, " Parçacıkları Analiz Et " işleviyle seçilen hücre anahatlarını incelemek için açılır menüden Çıplak Anahatlar'ı seçin. Çakışan hücrelerin ayırt edildiğinden emin olmak için anahatları tarayın, ancak hücreler gereksiz yere bölünmez. Ayrıca, "Sonuçları Görüntüle", "Özetle" ve "Yöneticiye Ekle" menü kutularını işaretleyin.
- "Boyut" altında, ilgilenilen hücrelerin veya parçacıkların piksel cinsinden ne kadar büyük olduğunu kabaca tahmin edin, çünkü Boyut parametresi 0-Sonsuzluk'ta (örneğin, Şekil 5'te 500-Sonsuz olarak ayarlanmış) kalırsa, arka plan sinyali veya daha küçük hücre kalıntıları da dahil edilecektir.
- Tüm parametreler ayarlandıktan sonra, Tamam'a tıklayın.
NOT: (1) resimde tanımlanan hücrelerin çıplak ana hatlarını, (2) görüntüde sayılan hücreleri, (3) her hücrenin ölçümlerinin sonuçlarını ve (4) sayılan toplam hücre sayısının ve bunların ortalama ölçümlerinin bir özetini gösteren dört ayrı pencere açılır.- Enkaz sayılırsa, üst üste binen hücreler bir olarak sayılır, tek hücreler katlar olarak sayılır veya sayımdan birçok hücre çıkarılır, orijinal, düzenlenmemiş görüntüye geri döner, başka bir kopya oluşturur ve "Eşik" veya diğer parametreleri ayarlar.
Sonuçlar
Mevcut protokole genel bir bakış Şekil 1'de gösterilmiştir. Kuluçkaya yatırılan yumurtalar açıldı ve yumurta sarısı, embriyo yüzeyde olacak şekilde, eldivenli bir elin avucuna hafifçe dökülerek izole edildi (Şekil 2A, B). Albümin temizlendikten sonra (Şekil 2C), embriyonun sarıdan kesilmesini ve kaldırılmasını kolaylaştırmak için embriyoyu çevreleyen yumurta sarısı zarına filtre kağ...
Tartışmalar
Burada açıklanan teknik, civciv nöral kıvrımlarını izole etmek ve göçmen kraniyal NCC'lerin kültürlerini oluşturmak için bunları kaplamak için uyarlanabilir bir yöntem sağlar. Bu kültürler, civciv NCC migrasyonunun ve morfolojisinin kolay analizi için basitleştirilmiş 2D koşullar sağlar ve bu da ovo görüntüleme yöntemlerinde teknik olarak daha zorluolabilir 24,25,26. Bu in vitro yön...
Açıklamalar
Yazarların çıkar çatışması yoktur.
Teşekkürler
Civciv kafatası nöral kıvrım kültürü protokolümüzün versiyonunun geliştirilmesine katılan Corinne A. Fairchild ve Katie L. Vermillion'a teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AxioObserver equipped with an LSM710 confocal scan head controlled by ZEN 3.0 SR software | Zeiss | Used alpha Plan-Apochromat 100x/1.46 Oil DIC M27 objective | |
| CaCl2 | Sigma-Aldrich | C3306 | |
| Chamber dishes (glass bottom, single or divided) | MatTek; Cell Vis | P35G-1.5-14-C (MatTek) X000NOJQGX (Cellvis) X000NOK1OJ (Cellvis) | Single chamber 35 mm or 4 chamber 35 mm |
| Cover glass | Carolina Biological Supply Company | 633029, 633031, 633033, 633035, 633037 | circles, 0.13–0.17 mm thickness, available in 12-25 mm diameter |
| DMEM/F12 | ThermoFisher Scientific | 11320033 | Alternative for L15 media |
| Egg incubator | Sportsman | 1502 | |
| FBS | Life Technologies | 10437-028 | |
| Fibronectin | Fisher Scientific | CB-40008A | |
| Filter paper | Whatman | grade 3MM chromatography | |
| Forceps (blunt) | Fisher Scientific; Thomas Scientific | 08-890 (Fisher);1141W97 (Thomas) | |
| Forceps (fine) | Fine Science Tools | 11252-20 | Dumont #5 |
| Image J | https://fiji.sc/ | Free image analysis software | |
| KCl | Sigma-Aldrich | P3911 | |
| KH2PO4 | Sigma-Aldrich | P0662 | |
| L15 media | Invitrogen | 11415064 | |
| L-glutamine | Invitrogen | 25030 | |
| Mounting Media (Vectashield or ProLong Gold) | Vector Laboratories; Thermofisher Scientific | H-1700 (Vectashield); P36930 (ProLong Gold) | |
| Na2HPO4 | Sigma-Aldrich | S9638 | |
| NaCl | Sigma-Aldrich | S9888 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Penicillin/streptomycin | Life Technologies | 15140-148 | 10,000 Units/mL Penicillin; 10,000 mg/mL Streptomycin |
| Petri Dishes | VWR (or similar) | 60 mm, 100 mm | |
| Phalloidin | Sigma-Aldrich | P1951 | multiple flurophores available |
| Pin holder | Fine Science Tools | 26016-12 | For tungsten needle (alternative for spring scissors) |
| Scissors (dissection) | Fine Science Tools | 14061-10 | |
| Spring Scissors | Fine Science Tools | 15000-08 | 2.5 mm cutting edge (alternative for tungsten needle) |
| Sylgard | Krayden | Sylgard 184 | |
| Syringe Filters | Sigma-Aldrich | SLGVM33RS | Millex-GV Syringe Filter Unit, 0.22 µm, PVDF, 33 mm, gamma sterilized |
| Tissue culture dishes | Sarstedt | 83-3900 | 35 mm culture dishes for bulk neural fold cultures |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Tungsten wire | Variety of sources | 0.01" diameter for tungsten needle (alternative for spring scissors) |
Referanslar
- Pla, P., Monsoro-Burq, A. H. The neural border: Induction, specification and maturation of the territory that generates neural crest cells. Developmental Biology. 444, 36-46 (2018).
- Tang, W., Bronner, M. E. Neural crest lineage analysis: From past to future trajectory. Development. 147 (20), (2021).
- Piacentino, M. L., Li, Y., Bronner, M. E. Epithelial-to-mesenchymal transition and different migration strategies as viewed from the neural crest. Current Opinion in Cell Biology. 66, 43-50 (2020).
- McLennan, R., et al. Neural crest cells bulldoze through the microenvironment using Aquaporin 1 to stabilize filopodia. Development. 147 (1), 185231 (2020).
- Carmona-Fontaine, C., et al. Complement fragment C3a controls mutual cell attraction during collective cell migration. Developmental Cell. 21 (6), 1026-1037 (2011).
- Giovannone, D., et al. Slits affect the timely migration of neural crest cells via robo receptor. Developmental Dynamics. 241 (8), 1274-1288 (2012).
- Vermillion, K. L., Lidberg, K. A., Gammill, L. S. Cytoplasmic protein methylation is essential for neural crest migration. Journal of Cell Biology. 204 (1), 95-109 (2014).
- Yang, X., Li, J., Zeng, W., Li, C., Mao, B. Elongator Protein 3 (Elp3) stabilizes Snail1 and regulates neural crest migration in Xenopus. Scientific Reports. 6 (1), 1-9 (2016).
- Gonzalez Malagon, S. G., et al. Glycogen synthase kinase 3 controls migration of the neural crest lineage in mouse and Xenopus. Nature Communications. 9 (1), 1-15 (2018).
- Bhattacharya, D., Azambuja, A. P., Simoes-Costa, M. Metabolic reprogramming promotes neural crest migration via yap/tead signaling. Developmental Cell. 53 (2), 199-211 (2020).
- Jacques-Fricke, B. T., et al. Profiling NSD3-dependent neural crest gene expression reveals known and novel candidate regulatory factors. Developmental Biology. 475, 118-130 (2021).
- Bronner-Fraser, M., García-Castro, M. Chapter 4 manipulations of neural crest cells or their migratory pathways. Methods in Cell Biology. 87, 75-96 (2008).
- Milet, C., Monsoro-Burq, A. H. Dissection of xenopus laevis neural crest for in vitro explant culture or in vivo transplantation. Journal of Visualized Experiments. (85), e51118 (2014).
- Malagon, S. G. G., et al. Dissection, culture and analysis of primary cranial neural crest cells from mouse for the study of neural crest cell delamination and migration. Journal of Visualized Experiments. (152), e60051 (2019).
- Theveneau, E., Mayor, R. Neural crest delamination and migration: From epithelium-to-mesenchyme transition to collective cell migration. Developmental Biology. 366 (1), 34-54 (2012).
- Conrad, G. W., Bee, J. A., Roche, S. M., Teillet, M. A. Fabrication of microscalpels by electrolysis of tungsten wire in a meniscus. Journal of Neuroscience Methods. 50 (1), 123-127 (1993).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. Journal of Morphology. 88 (1), 49-92 (1951).
- Gammill, L. S., Jacques-Fricke, B., Roffers-Agarwal, J. Embryological and genetic manipulation of chick development. Methods in Molecular Biology. 1920, 75-97 (2019).
- Vandekerckhove, J., Deboben, A., Nassal, M., Wieland, T. The phalloidin binding site of F-actin. The EMBO Journal. 4 (11), 2815-2818 (1985).
- Bronner-Fraser, M. Analysis of the early stages of trunk neural crest migration in avian embryos using monoclonal antibody HNK-1. Developmental Biology. 115 (1), 44-55 (1986).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Soille, P., Vincent, L. Determining watersheds in digital pictures via flooding simulations. Visual Communications and Image Processing '90: Fifth in a Series. (1360), 240-250 (1990).
- Haupt, A., Minc, N. How cells sense their own shape - mechanisms to probe cell geometry and their implications in cellular organization and function. Journal of Cell Science. 131 (6), (2018).
- Ezin, M., Fraser, S. Chapter 11 time-lapse imaging of the early avian embryo. Methods in Cell Biology. 87, 211-236 (2008).
- Kulesa, P. M., Bailey, C. M., Cooper, C., Fraser, S. E. In ovo live imaging of avian embryos. Cold Spring Harbor Protocols. 5 (6), (2010).
- McKinney, M. C., Kulesa, P. M. Live imaging of the neural crest cell epithelial-to-mesenchymal transition in the chick embryo. Methods in Molecular Biology. 2179, 107-114 (2021).
- Gustafson, C. M., Roffers-Agarwal, J., Gammill, L. S. Chick cranial neural crest cells release extracellular vesicles that are critical for their migration. Journal of Cell Science. , (2022).
- Williams, R., Sauka-Spengler, T. Ex ovo electroporation of early chicken embryos. STAR Protocols. 2 (2), 100424 (2021).
- Moulton, J. D. Using morpholinos to control gene expression. Current Protocols in Nucleic Acid Chemistry. 68 (1), 4-30 (2017).
- Gandhi, S., et al. A single-plasmid approach for genome editing coupled with long-term lineage analysis in chick embryos. Development. 148 (7), (2021).
- Williams, R. M., et al. Reconstruction of the Global Neural Crest Gene Regulatory Network In Vivo. Developmental Cell. 51 (2), 255-267 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır