Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Septinlerin Ultrayapısal Organizasyonunu, Membran Yeniden Şekillendirmesini ve Eğrilik Duyarlılığı Davranışını Analiz Etmek için Aşağıdan Yukarıya In Vitro Yöntemler
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Septinler sitoiskelet proteinleridir. Lipid membranlarla etkileşime girerler ve mikron ölçeğinde membran eğriliğini algılayabilir ancak aynı zamanda üretebilirler. Bu protokolde membran deformasyonlarını, eğriliğe duyarlı septin bağlanmasını ve septin filament ultrayapısını analiz etmek için aşağıdan yukarıya in vitro metodolojileri tanımladık.
Özet
Membran yeniden şekillenmesi plazma zarında ve hücresel organellerde sürekli olarak gerçekleşir. Çevrenin rolünü (iyonik koşullar, protein ve lipit bileşimleri, membran eğriliği) ve spesifik membran yeniden şekillendirme süreçleriyle ilişkili farklı ortakları tam olarak incelemek için, in vitro aşağıdan yukarıya yaklaşımlar benimsiyoruz. Son yıllarda, septin proteinlerinin büyük hastalıklarla ilişkili rolünü ortaya çıkarmaya büyük ilgi duyulmaktadır. Septinler, plazma zarı ile etkileşime giren esansiyel ve her yerde bulunan sitoiskelet proteinleridir. Diğer fonksiyonların yanı sıra hücre bölünmesi, hücre hareketliliği, nöro-morfogenez ve spermiogenezde rol oynarlar. Bu nedenle, septinlerin membranlarda nasıl etkileşime girdiğini ve daha sonra membran deformasyonlarını indüklemek için nasıl organize olduklarını ve spesifik membran eğriliklerine nasıl duyarlı olabileceklerini anlamak önemlidir. Bu makale, septinlerin moleküler düzeyde ultra yapısı ile mikron ölçeğinde meydana gelen membran yeniden şekillenmesi arasındaki etkileşimi deşifre etmeyi amaçlamaktadır. Bu amaçla, tomurcuklanan maya ve memeli septin kompleksleri rekombinant olarak eksprese edildi ve saflaştırıldı. Daha sonra membrandaki septinlerin kendi kendine montajını analiz etmek için in vitro testlerin bir kombinasyonu kullanıldı. Desteklenen lipit çift katmanları (SLB'ler), dev unilamellar veziküller (GUV'lar), büyük unilamellar veziküller (LUV'ler) ve dalgalı substratlar, septinin kendi kendine montajı, membran yeniden şekillendirme ve membran eğriliği arasındaki etkileşimi incelemek için kullanıldı.
Giriş
Septinler, lipid membranları ile etkileşime giren sitoiskelet filament oluşturan proteinlerdir. Septinler ökaryotlarda her yerde bulunur ve çok sayıda hücresel fonksiyon için gereklidir. Tomurcuklanan maya ve memelilerde hücre bölünmesinin ana düzenleyicileri olarak tanımlanmışlardır 1,2. Membran yeniden şekillendirme olaylarında, siliyogenez3'te ve spermiyogenez4'te rol oynarlar. Memeli hücrelerinde, septinler ayrıca Rho GTPazların (BORG) bağımlı bir şekilde 8 bağlayıcısında aktin ve mikrotübüller5,6,7 ile etkileşime girebilir. Çeşitli dokularda (nöronlar9, kirpikler3, spermatozoa10), septinler membrana bağlı bileşenler için difüzyon bariyerlerinin düzenleyicileri olarak tanımlanmıştır11. Septinlerin ayrıca membran ağartmasını ve çıkıntı oluşumunu düzenlediği gösterilmiştir12. Çok görevli proteinler olan septinler, çeşitli yaygın hastalıkların ortaya çıkmasında rol oynar13. Yanlış düzenlemeleri, kanserlerinortaya çıkması ile ilişkilidir 14 ve nörodejeneratif hastalıklar15.
Organizmaya bağlı olarak, birkaç septin alt birimi (Caenorhabditis elegans'ta iki, insanlarda 13'e kadar), organizasyonu dokuya bağımlı bir şekilde değişen kompleksler oluşturmak için bir araya gelir16. Temel septin yapı bloğu, iki kopya halinde bulunan ve çubuk benzeri palindromik bir şekilde kendiliğinden monte edilen iki ila dört alt birim toplar. Tomurcuklanan mayada, septinler oktamerik 17,18'dir. In situ, septinler genellikle mikrometre eğriliği olan bölgelerde lokalizedir; bölünme daralma bölgelerinde, kirpik ve dendritlerin tabanında ve spermatozoa anulusundabulunurlar 19,20. Membranda, septinlerin rolü ikili görünmektedir: lipid çift katmanının yeniden şekillendirilmesinde ve membran bütünlüğünün korunmasında rol oynarlar21. Bu nedenle, septin filament oluşturan proteinlerin ve / veya membrandaki alt birimlerin biyofiziksel özelliklerinin araştırılması, rollerini anlamak için çok önemlidir. İyi kontrol edilen bir ortamda septinlerin spesifik özelliklerini incelemek için, aşağıdan yukarıya in vitro yaklaşımlar uygundur. Şimdiye kadar, sadece birkaç grup septinlerin in vitro20,22,23 biyofiziksel özelliklerini tanımlamıştır. Bu nedenle, diğer sitoiskelet filamentleri ile karşılaştırıldığında, septinlerin in vitro davranışı hakkındaki mevcut bilgiler sınırlı kalmaktadır.
Bu protokol, septin filamentlerinin organizasyonunun, membran yeniden şekillendirmenin ve eğrilik duyarlılığının nasıl analiz edilebileceğini açıklar19. Bu amaçla, optik ve elektron mikroskobu yöntemlerinin bir kombinasyonu (floresan mikroskobu, kriyo-elektron mikroskobu [kriyo-EM] ve taramalı elektron mikroskobu [SEM]) kullanılmıştır. Mikrometre boyutundaki dev unilamellar veziküllerin (GUV'ler) membran yeniden şekillendirilmesi, floresan optik mikroskopi kullanılarak görselleştirilir. Lipid veziküllerine bağlı septin filamentlerinin düzenlenmesi ve ultrayapısının analizi kriyo-EM kullanılarak gerçekleştirilir. Septin eğrilik duyarlılığının analizi, hem pozitif hem de negatif eğrilikler için eğrilik duyarlılığının analizini sağlayan, değişken eğriliklerin dalgalı substratları üzerinde biriken katı destekli lipit çift katmanlarına bağlı septin filamentlerinin davranışını inceleyerek SEM kullanılarak gerçekleştirilir. Önceki analiz20,24 ile karşılaştırıldığında, burada, septinlerin kendi kendine nasıl birleşebileceğini, membranı sinerjik olarak deforme edebileceğini ve eğriliğe duyarlı olabileceğini kapsamlı bir şekilde analiz etmek için bir yöntem kombinasyonu kullanmayı öneriyoruz. Bu protokolün, membranlar için bir afinite gösteren herhangi bir filamentli proteine yararlı ve uyarlanabilir olduğuna inanılmaktadır.
Protokol
1. Dev unilamellar veziküller (GUV'ler) kullanılarak membran yeniden şekillendirmenin belirlenmesi
NOT: Bu bölümde, hücresel bağlamda septinler tarafından indüklenmesi muhtemel membran deformasyonlarını taklit etmek için GUV'lar üretilmektedir. Gerçekten de, hücrelerde, septinler sıklıkla mikrometre eğrilikleri olan bölgelerde bulunur. GUV'lar birkaç ila onlarca mikrometre arasında değişen boyutlara sahiptir ve deforme olabilir. Bu nedenle, mikrometre ölçeğinde septin kaynaklı deformasyonları analiz etmek için uygundurlar. Floresan lipitlerin yanı sıra floresan etiketli septinler (Yeşil Floresan Protein [GFP] kullanılarak), floresan mikroskobu yoluyla hem lipitlerin hem de proteinlerin davranışını takip etmek için kullanılır.
- Tamponların ve çözeltilerin hazırlanması
- GUV büyüme tamponunu (50 mM NaCl, 50 mM sakkaroz ve 10 mM Tris [pH = 7,8]) ve gözlem tamponunu (75 mM NaCl ve 10 mM Tris [pH = 7,8]) hazırlayın.
- Gözlem ve büyüme tamponlarının ozmolaritesini ölçün (ticari bir ozmometre kullanarak) ve ayarlayın (170 mOsmol· L-1, teoride) kendi ozmolariteleri eşit olana kadar az miktarda NaCl ekleyerek. Arabellekleri 0,2 μm filtre kullanarak filtreleyin. Büyüme tamponunu alıkoyun ve daha fazla kullanım için -20 ° C'de saklayın. Gözlem tamponunu 4 °C'de saklayın.
NOT: Her iki tampon arasındaki ozmolarite farkı %5'i geçmemelidir. - Gözlem tamponunda 5 mg · mL-1 β-kazein çözeltisi hazırlayın. Tam çözünmeyi sağlayın (manyetik karıştırma ile 4 ° C'de birkaç saat sonra). Çözeltiyi 0,2 μm filtre, aliquot ile filtreleyin ve -20 ° C'de saklayın.
- Lipid karışımlarını kloroformda toplam 3 mg · mL-1 lipid konsantrasyonunda hazırlayın. Protein-lipid etkileşimlerini arttırmak ve PI(4,5)P 2 25'in dahil edilmesini desteklemek için% 56.8 Yumurta L-α-fosfatidilkolin (EggPC),% 10 1,2-dioleoyl-sn-glycero-3-fosfoethanolamine (DOPE),% 10-1,2-dioleoyl-sn-glycero-3-phospho-L-serin (DOPS),% 8 beyin L-α-fosfatidilinositol-4,5-bisfosfat (PI (4,5)P2) ve% 0,2 Bodipy-TR-Seramid bileşimini (mol)kullanın.
NOT: Kloroformu nitril eldivenler ve güvenlik gözlükleri kullanarak duman başlığının altında tutun. Cam şırıngalarla pipet kloroform çözeltileri ve kloroform plastiği çözdüğü için plastikten kaçının. Kullanmadan önce ve sonra, şırıngaları kloroform 5x-10x pipetleyerek durulayın. Çapraz kontaminasyonu önlemek üzere spesifik floresan lipitleri pipetlemek için ayrı şırıngalar kullanın. Lipitler, Teflon ile kaplanmış amber cam bir şişede -20 ° C'de kloroform içinde saklanabilir. Şişeler kapanmadan önce argon ile doldurulmalı ve herhangi bir lipit oksidasyonunu önlemek için parafilm ile kapatılmalıdır. - Platin teller kurulumu kullanılarak GUV'ların elektro-oluşumu
NOT: Şekil 1 , deneysel adımların şemasını ve odanın bir resmini sunmaktadır.- Lipid kalıntılarını gidermek için odacığı ve platin telleri aşağıdaki gibi iyice temizleyin.
- Telleri ve odayı asetona daldırın ve 10 dakika boyunca sonikleştirin. Aseton kullanarak bir kağıt mendille dikkatlice silin.
- Telleri yerleştirerek odayı monte edin, tekrar asetona dalın ve 10 dakika boyunca sonikasyon yapın. Tellerin tamamen temizlendiğinden emin olarak bir kez daha asetonla silin. Odayı etanol içine daldırın, 10 dakika boyunca sonikasyon yapın ve etanol ile silin.
- Son olarak, odayı deiyonize suya batırın, 10 dakika boyunca sonikatın ve bir azot veya hava akımı ile kurulayın.
NOT: Teflon odası (Şekil 1B) şirket içi atölyede özel olarak üretilmiştir. Cam kapaklar kullanılarak her iki tarafa da kapatılabilen üç bölme barındırır. Platin teller, 1,3 mm çaplı deliklerden odaya yerleştirilebilir. - Odayı temizledikten sonra, her platin tel üzerinde 3 mg · mL-1 lipit karışımının bölmesi başına 3-4 damla (her damla yaklaşık 0.1 μL'dir) biriktirin. Telleri 180 ° çevirin ve her platin telin karşı tarafında bölme başına 3-4 lipit damlacığı biriktirin. Damlaların birbirine temas etmediğinden emin olun. Tüm oda başına yaklaşık 5 μL lipit karışımı gereklidir.
- Herhangi bir kloroform izini çıkarmak için büyüme odasını 30 dakika boyunca bir vakum odasına yerleştirin.
NOT: Derin vakum (0,1 mbar) en iyisidir. Kurutulduğunda, lipitler oksidasyona karşı savunmasızdır ve bu nedenle birkaç dakikadan fazla havada bırakılmamalıdır. - Yüksek vakumlu gresi haznenin dibinde (tellere en yakın taraf) bir şırınga kullanarak üç bölmenin çevresi boyunca biriktirin ve mükemmel sızdırmazlık sağlamak için grese karşı temiz (22 mm x 40 mm) bir kapak kaymasına basın. Odanın her iki ekstremitesini (yani, tellerin giriş / çıkış bölgelerinde) sızdırmazlık macunu (balmumu plakaları) kullanarak kapatın. Benzer şekilde, odanın diğer tarafına vakum gresi uygulayın.
- Pipet kullanarak bölmeleri büyüme tamponuyla (oda başına ~1 mL) doldurun. Lipit filminin tellerden ayrılmasını önlemek için çözeltiyi çok hızlı veya kuvvetli bir şekilde karıştırmayın. Haznenin üst kısmını, grese bastırarak 22 mm x 40 mm'lik bir kapak kayması kullanarak hermetik olarak kapatın. Hava kabarcıklarının oluşumunu önlemek için, cam kapak kaymasını merkezden kenarlara doğru hafifçe bastırın.
- Odayı 4 °C'lik bir buzdolabına yerleştirin ve kabloları bir dalga fonksiyonu jeneratörüne bağlayın (500 Hz'de sinüs fonksiyonu). Beber ve ark.25 tarafından yapılan bir çalışmada daha önce sunulduğu ve optimize edildiği gibi, daha kısa bir büyüme süresi (yani, 6 saat) için 350 mV veya daha uzun bir büyüme süresi (yani, 12-16 saat) için 250 mV'luk etkili bir voltaj ayarlayın.
- Kapak kapaklarını çıkarın, sızdırmazlık maddesini ve gresi silin ve telleri çıkarın. Odayı dönüşümlü olarak su ve etanol (≥% 70) kullanarak bir kağıt mendille yıkayın ve fırçalayın.
NOT: GUV büyümesi için optimum voltaj ve zaman ölçeği, tampon tuzu konsantrasyonundan oda geometrisine (yani, teller ve oda boyutu arasındaki mesafeye) kadar birçok parametreye bağlıdır. Tekrarlanabilirliği sağlamak için deney her tekrarlandığında aynı odayı kullanın. Teller odanın dibine yakındır, böylece lipitler floresan mikroskopi kullanılarak görüntülenebilir. Elektro-oluşum sürecinin başarılı olduğundan emin olmak için lipitleri her adımda görüntüleyin (bkz. Şekil 1C, D).
- Veziküllerle septin inkübasyonu
- Tellere yakın bir yere getirilen önceden kesilmiş pipet uçlarını (~ 1 mm açıklık) kullanarak tellerden GUV'ları toplayın. Ardından, çözeltiyi tel boyunca pipetleyin. Bu prosedür, GUV'ları bozabilecek güçlü lamel akışların oluşmasını önler. Bu adımın ardından, pipet uçlarının kesilmesi artık gerekli değildir. Gerçekten de, lamel akışlar çözeltideki GUV'lara zarar vermez.
NOT: Lipid karışımında PI(4,5)P2 bulunması nedeniyle, toplanan GUV'lar deneyden önce en fazla 2-3 saat saklanmalıdır. Gerçekten de, PI (4,5) P2 hızla çözünür ve septinler oluşumlarından birkaç saat sonra membranlara artık bağlanmaz. Bununla birlikte, septinler zara bağlandıktan sonra, birkaç gün boyunca bağlı kalırlar. - Septinlerin stok çözeltisini Tris 10 mM'de (pH 8) seyreltin, sadece büyüme tamponununkine eşit bir ozmolariteye ulaşmak için; Gerekirse, septin çözeltisini gözlem tamponunda daha fazla seyreltin. Toplanan GUV'ların amaçlanan hacmini ekleyin (toplam 200 μL hacim için 50-100 μL). β-kazein ile pasivasyondan sonra inkübasyonu doğrudan gözlem odasında gerçekleştirin (aşağıya bakınız). Dengeye ulaşmak için 20-30 dk bekleme süresi gereklidir.
NOT: Septin oktamerik komplekslerinin (insan veya tomurcuklanan mayalar) ifadesi ve saflaştırılması diğer madde17'de kapsamlı bir şekilde tanımlanmıştır. Kısaca, septinler Escherichia coli'de eksprese edildi, laboratuarda afinite, boyut dışlama ve iyon değişim kromatografisi adımları kullanılarak saflaştırıldı ve -80 ° C'de 50 mM Tris-HCl (pH 8), 300 mM KCl ve 5 mM MgCl2'lik sulu bir çözeltide ~ 1 mg · mL-1 (3 μM) konsantrasyonunda saklandı. Septin agregasyonunu önlemek için yüksek tuz konsantrasyonu kullanılır. Septin kompleksleri, agregasyonu indükleyen ve böylece protein verimini azaltan bir filtre santrifüj cihazı ile konsantre edilmemelidir.
- Tellere yakın bir yere getirilen önceden kesilmiş pipet uçlarını (~ 1 mm açıklık) kullanarak tellerden GUV'ları toplayın. Ardından, çözeltiyi tel boyunca pipetleyin. Bu prosedür, GUV'ları bozabilecek güçlü lamel akışların oluşmasını önler. Bu adımın ardından, pipet uçlarının kesilmesi artık gerekli değildir. Gerçekten de, lamel akışlar çözeltideki GUV'lara zarar vermez.
- Konfokal ve/veya dönen disk mikroskobu ile görüntüleme
- GUV'ların yüzeye yapışmasını ve / veya patlamasını önlemek için, gözlem odasını 30 dakika boyunca 5 mg · mL-1 β kazein çözeltisi ile inkübe ederek pasifleştirin.
- β kazein çözeltisini çıkarın ve septin-GUV çözeltisini (Adım 1.4.2.) bir pipet kullanarak gözlem odasına aktarın. GUV'ların tortusunu 10-15 dakika boyunca odanın dibine bırakın.
NOT: GUV'nin içi ile harici tampon arasındaki bileşim tutarsızlığı hem yoğunluk hem de kırılma indisi uyumsuzluğu yaratır. Kırılma indisi uyumsuzluğu nedeniyle, GUV'lar iletim ışığı optik mikroskopisi ile görülebilir. - Konfokal mikroskopi kullanarak, GUV'ların kalitesini ve membran lamellerite durumunu kontrol etmek için lipitlerin floresan sinyalini görselleştirin. Uygun bir kalibrasyon yaptıktan sonra septinlerin floresan sinyalini kaydederek GUV'lara bağlı septinlerin yoğunluğunu değerlendirin25. Septinler ve membran arasındaki etkileşimin neden olduğu veziküllerin 3D deformasyonlarını analiz etmek ve görselleştirmek için 0,4 μm uzamsal aralıkta Z-yığını alımları gerçekleştirin.
NOT: 60 veya 100 kat büyütmeli yağ daldırma hedefleri kullanılmıştır. Sırasıyla 250 nm ve 110 nm piksel boyutlarına sahip standart konfokal veya dönen disk mikroskopları (Malzeme Tablosu) kullanılmıştır. Görüntüleme koşullarını belirli bir ekipman parçasına uyarlamak gerekir. Çözeltiye spesifik bir anti-foto-beyazlatma ajanı eklenmedi.
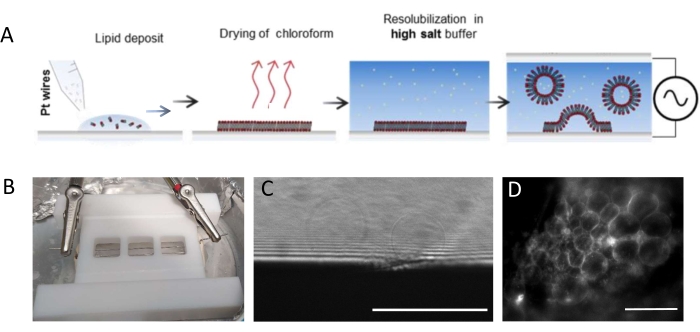
Şekil 1: GUV'ların elektro-oluşumu . (A) Platin teller kullanılarak elektro-oluşum sürecinin şematik gösterimi. (B) Elektro-formasyon yoluyla GUV'lar üretmek için kullanılan platin tellerle monte edilmiş Teflon ev yapımı cihazın resmi. Teller 0,5 mm çapında ve 3 mm aralıklıdır. (C) Büyüme süreci sırasında iletim optik mikroskobu ile gözlenen GUV'lar (küresel nesneler). Görüntünün altındaki opak bölge platin teldir. (D) Platin tel üzerindeki büyüme sırasında floresan mikroskopi ile gözlenen GUV'lar (yuvarlak floresan nesneler). Ölçek çubukları = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. Septin filamentlerinin ultrastrüktürel organizasyonunun kriyo-elektron mikroskobu ile analizi
NOT: Veziküller standart elektron mikroskobu yöntemleriyle görüntüleme için uygun değildir. Gerçekten de, numuneler standart negatif leke yöntemleri kullanılarak kurutulur. Dehidrasyon üzerine, veziküllerin spesifik olmayan deformasyonlara uğraması muhtemeldir, bu da sıklıkla lipit çıkıntılarına neden olur. Kriyo-elektron mikroskobu bu nedenle veziküllerin spesifik deformasyonlarını gözlemlemek için çok daha iyi bir stratejidir. Kriyo-EM kullanılarak, numuneler, numuneleri doğal duruma yakın koruyan ince (~ 100-200 nm) bir vitrifiye buz tabakası içine gömülür. Bununla birlikte, GUV'lar ince buzun içine gömülemeyecek kadar büyüktür (birkaç on mikrometre) ve böylece iletim elektron mikroskobu ile görüntülenir. Bu nedenle, çapları ~ 50-500 nm arasında değişen büyük unilamellar veziküller (LUV'ler), septinlerin vezikülleri nasıl deforme edebileceğini ve veziküller üzerinde nasıl düzenlendiklerini belirlemek için üretilir.
- Büyük unilamellar veziküllerin (LUV'ler) oluşumu
- Bir cam şişedeki membranla septin etkileşimini arttırmak için optimize edilmiş% 57 EggPC,% 15 kolesterol,% 10 DOPE,% 10 DOPS ve% 8 beyin PI (4,5) P2 molar bileşimi ile kloroformda çözünmüş 50 μg lipit karışımı hazırlayın.
- Şişede kurutulmuş bir lipit filmi oluşturmak için çözeltiyi argon akışı altında kurutun. Lipiti tamamen kurutmak için şişeyi 30 dakika boyunca vakum altına alın.
- Lipid filmini 50 μL sulu çözelti (50 mM Tris-HCl [pH 8]; 50 mM KCl; 2 mM MgCl2) içinde çözündürerek 1 mg · mL-1'lik bir nihai konsantrasyon, 10 s için vorteks elde edin ve çözeltiyi bir tüpe aktarın.
NOT: LUV'ler septinlerle inkübasyon için bir kerede kullanılmalıdır. Aksi takdirde PI(4,5)P2 çözünürlüğü nedeniyle protein-lipid etkileşimi zayıf olacaktır. Bu ham yeniden çözündürme işlemi, çapları 50 nm ila 500 nm arasında değişen heterojen bir vezikül popülasyonu oluşturur. Bu nedenle, bir dizi çap ve dolayısıyla eğrilikler aynı anda test edilir.
- Septinleri, yüksek tuzlu bir tamponda (50 mM Tris-HCl [pH 8], 300 mM KCl, 2 mM MgCl 2) sırasıyla 0.1 mg · mL-1 (yaklaşık 300 nM) ve 20 nM'lik nihai lipit ve septin konsantrasyonlarında çözünür lipitlerle inkübeedin. Numuneyi oda sıcaklığında 1 saat boyunca inkübe edin.
- Numuneyi vitrifiye etmek için daldırma dondurma
- Plazma jeneratörü ekipmanı kullanılarak 5 mA'da 30 s boyunca karbon tarafında parıltı-deşarjlı delikli karbon ızgaraları (300 ağ) ve ızgarayı nemli bir ortamda bir dalma dondurma makinesinin içine yerleştirin.
- Izgaranın parıltılı karbon tarafındaki numunenin 4 μL'sini (Adım 2.2.) adsorbe edin. Numune adsorpsiyonundan hemen önce, numunelerin kriyotomografi ile eğimli seriler oluşturmak için kullanılması durumunda, çözeltiye 5-10 nm altın boncuklar ekleyin.
NOT: Altın boncukların yoğunluğu ampirik olarak taranmalı ve ayarlanmalıdır ve sağlayıcıya bağlıdır. Optimize edilmiş yoğunluk, görüş alanında 10-15 altın boncuktur. - Numune damlasını karşı tarafa aspire etmek için numuneleri çıplak taraftan kurulayın.
NOT: Lekelenme süresi tipik olarak 4 sn'dir ve filtre kağıdının konumu ve lekelenme kuvveti, buz kalitesini (kalınlığını) ve malzeme yoğunluğunu optimize etmek için filtre kağıdının alternatif konumlarını test ederek ve tarayarak ampirik olarak ayarlanır. - Izgaraları bir mikroskopa aktarın veya bir sıvı azot kabında saklayın.
NOT: Delikli karbon ızgaraların kullanılması, veziküllerin boyutundaki polidispersiteye uyum sağlamak için gereklidir. Numunenin karşı taraftan lekelenmesi, ızgaradaki biyolojik materyalin gelişmiş adsorpsiyonunu destekler.
- Kriyo-elektron mikroskobu görüntüleme
- Izgaraları kriyo-EM gözlemi için donatılmış bir elektron mikroskobuna (EM) yerleştirin. Daha iyi buz (yani, ince ve iyi vitrifiye) gösteren alanları seçmek için düşük büyütmede (tipik olarak 120x büyütmede) tüm numunenin bir haritasını oluşturarak tüm ızgarayı tarayın.
- Cryo-EM 2D veri toplama için, numunenin kalitesini kontrol etmek üzere piksel başına yaklaşık 2 şpiksel boyutunda görüntüler toplayın. Hem septin filamentlerinin hem de lipit çift katmanının görünür olduğundan emin olun.
- Kriyo-elektron tomografi verilerinin toplanması için, deforme olmuş vezikülleri gösteren ilgi alanlarını seçin. Görüş alanında yeterli sayıda altın boncuk (en az 10) bulunduğundan emin olun.
- Eğimli seri veri toplama için kullanılan yazılıma göre, ilgi alanından yeterince uzak olması için odak ve izleme konumlarını seçin. Eğim açısını -60° ile +60° arasında değiştirerek ve her 2°-3° derecede bir görüntü toplayarak eğimli serileri toplayın.
NOT: Toplam doz yaklaşık 100 elektron / Å2 olmalıdır. Piksel boyutu, veri toplama için kullanılan mikroskopa bağlı olarak 1,3 şile 2,1 şarasında değişir. İdeal olarak, veri toplama için açısal bir simetrik şema aşağıdaki gibi tercih edilir: 0 °, -3 °, +3 °, -6 °, +6 °, -9 °, +9 ° [...] -60 °, +60 °. Bununla birlikte, yandan giriş mikroskoplarının gonyometreleri, bu simetrik şemaları elde etmek için yeterli mekanik stabilite sağlamaz. Alternatif olarak, elde etme 0° ila 34°'de başlatılabilir, ardından -2° ila -60° arasında ikinci bir açısal dizi izlenebilir ve 36° ila 60° arasında bir son sekansla sonlandırılabilir. Amaç, ilk görüntüleri (en düşük radyasyon hasarı ile) en düşük açılarda toplamaktır. Ayrıca, veziküllerin ve bağlı septin filamentlerinin ultrayapısını görselleştirmek için standart bir kriyo-EM mikroskobu kullanılabilir (200 kV, Lantan hekzaborid (LaB6) filament ve numune yan girişi). Bununla birlikte, eğer biri daha fazla görüntü işleme (örneğin alt-tomogram ortalaması) peşinde koşmayı hedefliyorsa, doğrudan dedektörlerle donatılmış son nesil alan emisyon tabancası (FEG) mikroskoplarını kullanmak en iyisidir. Bu protokolde, açıklamamızı 3D rekonstrüksiyonların edinilmesiyle sınırlandırıyoruz ve alt tomogram ortalamasını dışarıda bırakıyoruz.
- Kriyotomografi ve segmentasyondan 3D rekonstrüksiyon
- Eğik seri görüntü hizalaması ve26,27 3B yeniden yapılandırma için IMOD yazılım paketini (Malzeme Tablosu) kullanın. IMOD içinde, referansların (altın boncuklar) konumlandırılmasına dayalı eğim serisi hizalaması gerçekleştirin. Ek olarak, gerekirse, IMOD26 içinde kontrast transfer fonksiyonu (CTF) belirleme ve düzeltme gerçekleştirin. Son olarak, her adımı titizlikle takip ederek IMOD ile 3D rekonstrüksiyon elde edin.
- Lipid çift katmanlarını ve septin filamentlerini, görüntüleme için IMOD yazılım paketinden 3Dmod27'yi kullanarak manuel olarak segmentlere ayırın.
3. SEM kullanarak septinin eğrilik duyarlılığının analizi
NOT: Septinlerin mikrometre eğriliklerine nasıl duyarlı olabileceğini anlamak için, septin filament komplekslerini mikrometre ölçeğinde dalgalı dalgalı desenler üzerinde biriken katı destekli lipit çift katmanlı inkübe etmek için in vitro bir yaklaşım kullanılmıştır.
- Dalgalı polidimetilsiloksan (PDMS) desenlerinden dalgalı NOA (Norland optik yapıştırıcı) replikasının tasarlanması
- İlgilenilen proteine uygun eğrilikleri analiz etmek için 250 nm genlik ve 2 μm lateral periyodiklik veya diğer boyutlardaki PDMS dalgalı desenlerini kullanın.
NOT: PDMS dalgalı desenleri, Nania ve ark.28,29'da açıklandığı gibi tasarlanmış ve üretilmiştir. - Temiz oda ortamında, 1 cm çapında dairesel bir cam kapak kapağı üzerine 5 μL sıvı NOA biriktirin ve PDMS şablonunu damlanın üzerine yerleştirin. Sıvı NOA'yı ince bir polimer filme fotopolimerize etmek için 5 dakika boyunca UV ışığı (320 nm) ile muamele edin. Ardından, PDMS şablonunu taze polimerize NOA ile kapak fişinden yavaşça çıkarın.
NOT: NOA, optik mikroskopi görüntüleme için uygun, yaygın bir optik şeffaf yapıştırıcıdır. Ek olarak, NOA, SEM görüntülemeden önce gerçekleştirilen kimyasal fiksasyon ve boyama işlemlerine karşı dirençlidir. Hem NOA 71 hem de NOA 81 reçineleri benzer sonuçlarla kullanılabilir. İlk PDMS deseni, NOA kopyaları üretmek için birkaç kez kullanılabilir. Elde edilen NOA replikaları aylarca oda sıcaklığında bir kutuda saklanabilir.
- İlgilenilen proteine uygun eğrilikleri analiz etmek için 250 nm genlik ve 2 μm lateral periyodiklik veya diğer boyutlardaki PDMS dalgalı desenlerini kullanın.
- Desteklenen lipit çift katmanlı üretimi ve protein inkübasyonu
- Yüzeyi hidrofilik hale getirmek için NOA filmlerini 5 dakika boyunca bir hava plazma temizleyici kullanarak tedavi edin.
- Toplam 1 mg · mL-1 lipid konsantrasyonunda% 57 EggPC,% 15 kolesterol,% 10 DOPE,% 10 DOPS ve% 8 beyin PI (4,5) P2 molar bileşimine sahip küçük unilamellar veziküller (SUV'lar) çözeltisi hazırlayın. SUV'ları, Adım 2.1.3'te açıklandığı gibi, gözlem tamponunda kurutulmuş bir lipit filmi askıya alarak hazırlayın. Çözelti şeffaf olana kadar 5-10 dakika boyunca bir banyo sonikatör kullanarak çözeltiyi nazikçe sonikleştirin.
NOT: SUV'ların çözeltisi -20 ° C'de birkaç hafta boyunca dondurulmuş olarak saklanabilir. - NOA desenlerini destekleyen kapakları hücre kültürü kutularının kuyucuklarına yerleştirin. Yeni parıldayan NOA desenleri (Adım 3.2.1.) üzerine 100 μL 1 mg · mL-1 SUV çözeltisi koyun ve oda sıcaklığında 30 dakika boyunca inkübe edin. Bu adım, desteklenen bir lipit çift katmanı oluşturmak için SUV'ların NOA deseninin yüzeyi ile kaynaşmasını sağlar.
- Kaynaşmamış SUV'yi çıkarmak için septin tamponu (50 mM Tris-HCl [pH 8], 50 mM KCl, 2 mM MgCl2) ile kızakları 6 kat iyice durulayın. Her durulamadan sonra, numunenin tamamen kurumasına asla izin vermeyin.
- Oktamerik septin stok çözeltisini septin yüksek tuz tamponunda (50 mM Tris-HCl [pH 8], 300 mM KCl, 2 mM MgCl 2) septin tamponu (50 mM Tris-HCl [pH 8], 50 mM KCl,2 mM MgCl2) kullanarak 10 nM ila 100 nM arasında değişen nihai konsantrasyonlara ve 1 mL'lik hacimlere kadar seyreltin. Protein çözeltisini slaytlardaki oda sıcaklığında ~ 1 saat boyunca inkübe edin.
NOT: Hacim, buharlaşmanın bir sorun olmaması için yeterince büyüktür.
- SEM analizi için numune hazırlama
NOT: Elektron mikroskobunda protein yapılarını ve bunların montajını analiz etmek için çeşitli protokoller geliştirilmiştir. Mevcut protokol, Svitkina ve ark.'dan türetilen bir fiksasyon protokolü kullanarak septin filamentlerinin organizasyonunu korur.30 uygulanması kolaydır. Ayrıca, bu protokol yüksek çözünürlüklü SEM gözlemlerini optimize eder.- Reaktiflerin ve stok çözeltilerinin hazırlanması
NOT: Bu protokol, önceden veya inkübasyondan hemen önce hazırlanabilen çeşitli reaktifler ve çözeltiler gerektirir. Herhangi bir eserden veya kimyasal reaktivite eksikliğinden kaçınmak için verilen talimatları izleyin.- Sodyum kakodilat 0.2 M stok çözeltisi: Bu çift mukavemetli çözeltiyi hazırlamak için, manyetik karıştırma altında ~ 40 mL damıtılmış su içinde 2.14 g sodyum kakodilat tozu çözün. Tamamen çözündükten sonra, yavaşça 0,1 M HCl (50 mL çözelti için ~ 1 mL) ekleyerek pH'ı 7,4'e ayarlayın ve damıtılmış su ile son hacmi oluşturun. Bu çözelti 4°C'de 24-48 saat saklanabilir.
- 0.1 M sodyum kakodilat (fiksatif çözelti) içinde% 2 glutaraldehit (GA): Bu çözeltiyi, 0.2 M sodyum kakodilat çözeltisi ile seyrelterek kullanımdan hemen önce hazırlayın (yukarıya bakınız). 4 °C'de optimize edilmiş depolama kapasitesi nedeniyle %25-%50 ticari GA stok çözümü kullanın. 10 mL fiksatif çözelti hazırlamak için, 0.8 mL% 25 ticari GA çözeltisini 4.2 mL damıtılmış su ve 5 mL 0.2 M sodyum kakodilat ile seyreltin.
- 0.1 M sodyum kakodilat içinde% 1 osmiyum tetroksit (OsO4): Ticari % 4 OsO4 stok çözeltisini 0.2 M sodyum kakodilat ile seyrelterek bu ikinci fiksatif çözeltiyi kullanımdan hemen önce hazırlayın (yukarıya bakınız). 4 mL OsO 4 fiksatif çözeltisi için, 1 mL% 4 ticari OsO4 çözeltisini 1 mL damıtılmış su ve 2 mL 0.2 M sodyum kakodilat ile seyreltin.
NOT: Depolama ve taşıma özellikleri nedeniyle bölünebilir cam ampullerde ticari% 4 OsO4 stok çözeltisi kullanın. OsO4'ün oldukça reaktif olduğunu unutmayın. Renginin hafif sarı olduğundan ve koyu olmadığından emin olun. - Suda% 1 tanik asit (TA): Bu çözeltiyi kullanmadan hemen önce hazırlayın. Oda sıcaklığında damıtılmış suda nihai konsantrasyonun% 1 TA'lık bir konsantrasyon elde etmek için TA çözeltisini hazırlayın. 10 mg'ı 1 mL damıtılmış suda ve vortekste birkaç dakika çözün. TA çözeltisi depolanamaz ve kullanılmadan önce 0,2 μm filtre ile filtrelenmelidir.
- Suda% 1 uranil asetat (UA) çözeltisi Damıtılmış sudamıtılmış suda% 1'lik bir UA nihai konsantrasyonu elde etmek için UA çözeltisi hazırlayın. 10 mg'ı 1 mL damıtılmış su ve vorteks içinde en az 30 dakika ila 1 saat arasında vorteks yaparak veya oda sıcaklığında sallayarak çözün. Bu çözelti 4 ° C'de 1 ay boyunca saklanabilir, ancak kolayca çökelebilir ve bu nedenle kullanımdan önce 0,2 μm'lik bir filtre ile filtrelenmelidir.
- Derecelendirilmiş etanol çözeltileri serisi Suda% 50,% 70,% 95 ve% 100 etanol çözeltileri hazırlayın. Son banyoyu, kurutma ve kaplamaya müdahale edebilecek tüm su izlerini numunelerden çıkarmak için yeni açılmış %100 etanol şişelerinden veya moleküler eleklerle (nominal gözenek çapı = 4 Å) en az 24 saat kurutulmuş %100 etanolden hazırlayın. Silikat parçacıklarının yeniden süspansiyonuna neden olabileceğinden bu çözeltiyi sallamamaya dikkat edin.
NOT: Bu protokolde kullanılan kimyasal reaktifleri kullanırken dikkatli olun. Glutaraldehit, osmiyum tetroksit, sodyum kakodilat ve uranil asetat oldukça toksiktir, uranil asetat da radyoaktiftir. Reaktiflerin ve atıklarının tüm manipülasyonu, laboratuvara özgü prosedürlere göre bireysel (eldivenler, laboratuvar önlükleri, güvenlik gözlükleri) ve toplu koruma (duman davlumbazları ve pleksiglas kalkanlar) kullanılarak yapılmalıdır.
- Örnek sabitleme
- Numuneleri (yani, kaynaşmış destekli lipit çift katmanlı ve inkübe proteinli NOA slaytları) PBS ile yıkayın. PBS'yi 37 °C'de önceden ısıtılmış GA fiksatif çözeltisi ile değiştirin ve reaksiyonun 15 dakika boyunca devam etmesine izin verin. Numuneler daha sonra 4 °C'de saklanabilir.
- Fiksatif çözeltiyi çıkarın ve sabit numuneleri 3 kat 0,1 M sodyum kakodilat (yıkama başına 5 dakika) ile hafifçe çalkalayarak yıkayın.
- Membranöz yapıların sabitlenmesine izin vermek ve numunelerin elektriksel iletkenliğini artırmak için OsO4 fiksatif çözeltisindeki numuneleri ışıktan maksimum koruma ile 10 dakika boyunca inkübe edin. Fiksatif çözeltiyi çıkarın ve numuneleri 3 kat damıtılmış suda (yıkama başına 5 dakika) hafifçe çalkalayarak yıkayın.
- Yıkanmış numuneleri filtrelenmiş TA fiksatif çözeltisinde maksimum 10 dakika boyunca inkübe edin. TA çözeltisini çıkarın ve numuneleri 3 kat damıtılmış suda (yıkama başına 5 dakika) hafifçe çalkalayarak yıkayın.
- Yıkanmış numuneleri, ışıktan maksimum koruma ile 10 dakika boyunca taze filtrelenmiş UA fiksatif bir çözeltide inkübe edin. UA çözeltisini çıkarın ve numuneleri 3 kat damıtılmış suda (yıkama başına 5 dakika) hafifçe çalkalayarak yıkayın.
- Numune dehidrasyonu ve kritik nokta kurutma
NOT: Sıvıdan gaz haline geçerken numunelerin istenmeyen yüzey gerilimleri yoluyla zarar görmesini önlemek için hava ile kurutmaya izin verilmez. EM'de iki yöntem oluşturulmuştur: CO2'nin süperkritik durumuna ulaşmak ve kritik noktasını (31 ° C, 74 bar) atlamak için fiziksel yöntem veya yüzey gerilimi azaltılmış bir kurutma maddesi olan hekzametildilazonu (HMDS) buharlaştırmanın kimyasal yöntemi. CO2 ve HMDS su ile zayıf bir şekilde karışabilir. Sonuç olarak, kurutma prosesleri sırasında daha sonra herhangi bir hasarı önlemek için tüm su izleri bir geçiş çözücüsü (etanol) ile değiştirilmelidir.- Numuneleri her etanol çözeltisinde% 50 ila% 100 (susuz) etanol banyosundan başlayarak 2-3 dakika boyunca inkübe edin.
NOT: Etanolün banyolar arasında buharlaşması hızlı olduğundan, hava kurumasını önlemek için numune işleme de hızlı olmalıdır. - Cam kızakları etanol ile önceden doldurulmuş kritik nokta kurutucunun içine aktarın ve üreticinin talimatlarına uyun.
NOT: Bu protokolde otomatik bir aparat kullanılmıştır, ancak herhangi bir sistem kullanılabilir. Protokoller her aparat için farklı olabilir, ancak etanolün tamamen giderilmesi (bu protokolde 25 banyo) ve farklı çözücü değişimleri (CO 2 girişleri ve etanol / CO2 çıkışları) ve nihai basınçsızlaştırma (bu protokolde yaklaşık 1 saat) için hızları azaltmak için optimize edilmelidir. - Kritik nokta kurutmanın sonunda, numuneleri montaj ve kaplamaya kadar hemen bir kurutucuda saklayın. Kurutulmuş numuneler oldukça higroskopik olduğundan, mümkün olan en kısa sürede kaplayın (aşağıya bakınız).
NOT: Alternatif olarak, HMDS daha ucuz ve daha hızlı bir yöntem sunabilir. HDMS, numunelerimiz üzerinde hiç test edilmemiş olmasına rağmen, bu yaklaşım hücresel membranların iç yüzündeki proteinlerin gözlemlenmesi için iyi sonuçlar vermiştir31,32.
- Numuneleri her etanol çözeltisinde% 50 ila% 100 (susuz) etanol banyosundan başlayarak 2-3 dakika boyunca inkübe edin.
- Örnek montaj ve kaplama.
NOT: Biyolojik numuneler zayıf elektriksel iletkenlik özellikleri gösterdiğinden, SEM gözleminden önce iletken bir metal film ile kaplanmaları gerekir. Böylece plazma-magnetron püskürtme kullanılır.- Kapak fişini gelecekteki SEM gözlemleri için kullanılacak saplamalara takın. Karbon disklere kıyasla gelişmiş elektrik iletkenliği nedeniyle gümüş boya kullanın. Kapak kapağının üst yüzüne bir gümüş boya şeridi ekleyin ve saplama ile bağlantının tatmin edici olduğundan emin olun. Herhangi bir boya aglomerasından kaçının.
NOT: Yüksek çözünürlüklerde (yani, düşük çalışma mesafesi) çalışırken numune ile SEM'in objektif lensi arasında herhangi bir teması önlemek için gümüş boya şeridi ince olmalıdır. - Çözücünün tamamen buharlaşmasını bekleyin.
NOT: Bu adımın süresi, gümüş boya birikintisinin miktarına ve kalınlığına bağlı olarak değişebilir. Bu adım, bir çan kavanozu veya kaplayıcı ve 10-30 dakika boyunca birincil vakum kullanılarak kısaltılabilir. - Bir plazma-magnetron püskürtme kafası ve döner-gezegen aşaması ile donatılmış bir aparat kullanın ve üretici tarafından sağlanan standart protokolleri izleyin. Burada, aparat 2.5 x 10-5 mbar'a tahliye edildi, yüksek kaliteli argon ile 1x'ten temizlendi ve daha sonra 8.0 x 10-3 mbar'a ayarlandı.
- Yüzeydeki oksit tabakasını çıkarmak için ön püskürtme (60 s için 120 mA) gerçekleştirin. Daha sonra, bir film kalınlığı monitörü yardımıyla 1,5 nm tungsten (90 mA, çalışma mesafesi = 50 mm) biriktirin.
NOT: Film buharlaşmasının tekrarlanabilirliğini sağlamak için kaplayıcı mükemmel bir şekilde temizlenmelidir. Hedeflenen kalınlığa ulaşıldığında kaplama durdurulmalıdır. Son film kalınlığı hesaplanır ve daha sonra düzeltilir. Yaklaşık 1,5 nm'lik filmler, cihazımızı kullanarak ortalama olarak 0,7 nm'lik bir düzeltme sonrasına sahiptir. Bu düzeltme değerleri hedefe yakın olduğundan, bu düzeltmeyi değerlendirmek ve ardından hedef değerden çıkarmak için bir dizi kaplama gerçekleştirilir. - Tüm SEM analizlerine kadar ve boyunca ortam havasından korumak için numuneleri vakum altında saklayın.
NOT: Püskürtme için kullanılan metalin doğası önemlidir. Pt, yaygın bir malzeme olmasına rağmen, septin filamentlerine (1.5 nm) uyarlanmış bir Pt film kalınlığına sahip düşük kaliteli bir kaplama ile sonuçlanır. Yüksek çözünürlüklerde, 1,5 nm Pt film tutarlılıktan yoksundur; Pt kümelerinin ve septin filamentlerinin büyüklüğü benzer hale gelir ve filament segmentasyon işlemi33 sırasında yanlış yorumlamalara yol açar (bkz. Şekil 2A, giriş). Tungsten, Pt'ye iyi bir alternatiftir, çünkü yüksek çözünürlüklü SEM'de zar zor görülebilen daha küçük bir tane boyutu gösterir (bkz. Şekil 2B, giriş). Bununla birlikte, saf tungsten kolayca oksitlenir, bu da prosedür Adım 3.3.4'te ayrıntılı olarak belirtilirse, SEM gözlemi sırasında güçlü şarj etkisi artefaktlarına yol açar. kesinlikle takip edilmez.
- Kapak fişini gelecekteki SEM gözlemleri için kullanılacak saplamalara takın. Karbon disklere kıyasla gelişmiş elektrik iletkenliği nedeniyle gümüş boya kullanın. Kapak kapağının üst yüzüne bir gümüş boya şeridi ekleyin ve saplama ile bağlantının tatmin edici olduğundan emin olun. Herhangi bir boya aglomerasından kaçının.
- Reaktiflerin ve stok çözeltilerinin hazırlanması
- Görüntüleri alan emisyonu SEM (FESEM) mikroskobu kullanarak elde edin.
NOT: SEM teknolojileri çözünürlüğü iyileştirmek için yakın zamanda yükseltilmiştir ve teknolojiler üreticiye bağlıdır (örneğin, elektron optiği, ışın yavaşlaması, manyetik lens). Bu çözünürlük kazancı (birkaç üreticiyle erişilebilir), özellikle düşük bir hızlanan voltajda (1 kV'de nanometrenin yakınında), septin ağlarına benzer nanometrik yapıları çözmek için gereklidir.- Aşağıdaki ayarları kullanarak "lens içi" dedektör ile birincil ikincil elektronların (SE1) algılanması yoluyla yüksek çözünürlüklü görüntüleme elde edin.
- Hızlanma voltajını 3 kV'a ayarlayın. Şarj efektlerinin bastırılması gerekiyorsa, ışın akımını 20 μm diyafram açıklığıyla (Zeiss Gemini I sütunları için veya 34 pA'ya eşdeğer) veya 15 μm diyafram açıklığıyla (Zeiss Gemini I sütunları için veya 18,5 pA'ya eşdeğer) sabitleyin.
- Gözlemler için, 21,25 nm/piksel ile 1,224 nm/piksel arasında değişen çözünürlükler kullanın ve veri analizi için ~5,58 nm/piksel çözünürlük kullanın (Polaroid 545 referansına göre 20.000x büyütme).
- Yüksek çözünürlüklü gözlem için çalışma mesafesini 1 mm ile 2 mm arasında, daha fazla alan derinliği gerekiyorsa yaklaşık 3 mm arasında ayarlayın. Görüntü başına yaklaşık 30-45 sn alma süresiyle sabit bir sinyal-gürültü oranı sağlamak için tarama hızını ve hat entegrasyonunu sürekli olarak ayarlayın.
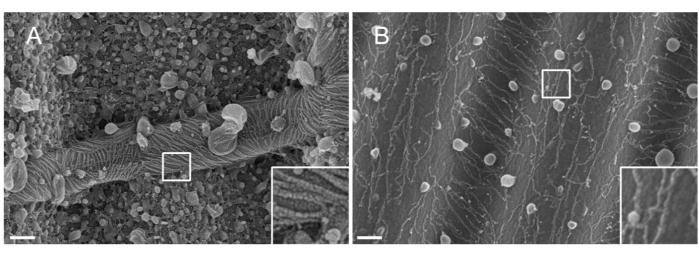
Şekil 2: Septin filamentleri üzerinde biriken malzemenin dalgalı PDMS desenleri üzerine etkisi. (A) 1.5 nm platin ile püskürtülerek kaplanmış septin filamentlerinin SEM'i, platin çekirdeği kümeleri arasındaki tutarlılık eksikliğinin tipik bir örneği olan "kurak çatlak toprak" desenini veya (B) pürüzsüz ve yapışkan bir tabaka ile kaplanmış 1.5 nm tungsten. Ölçek çubuğu = 200 nm. Beyaz kare kutular, sağ alttaki büyütülmüş görünümleri temsil eder. Küresel kürecikler, septinlerle etkileşime giren küçük lipit vezikülleridir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
GUV'ların deformasyonları
Septinlerle inkübe edildikten sonra yeniden şekillenen GUV'ların tipik konfokal floresan görüntüleri, septinlerin polimerize olduğu koşullarda Şekil 3'te gösterilmiştir. Çıplak GUV'lar (Şekil 3A) mükemmel bir şekilde küreseldi. 50 nM'den fazla tomurcuklanan maya septin filamentleri ile inkübasyon üzerine, veziküller deforme olmuş olarak ortaya çıktı. 100 nM tomurcuklanan maya septin oktamer ...
Tartışmalar
Yukarıda belirtildiği gibi, lipid çift katmanı içinde PI (4,5) P2 ilişkisini artıran ve böylece septin-membran etkileşimlerini kolaylaştıran bir lipit karışımı kullanılmıştır. Gerçekten de,25 başka bir yerde, tomurcuklanan maya septinlerinin veziküllerle PI (4,5) P2'ye özgü bir şekilde etkileşime girdiğini gösterdik. Bu lipit bileşimi, çoklu kompozisyonların taranmasından ampirik olarak ayarlanmıştır ve şimdi yazarlar tarafından yaygın ol...
Açıklamalar
Yazarların çıkar çatışması yoktur.
Teşekkürler
Patricia Bassereau ve Daniel Lévy'ye yararlı tavsiyeleri ve tartışmaları için teşekkür ederiz. Bu çalışma, "SEPTIME", ANR-13-JSV8-0002-01, ANR SEPTIMORF ANR-17-CE13-0014 projesini ve "SEPTSCORT", ANR-20-CE11-0014-01 projesini finanse etmek için ANR'nin (Agence Nationale de la Recherche) desteğinden yararlandı. B. Chauvin Ecole Doctorale "ED564: Physique en Ile de France" ve Fondation pour lea Recherche Médicele tarafından finanse edilmektedir. K. Nakazawa, Sorbonne Université (AAP Emergence) tarafından desteklendi. G.H. Koenderink, Nederlandse Organisatie voor Wetenschappelijk Onderzoek (NWO/OCW) tarafından 'BaSyC-Building a Synthetic Cell' aracılığıyla desteklendi. Yerçekimi hibesi (024.003.019). Labex Cell(n)Scale (ANR-11-LABX0038) ve Paris Sciences et Lettres'e (ANR-10-IDEX-0001-02) teşekkür ederiz. Hücre ve Doku Görüntüleme (PICT-IBiSA), Fransız Ulusal Araştırma Altyapısı Fransa-BioImaging (ANR10-INBS-04) üyesi Institut Curie'ye teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine | Avanti Polar Lipids | 850725 | |
| 1,2-dioleoyl-sn-glycero-3-phospho-L-serine | Avanti Polar Lipids | 840035 | |
| Bath sonicator | Elma | Elmasonic S10H | |
| Bodipy-TR-Ceramide | invitrogen, Thermo Fischer scientific | 11504726 | |
| Chemicals: NaCl, Tris-HCl, sucrose, KCl, MgCl2, B-casein, chloroform, sodium cacodylate, tannic acid, ethanol | Sigma Aldrich | ||
| Confocal microscope | nikon | spinning disk or confocal | |
| Critical point dryer | Leica microsystems | CPD300 | |
| Deionized water generator | MilliQ | F1CA38083B | MilliQ integral 3 |
| Egg L-α-phosphatidylcholine | Avanti Polar Lipids | 840051 | |
| Field Emission Gun SEM (FESEM) | Carl Zeiss | Gemini SEM500 | |
| Glutaraldehyde 25 %, aqueous solution | Thermo Fischer scientific | 50-262-19 | |
| High vacuum grease, Dow corning | VWR | ||
| IMOD software | https://bio3d.colorado.edu/imod/ | software suite for tilted series image alignment and 3D reconstruction | |
| Lacey Formvar/carbon electron microscopy grids | Eloise | 01883-F | |
| Lipids | Avanti Polar Lipids | ||
| L-α-phosphatidylinositol-4,5-bisphosphate | Avanti Polar Lipids | 840046 | |
| Metal evaporator | Leica microsystems | EM ACE600 | |
| NOA (Norland Optical Adhesives), NOA 71 and NOA 81 | Norland Products | NOA71, NOA81 | |
| Osmium tetraoxyde 4% | delta microscopies | 19170 | |
| Osmometer | Löser | 15 M | |
| Plasma cleaner | Alcatel | pascal 2005 SD | |
| Plasma generator | Electron Microscopy Science | ||
| Plunge freezing equipment | leica microsystems | EMGP | |
| Transmission electron microscope | Thermofischer | Tecnai G2 200 kV, LaB6 | |
| Uranyl acetate | Electron Microscopy Science | 22451 | this product is not available for purchase any longer |
| Wax plates, Vitrex | VWR |
Referanslar
- Finger, F. P. Reining in cytokinesis with a septin corral. BioEssays: News and Reviews in Molecular, Cellular and Developmental Biology. 27 (1), 5-8 (2005).
- Barral, Y., Kinoshita, M. Structural insights shed light onto septin assemblies and function. Current Opinion in Cell Biology. 20 (1), 12-18 (2008).
- Hu, Q., et al. A septin diffusion barrier at the base of the primary cilium maintains ciliary membrane protein distribution. Science. 329 (5990), 436-439 (2010).
- Lin, Y. -. H., Kuo, Y. -. C., Chiang, H. -. S., Kuo, P. -. L. The role of the septin family in spermiogenesis. Spermatogenesis. 1 (4), 298-302 (2011).
- Addi, C., Bai, J., Echard, A. Actin, microtubule, septin and ESCRT filament remodeling during late steps of cytokinesis. Current Opinion in Cell Biology. 50, 27-34 (2018).
- Spiliotis, E. T., Kesisova, I. A. Spatial regulation of microtubule-dependent transport by septin GTPases. Trends in Cell Biology. 31 (12), 979-993 (2021).
- Spiliotis, E. T., Nakos, K. Cellular functions of actin- and microtubule-associated septins. Current Biology: CB. 31 (10), 651-666 (2021).
- Salameh, J., Cantaloube, I., Benoit, B., Poüs, C., Baillet, A. Cdc42 and its BORG2 and BORG3 effectors control the subcellular localization of septins between actin stress fibers and microtubules. Current Biology: CB. 31 (18), 4088-4103 (2021).
- Ewers, H., Tada, T., Petersen, J. D., Racz, B., Sheng, M., Choquet, D. A septin-dependent diffusion barrier at dendritic spine necks. PloS One. 9 (12), 113916 (2014).
- Myles, D. G., Primakoff, P., Koppel, D. E. A localized surface protein of guinea pig sperm exhibits free diffusion in its domain. The Journal of Cell Biology. 98 (5), 1905-1909 (1984).
- Luedeke, C., Frei, S. B., Sbalzarini, I., Schwarz, H., Spang, A., Barral, Y. Septin-dependent compartmentalization of the endoplasmic reticulum during yeast polarized growth. The Journal of Cell Biology. 169 (6), 897-908 (2005).
- Gilden, J. K., Peck, S., Chen, Y. -. C. M., Krummel, M. F. The septin cytoskeleton facilitates membrane retraction during motility and blebbing. The Journal of Cell Biology. 196 (1), 103-114 (2012).
- Dolat, L., Hu, Q., Spiliotis, E. T. Septin functions in organ system physiology and pathology. Biological Chemistry. 395 (2), 123-141 (2014).
- Angelis, D., Spiliotis, E. T. Septin mutations in human cancers. Frontiers in Cell and Developmental Biology. 4, 122 (2016).
- Takehashi, M., et al. Septin 3 gene polymorphism in Alzheimer's disease. Gene Expression. 11 (5-6), 263-270 (2004).
- Shuman, B., Momany, M. Septins from protists to people. Frontiers in Cell and Developmental Biology. 9, 824850 (2022).
- Bertin, A., et al. Saccharomyces cerevisiae septins: supramolecular organization of heterooligomers and the mechanism of filament assembly. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8274-8279 (2008).
- Iv, F., et al. Insights into animal septins using recombinant human septin octamers with distinct SEPT9 isoforms. Journal of cell science. 134 (15), (2021).
- Beber, A., et al. Membrane reshaping by micrometric curvature sensitive septin filaments. Nature communications. 10 (1), 420 (2019).
- Bridges, A. A., Jentzsch, M. S., Oakes, P. W., Occhipinti, P., Gladfelter, A. S. Micron-scale plasma membrane curvature is recognized by the septin cytoskeleton. The Journal of Cell Biology. 213 (1), 23-32 (2016).
- Patzig, J., et al. Septin/anillin filaments scaffold central nervous system myelin to accelerate nerve conduction. eLife. 5, 17119 (2016).
- Szuba, A., et al. Membrane binding controls ordered self-assembly of animal septins. eLife. 10, 63349 (2021).
- Tanaka-Takiguchi, Y., Kinoshita, M., Takiguchi, K. Septin-mediated uniform bracing of phospholipid membranes. Current Biology: CB. 19 (2), 140-145 (2009).
- Bertin, A., et al. Phosphatidylinositol-4,5-bisphosphate promotes budding yeast septin filament assembly and organization. Journal of Molecular Biology. 404 (4), 711-731 (2010).
- Beber, A., et al. Septin-based readout of PI(4,5)P2 incorporation into membranes of giant unilamellar vesicles. Cytoskeleton. 76 (4,5), 92-103 (2019).
- Mastronarde, D. N., Held, S. R. Automated tilt series alignment and tomographic reconstruction in IMOD. Journal of Structural Biology. 197 (2), 102-113 (2017).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116 (1), 71-76 (1996).
- Nania, M., Foglia, F., Matar, O. K., Cabral, J. T. Sub-100 nm wrinkling of polydimethylsiloxane by double frontal oxidation. Nanoscale. 9 (5), 2030-2037 (2017).
- Nania, M., Matar, O. K., Cabral, J. T. Frontal vitrification of PDMS using air plasma and consequences for surface wrinkling. Soft Matter. 11 (15), 3067-3075 (2015).
- Svitkina, T. M., Borisy, G. G. Correlative light and electron microscopy of the cytoskeleton of cultured cells. Methods in Enzymology. 298, 570-592 (1998).
- Franck, A., et al. Clathrin plaques and associated actin anchor intermediate filaments in skeletal muscle. Molecular Biology of the Cell. 30 (5), 579-590 (2019).
- Elkhatib, N., et al. Tubular clathrin/AP-2 lattices pinch collagen fibers to support 3D cell migration. Science. 356 (6343), (2017).
- Stokroos, I., Kalicharan, D., Van Der Want, J. J., Jongebloed, W. L. A comparative study of thin coatings of Au/Pd, Pt and Cr produced by magnetron sputtering for FE-SEM. Journal of Microscopy. 189, 79-89 (1998).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır