Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Farelerde ve Sıçanlarda İskelet Kas Termogenezinin Ölçülmesi
Bu Makalede
Özet
Fareler ve sıçanlar cerrahi olarak uzak sıcaklık transponderleri ile implante edilir ve daha sonra test ortamına ve prosedürüne alışır. Kas sıcaklığındaki değişiklikler, ev kafesindeki farmakolojik veya bağlamsal uyaranlara yanıt olarak veya öngörülen fiziksel aktivite sırasında (yani, sabit bir hızda koşu bandı yürüyüşü) ölçülür.
Özet
İskelet kası termojenezi, metabolik homeostazı ve enerji harcamasının altında yatan mekanizmaları daha iyi anlamak için potansiyel bir yol sağlar. Termojenezin nöral, miyosellüler ve moleküler mekanizmalarını doğrudan kas sıcaklığındaki ölçülebilir değişikliklere bağlamak için şaşırtıcı derecede az kanıt mevcuttur. Bu yazıda, fare ve sıçan iskelet kas sıcaklığının doğrudan ölçümlerini almak için sıcaklık transponderlerinin kullanıldığı bir yöntem açıklanmaktadır.
Uzak transponderler cerrahi olarak farelerin ve sıçanların kasına implante edilir ve hayvanlara iyileşmeleri için zaman verilir. Fareler ve sıçanlar daha sonra tekrar tekrar test ortamına ve prosedürüne alışmalıdır. Kas sıcaklığındaki değişiklikler, ev kafesindeki farmakolojik veya bağlamsal uyaranlara yanıt olarak ölçülür. Kas sıcaklığı, bu uyaranların neden olduğu kas sıcaklığındaki değişikliklere katkıda bulunan aktivitedeki değişiklikleri hesaba katmak için öngörülen fiziksel aktivite sırasında (yani, sabit bir hızda koşu bandı yürüyüşü) de ölçülebilir.
Bu yöntem, beyin, sempatik sinir sistemi ve iskelet kası düzeyinde kas termojenik kontrolünün altında yatan mekanizmaları aydınlatmak için başarıyla kullanılmıştır. Sağlanan bu başarının kanıtları, yırtıcı kokuyu (PO; gelincik kokusu) bağlamsal bir uyaran olarak ve oksitosin (Oxt) enjeksiyonlarını, yırtıcı kokunun kas termogenezini indüklediği ve Oxt'un kas sıcaklığını baskıladığı farmakolojik bir uyaran olarak kullanılmasıdır. Bu nedenle, bu veri kümeleri, kas sıcaklığındaki hızlı değişiklikleri tespit etmede bu yöntemin etkinliğini göstermektedir.
Giriş
Metabolik araştırmalarda, iskelet kası termogenezinin incelenmesi, vücut ağırlığı homeostazını araştırmak için umut verici yeni bir yoldur. Yayınlanan literatür, vücudun en büyük organ sistemlerinden biri olan iskelet kasının termojenik tepkilerinin, enerji harcamasını ve diğer metabolik etkileri artırmak için bir yol sağladığı ve böylece obezite 1,2,3 gibi hastalıklardaki sistemleri etkili bir şekilde yeniden dengelediği fikrini desteklemektedir. Kas termojenik bir organ olarak kabul edilebilirse, çalışmalar bu organdaki termojenik değişiklikleri incelemek için pratik bir metodoloji kullanmalıdır. İskelet kaslarının endotermik etkisini anlama arzusu ve titremeyen kas termogenezini incelemek için bu metodolojinin faydası metabolik çalışmalara özgü değildir. Evrim4, karşılaştırmalı fizyoloji5 ve ekofizyoloji6,7 dahil olmak üzere disiplinler, kas termogenezinin endotermiye nasıl katkıda bulunabileceğini ve bu mekanizmanın çevreye nasıl uyum sağladığını anlamaya ilgi göstermiştir. Sunulan protokol, bu soruları ele almak için gerekli kritik yöntemleri sağlar.
Sağlanan yöntem, kas sıcaklığının hem bağlamsal hem de farmakolojik uyaran modülasyonunun değerlendirilmesinde, avcı tehdidini çoğaltmak için bağlamı değiştirmek için yırtıcı koku (PO) sağlamanın benzersiz tekniği de dahil olmak üzere kullanılabilir. Önceki raporlar, PO'nun kas termojenezi8'de hızlı bir şekilde büyük bir artışa neden olma yeteneğini göstermiştir. Ayrıca, farmakolojik uyaranlar kas sıcaklığını da değiştirebilir. Bu, nadolol kullanarak periferik β-adrenerjik reseptörlerin farmakolojik blokajının, koşu bandı yürüyüşü sırasında kasılma termojenezini önemli ölçüde etkilemeden PO'nun kas termojenezini indükleme yeteneğini inhibe ettiği PO kaynaklı kas termojenezi bağlamında gösterilmiştir8. Sıçanlarda melanokortin reseptör agonistlerinin merkezi olarak uygulanması, termojenezi değiştiren beyin mekanizmalarını ayırt etmek için de kullanılmıştır 9,10.
Burada sağlanan, nörohormon oksitosinin (Oxt) farelerde kas termojenezini değiştirme yeteneğinin bir ön araştırmasıdır. Yırtıcı hayvan tehdidine benzer şekilde, aynı cinsiyetten bir konspesifik ile sosyal karşılaşmalar, sosyal hipertermi11 olarak adlandırılan bir fenomen olan vücut ısısını arttırır. Oxt'nin sosyal davranış12 ile ilgisi göz önüne alındığında, Oxt'un farelerde sosyal hiperterminin bir aracısı olduğu tahmin edilmektedir. Gerçekten de, bir oksitosin reseptör antagonisti, farelerde sosyal hipertermiyi azaltır11 ve Oxt'den yoksun fare yavruları, termojenez13 de dahil olmak üzere termoregülasyonun davranışsal ve fizyolojik yönlerinde eksiklikler gösterir. Harshaw ve ark.'nın (2021) sosyal hipertermi11 ile β3 adrenerjik reseptöre bağımlı kahverengi yağ dokusu (BAT) termojenezini destekleyen kanıtlar bulamadıkları göz önüne alındığında, sosyal hiperterminin Oxt'un kas termogenezi indüksiyonu tarafından yönlendirilebileceği öne sürülmüştür.
İskelet kası termojenezini ölçmek için, aşağıdaki protokol, bir fare veya sıçan 8,10,14,15 içindeki ilgili kasın bitişiğindeki önceden programlanmış IPTT-300 transponderlerinin implantasyonunu kullanır. Bu transponderler, karşılık gelen transponder okuyucuları kullanılarak okunan cam kapsüllü mikroçiplerdir. Çok az araştırma bu teknolojiyi bu kapasitede kullanmamıştır, ancak çalışmalar bu yöntemin sağladığı özgüllüğe ihtiyaç duyulduğunu ileri sürmüştür16,17. Önceki araştırmalar, bu yöntemin güvenilirliğini ve sıcaklık transponderlerinin diğer sıcaklık testi yöntemleriyle karşılaştırıldığındaveya cerrahi yöntemlerle (örneğin, kanülasyon19) birlikte kullanılabileceği çeşitli yollar göstermiştir. Bununla birlikte, bu nitelikteki çalışmalar, genel vücut ısısı 20,21,22 veya BAT 23,24,25 gibi belirli dokuları ölçmek için farklı stratejik yerleşimlere dayanmaktadır.
Bu konumlardan veya kulak veya rektal termometreler26 kullanırken sıcaklığı ölçmek yerine, burada açıklanan yöntem ilgilenilen kas için özgüllük sağlar. İlgilenilen kaslara bitişik transponderleri doğrudan implante ederek bir bölgeyi hedefleme yeteneği, özellikle kas termojenejenini araştırmak için daha etkilidir. Yüzey kızılötesi termometri 27,28 veya termokupl29 aracılığıyla kutanöz sıcaklık ölçümleri ile sağlananlara ek olarak yeni bir yol sağlar. Ayrıca, bu yöntemle sağlanan veriler, kızılötesi termografi30,31,32 gibi büyük, pahalı, yüksek teknolojili ekipman ve yazılımlara ihtiyaç duymadan bir dizi araştırma yolu sunmaktadır.
Bu yöntem, kuadriseps ve gastroknemiustaki sıcaklığı tek taraflı veya iki taraflı olarak ölçmek için başarıyla kullanılmıştır. Bu yöntem stereotaksik cerrahi ile birlikte de etkili olmuştur14,15. Transponder uzuvdan ~ 7-10 cm içinde, sıcaklığı taramak, ölçmek ve görüntülemek için taşınabilir transponder okuyucular (DAS-8027 / DAS-7007R) kullanılır. Bu mesafe, önceki araştırmalar 8,9,10 için kritik ve değerli olmuştur, çünkü test prosedürleri sırasında potansiyel stresörleri ve hayvan kullanımı gibi sıcaklık değiştiren değişkenleri en aza indirir. Zamanlayıcılar kullanılarak, ölçümler daha sonra hayvanlarla doğrudan etkileşim olmadan belirli bir süre boyunca kaydedilebilir ve toplanabilir.
Test sırasında farelerin rahatsızlığını daha da azaltmak için, bu yöntem, deneycinin test sırasında ev kafeslerinin dibine erişmesini sağlamak için PVC borulardan yapılmış yükselticilerin montajını ve kullanımını açıklar. Yükselticiler dijital okuyucu ile birlikte kullanılarak, transponder uzuvun sıcaklık ölçümleri, uyaran yerleştirildikten sonra herhangi bir hayvan etkileşimi olmadan yapılabilir. Minimum maliyetle, bu yöntem farmakolojik ve bağlamsal uyaranlarla birlikte kullanılabilir ve bu da araştırmacılar için oldukça erişilebilir olmasını sağlar. Ek olarak, bu yöntem bir seferde önemli sayıda denekle (~ 16 fare veya ~ 12 sıçan) kullanılabilir ve herhangi bir araştırma projesi için genel verimi arttırmada zaman kazandırır.
Bu yöntemde tanıtılan, bundan böyle "çay topları" olarak adlandırılan paslanmaz çelik örgü çay demleme topları kullanarak farelere koku sunmak için hazırlanmış bir mekanizmadır. Bu çay topları herhangi bir koku malzemesi içermek için ideal olsa da, bu çalışmalarda, farelerin ve sıçanların doğal bir avcısı olan yaban gelinciği için 2-3 hafta boyunca kafes içi yatak görevi gören havlular, her tedavi çay topunun içine yerleştirilir. Her havlu 5 cm x 5 cm kareler halinde kesilir. Bu alıntılama, aksi takdirde aynı kokusuz kontrol havluları ile de tekrarlanır. Bu kokuları bir bariyer olmadan (yani çay topu) sunmak, farelerin kafeslerindeki lifleri parçalamasına ve fiziksel aktiviteyi arttırmasına neden oldu. Bu davranış sıçanlarda belirgin değildi. Çay topları, havluya havalandırılan bir muhafaza sağlar ve deneysel denemenin tamamı boyunca korunurken kokuya tam erişim sağlar. Bu çay topları, hayvan kullanım protokollerine uygun olarak sterilize edilebilir, kontrol uyaranı ile birlikte hayvanları yapıya alıştırmaya başlamak için ameliyattan hemen sonra hazırlanabilir ve tanıtılabilir. Fareler daha sonra akut uyaran sunumunun belirginliğini azaltarak ek zenginleştirme ile yaşayabilirler.
Çay topunun varlığına alışmak, bu yöntem için kritik olan alışkanlığın sadece bir yönüdür. Tanımlanan alışkanlık protokolü aynı zamanda test ortamını normalleştirmek için test prosedürüne tekrar tekrar maruz kalmaktan oluşur (yani, personel, test yerine ulaşım ve hareket, uyarana maruz kalma). Bu genişletilmiş alışkanlık, hayvanlardan gelen nüanslı tepkileri en aza indirir ve ölçümleri istenen bağımlı değişkenlere (örneğin, farmakolojik veya bağlamsal uyaranlar) odaklar. Bu protokolün önceki değerlendirmesi, sıçanlarda ev kafeslerinde sıcaklık testinden önce gerekli minimum alışkanlık sayısı olarak dört çalışma tanımlamıştır8. Test uzun sürelerle (2-3 haftadan fazla) ayrılırsa, hayvanlar tekrar alışkanlık haline getirilmelidir. Tekrarlanan alışkanlık için, en az bir ila iki deneme yeterlidir. Bununla birlikte, sıcaklık testleri daha uzun süreli zaman dilimleri ile ayrılırsa, daha fazla denemenin tekrarlanması gerekebilir.
Fareleri ve sıçanları test prosedürüne alıştırmak için devam eden çabalarda, uyaran sunumundan önce bir alışma süresi her deneysel çalışmaya dahil edilmelidir. Bu alışma süresi, test yerine kaydırıldıktan sonra sıcaklığı ve aktiviteyi yeniden dengelemek için kritik öneme sahiptir. Kemirgenler translokasyon nedeniyle keskin sıcaklık artışlarına sahip olma eğilimindedir. Alışma, herhangi bir farmakolojik ajan veya bağlamsal uyaranın eklenmesinden önce test gününde deneycinin etkileşimi olmadan en az 1 saatten oluşmalıdır. Bu, her test günü gereklidir.
Özetlenen ev kafesi sıcaklık testlerinde, fareler, test edilen uyarana yanıt olarak dolaşmak için ev kafeslerinin serbest menziline sahiptir. Bu, aktivitede değişken kaymalara neden olabilir, sıcaklık okumalarının doğruluğunu ve dolayısıyla bağımsız değişkenin termojenik etkilerinin analizini (örneğin, farmakolojik veya bağlamsal uyaran) etkileyebilir. Aktivite seviyesine bağlı olarak sıcaklıktaki potansiyel değişikliklerin tanınmasında, koşu bandı yürüyüşü sırasında sıcaklığın kullanımını açıklayan bir protokol aşağıda yer almaktadır. Yayınlanan literatür, bu prosedürün sıçanlarda başarılı bir şekilde kullanıldığını açıklamaktadır ve şu andafareler 8,10,14,15 ile kullanılmaktadır. Koşu bandı yürüyüşü, test konusu için sabit bir aktivite hızını korur. Bu çalışma için, koşu bantları kesinlikle aktivite seviyesini kontrol etmek için kullanılır ve bu nedenle, fareler için yürümeyi ve sıçanlar için benzer şekilde düşük bir ayarı teşvik etmek için koşu bandında mevcut en düşük hıza ayarlanır.
Farelerde tek taraflı gastroknemiusun sıcaklık ölçümü ve yırtıcı koku sunumu için aşağıdaki prosedür özetlenmiştir. Tasarım farmakolojik ajanlarla birlikte kullanılabilir ve farelerde sıçanlara ve diğer iskelet kas gruplarına (yani kuadriseps) aktarılabilir. Sıçanlar için, transponderler gastroknemiusa iki taraflı olarak ve kahverengi yağ dokusuna yerleştirilebilir. Boyut ve mesafe sınırlamaları nedeniyle, fare başına yalnızca bir transponder kullanılabilir. Farmakolojik ajanlara termojenik yanıtları değerlendirmek için küçük değişiklikler (örneğin, bağlamsal uyaranların çıkarılması) yapılabilir.
Protokol
Bu yöntemler hem sıçan hem de fare modellerine uygulanabilir ve kurumsal onay ile gerçekleştirilmiştir (Kent State University, IACUC Approval #359 ve #340 CN 12-04). Protokolün uygulanmasından önce, hayvanlar Laboratuvar Hayvanlarının Bakımı ve Kullanımı Kılavuzuna uygun olarak barındırılmalıdır.
1. Transponder okuyucunun hazırlanması
NOT: Kullanmadan önce, transponder okuyucu ayarlanmalıdır; Aşağıdaki adımlar yalnızca bu etüt için gerekli ayar değişikliklerini içerir. Protokolün bu kısmı doğrudan DAS-8027-IUS taşınabilir okuyucularla ilişkilidir; diğer okuyucu modelleri, programlama sonuçları elde etmek için kılavuz tarafından sağlanan talimatları izlemelidir.
- Ses Bip Sesi öğesini KAPALI olarak ayarlayın.
- SCAN düğmesine basarak cihazı açın ve aydınlatmanın OLED ekranda görünmesini bekleyin. Menü ekranına gitmek için GERİ/MENÜ düğmesini basılı tutun.
- NEXT/ENTER düğmesini kullanarak, OPERATIONAL SETUP'a kadar seçenekler arasında gezinin. Burada, EVET'i çevirmek için yukarı veya aşağı okları değiştirin ve işlem alt menüsünü açın.
- NEXT/ENTER düğmesini kullanarak AUDIO BEEP'e gidin. Varsayılan ayar AÇIK olduğundan, yukarı veya aşağı okları değiştirin ve ayarı KAPALI olarak değiştirin.
- Bu ayar değişikliğini kaydetmek için İLERİ/ENTER düğmesine basın.
- Okunduktan Sonra Titreştir'i AÇIK olarak ayarlayın.
- Adım 1.1'den adım 1.2'ye kadar olan adımları izleyin veya adım 1.4'ten hemen sonra bir sonraki adımı tamamlayın.
- NEXT/ENTER düğmesini kullanarak, OKUMA ÜZERİNDE TİTREŞTİR'e gidin. Varsayılan ayar KAPALI olduğundan, ekranı görüntüleyebilmekten bağımsız olarak okuma tamamlandığında titreşim yoluyla hissetmek için yukarı ve aşağı okları değiştirin ve ayarı AÇIK olarak değiştirin.
2. Program transponderleri
NOT: İmplante edilen her transponder öncelikle bir hayvan kimliği (hayvan kimliği veya transponder kimliği) ile programlanmalıdır. Bu isimlendirme, test konusu için ikincil tanımlama olarak kullanılabilir (örneğin, fare suşu kısaltması için dört basamak, transponderin konumu ve hayvan sayısını belirtmek için ek üç ila dört basamak). Programlama, ameliyattan günler önce tamamlanabilirken, transponderler ameliyattan önce steril tutulabilir.
- Transponder üzerindeki Kimlik Kodunu girin.
- Okuyucu kafasına, programlama prosedürüne yardımcı olan DAS 8027-IUS modeli için özel bir aksesuar olan bir güçlendirici bobini uygulayın.
- Eldivenli bir el kullanarak, transponderi (aplikatörün içine) güçlendirici bobinine yerleştirin.
- TARAMA düğmesine basarak cihazı açın ve OLED ekranın yanmasını bekleyin. Menü ekranına gitmek için GERİ/MENÜ düğmesini basılı tutun.
- NEXT/ENTER düğmesini kullanarak, WRITE TRANSPONDER ID'ye kadar seçenekler arasında gezinin. Burada, EVET'i çevirmek için yukarı veya aşağı okları değiştirin.
- NEXT/ENTER düğmesini kullanarak ID CODE'u GİRİN seçeneğine geçin.
- Sayılar ve harfler arasında gezinmek için yukarı ve aşağı ok tuşlarını kullanın. Aşağıdaki karaktere geçmek için her karakter seçiminden sonra NEXT/ENTER tuşlarına basın.
- Kimlik kodu tamamlandığında, transponderi yazmak için SCAN tuşuna basın.
- Transponderi güçlendirici bobininden çıkarın ve gerektiğinde tekrarlayın. Transponderin kapalı transponderleri eldivenli eller arasında ısıtarak ve sıcaklık tarayıcısını kullanarak ölçerek sıcaklık değişimlerini okuyup okumadığını kontrol edin.
NOT: OTOMATIK ÇOKLU YAZMA ve Sıralı SAYI ayarları, bir oturum sırasında çoklu veya sıralı transponder programlamaya izin vermek için AÇIK olarak ayarlanabilir. Her transponder programlama sırasında test edilmelidir.
3. "Ev kafesi topları" hazırlayın
- 5 cm x 5 cm kokusuz/kontrol havlusunu bir çay topunun içine yerleştirin.
- Bu ev kafesi toplarını, hayvanı test sırasında bağlamsal uyaranların sunulacağı yönteme alıştırmaya başlamak için ameliyattan sonra yeni ev kafeslerine yerleştirin. Bu ev kafesi toplarını her 2 haftada bir değiştirin.
4. Ameliyat ve ameliyat sonrası bakım
- Deneklerin ameliyat öncesi vücut ağırlığını tartın ve kaydedin. Bir indüksiyon odası kullanarak, hayvana anestezi (örneğin,% 2-5 izofluran) sağlayın.
- Elektrikli makaslar kullanarak, arka bacağı tamamen tıraş edin. Analjezi (örneğin, 5 mg / kg ketoprofen, s.c.) kurumsal kılavuzlara uygun olarak uygulayın.
NOT: Bu prosedür diğer cerrahi yöntemlerle kombine edilirse ek analjezi gerekebilir. - Bölgeyi% 70 alkol (veya ticari olarak temin edilebilen steril alkollü mendil) ve povidon-iyot yıkama (veya ticari olarak temin edilebilen steril, ayrı ayrı sarılmış betadin çubukları) ile en az üç kez dönüşümlü olarak povidon-iyot ile bitirerek temizleyin.
- Hayvanı indüksiyon odasına geri döndürün ve hayvanı cerrahi seviyelere getirin. Ardından, anesteziye sürekli maruz kalmak için fareyi bir yüz maskesine yerleştirin. Anestezi altındayken kuruluğu önlemek için hayvanın gözlerine neomisin oftalmik merhem uygulayın.
NOT: Fare, ağrı alımına dair hiçbir kanıt göstermeyene kadar prosedür başlamamalıdır (örneğin, kornea refleksi, kuyruk kıstırma tepkisi, ayak parmağı sıkışma refleksi). - Sadece cerrahi makas kullanarak, sağ arka bacaktaki deriden sığ bir kesim yapın.
- Gastroknemiusa paralel hareket ederek, önceden programlanmış ve açılmamış steril bir transponderin keskin kenarını insizyona yerleştirin. Yeşil pistonun yukarı baktığından ve görünür olduğundan emin olun. Transponder aplikatörünün açıklığı artık görünmeyene kadar transponder aplikatörünü insizyona itmeye devam edin.
NOT: Adım 4.6 sırasında transponder aplikatörü üzerindeki yeşil pistona yanlışlıkla basmayın. Transponderin erken boşalması yanlış yerleştirmeye yol açacaktır. - Aplikatörü 180° çevirin, böylece yeşil pistonun farenin uzvuna doğru aşağı bakmasına neden olur ve artık deneyci tarafından görülemez. Transponder aplikatörünü son konuma itin. İdeal yerleştirmeye girdikten sonra, gastroknemiusun bitişiğinde veya kısmen içine alındığında, yeşil pistonu iterek, aplikatörün basıncının araştırmacının elini fareden uzağa yönlendirmesine izin verin.
- Forseps kullanarak, açılan cildi bir arada tutun ve steril bir otomatik klip veya steril sütür ile bir yara klipsi yerleştirin. Gerekirse, fasya tabakasını kapatmak için steril otomatik klipsten önce emilebilir dikişler kullanın. Transponder okuyucuyu kullanarak, fare kasının sıcaklığını kontrol edin.
- Fareyi anesteziden çıkarın ve iyileşme için düşük olarak ayarlanmış su sirkülasyonlu bir ısıtma yastığının üzerine yerleştirilmiş temiz bir ev kafesine yerleştirin. Ev kafesinin alışkanlığa başlamak için kokusuz bir havlu içeren bir çay topu içerdiğinden emin olun.
NOT: Fare 15 dakika içinde ameliyattan uyanmalıdır. İyileşme günlerinde kolay erişim için yiyecekler kafesin altına yerleştirilebilir. - Postoperatif bakım
- Ameliyattan sonra en az 2 gün boyunca veya fareler vücut ağırlığını yeniden kazanana veya stabilize edene kadar bir transponder okuyucu kullanarak günlük fare ağırlıklarını ve sıcaklıklarını kaydedin.
- Narkotik olmayan analjezi (örneğin, 5 mg / kg ketoprofen, s.c.) günde bir kez farelere ameliyat sonrası en az 2 gün boyunca uygulayın ve gerektiğinde ek dozlar sağlayın.
NOT: Fareler ve sıçanlar ameliyattan sonraki 5-8 gün içinde tamamen iyileşmelidir ve alışkanlık ve test prosedürlerine tabi tutulabilir.
5. Test hazırlığı - ev kafesi
- Yükselticilerin inşası
NOT: Aşağıdaki adım, 194 mm x 181 mm x 398 mm fare filtresi üstlü kafesleri temel alır. Daha büyük kafeslere (örneğin, bir sıçan ev kafesi) sığdırmak için, genişliğin ayarlanması gerekecektir.- PVC boruyu cırcırlı bir PVC kesici ile sekiz bölüme ayırın ve Şekil 1C'yi izleyerek monte edin. Bu, yaklaşık dört kafesi tutabilen açık bir masa üstü yapısı verecektir. İstediğiniz sayıda yükseltici yapın.
- Oda kurulumu
- Sınav odasındaki her yükselticiye bir konum atayın. Karıştırıcı değişkenleri önlemek için farklı bağlamsal uyaranları (yani kokuları) alacak şekilde ayarlanmış yükselticileri en az 2 m ayırın.
NOT: Her farenin, farklı konumlar ve termojenik uyaranlar arasında ilişki gelişmesini önlemek için mümkün olduğunca test odası içinde ve fiziksel yükselticiler üzerinde atanmış bir test yeri olmalıdır. - Manyetik şeritler kullanarak, yükselticiler boyunca cerrahi çarşaflar veya önlükler takın, araştırmacı ve test denekleri arasında görsel bir bariyer oluşturun. Bu bariyeri, kafese doğru hareket eden deneycileri veya test odasının etrafında izlerken fare etkinliğinden kaynaklanan sıcaklık değişikliklerini en aza indirecek şekilde ayarlayın.
- (İsteğe bağlı) Test sırasında kafes tabanının görüntülenmesini kolaylaştırmak için aynaları yükselticilerin altındaki yüzeye yerleştirin.
NOT: Yükselticiler bir kafes yıkama sistemi ile sterilize edilebilir. Bez veya cerrahi çarşaflar alışkanlık ve testten önce yıkanmalıdır.
- Sınav odasındaki her yükselticiye bir konum atayın. Karıştırıcı değişkenleri önlemek için farklı bağlamsal uyaranları (yani kokuları) alacak şekilde ayarlanmış yükselticileri en az 2 m ayırın.
- Çay topu hazırlama
- Kontrol ve PO havlu ile çay topları hazırlayın (yaklaşık 5 cm x 5 cm). Çapraz kontaminasyonu önlemek için, önce kontrol-koku çay topları hazırlayın.
NOT: Yırtıcı kokulu havlular kullanılmadan önce patojen testinden geçirilmelidir. Bu havlular da içermeli ve onlarla etkileşime giren malzemeler derhal sterilize edilmeli (yani kafes yıkama), kokunun diğer hayvanlara maruz kalmasını önlemelidir.
- Kontrol ve PO havlu ile çay topları hazırlayın (yaklaşık 5 cm x 5 cm). Çapraz kontaminasyonu önlemek için, önce kontrol-koku çay topları hazırlayın.
6. Sıcaklık testi - ev kafesi
NOT: Hayvanların, deneysel bağlamsal veya farmakolojik uyaranlar hariç, tüm test prosedürüne alışması gerekir. Bu, testten önce en az 4x tamamlanmalıdır.
- Hayvanları hazırlanan test odasına aktarın. Hayvanları yükselticide önceden belirlenmiş bir yere yerleştirin. Bu konum tüm alışkanlık ve test prosedürleri boyunca aynı olmalıdır.
- "Ev kafesi topunu" fare ev kafesinden çıkarın ve kafesleri bir bez veya cerrahi çarşafla tekrar örtün. Farelerin 1-2 saat boyunca test alanına alışmasına izin verin.
- Alışma tamamlandıktan sonra, her bir nesnenin temel sıcaklığını ölçmek ve kaydetmek için tarayıcıyı kullanın. Ölçümler sırasında bez kaplamaları manipüle etmekten kaçının.
NOT: Farmakolojik ajanlar buraya uygulanabilir. Enjeksiyon veya uygulama sonrası bekleme süresi, testten önce gerektiğinde eklenebilir. Farmakolojik uyaranlara yanıtı izlemek için farmakolojik bir ajanın eklenmesinden sonra testten hemen önce ikincil bir taban çizgisinin kaydedilmesi önerilir. Koku tepkisi test edilmiyorsa, farelerin sıcaklık ölçümleri enjeksiyondan hemen sonra başlayabilir. Herhangi bir uyaran sağlarken randomizasyon kullanılmalıdır. - Kafesi ortaya çıkarın ve çay topunu (kontrol veya PO) ev kafesinin zeminine yerleştirin. Kafes kapağını ve bez kaplamayı yerine takın.
- Kronometreyi başlatın. Test deneklerinin sıcaklıklarını aynı çay topu yerleştirme sırasına göre ölçün. İstenilen zaman noktalarını takip eden ölçümlerin sıcaklıklarını ve saat zamanını kaydedin.
- Deney tamamlandığında, tedavi topunu çıkarın. PO alan fareleri orijinal "ev kafesi topu" ile yeni bir ev kafesine yerleştirin. "Ev kafesi topunu" kontrol kokusu alan farelerin kafesine geri döndürün. Fareleri muhafaza yerine aktarın.
NOT: Yukarıdaki prosedür, uygun büyüklükteki kafesler içindeki sıçan modellerine çevrilebilir. Ev kafesinin dibine daha iyi erişim sağlamak için Şekil 1C'de önerilen ölçümlerde ayarlamalar yapılması gerekebilir.

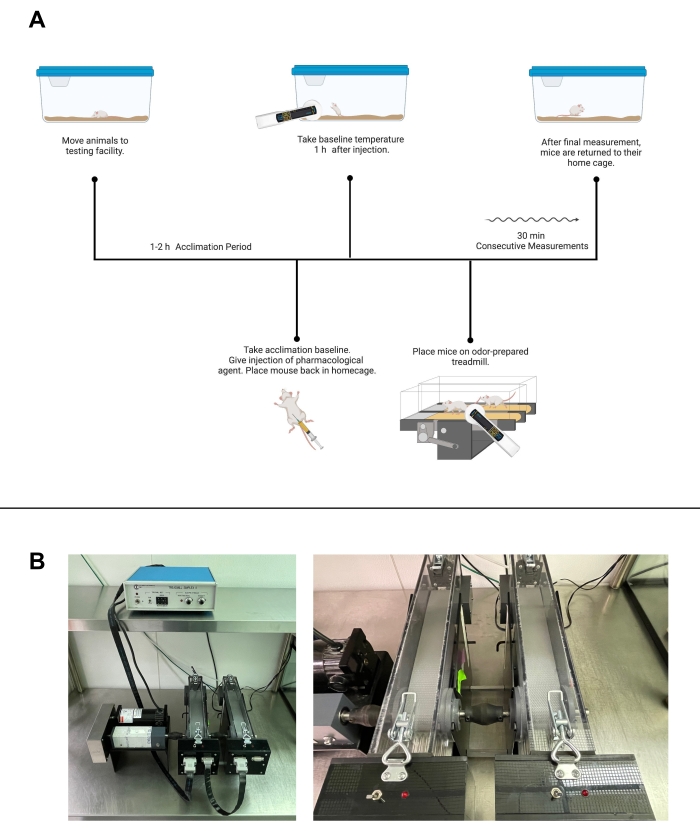
Şekil 1: Transponderler ve ev kafesi sıcaklık testi . (A) Bir fare gastroknemiusunda sıcaklığı test etmek için tek taraflı transponder yerleştirme diyagramı. Programlandıktan ve yerleştirildikten sonra, transponder okuyucu (DAS-8027-IUS, gösterilmiştir) sıcaklığı ölçmek için kullanılabilir. (B) Solda, açık örgülü paslanmaz çelik çay topu ve 5 cm x 5 cm havlunun fotoğrafı. Sağda, kapalı çay topu, ev kafesi testinde alışkanlık ve koku havlularını tutmak için kullanılır. (C) Ev kafesi testi için PVC borularla inşa edilmiş yükselticilerin şeması. (D) Ev kafesi test protokolünün iş akışı. (E) Ev kafesi test alanının tesis görüntüleri. Solda, bir yükselticinin üstünde dört fare kafesi. Manyetik şeritler bitişik duvarda bulunur ve mıknatıslar ve cerrahi bez masanın üzerindedir. Sağda, yükselticilerde kapalı fare kafesleri. (A), (C) ve (D) Biorender.com ile oluşturulmuştur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
7. Sıcaklık testi - koşu bandı yürüyüşü
- Her hayvana alışkanlık ve test prosedürleri için atanmış yerleri olarak bir koşu bandı atayın.
- Koşu bantlarını test için hazırlayın ve şokörlerin işlevsel olduğundan emin olun.
NOT: Koşu bandı yürüyüşü için, koşu bantları sürekli hareketi teşvik eden, ancak hem alışkanlık hem de test için koşmayan mevcut en düşük hızda ayarlanmalıdır. 1012M-2 Modüler Kapalı Metabolik Koşu Bandı için bu, fareler için 5,2 m / dak ve sıçanlar için 7 m / dak'dır. Bu hızın konunun obezitesine göre ayarlanması gerekebilir. Şokerler 5.0 yoğunluk ve tekrarlama oranına ayarlanmalıdır. - Alışkanlık
- Fareleri test odasına taşıyın. Farelerin ev kafeslerindeki oda transferine alışmaları için 1-2 saat izin verin.
- Alıştıktan sonra, fareleri atanmış koşu bandının açılmasına yönlendirin ve koşu bandını kapatın. Kayışı, şoker'ı ve kronometreyi çalıştırın.
- Farelerin koşu bantlarında 15 dakika yürümesine izin verin, şok uyaranını hareket için motivasyon olarak kullanın. Bir hayvan uzun süre aktif bir şok cihazında kalırsa testi derhal durdurun.
- Testten sonra, fareleri çıkarın ve ev kafeslerine geri getirin.
- Koşu bantlarını sıvı deterjan ve su kullanarak temizleyin.
- Test etme
- Fareleri test odasına taşıyın. Farelerin ev kafeslerindeki oda transferine alışmaları için 1-2 saat bekleyin.
- Fareyi koşu bandına hareket ettirmeden önce taban çizgisi sıcaklığını ölçün ve kaydedin.
NOT: Farmakolojik ajanlar da dahil olmak üzere testler için, Şekil 2A'da gösterilen şemayı izleyerek bunları buraya uygulayın veya enjekte edin. Enjeksiyondan sonra bekleme süresi, fareler koşu bandına yerleştirilmeden önce gerektiği gibi eklenebilir. Herhangi bir uyaran sağlarken randomizasyon kullanılmalıdır. - 5 cm x 5 cm karelik kontrol veya PO havluları koşu bandının önüne en yakın koşu bandına yerleştirin. Kolay yerleştirme ve çıkarma için havluları koşu bandının tavanına veya altına yapıştırın.
- Fareleri atanan koşu bandına yönlendirin. Koşu bandı kemerini ve şokerini açın.
- Kronometreyi başlatın. Test deneklerinin ölçümlerini, farelerin koşu bantlarında kurulduğu sırayla alın. İstenilen zaman noktalarını takip eden ölçümlerin sıcaklıklarını ve saat zamanını kaydedin.
NOT: Sıcaklık, koşu bandının dışından güvenilir bir şekilde ölçülebilirken, bir fare yürüme aktivitesi sırasında kapalı bir koşu bandının içindedir. Sıçanlar için, koşu bandı boyutu ve transponder-okuyucu mesafesi sınırlamaları, okuyucuyu koşu bandının içine, konuya daha yakın bir yere yerleştirmek için koşu bandının arkasını açık tutması için bir deneycinin çalışmasını gerektirebilir. - Test tamamlandığında, şokerleri ve koşu bantlarını kapatın; fareleri ev kafeslerine geri döndürün. Fareleri muhafaza yerine aktarın.
- Koşu bantlarını sıvı deterjan ve su kullanarak temizleyin, kalan PO'yu çıkarmak için özellikle dikkat edin.
- Deneyler tamamlandığında, hayvanları ötenazi yapın (örneğin, CO2 inhalasyonunu kullanarak) ve transponder yerini görsel olarak onaylayın.
Şekil 2: Aktivite kontrollü sıcaklık testi. (A) Koşu bandı yürüyüşü kullanan farmakolojik bir ajanla aktivite kontrollü sıcaklık testinin iş akışı. (B) Koşu bantlarının tesis görüntüleri. Solda, tam ekipman kurulumunun bir görüntüsü. Sağda, bireysel koşu bantlarının ve şok cihazlarının daha yakın bir görüntüsü. (A) Biorender.com ile yaratılmıştır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Transponderler, SF1-Cre suşundan (Tg (Nr5a1-cre) 7Lowl / J, Suş # 012462, C57BL / 6J ve FVB arka planlarından; dişi N = 5; erkek N = 5) yetiştirilen on adet 4-6 aylık, vahşi tip (WT) farenin sağ gastroknemisine tek taraflı olarak implante edildi. İyileşmeden sonra, fareler bağlamsal bir uyaran içermeyen bir ev kafesi sıcaklık testi prosedürüne alıştılar (örneğin, PO). Bir transponder değnek kullanılarak yapılan sıcaklık ölçümleri, muhafaza odalarına ve test yerine aktarıldıktan sonra kayd...
Tartışmalar
Bu sıcaklık testi protokolü, alana iskelet kası termojenezini doğrudan ölçmek için bir yol sağlar. Bu, araştırmaların kas termojenezinin altında yatan mekanizmaları tanımlamaya çalıştığı içinkritik öneme sahiptir 33. Yöntem, bağlamsal ve farmakolojik koşullar altında iskelet kası termojenezisini ölçmek için iki uygun maliyetli protokol sağlar. Bu protokol, bu prosedürler içinde hem alışkanlık hem de alışmanın önemini vurgulamaktadır. Alışkanlık, herhang...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma R15 DK097644 ve R15 DK108668 tarafından desteklenmektedir. Önceki katkıları için Dr. Chaitanya K Gavini ve Dr. Megan Rich'e ve kurumsal hayvan kullanım kurallarına uymamızı sağladıkları için Dr. Stanley Dannemiller'e teşekkür ederiz. Bu yöntemi ve ilgili çalışmalarını oluşturmak için gerekli temel araştırmaları sağladığı için Dr. Tim Bartness'e özel bir teşekkür ederiz. Şekil 1A, C, D ve Şekil 2A, Biorender.com kullanılarak oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1012M-2 Modular Enclosed Metabolic Treadmill for Mice, 2 Lanes w/ Shock | Columbus Instruments | ||
| 1012R-2 Modular Enclosed Metabolic Treadmill for Rats, 2 Lanes w/ Shock | Columbus Instruments | ||
| 1-1/4 in. Ratcheting PVC Cutter | BrassCraft | ||
| 1 mL Syringes | Fisher Scientific | BD 309659 | |
| Betadine Swabs | Fisher Scientific | 19-898-945 | |
| Booster Coil | BioMedic Data Systems | Transponder Accessory | |
| Electric Clippers | Andis | 40 Ultraedge Clipper Blade | |
| Flexible Mirror Sheets | Amazon | Self Adhesive Non Glass Mirror Tiles | |
| Forceps | Fisher Scientific | 89259-940 | |
| Heating Pad | |||
| Induction Chamber (isoflurane) | Kent Scientific | VetFlo-0730 | 3.0 L Low Cost Chambers for Traditional Vaporizers |
| Ketoprophen | Med-Vet Intl. | RXKETO-50 | |
| Magnetic Strips | Amazon | ||
| Magnets | Amazon | DIYMAG Magnetic Hooks 40lbs | |
| Needles | Med-Vet Intl. | 26400 | |
| Neomycin/Polymixin/Bacitracin with Hydrocortisone Ophthalmic Ointment, 3.5 g | Med-Vet Intl. | RXNPB-HC | |
| Oasis Absorbable Suture | Med-Vet Intl. | MV-H821-V | |
| Predator (Ferret) Odor Towels | Marshall BioResources | ||
| PVC pipe | |||
| Reflex Wound Clip Remover | CellPoint Scientific | ||
| Reflex Wound Clip, 7 mm (mouse) | CellPoint Scientific | ||
| Reflex Wound Clip, 9 mm (rat) | CellPoint Scientific | ||
| Srerile Autoclip, 7 mm (mouse) | CellPoint Scientific | Wound Clip Applier (mouse) | |
| Stainless Strainers Interval Seasonings Tea Infuser | Amazon | ||
| Sterile Autoclip, 9 mm (rat) | CellPoint Scientific | Wound Clip Applier (rat) | |
| Sterile Saline | Med-Vet Intl. | RX0.9NACL-10 | |
| Surgical Scissors | Fisher Scientific | 08-951-5 | |
| Surgical Sheets | |||
| Towels (Control/Habituation) | Amazon | 100% Cotton Towels, white | |
| Transponders | BioMedic Data Systems | Model: IPTT-300 | |
| Transponders Reader | BioMedic Data Systems | Model: DAS-8027-IUS/ DAS-7007R | |
| Versaclean | Fisher Scientific | 18-200-700 | liquid detergent |
| Webcol Alcohol Preps | Covidien | 22-246-073 | |
| Wedge pieces for PVC pipe |
Referanslar
- Periasamy, M., Herrera, J. L., Reis, F. C. G. Skeletal muscle thermogenesis and its role in whole body energy metabolism. Diabetes Metabolism Journal. 41 (5), 327-336 (2017).
- Rowland, L. A., Bal, N. C., Periasamy, M. The role of skeletal-muscle-based thermogenic mechanisms in vertebrate endothermy. Biological Reviews of the Cambridge Philosophical Society. 90 (4), 1279-1297 (2015).
- Maurya, S. K., et al. Sarcolipin is a key determinant of the basal metabolic rate, and its overexpression enhances energy expenditure and resistance against diet-induced obesity. Journal of Biological Chemistry. 290 (17), 10840-10849 (2015).
- Grigg, G., et al. Whole-body endothermy: Ancient, homologous and widespread among the ancestors of mammals, birds and crocodylians. Biological Reviews of the Cambridge Philosophical Society. 97 (2), 766-801 (2022).
- Franck, J. P. C., Slight-Simcoe, E., Wegner, N. C. Endothermy in the smalleye opah (Lampris incognitus): A potential role for the uncoupling protein sarcolipin. Comparative Biochemistry and Physiology - Part A: Molecular & Integrative Physiology. 233, 48-52 (2019).
- Nowack, J., et al. Muscle nonshivering thermogenesis in a feral mammal. Scientific Reports. 9, 6378 (2019).
- Oliver, S. R., Anderson, K. J., Hunstiger, M. M., Andrews, M. T. Turning down the heat: Down-regulation of sarcolipin in a hibernating mammal. Neuroscience Letters. 696, 13-19 (2019).
- Gorrell, E., et al. Skeletal muscle thermogenesis induction by exposure to predator odor. The Journal of Experimental Biology. 223, (2020).
- Gavini, C. K., et al. Leanness and heightened nonresting energy expenditure: Role of skeletal muscle activity thermogenesis. The American Journal of Physiology - Endocrinology and Metabolism. 306 (6), 635-647 (2014).
- Almundarij, T. I., Gavini, C. K., Novak, C. M. Suppressed sympathetic outflow to skeletal muscle, muscle thermogenesis, and activity energy expenditure with calorie restriction. Physiological Reports. 5 (4), 13171 (2017).
- Harshaw, C., Lanzkowsky, J., Tran, A. D., Bradley, A. R., Jaime, M. Oxytocin and 'social hyperthermia': Interaction with beta3-adrenergic receptor-mediated thermogenesis and significance for the expression of social behavior in male and female mice. Hormones and Behavior. 131, 104981 (2021).
- Caldwell, H. K. Oxytocin and vasopressin: Powerful regulators of social behavior. The Neuroscientist. 23 (5), 517-528 (2017).
- Harshaw, C., Leffel, J. K., Alberts, J. R. Oxytocin and the warm outer glow: Thermoregulatory deficits cause huddling abnormalities in oxytocin-deficient mouse pups. Hormones and Behavior. 98, 145-158 (2018).
- Gavini, C. K., Britton, S. L., Koch, L. G., Novak, C. M. Inherently lean rats have enhanced activity and skeletal muscle response to central melanocortin receptors. Obesity. 26 (5), 885-894 (2018).
- Gavini, C. K., Jones, W. C., Novak, C. M. Ventromedial hypothalamic melanocortin receptor activation: regulation of activity energy expenditure and skeletal muscle thermogenesis. The Journal of Physiology. 594 (18), 5285-5301 (2016).
- Zaretsky, D. V., Romanovsky, A. A., Zaretskaia, M. V., Molkov, Y. I. Tissue oxidative metabolism can increase the difference between local temperature and arterial blood temperature by up to 1.3(o)C: Implications for brain, brown adipose tissue, and muscle physiology. Temperature. 5 (1), 22-35 (2018).
- Yoo, Y., et al. Exercise activates compensatory thermoregulatory reaction in rats: A modeling study. Journal of Applied Physiology. 119 (12), 1400-1410 (2015).
- Langer, F., Fietz, J. Ways to measure body temperature in the field. Journal of Thermal Biology. 42, 46-51 (2014).
- Pence, S., et al. Central apolipoprotein A-IV stimulates thermogenesis in brown adipose tissue. International Journal of Molecular Sciences. 22 (3), 1221 (2021).
- Li, D., et al. Homeostatic disturbance of thermoregulatory functions in rats with chronic fatigue. Journal of Neuroscience Research. 165, 45-50 (2021).
- Carlier, J., et al. Pharmacodynamic effects, pharmacokinetics, and metabolism of the synthetic cannabinoid AM-2201 in male rats. Journal of Pharmacology and Experimental Therapeutics. 367 (3), 543-550 (2018).
- Pato, A. M., Romero, D. M., Sosa Holt, C. S., Nemirovsky, S. I., Wolansky, M. J. Use of subcutaneous transponders to monitor body temperature in laboratory rats. Journal of Pharmacological and Toxicological Methods. 114, 107145 (2022).
- Almeida, D. L., et al. Lean in one way, in obesity another: Effects of moderate exercise in brown adipose tissue of early overfed male Wistar rats. International Journal of Obesity. 46 (1), 137-143 (2022).
- Brito, M. N., Brito, N. A., Baro, D. J., Song, C. K., Bartness, T. J. Differential activation of the sympathetic innervation of adipose tissues by melanocortin receptor stimulation. Endocrinology. 148 (11), 5339-5347 (2007).
- Vaughan, C. H., Shrestha, Y. B., Bartness, T. J. Characterization of a novel melanocortin receptor-containing node in the SNS outflow circuitry to brown adipose tissue involved in thermogenesis. Brain Research. 1411, 17-27 (2011).
- Kort, W. J., Hekking-Weijma, J. M., TenKate, M. T., Sorm, V., VanStrik, R. A microchip implant system as a method to determine body temperature of terminally ill rats and mice. Laboratory Animals. 32 (3), 260-269 (1998).
- Mei, J., et al. Body temperature measurement in mice during acute illness: Implantable temperature transponder versus surface infrared thermometry. Scientific Reports. 8, 3526 (2018).
- Warn, P. A., et al. Infrared body temperature measurement of mice as an early predictor of death in experimental fungal infections. Laboratory Animals. 37 (2), 126-131 (2003).
- Hargreaves, K., Dubner, R., Brown, F., Flores, C., Joris, J. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia. Pain. 32 (1), 77-88 (1988).
- Fiebig, K., Jourdan, T., Kock, M. H., Merle, R., Thone-Reineke, C. Evaluation of infrared thermography for temperature measurement in adult male NMRI nude mice. Journal of the American Association for Laboratory Animal Science. 57 (6), 715-724 (2018).
- Franco, N. H., Geros, A., Oliveira, L., Olsson, I. A. S., Aguiar, P. ThermoLabAnimal - A high-throughput analysis software for non-invasive thermal assessment of laboratory mice. Physiology & Behavior. 207, 113-121 (2019).
- Koganti, S. R., et al. Disruption of KATP channel expression in skeletal muscle by targeted oligonucleotide delivery promotes activity-linked thermogenesis. Molecular Therapy. 23 (4), 707-716 (2015).
- Bal, N. C., Periasamy, M. Uncoupling of sarcoendoplasmic reticulum calcium ATPase pump activity by sarcolipin as the basis for muscle non-shivering thermogenesis. Philosophical Transactions of the Royal Society B. 375 (1793), 20190135 (2020).
- Hicks, C., et al. Body temperature and cardiac changes induced by peripherally administered oxytocin, vasopressin and the non-peptide oxytocin receptor agonist WAY 267,464: a biotelemetry study in rats. British Journal of Pharmacology. 171 (11), 2868-2887 (2014).
- Kasahara, Y., et al. Oxytocin receptor in the hypothalamus is sufficient to rescue normal thermoregulatory function in male oxytocin receptor knockout mice. Endocrinology. 154 (11), 4305-4315 (2013).
- Kasahara, Y., et al. Role of the oxytocin receptor expressed in the rostral medullary raphe in thermoregulation during cold conditions. Frontiers in Endocrinology. 6, 180 (2015).
- Yuan, J., Zhang, R., Wu, R., Gu, Y., Lu, Y. The effects of oxytocin to rectify metabolic dysfunction in obese mice are associated with increased thermogenesis. Molecular and Cellular Endocrinology. 514, 110903 (2020).
- Scholl, J. L., Afzal, A., Fox, L. C., Watt, M. J., Forster, G. L. Sex differences in anxiety-like behaviors in rats. Physiology & Behavior. 211, 112670 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır