JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
마우스와 쥐의 골격근 열발생 측정
요약
마우스와 쥐는 원격 온도 트랜스폰더를 외과적으로 이식한 다음 테스트 환경과 절차에 익숙해집니다. 근육 온도의 변화는 홈 케이지의 약리학 적 또는 문맥 적 자극에 반응하여 또는 규정 된 신체 활동 (즉, 일정한 속도로 러닝 머신 걷기) 중에 측정됩니다.
초록
골격근 열 발생은 대사 항상성과 에너지 소비의 기본 메커니즘을 더 잘 이해할 수있는 잠재적 인 방법을 제공합니다. 놀랍게도 열 발생의 신경, 근세포 및 분자 메커니즘을 근육 온도의 측정 가능한 변화와 직접 연결하는 증거는 거의 없습니다. 이 논문은 온도 트랜스폰더를 사용하여 마우스 및 쥐 골격근 온도의 직접 측정을 검색하는 방법을 설명합니다.
원격 트랜스폰더는 생쥐와 쥐의 근육 내에 외과적으로 이식되며 동물에게 회복할 시간이 주어집니다. 마우스와 랫트는 시험 환경 및 절차에 반복적으로 익숙해 져야합니다. 근육 온도의 변화는 홈 케이지의 약리학 적 또는 문맥 적 자극에 반응하여 측정됩니다. 근육 온도는 또한 규정 된 신체 활동 (즉, 일정한 속도로 러닝 머신 걷기) 중에 측정되어 이러한 자극에 의해 유도 된 근육 온도의 변화에 기여하는 활동의 변화를 고려할 수 있습니다.
이 방법은 뇌, 교감 신경계 및 골격근 수준에서 근육 열 발생 제어의 기본 메커니즘을 설명하는 데 성공적으로 사용되었습니다. 포식자 냄새 (PO; 흰 족제비 냄새)를 문맥 적 자극으로 사용하고 옥시토신 (Oxt)을 약리학 적 자극으로 사용하여 포식자 냄새가 근육 열 발생을 유도하고 Oxt가 근육 온도를 억제하는 이러한 성공의 시연이 제공됩니다. 따라서 이러한 데이터 세트는 근육 온도의 급격한 변화를 감지하는 이 방법의 효능을 표시합니다.
서문
대사 연구 내에서 골격근 열 발생 검사는 체중 항상성을 조사하는 유망한 새로운 방법입니다. 출판 된 문헌은 신체의 가장 큰 장기 시스템 중 하나 인 골격근의 열 발생 반응이 에너지 소비 및 기타 대사 효과를 증가시키는 길을 제공하여 비만과 같은 질병 내에서 시스템을 효과적으로 재조정한다는 아이디어를지지합니다 1,2,3. 근육이 열 발생 기관으로 간주 될 수 있다면, 연구는이 기관 내의 열 발생 변화를 연구하기위한 실용적인 방법론을 활용해야합니다. 골격근의 흡열 효과와 떨리지 않는 근육 열 발생을 연구하기 위한 이 방법론의 유용성을 이해하려는 욕구는 대사 연구에만 국한되지 않습니다. 진화4, 비교생리학5, 생태생리학6,7을 포함한 학문은 근육 열발생이 흡열에 기여할 수 있는 방식과 이 메커니즘이 환경에 적응하는 방법을 이해하는 데 기득권을 보여주었습니다. 제시된 프로토콜은 이러한 질문을 해결하는 데 필요한 중요한 방법을 제공합니다.
제공된 방법은 포식자 위협을 복제하기 위해 컨텍스트를 이동시키기 위해 포식자 냄새(PO)를 제공하는 독특한 기술을 포함하여, 근육 온도의 상황적 및 약리학적 자극 조절 둘 다의 평가에 활용될 수 있다. 이전 보고서는 근육 열 발생의 상당한 증가를 빠르게 유도하는 PO의 능력을 입증했습니다8. 또한 약리학 적 자극은 근육 온도를 변화시킬 수도 있습니다. 이것은 PO 유도 근육 열 생성의 맥락에서 입증되었으며, 여기서 nadolol을 사용하는 말초 β- 아드레날린 성 수용체의 약리학 적 차단은 러닝 머신 보행 중 수축성 열 생성에 큰 영향을 미치지 않으면 서 근육 열 생성을 유도하는 PO의 능력을 억제했습니다8. 쥐에서 멜라노 코르 틴 수용체 작용제의 중앙 투여는 또한 열 발생 9,10을 변경하는 뇌 메커니즘을 식별하는 데 사용되었습니다.
여기에 제공된 것은 마우스의 근육 열 발생을 변화시키는 신경 호르몬 옥시토신 (Oxt)의 능력에 대한 예비 조사입니다. 포식자 위협과 유사하게, 동성 동종과의 사회적 만남은 체온을 상승시키는데, 이를 사회적 온열요법11이라고 합니다. Oxt와 사회적 행동12의 관련성을 감안할 때, Oxt는 생쥐의 사회적 고열의 매개체라고 추측되었습니다. 실제로, 옥시토신 수용체 길항제는 마우스11에서 사회적 온열요법을 감소시키고, Oxt가 결핍된 마우스 새끼는 열 발생13을 포함한 체온 조절의 행동 및 생리학적 측면에서 결함을 보입니다. Harshaw 등(2021)은 사회적 온열요법11에서 β3 아드레날린 수용체 의존성 갈색 지방 조직(BAT) 열 발생을 뒷받침하는 증거를 찾지 못했다는 점을 감안할 때, 사회적 온열요법은 Oxt의 근육 열 발생 유도에 의해 유발될 수 있다고 가정되었습니다.
골격근 열 발생을 측정하기 위해 다음 프로토콜은 마우스 또는 래트300 내의 관심 근육에 인접한 사전 프로그래밍 된 IPTT-8,10,14,15의 이식을 사용합니다. 이 트랜스폰더는 해당 트랜스폰더 판독기를 사용하여 판독되는 유리 캡슐화된 마이크로칩입니다. 이 능력에서이 기술을 활용 한 연구는 거의 또는 전혀 없었지만,이 방법에서 제공하는 특이성에 대한 필요성을 제안했습니다16,17. 이전의 조사들은 이 방법의 신뢰성 및 온도 트랜스폰더가 다른 온도 테스트 방법(18)과 비교하여 또는 외과적 방법(예를 들어, 캐뉼레이션(c�ulation)(19))과 함께 사용될 수 있는 다양한 방법을 보여주었다. 그러나 이러한 성격의 연구는 전체 체온20,21,22 또는 BAT 23,24,25와 같은 특정 조직을 측정하기 위해 다른 전략적 배치에 의존합니다.
이들 위치로부터 또는 귀 또는 직장 온도계(26)를 사용하는 동안 온도를 측정하는 대신, 여기에 설명된 방법은 관심있는 근육에 대한 특이성을 제공한다. 관심있는 근육에 인접한 트랜스 폰더를 직접 이식하여 부위를 타겟팅하는 능력은 근육 열 발생을 구체적으로 조사하는 데 더 효과적입니다. 표면 적외선 온도계(27, 28) 또는 열전대(29)를 통한 피부 온도 측정에 의해 제공되는 것 외에 새로운 길을 제공한다. 더욱이, 이 방법을 통해 제공된 데이터는 적외선 서모그래피(30,31,32)와 같은 크고 값비싼 첨단 장비 및 소프트웨어의 필요성을 피하면서 다양한 연구 방법을 제공한다.
이 방법은 대퇴사 두근과 비복근의 온도를 일방적 또는 양측으로 측정하는 데 성공적으로 사용되었습니다. 이 방법은 정위 수술14,15와 함께 효과적이었습니다. 트랜스폰더 사지의 ~7-10cm 이내에 휴대용 트랜스폰더 리더(DAS-8027/DAS-7007R)를 사용하여 온도를 스캔, 측정 및 표시합니다. 이 거리는 테스트 절차 중 동물 취급과 같은 잠재적 스트레스 요인 및 온도 변화 변수를 최소화하기 때문에 이전 조사 8,9,10에 중요하고 가치가 있습니다. 타이머를 사용하여 동물과의 직접적인 상호 작용없이 일정 기간 동안 측정 값을 기록하고 수집 할 수 있습니다.
테스트 중 마우스의 교란을 더욱 최소화하기 위해이 방법은 테스트 중에 실험자가 홈 케이지 바닥에 접근 할 수 있도록 PVC 배관으로 만든 라이저의 조립 및 사용을 설명합니다. 디지털 리더와 함께 라이저를 사용하면 자극이 배치 된 후 동물 상호 작용없이 트랜스 폰더 사지의 온도 측정을 수행 할 수 있습니다. 최소한의 비용으로이 방법은 약리학 적 및 문맥 적 자극과 함께 사용할 수있어 연구자가 쉽게 접근 할 수 있습니다. 또한 이 방법은 한 번에 상당한 수의 피험자(~16마리 마우스 또는 ~12마리의 쥐)에게 사용할 수 있으므로 모든 연구 프로젝트의 전체 처리량을 늘리는 데 시간을 절약할 수 있습니다.
이 방법에 도입 된 것은 스테인레스 스틸 메쉬 티 인퓨저 볼을 사용하여 생쥐에게 냄새를 나타내는 제작 된 메커니즘으로, 이제부터 "티 볼"이라고합니다. 이 티 볼은 모든 냄새 물질을 포함하는 데 이상적이지만,이 연구에서는 생쥐와 쥐의 자연 포식자 인 흰 족제비를 위해 2-3 주에 걸쳐 케이지 내 침구로 사용 된 수건을 각 치료 티 볼 안에 넣습니다. 각 수건은 5cm x 5cm 정사각형으로 자릅니다. 이 분취는 또한 동일한 무취 제어 타월로 반복됩니다. 장벽 (즉, 티 볼)없이 이러한 냄새를 나타내면 쥐가 우리 내에서 섬유를 파쇄하여 신체 활동을 증가 시켰습니다. 이 행동은 쥐에서 두드러지지 않았습니다. 티 볼은 수건에 통풍이 잘되는 케이스를 제공하여 실험 실험 내내 보호 상태를 유지하면서 냄새에 완전히 접근 할 수 있도록합니다. 이러한 티볼은 동물 사용 프로토콜에 따라 살균하고, 준비하고, 수술 직후에 도입하여 대조군 자극과 함께 동물을 구조물에 습관화하기 시작할 수 있다. 그런 다음 마우스는 추가 농축과 함께 살 수 있으며 급성 자극 표현의 현저성을 감소시킵니다.
티 볼의 존재에 대한 습관화는이 방법에 중요한 습관화의 한 측면 일뿐입니다. 설명된 습관화 프로토콜은 또한 테스트 환경을 정상화하기 위한 테스트 절차에의 반복적인 노출(즉, 인력, 테스트 위치로의 운송 및 이동, 자극에의 노출)로 구성됩니다. 이 확장된 습관화는 동물의 미묘한 반응을 최소화하고 원하는 종속 변수(예: 약리학적 또는 상황적 자극)에 측정을 집중합니다. 이 프로토콜에 대한 이전 평가는 쥐8의 집 케이지 내에서 온도 테스트 전에 필요한 최소 습관화 횟수로 4 건의 시험을 확인했습니다. 검사가 장기간 (2-3 주 이상) 분리되면 동물을 다시 습관화해야합니다. 반복적인 습관화의 경우 최소 1-2번의 시도로 충분합니다. 그러나 온도 테스트가 더 오랜 시간 동안 분리되면 더 많은 시도를 반복해야 할 수 있습니다.
마우스와 랫트를 시험 절차에 익숙하게하기위한 지속적인 노력에서, 자극 제시 전 적응 기간이 모든 실험 시험에 포함되어야한다. 이 적응 시간은 테스트 장소로 이동한 후 온도와 활동의 균형을 재조정하는 데 중요합니다. 설치류는 전좌로 인해 급격한 온도 상승을하는 경향이 있습니다. 순응은 약리학 적 약제 또는 문맥 자극을 추가하기 전에 시험 당일 실험자의 상호 작용없이 최소 1 시간으로 구성되어야합니다. 이것은 매일 테스트해야합니다.
윤곽이 잡힌 홈 케이지 온도 테스트에서 마우스는 테스트 된 자극에 반응하여 홈 케이지의 자유 범위를 로밍 할 수 있습니다. 이는 활동의 다양한 변화를 일으켜 온도 판독값의 정확도에 영향을 미치고 따라서 독립 변수의 열 발생 효과(예: 약리학적 또는 상황적 자극)의 분석에 영향을 미칠 수 있습니다. 활동 수준으로 인한 온도의 잠재적 변화를 인식하여 러닝 머신 보행 중 온도 사용을 설명하는 프로토콜이 아래에 포함되어 있습니다. 출판 된 문헌은 쥐에서이 절차의 성공적인 사용을 설명하고 있으며 현재 마우스 8,10,14,15에서 사용되고 있습니다. 러닝 머신 걷기는 피험자에게 일정한 활동 속도를 유지합니다. 이 연구에서 러닝 머신은 활동 수준을 제어하는 데 엄격하게 사용되므로 러닝 머신에서 사용 가능한 가장 낮은 속도로 설정되어 마우스의 걷기를 촉진하고 쥐의 경우 유사하게 낮은 설정으로 설정됩니다.
다음 절차는 마우스에서 일방적 인 비복근의 온도 측정 및 포식자 냄새 표현에 대해 간략하게 설명됩니다. 상기 디자인은 약리학 적 약제와 함께 사용될 수 있으며 마우스의 쥐 및 다른 골격근 그룹 (즉, 대퇴사 두근)으로 옮길 수 있습니다. 쥐의 경우, 트랜스 폰더는 비복근에 양측 및 갈색 지방 조직에 배치 할 수 있습니다. 크기 및 거리 제한으로 인해 마우스당 하나의 트랜스폰더만 사용할 수 있습니다. 약리학적 작용제에 대한 열 발생 반응을 평가하기 위해 경미한 수정(예를 들어, 문맥적 자극의 제거)이 이루어질 수 있다.
프로토콜
이러한 방법은 래트 및 마우스 모델 모두에 적용될 수 있으며 기관 승인 (켄트 주립 대학, IACUC 승인 # 359 및 # 340 CN 12-04)으로 수행되었습니다. 의정서를 시행하기 전에 동물은 실험실 동물의 관리 및 사용 가이드에 따라 사육되어야합니다.
1. 트랜스 폰더 리더 준비
알림: 사용하기 전에 트랜스폰더 리더를 설정해야 합니다. 다음 단계에는 이 연구에 필요한 설정 변경만 포함됩니다. 프로토콜의 이 부분은 DAS-8027-IUS 휴대용 리더와 직접 연결됩니다. 다른 리더 모델은 프로그래밍 결과를 얻기 위해 설명서에서 제공하는 지침을 따라야 합니다.
- 오디오 비프음을 OFF로 설정합니다.
- SCAN 버튼을 눌러 장치를 켜고 OLED 디스플레이에 조명이 나타날 때까지 기다립니다. BACK/MENU 버튼을 길게 눌러 메뉴 화면으로 이동합니다.
- NEXT/ENTER 버튼을 사용하여 작동 설정까지 옵션을 스크롤합니다. 여기에서 위쪽 또는 아래쪽 화살표를 전환하여 YES로 전환하고 작동 하위 메뉴를 엽니다.
- 다음/입력 버튼을 사용하여 오디오 신호음으로 스크롤합니다. 기본 설정은 ON이므로 위쪽 또는 아래쪽 화살표를 전환하고 설정을 OFF로 변경합니다.
- NEXT/ENTER 버튼을 눌러 이 설정 변경 사항을 저장합니다.
- 읽기 시 진동을 ON으로 설정합니다.
- 1.1단계부터 1.2단계까지 수행하거나 1.4단계 바로 후 다음 단계를 완료합니다.
- 다음/입력 버튼을 사용하여 읽기 시 진동으로 스크롤합니다. 기본 설정은 OFF이므로 위쪽 및 아래쪽 화살표를 전환하고 설정을 ON으로 변경하여 화면을 볼 수 있는지 여부에 관계없이 판독이 완료되었을 때 진동을 통해 느낍니다.
2. 프로그램 트랜스 폰더
알림: 이식된 각 트랜스폰더는 먼저 동물 식별(동물 ID 또는 트랜스폰더 ID)로 프로그래밍해야 합니다. 이 명명법은 피험자에 대한 2차 식별로서 사용될 수 있다(예를 들어, 마우스 균주 약어의 경우 4자리, 트랜스폰더의 위치, 및 동물 번호를 나타내기 위한 추가 3 내지 4자리). 프로그래밍은 수술 며칠 전에 완료하면서 수술 전에 트랜스폰더를 멸균 상태로 유지할 수 있습니다.
- 트랜스폰더에 ID 코드를 입력합니다.
- 프로그래밍 절차에 도움이 되는 모델 DAS 8027-IUS의 특정 액세서리인 부스터 코일을 리더 헤드에 적용합니다.
- 장갑을 낀 손을 사용하여 트랜스폰더(애플리케이터 내)를 부스터 코일에 넣습니다.
- SCAN 버튼을 눌러 장치를 켜고 OLED 디스플레이가 켜질 때까지 기다립니다. BACK/MENU 버튼을 길게 눌러 메뉴 화면으로 이동합니다.
- NEXT/ENTER 버튼을 사용하여 트랜스폰더 ID 쓰기까지 옵션을 스크롤합니다. 여기에서 위쪽 또는 아래쪽 화살표를 전환하여 YES로 바꿉니다.
- 다음/입력 버튼을 사용하여 ID 코드 입력으로 전환합니다.
- 위쪽 및 아래쪽 화살표 키를 사용하여 숫자와 문자를 스크롤합니다. 각 문자 선택 후에 NEXT/ENTER 를 눌러 다음 문자로 이동합니다.
- ID 코드가 완료되면 SCAN 을 눌러 트랜스폰더를 작성합니다.
- 부스터 코일에서 트랜스폰더를 제거하고 필요에 따라 반복합니다. 트랜스폰더가 장갑을 낀 손 사이에 동봉된 트랜스폰더를 데우고 온도 스캐너를 사용하여 측정하여 온도 변화를 읽는지 확인합니다.
참고: 자동 다중 쓰기 및 순차 카운트 설정을 ON 으로 설정하여 세션 중에 다중 또는 순차 트랜스폰더 프로그래밍을 허용할 수 있습니다. 각 트랜스 폰더는 프로그래밍 중에 테스트해야합니다.
3. "홈 케이지 볼"준비
- 5cm x 5cm 무취/조절 수건을 티볼에 넣습니다.
- 수술 후 이 홈 케이지 볼을 새 홈 케이지에 넣어 테스트 중에 문맥적 자극이 나타나는 방법에 동물을 습관화하기 시작합니다. 이 홈 케이지 볼은 2 주마다 교체하십시오.
4. 수술 및 수술 후 관리
- 피험자의 수술 전 체중의 무게를 측정하고 기록합니다. 유도 챔버를 사용하여, 동물에게 마취 (예를 들어, 2-5% 이소플루란)를 제공한다.
- 전기 클리퍼를 사용하여 뒷다리를 완전히 면도하십시오. 진통제 (예 : 5mg / kg의 케토 프로 펜, sc)를 기관 지침에 따라 투여하십시오.
참고: 이 절차를 다른 수술 방법과 병용하는 경우 추가 진통제가 필요할 수 있습니다. - 70 % 알코올 (또는 시중에서 판매되는 멸균 알코올 물티슈)과 포비돈-요오드 세척 (또는 시판되는 멸균되고 개별 포장 된 베타 딘 면봉)을 적어도 세 번 번갈아 가며 포비돈-요오드로 끝나는 부위를 청소하십시오.
- 동물을 유도 챔버로 되돌리고 동물을 수술 수준으로 마취하십시오. 그런 다음 마취에 계속 노출되도록 안면 마스크에 마우스를 설정하십시오. 마취 상태에서 건조를 방지하기 위해 동물의 눈에 네오 마이신 안과 연고를 바르십시오.
알림: 마우스가 통증 수용의 증거(예: 각막 반사, 꼬리 핀치 반응, 발가락 핀치 반사)를 보이지 않을 때까지 절차를 시작해서는 안 됩니다. - 수술 용 가위 만 사용하여 오른쪽 뒷다리의 피부를 얕게 자릅니다.
- 비복근과 평행하게 이동하여 사전 프로그래밍되고 뚜껑이 없는 멸균 트랜스폰더의 날카로운 모서리를 절개 부위에 넣습니다. 녹색 플런저가 위를 향하고 보이는지 확인하십시오. 트랜스폰더 어플리케이터의 개방이 더 이상 보이지 않을 때까지 트랜스폰더 어플리케이터를 절개 부위로 계속 밀어 넣습니다.
알림: 4.6단계에서 트랜스폰더 애플리케이터의 녹색 플런저를 실수로 누르지 마십시오. 트랜스 폰더의 조기 방전은 부적절한 배치로 이어질 것입니다. - 애플리케이터를 180° 돌리면 녹색 플런저가 마우스의 팔다리를 향하게 되어 실험자에게 더 이상 보이지 않습니다. 트랜스폰더 어플리케이터를 최종 위치로 밀어 넣습니다. 이상적인 위치에 있거나 비복근에 인접하거나 부분적으로 둘러싸이면 녹색 플런저를 밀어 애플리케이터의 압력이 조사자의 손을 마우스에서 멀어지도록 안내합니다.
- 집게를 사용하여 열린 피부를 함께 잡고 멸균 오토 클립 또는 멸균 봉합사로 상처 클립을 놓습니다. 필요한 경우 멸균 오토클립 전에 흡수성 봉합사를 사용하여 근막 층을 닫습니다. 트랜스 폰더 리더를 사용하여 마우스 근육의 온도를 확인하십시오.
- 마우스를 마취에서 꺼내 회복을 위해 낮게 설정된 물 순환 가열 패드 위에 놓인 깨끗한 홈 케이지에 넣습니다. 홈 케이지에 습관화를 시작하기 위해 무취 수건이 달린 티 볼이 포함되어 있는지 확인하십시오.
참고: 마우스는 수술에서 15분 이내에 깨어나야 합니다. 회복 일 동안 쉽게 접근 할 수 있도록 케이지 바닥에 음식을 놓을 수 있습니다. - 수술 후 관리
- 수술 후 최소 2일 동안 또는 마우스가 체중을 회복하거나 안정화할 때까지 트랜스폰더 리더를 사용하여 매일 마우스 체중과 온도를 기록합니다.
- 비마약성 진통제(예: 5mg/kg의 케토프로펜, s.c.)를 수술 후 최소 2일 동안 마우스에게 하루에 한 번 투여하고 필요에 따라 추가 용량을 제공합니다.
알림: 생쥐와 쥐는 수술 후 5-8일 이내에 완전히 회복되어야 하며 습관화 및 검사 절차를 거칠 수 있습니다.
5. 시험 준비 - 홈 케이지
- 라이저 구성
참고: 아래 단계는 194mm x 181mm x 398mm 마우스 필터 상단 케이지를 기준으로 합니다. 더 큰 케이지 (예 : 쥐 집 케이지)에 맞추려면 너비를 조정해야합니다.- 래칫 PVC 커터로 PVC 파이프를 8 개의 섹션으로 자르고 그림 1C에 따라 조립합니다. 이렇게하면 약 4 개의 케이지를 수용 할 수있는 개방형 탁상 구조가 제공됩니다. 원하는 수의 라이저를 만드십시오.
- 방 설정
- 시험장 내의 각 응시자에 위치를 지정합니다. 교란 변수를 피하기 위해 서로 다른 상황적 자극(즉, 냄새)을 받도록 설정된 라이저를 최소 2m 분리합니다.
알림: 각 마우스는 다른 위치와 열 발생 자극 사이에 연관성이 발생하지 않도록 가능한 한 테스트 룸 및 물리적 라이저에 지정된 테스트 위치가 있어야 합니다. - 마그네틱 스트립을 사용하여 라이저를 가로질러 수술 시트나 가운을 부착하여 연구원과 피험자 사이에 시각적 장벽을 만듭니다. 케이지 쪽으로 또는 시험장 주변으로 이동하는 실험자를 볼 때 마우스 활동으로 인한 온도 변화를 최소화하도록 이 장벽을 설정합니다.
- (선택 사항) 테스트 중에 케이지 바닥을 쉽게 볼 수 있도록 라이저 아래 표면에 거울을 놓습니다.
알림: 라이저는 케이지 세척 시스템을 통해 소독할 수 있습니다. 천이나 수술 시트는 습관화 및 테스트 전에 세탁해야 합니다.
- 시험장 내의 각 응시자에 위치를 지정합니다. 교란 변수를 피하기 위해 서로 다른 상황적 자극(즉, 냄새)을 받도록 설정된 라이저를 최소 2m 분리합니다.
- 티 볼 준비
- 컨트롤과 PO 타월 (약 5cm x 5cm)로 티 볼을 준비하십시오. 교차 오염을 방지하려면 먼저 냄새가 나는 티볼을 준비하십시오.
알림: 포식자 냄새가 나는 수건은 사용하기 전에 병원체 테스트를 거쳐야 합니다. 이 수건도 포함되어야하며, 그들과 상호 작용하는 물질은 즉시 위생 처리 (예 : 케이지 세척)하여 냄새가 다른 동물에게 노출되지 않도록해야합니다.
- 컨트롤과 PO 타월 (약 5cm x 5cm)로 티 볼을 준비하십시오. 교차 오염을 방지하려면 먼저 냄새가 나는 티볼을 준비하십시오.
6. 온도 테스트 - 홈 케이지
참고: 동물은 실험적 맥락적 자극 또는 약리학적 자극을 제외한 전체 테스트 절차에 익숙해져야 합니다. 테스트하기 전에 최소 4 배를 완료해야합니다.
- 동물을 준비된 시험실로 옮깁니다. 라이저의 미리 지정된 위치에 동물을 놓습니다. 이 위치는 모든 습관화 및 테스트 절차에서 동일해야 합니다.
- 마우스 홈 케이지에서 "홈 케이지 볼"을 제거하고 케이지를 천이나 수술 시트로 다시 덮습니다. 마우스가 1-2 시간 동안 테스트 공간에 적응하도록하십시오.
- 적응이 완료되면 스캐너를 사용하여 각 피사체의 기준 온도를 측정하고 기록합니다. 측정하는 동안 천 덮개를 조작하지 마십시오.
참고: 약리학적 제제를 여기에 적용할 수 있습니다. 주입 또는 적용 후 대기 시간은 테스트 전에 필요에 따라 추가할 수 있습니다. 시험 직전에 2차 기준선을 기록하는 것은 약리학적 자극에 대한 반응을 모니터링하기 위해 약리학적 제제를 첨가한 후에 권장된다. 냄새 반응을 테스트하지 않는 경우 주사 직후 마우스의 온도 측정을 시작할 수 있습니다. 자극을 제공할 때 무작위화를 사용해야 합니다. - 케이지를 열고 티 볼 (컨트롤 또는 PO)을 홈 케이지 바닥에 놓습니다. 케이지 뚜껑과 천 덮개를 교체하십시오.
- 스톱워치를 시작합니다. 티볼 배치와 동일한 순서로 시험 대상자의 온도를 측정합니다. 원하는 시점을 따라 측정의 온도와 클럭 시간을 기록합니다.
- 실험이 완료되면 처리 공을 제거하십시오. PO를받은 마우스를 원래의 "홈 케이지 볼"이있는 새 홈 케이지에 넣습니다. "홈 케이지 볼"을 제어 냄새를받은 마우스의 케이지로 되돌립니다. 마우스를 하우징 위치로 옮깁니다.
알림: 위의 절차는 적절한 크기의 케이지 내에서 쥐 모델로 변환 될 수 있습니다. 도 1C 에서 제안된 측정치에 대한 조정은 홈 케이지의 바닥에 더 잘 접근할 수 있도록 하기 위해 필요할 수 있다.

그림 1: 트랜스폰더 및 홈 케이지 온도 테스트. (A) 마우스 비복근에서 온도 테스트를 위한 일방적인 트랜스폰더 배치 다이어그램. 일단 프로그래밍되고 배치되면, 트랜스폰더 리더(DAS-8027-IUS, 그림)를 사용하여 온도를 측정할 수 있다. (B) 왼쪽, 오픈 메쉬 스테인레스 티 볼과 5cm x 5cm 수건의 사진. 오른쪽, 동봉 된 티 볼, 홈 케이지 테스트에서 습관과 냄새 타월을 잡는 데 사용됩니다. (C) 홈 케이지 테스트를 위해 PVC 배관으로 구성된 라이저의 개략도. (D) 홈 케이지 테스트 프로토콜의 워크 플로우. (E) 홈 케이지 테스트 영역의 시설 이미지. 왼쪽, 라이저 위에 4 개의 마우스 케이지. 마그네틱 스트립은 인접한 벽에 있으며 자석과 수술 용 천이 테이블 위에 있습니다. 오른쪽, 라이저에 덮인 마우스 케이지. (A), (C) 및 (D)는 Biorender.com 로 만들어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 온도 테스트 - 러닝머신 걷기
- 각 동물에게 습관화 및 테스트 절차를 위해 지정된 위치로 러닝 머신을 할당하십시오.
- 테스트를 위해 런닝 머신을 준비하고 쇼커가 작동하는지 확인하십시오.
알림: 트레드밀 걷기의 경우 트레드밀은 지속적인 움직임을 촉진하지만 습관화와 테스트 모두를 위해 달리지 않는 가장 낮은 속도로 설정해야 합니다. 1012M-2 모듈식 밀폐형 대사 트레드밀의 경우 마우스의 경우 5.2m/min, 쥐의 경우 7m/min입니다. 이 속도는 피험자의 비만에 따라 조정해야 할 수도 있습니다. 쇼커는 강도와 반복률 5.0으로 설정해야 합니다. - 습관화
- 마우스를 시험장으로 옮깁니다. 생쥐가 1-2 시간 동안 집 케이지에서 방 이동에 적응하도록하십시오.
- 적응 후, 마우스를 지정된 러닝 머신의 개방으로 안내하고 러닝 머신을 닫습니다. 벨트, 쇼커 및 스톱워치를 시동하십시오.
- 생쥐가 운동 동기로 충격 자극을 사용하여 15 분 동안 러닝 머신을 걸을 수있게하십시오. 동물이 장기간 활성 쇼커에 남아 있으면 즉시 검사를 중단하십시오.
- 검사 후 마우스를 제거하고 홈 케이지로 되돌립니다.
- 액체 세제와 물을 사용하여 러닝 머신을 청소하십시오.
- 테스트
- 마우스를 시험장으로 옮깁니다. 생쥐가 1-2 시간 동안 집 케이지에서 방 이동에 적응하도록하십시오.
- 마우스를 트레드밀로 이동하기 전에 기준 온도를 측정하고 기록합니다.
알림: 약리학 적 약제를 포함한 검사의 경우 그림 2A에 표시된 회로도에 따라 여기에 적용하거나 주입하십시오. 마우스를 러닝 머신에 놓기 전에 필요에 따라 주입 후 대기 시간을 추가 할 수 있습니다. 자극을 제공할 때 무작위화를 사용해야 합니다. - 런닝 머신 전면에 가장 가까운 러닝 머신 안에 5cm x 5cm 정사각형의 컨트롤 또는 PO 타월을 놓습니다. 쉽게 배치하고 제거 할 수 있도록 수건을 러닝 머신의 천장이나 아래에 부착하십시오.
- 마우스를 지정된 러닝 머신으로 안내하십시오. 러닝 머신 벨트와 쇼커를 켜십시오.
- 스톱워치를 시작합니다. 마우스를 러닝머신에 설치한 순서와 동일한 순서로 시험 대상자를 측정합니다. 원하는 시점을 따라 측정의 온도와 시계 시간을 기록합니다.
알림: 온도는 걷기 활동 중에 마우스가 밀폐된 트레드밀 내부에 있는 동안 트레드밀 외부에서 안정적으로 측정할 수 있습니다. 쥐의 경우, 러닝 머신 크기 및 트랜스 폰더 - 리더 거리 제한은 실험자가 러닝 머신의 뒷면을 열어 두어 리더를 디딜 방아 내부에 삽입하여 피사체에 더 가깝게 삽입해야 할 수 있습니다. - 테스트가 완료되면 쇼커와 트레드밀을 끕니다. 생쥐를 집 새장으로 되돌립니다. 마우스를 하우징 위치로 옮깁니다.
- 액체 세제와 물을 사용하여 러닝머신을 청소하고 잔여 PO를 제거하는 데 특히 주의하십시오.
- 실험이 완료되면, 동물을 안락사시키고(예를 들어,CO2 흡입을 사용하여), 트랜스폰더 위치를 육안으로 확인한다.
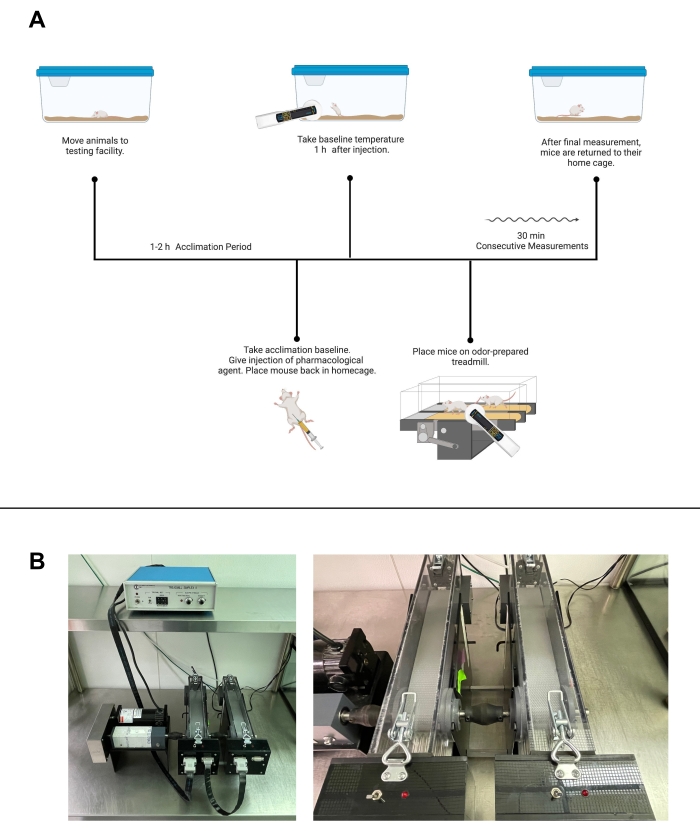
그림 2: 활동 제어 온도 테스트. (A) 트레드밀 워킹을 이용한 약리학적 약제를 이용한 활동 제어 온도 테스트의 워크플로우. (B) 러닝 머신의 시설 이미지. 왼쪽, 전체 장비 설정 이미지. 오른쪽, 개별 러닝 머신과 쇼커의 더 가까운 이미지. (A)는 Biorender.com 로 만들어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
트랜스폰더를 SF1-Cre 균주(Tg(Nr5a1-cre)7Lowl/J, 균주 #012462, C57BL/6J 및 FVB 배경; 암컷 N=5; 수컷 N=5; 수컷 N=5)로부터 사육된 10마리의 4-6개월 된 야생형(WT) 마우스의 우측 비복근에 일방적으로 이식하였다. 회복 후, 마우스는 문맥적 자극(예를 들어, PO)을 포함하지 않는 홈 케이지 온도 테스트 절차에 익숙해졌다. 트랜스폰더 완드를 사용한 온도 측정은 하우징 룸 내에서 그리고 테스트 장소로 옮긴 후 기록?...
토론
이 온도 테스트 프로토콜은 골격근 열 발생을 직접 측정 할 수있는 방법을 현장에 제공합니다. 이것은 연구가 근육 열 발생33의 기본 메커니즘을 식별하는 데 중요합니다. 이 방법은 상황적 및 약리학적 조건 하에서 골격근 열생성을 측정하기 위한 두 가지 비용 효율적인 프로토콜을 제공합니다. 이 프로토콜은 이러한 절차 내에서 습관화와 순응의 중요성을 강조합니다. 습관화?...
공개
저자는 이해 상충이 없다고 선언합니다.
감사의 말
이 작업은 R15 DK097644 및 R15 DK108668에서 지원됩니다. 이전 기여에 대해 Chaitanya K Gavini 박사와 Megan Rich 박사, 기관 동물 사용 지침을 준수하도록 보장해 주신 Stanley Dannemiller 박사에게 감사드립니다. 이 방법과 관련 연구를 구축하는 데 필요한 기초 연구를 제공한 Tim Bartness 박사에게 특별한 감사를 드립니다. 도 1A, C, D 및 도 2A는 Biorender.com 를 사용하여 작성하였다.
자료
| Name | Company | Catalog Number | Comments |
| 1012M-2 Modular Enclosed Metabolic Treadmill for Mice, 2 Lanes w/ Shock | Columbus Instruments | ||
| 1012R-2 Modular Enclosed Metabolic Treadmill for Rats, 2 Lanes w/ Shock | Columbus Instruments | ||
| 1-1/4 in. Ratcheting PVC Cutter | BrassCraft | ||
| 1 mL Syringes | Fisher Scientific | BD 309659 | |
| Betadine Swabs | Fisher Scientific | 19-898-945 | |
| Booster Coil | BioMedic Data Systems | Transponder Accessory | |
| Electric Clippers | Andis | 40 Ultraedge Clipper Blade | |
| Flexible Mirror Sheets | Amazon | Self Adhesive Non Glass Mirror Tiles | |
| Forceps | Fisher Scientific | 89259-940 | |
| Heating Pad | |||
| Induction Chamber (isoflurane) | Kent Scientific | VetFlo-0730 | 3.0 L Low Cost Chambers for Traditional Vaporizers |
| Ketoprophen | Med-Vet Intl. | RXKETO-50 | |
| Magnetic Strips | Amazon | ||
| Magnets | Amazon | DIYMAG Magnetic Hooks 40lbs | |
| Needles | Med-Vet Intl. | 26400 | |
| Neomycin/Polymixin/Bacitracin with Hydrocortisone Ophthalmic Ointment, 3.5 g | Med-Vet Intl. | RXNPB-HC | |
| Oasis Absorbable Suture | Med-Vet Intl. | MV-H821-V | |
| Predator (Ferret) Odor Towels | Marshall BioResources | ||
| PVC pipe | |||
| Reflex Wound Clip Remover | CellPoint Scientific | ||
| Reflex Wound Clip, 7 mm (mouse) | CellPoint Scientific | ||
| Reflex Wound Clip, 9 mm (rat) | CellPoint Scientific | ||
| Srerile Autoclip, 7 mm (mouse) | CellPoint Scientific | Wound Clip Applier (mouse) | |
| Stainless Strainers Interval Seasonings Tea Infuser | Amazon | ||
| Sterile Autoclip, 9 mm (rat) | CellPoint Scientific | Wound Clip Applier (rat) | |
| Sterile Saline | Med-Vet Intl. | RX0.9NACL-10 | |
| Surgical Scissors | Fisher Scientific | 08-951-5 | |
| Surgical Sheets | |||
| Towels (Control/Habituation) | Amazon | 100% Cotton Towels, white | |
| Transponders | BioMedic Data Systems | Model: IPTT-300 | |
| Transponders Reader | BioMedic Data Systems | Model: DAS-8027-IUS/ DAS-7007R | |
| Versaclean | Fisher Scientific | 18-200-700 | liquid detergent |
| Webcol Alcohol Preps | Covidien | 22-246-073 | |
| Wedge pieces for PVC pipe |
참고문헌
- Periasamy, M., Herrera, J. L., Reis, F. C. G. Skeletal muscle thermogenesis and its role in whole body energy metabolism. Diabetes Metabolism Journal. 41 (5), 327-336 (2017).
- Rowland, L. A., Bal, N. C., Periasamy, M. The role of skeletal-muscle-based thermogenic mechanisms in vertebrate endothermy. Biological Reviews of the Cambridge Philosophical Society. 90 (4), 1279-1297 (2015).
- Maurya, S. K., et al. Sarcolipin is a key determinant of the basal metabolic rate, and its overexpression enhances energy expenditure and resistance against diet-induced obesity. Journal of Biological Chemistry. 290 (17), 10840-10849 (2015).
- Grigg, G., et al. Whole-body endothermy: Ancient, homologous and widespread among the ancestors of mammals, birds and crocodylians. Biological Reviews of the Cambridge Philosophical Society. 97 (2), 766-801 (2022).
- Franck, J. P. C., Slight-Simcoe, E., Wegner, N. C. Endothermy in the smalleye opah (Lampris incognitus): A potential role for the uncoupling protein sarcolipin. Comparative Biochemistry and Physiology - Part A: Molecular & Integrative Physiology. 233, 48-52 (2019).
- Nowack, J., et al. Muscle nonshivering thermogenesis in a feral mammal. Scientific Reports. 9, 6378 (2019).
- Oliver, S. R., Anderson, K. J., Hunstiger, M. M., Andrews, M. T. Turning down the heat: Down-regulation of sarcolipin in a hibernating mammal. Neuroscience Letters. 696, 13-19 (2019).
- Gorrell, E., et al. Skeletal muscle thermogenesis induction by exposure to predator odor. The Journal of Experimental Biology. 223, (2020).
- Gavini, C. K., et al. Leanness and heightened nonresting energy expenditure: Role of skeletal muscle activity thermogenesis. The American Journal of Physiology - Endocrinology and Metabolism. 306 (6), 635-647 (2014).
- Almundarij, T. I., Gavini, C. K., Novak, C. M. Suppressed sympathetic outflow to skeletal muscle, muscle thermogenesis, and activity energy expenditure with calorie restriction. Physiological Reports. 5 (4), 13171 (2017).
- Harshaw, C., Lanzkowsky, J., Tran, A. D., Bradley, A. R., Jaime, M. Oxytocin and 'social hyperthermia': Interaction with beta3-adrenergic receptor-mediated thermogenesis and significance for the expression of social behavior in male and female mice. Hormones and Behavior. 131, 104981 (2021).
- Caldwell, H. K. Oxytocin and vasopressin: Powerful regulators of social behavior. The Neuroscientist. 23 (5), 517-528 (2017).
- Harshaw, C., Leffel, J. K., Alberts, J. R. Oxytocin and the warm outer glow: Thermoregulatory deficits cause huddling abnormalities in oxytocin-deficient mouse pups. Hormones and Behavior. 98, 145-158 (2018).
- Gavini, C. K., Britton, S. L., Koch, L. G., Novak, C. M. Inherently lean rats have enhanced activity and skeletal muscle response to central melanocortin receptors. Obesity. 26 (5), 885-894 (2018).
- Gavini, C. K., Jones, W. C., Novak, C. M. Ventromedial hypothalamic melanocortin receptor activation: regulation of activity energy expenditure and skeletal muscle thermogenesis. The Journal of Physiology. 594 (18), 5285-5301 (2016).
- Zaretsky, D. V., Romanovsky, A. A., Zaretskaia, M. V., Molkov, Y. I. Tissue oxidative metabolism can increase the difference between local temperature and arterial blood temperature by up to 1.3(o)C: Implications for brain, brown adipose tissue, and muscle physiology. Temperature. 5 (1), 22-35 (2018).
- Yoo, Y., et al. Exercise activates compensatory thermoregulatory reaction in rats: A modeling study. Journal of Applied Physiology. 119 (12), 1400-1410 (2015).
- Langer, F., Fietz, J. Ways to measure body temperature in the field. Journal of Thermal Biology. 42, 46-51 (2014).
- Pence, S., et al. Central apolipoprotein A-IV stimulates thermogenesis in brown adipose tissue. International Journal of Molecular Sciences. 22 (3), 1221 (2021).
- Li, D., et al. Homeostatic disturbance of thermoregulatory functions in rats with chronic fatigue. Journal of Neuroscience Research. 165, 45-50 (2021).
- Carlier, J., et al. Pharmacodynamic effects, pharmacokinetics, and metabolism of the synthetic cannabinoid AM-2201 in male rats. Journal of Pharmacology and Experimental Therapeutics. 367 (3), 543-550 (2018).
- Pato, A. M., Romero, D. M., Sosa Holt, C. S., Nemirovsky, S. I., Wolansky, M. J. Use of subcutaneous transponders to monitor body temperature in laboratory rats. Journal of Pharmacological and Toxicological Methods. 114, 107145 (2022).
- Almeida, D. L., et al. Lean in one way, in obesity another: Effects of moderate exercise in brown adipose tissue of early overfed male Wistar rats. International Journal of Obesity. 46 (1), 137-143 (2022).
- Brito, M. N., Brito, N. A., Baro, D. J., Song, C. K., Bartness, T. J. Differential activation of the sympathetic innervation of adipose tissues by melanocortin receptor stimulation. Endocrinology. 148 (11), 5339-5347 (2007).
- Vaughan, C. H., Shrestha, Y. B., Bartness, T. J. Characterization of a novel melanocortin receptor-containing node in the SNS outflow circuitry to brown adipose tissue involved in thermogenesis. Brain Research. 1411, 17-27 (2011).
- Kort, W. J., Hekking-Weijma, J. M., TenKate, M. T., Sorm, V., VanStrik, R. A microchip implant system as a method to determine body temperature of terminally ill rats and mice. Laboratory Animals. 32 (3), 260-269 (1998).
- Mei, J., et al. Body temperature measurement in mice during acute illness: Implantable temperature transponder versus surface infrared thermometry. Scientific Reports. 8, 3526 (2018).
- Warn, P. A., et al. Infrared body temperature measurement of mice as an early predictor of death in experimental fungal infections. Laboratory Animals. 37 (2), 126-131 (2003).
- Hargreaves, K., Dubner, R., Brown, F., Flores, C., Joris, J. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia. Pain. 32 (1), 77-88 (1988).
- Fiebig, K., Jourdan, T., Kock, M. H., Merle, R., Thone-Reineke, C. Evaluation of infrared thermography for temperature measurement in adult male NMRI nude mice. Journal of the American Association for Laboratory Animal Science. 57 (6), 715-724 (2018).
- Franco, N. H., Geros, A., Oliveira, L., Olsson, I. A. S., Aguiar, P. ThermoLabAnimal - A high-throughput analysis software for non-invasive thermal assessment of laboratory mice. Physiology & Behavior. 207, 113-121 (2019).
- Koganti, S. R., et al. Disruption of KATP channel expression in skeletal muscle by targeted oligonucleotide delivery promotes activity-linked thermogenesis. Molecular Therapy. 23 (4), 707-716 (2015).
- Bal, N. C., Periasamy, M. Uncoupling of sarcoendoplasmic reticulum calcium ATPase pump activity by sarcolipin as the basis for muscle non-shivering thermogenesis. Philosophical Transactions of the Royal Society B. 375 (1793), 20190135 (2020).
- Hicks, C., et al. Body temperature and cardiac changes induced by peripherally administered oxytocin, vasopressin and the non-peptide oxytocin receptor agonist WAY 267,464: a biotelemetry study in rats. British Journal of Pharmacology. 171 (11), 2868-2887 (2014).
- Kasahara, Y., et al. Oxytocin receptor in the hypothalamus is sufficient to rescue normal thermoregulatory function in male oxytocin receptor knockout mice. Endocrinology. 154 (11), 4305-4315 (2013).
- Kasahara, Y., et al. Role of the oxytocin receptor expressed in the rostral medullary raphe in thermoregulation during cold conditions. Frontiers in Endocrinology. 6, 180 (2015).
- Yuan, J., Zhang, R., Wu, R., Gu, Y., Lu, Y. The effects of oxytocin to rectify metabolic dysfunction in obese mice are associated with increased thermogenesis. Molecular and Cellular Endocrinology. 514, 110903 (2020).
- Scholl, J. L., Afzal, A., Fox, L. C., Watt, M. J., Forster, G. L. Sex differences in anxiety-like behaviors in rats. Physiology & Behavior. 211, 112670 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유