Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure de la thermogenèse des muscles squelettiques chez la souris et le rat
Dans cet article
Résumé
Les souris et les rats sont implantés chirurgicalement avec des transpondeurs de température à distance, puis habitués à l’environnement et à la procédure de test. Les changements de température musculaire sont mesurés en réponse à des stimuli pharmacologiques ou contextuels dans la cage familiale ou pendant l’activité physique prescrite (c.-à-d. la marche sur tapis roulant à une vitesse constante).
Résumé
La thermogenèse des muscles squelettiques offre une avenue potentielle pour mieux comprendre l’homéostasie métabolique et les mécanismes sous-jacents à la dépense énergétique. Étonnamment, peu de preuves sont disponibles pour relier les mécanismes neuronaux, myocellulaires et moléculaires de la thermogenèse directement aux changements mesurables de la température musculaire. Cet article décrit une méthode dans laquelle des transpondeurs de température sont utilisés pour récupérer des mesures directes de la température des muscles squelettiques de souris et de rats.
Des transpondeurs à distance sont implantés chirurgicalement dans le muscle des souris et des rats, et les animaux ont le temps de récupérer. Les souris et les rats doivent ensuite être habitués à plusieurs reprises à l’environnement et à la procédure de test. Les changements de température musculaire sont mesurés en réponse à des stimuli pharmacologiques ou contextuels dans la cage domestique. La température musculaire peut également être mesurée pendant l’activité physique prescrite (c.-à-d. la marche sur tapis roulant à une vitesse constante) pour tenir compte des changements d’activité qui contribuent aux changements de température musculaire induits par ces stimuli.
Cette méthode a été utilisée avec succès pour élucider les mécanismes sous-jacents au contrôle thermogénique musculaire au niveau du cerveau, du système nerveux sympathique et du muscle squelettique. Des démonstrations de ce succès sont fournies en utilisant l’odeur de prédateur (PO; odeur de furet) comme stimulus contextuel et des injections d’ocytocine (Oxt) comme stimulus pharmacologique, où l’odeur de prédateur induit la thermogenèse musculaire et Oxt supprime la température musculaire. Ainsi, ces ensembles de données montrent l’efficacité de cette méthode dans la détection des changements rapides de température musculaire.
Introduction
Dans le cadre de la recherche métabolique, l’examen de la thermogenèse des muscles squelettiques est une nouvelle avenue prometteuse pour sonder l’homéostasie du poids corporel. La littérature publiée soutient l’idée que les réponses thermogéniques de l’un des plus grands systèmes organiques du corps – le muscle squelettique – fournissent un moyen d’augmenter la dépense énergétique et d’autres effets métaboliques, rééquilibrant ainsi efficacement les systèmes au sein de maladies telles que l’obésité 1,2,3. Si le muscle peut être considéré comme un organe thermogénique, les études doivent utiliser une méthodologie pratique pour étudier les changements thermogéniques dans cet organe. Le désir de comprendre l’impact endothermique des muscles squelettiques et l’utilité de cette méthodologie pour étudier la thermogenèse musculaire non frissonnante ne sont pas spécifiques aux études métaboliques. Des disciplines telles que l’évolution4, la physiologie comparative5 et l’écophysiologie 6,7 ont montré un intérêt direct à comprendre comment la thermogenèse musculaire peut contribuer à l’endothermie et comment ce mécanisme s’adapte à l’environnement. Le protocole présenté fournit les méthodes critiques nécessaires pour répondre à ces questions.
La méthode fournie peut être utilisée dans l’évaluation de la modulation contextuelle et pharmacologique des stimuli de la température musculaire, y compris la technique unique consistant à fournir une odeur de prédateur (PO) pour modifier le contexte afin de reproduire la menace du prédateur. Des rapports antérieurs ont démontré la capacité de la PO à induire rapidement une augmentation considérable de la thermogenèse musculaire8. De plus, les stimuli pharmacologiques peuvent également modifier la température musculaire. Cela a été démontré dans le contexte de la thermogenèse musculaire induite par PO, où le blocage pharmacologique des récepteurs périphériques β-adrénergiques, à l’aide de nadolol, a inhibé la capacité de PO à induire la thermogenèse musculaire sans affecter de manière significative la thermogenèse contractile pendant la marche sur tapisroulant 8. L’administration centrale d’agonistes des récepteurs de la mélanocortine chez le rat a également été utilisée pour discerner les mécanismes cérébraux altérant la thermogenèse 9,10.
Voici une étude préliminaire de la capacité de la neurohormone ocytocine (Oxt) à modifier la thermogenèse musculaire chez la souris. Semblable à la menace des prédateurs, les rencontres sociales avec un conspécifique de même sexe augmentent la température corporelle, un phénomène appelé hyperthermie sociale11. Compte tenu de la pertinence d’Oxt pour le comportement social12, il a été spéculé qu’Oxt est un médiateur de l’hyperthermie sociale chez la souris. En effet, un antagoniste des récepteurs de l’ocytocine diminue l’hyperthermie sociale chez la souris11, et les petits souris dépourvus d’Oxt présentent des déficits dans les aspects comportementaux et physiologiques de la thermorégulation, y compris la thermogenèse13. Étant donné que Harshaw et coll. (2021) n’ont pas trouvé de preuves à l’appui de la thermogenèse du tissu adipeux brun (MTD) dépendante des récepteurs adrénergiques β3 avec hyperthermie sociale11, il a été postulé que l’hyperthermie sociale pourrait être entraînée par l’induction de la thermogenèse musculaire par Oxt.
Pour mesurer la thermogenèse du muscle squelettique, le protocole suivant utilise l’implantation de transpondeurs IPTT-300 préprogrammés adjacents au muscle d’intérêt chez une souris ou un rat 8,10,14,15. Ces transpondeurs sont des micropuces encapsulées dans du verre qui sont lues à l’aide des lecteurs de transpondeur correspondants. Peu ou pas de recherche a utilisé cette technologie à ce titre, bien que des études aient suggéré la nécessité de la spécificité fournie par cette méthode16,17. Des études antérieures ont montré la fiabilité de cette méthode et diverses façons d’utiliser les transpondeurs de température par rapport à d’autres méthodes d’essai de température18 ou en conjonction avec des méthodes chirurgicales (par exemple, canulation19). Cependant, les études de cette nature reposent sur différents emplacements stratégiques pour mesurer la température corporelle globale 20,21,22 ou des tissus spécifiés tels que BAT23,24,25.
Plutôt que de mesurer la température à partir de ces endroits ou à l’aide de thermomètres auriculaires ou rectaux26, la méthode décrite ici fournit une spécificité pour le muscle d’intérêt. La capacité de cibler un site en implantant directement des transpondeurs adjacents aux muscles d’intérêt est plus efficace pour sonder spécifiquement la thermogenèse musculaire. Il offre une nouvelle voie en plus de celles fournies par la thermométrie infrarouge de surface 27,28 ou les mesures de température cutanée via thermocouple 29. En outre, les données fournies par cette méthode offrent une gamme de pistes de recherche, évitant le besoin d’équipements et de logiciels de haute technologie coûteux tels que la thermographie infrarouge30,31,32.
Cette méthode a été utilisée avec succès pour mesurer la température dans les quadriceps et le gastrocnémien, unilatéralement ou bilatéralement. Cette méthode s’est également avérée efficace en conjonction avec la chirurgie stéréotaxique14,15. À ~7-10 cm du membre du transpondeur, des lecteurs de transpondeur portables (DAS-8027/DAS-7007R) sont utilisés pour scanner, mesurer et afficher la température. Cette distance a été critique et précieuse pour les études antérieures 8,9,10 parce qu’elle minimise les facteurs de stress potentiels et les variables modifiant la température telles que la manipulation des animaux pendant les procédures d’essai. À l’aide de minuteries, les mesures peuvent ensuite être enregistrées et collectées sur une période de temps sans interaction directe avec les animaux.
Pour minimiser davantage la perturbation des souris pendant les essais, cette méthode décrit l’assemblage et l’utilisation de risers en tuyauterie en PVC pour permettre à l’expérimentateur d’accéder au fond des cages domestiques pendant les essais. En utilisant les colonnes montantes en tandem avec le lecteur numérique, les mesures de température du membre transpondeur peuvent être effectuées sans aucune interaction animale après la mise en place du stimulus. À un coût minime, cette méthode peut être utilisée en conjonction avec des stimuli pharmacologiques et contextuels, ce qui la rend tout à fait accessible aux chercheurs. De plus, cette méthode peut être utilisée avec un nombre important de sujets (~16 souris ou ~12 rats) à la fois, ce qui permet de gagner du temps en augmentant le débit global de tout projet de recherche.
Cette méthode introduit dans ce mécanisme est conçu pour présenter des odeurs aux souris à l’aide de boules d’infuseur à thé en treillis en acier inoxydable, désormais appelées « boules de thé ». Bien que ces boules de thé soient idéales pour contenir n’importe quel matériau odorant, dans ces études, des serviettes qui ont servi de litière en cage pendant 2-3 semaines pour les furets, un prédateur naturel des souris et des rats, sont placées dans chaque boule de thé de traitement. Chaque serviette est coupée en carrés de 5 cm x 5 cm. Cette aliquote est également répétée avec des serviettes de contrôle inodores par ailleurs identiques. La présentation de ces odeurs sans barrière (c’est-à-dire boule de thé) a conduit les souris à déchiqueter les fibres dans leurs cages, augmentant ainsi l’activité physique. Ce comportement n’était pas aussi saillant chez les rats. Les boules de thé fournissent un boîtier ventilé à la serviette, donnant un accès complet à l’odeur tout en restant protégé pendant toute la durée de l’essai expérimental. Ces boules de thé peuvent être désinfectées conformément aux protocoles d’utilisation des animaux, préparées et introduites directement après la chirurgie pour commencer à habituer les animaux à la structure avec le stimulus de contrôle. Les souris peuvent alors vivre avec l’enrichissement supplémentaire, diminuant l’importance de la présentation de stimulus aigu.
L’accoutumance à la présence de la boule de thé n’est qu’un aspect de l’accoutumance qui est essentiel à cette méthode. Le protocole d’habituation décrit consiste également en une exposition répétée à la procédure d’essai pour normaliser l’environnement d’essai (c.-à-d. personnel, transport et déplacement vers le lieu d’essai, exposition à un stimulus). Cette accoutumance prolongée minimise les réponses nuancées des animaux et concentre les mesures sur les variables dépendantes souhaitées (p. ex., stimuli pharmacologiques ou contextuels). L’évaluation antérieure de ce protocole a identifié quatre essais comme le nombre minimum d’accoutumances nécessaires avant l’essai de température dans des cages domestiques chez le rat8. Si les tests sont séparés par de longues périodes (plus de 2-3 semaines), les animaux doivent être habitués à nouveau. Pour une accoutumance répétée, un minimum d’un à deux essais suffisent. Cependant, si les tests de température sont séparés par des périodes de temps plus longues, il peut être nécessaire de répéter d’autres essais.
Dans l’effort continu pour habituer les souris et les rats à la procédure d’essai, une période d’acclimatation avant la présentation du stimulus devrait être incluse dans chaque essai expérimental. Ce temps d’acclimatation est essentiel pour rééquilibrer la température et l’activité après avoir été déplacé vers le lieu d’essai. Les rongeurs ont tendance à avoir de fortes augmentations de température en raison de la translocation. L’acclimatation doit consister en un minimum de 1 h sans interaction de la part de l’expérimentateur le jour de l’essai avant tout ajout d’un agent pharmacologique ou de stimuli contextuels. Ceci est nécessaire chaque jour de test.
Dans les tests de température décrits dans la cage domestique, les souris ont la liberté de leur cage à domicile pour se déplacer en réponse au stimulus testé. Cela peut entraîner des changements variables dans l’activité, ce qui a une incidence sur la précision des lectures de température et, par conséquent, sur l’analyse des effets thermogéniques de la variable indépendante (p. ex., stimulus pharmacologique ou contextuel). En reconnaissance des changements potentiels de température dus au niveau d’activité, un protocole décrit ci-dessous l’utilisation de la température pendant la marche sur tapis roulant. La littérature publiée décrit l’utilisation réussie de cette procédure chez le rat, et elle est actuellement utilisée avec des souris 8,10,14,15. La marche sur tapis roulant maintient une vitesse d’activité constante pour le sujet testé. Pour cette étude, les tapis roulants sont strictement utilisés pour contrôler le niveau d’activité et, par conséquent, sont réglés à la vitesse la plus basse disponible sur le tapis roulant pour favoriser la marche pour les souris et un réglage tout aussi bas pour les rats.
La procédure suivante est décrite pour la mesure de la température du gastrocnémien unilatéral chez la souris et la présentation de l’odeur du prédateur. La conception peut être utilisée en conjonction avec des agents pharmacologiques et est transférable aux rats et à d’autres groupes musculaires squelettiques (quadriceps) chez la souris. Pour les rats, les transpondeurs peuvent être placés dans le gastrocnémien bilatéralement et dans le tissu adipeux brun. En raison des limites de taille et de distance, un seul transpondeur peut être utilisé par souris. Des modifications mineures (p. ex., la suppression de stimuli contextuels) peuvent être apportées pour évaluer les réponses thermogéniques aux agents pharmacologiques.
Protocole
Ces méthodes peuvent être appliquées à des modèles de rats et de souris et ont été réalisées avec l’approbation institutionnelle (Kent State University, IACUC Approval #359 et #340 CN 12-04). Avant la mise en œuvre du protocole, les animaux devraient être logés conformément au Guide sur le soin et l’utilisation des animaux de laboratoire.
1. Préparation du lecteur de transpondeur
REMARQUE: Avant utilisation, le lecteur de transpondeur doit être réglé; Les étapes suivantes incluent uniquement les modifications de paramètres nécessaires pour cette étude. Cette partie du protocole est directement associée aux lecteurs portables DAS-8027-IUS ; Les autres modèles de lecteurs doivent suivre les instructions fournies par le manuel pour obtenir des résultats de programmation.
- Réglez le bip audio sur OFF.
- Allumez l’appareil en appuyant sur le bouton SCAN et attendez que l’éclairage apparaisse sur l’écran OLED. Appuyez sur le bouton RETOUR/MENU et maintenez-le enfoncé pour accéder à l’écran de menu .
- À l’aide du bouton SUIVANT/ENTRÉE , faites défiler les options jusqu’à OPERATIONAL SETUP. Ici, basculez les flèches vers le haut ou vers le bas pour activer OUI et ouvrez le sous-menu opérationnel.
- À l’aide du bouton NEXT/ENTRÉE, faites défiler jusqu’à AUDIO BEEP. Comme le paramètre par défaut est ON, basculez les flèches vers le haut ou vers le bas et définissez le paramètre sur OFF.
- Appuyez sur le bouton NEXT/ENTER pour enregistrer cette modification de paramètre.
- Réglez Vibrer lors de la lecture sur ON.
- Suivez les étapes 1.1 à 1.2 ou passez à l’étape suivante directement après l’étape 1.4.
- À l’aide du bouton SUIVANT/ENTRÉE , faites défiler jusqu’à VIBRATE UPON READ. Comme le paramètre par défaut est désactivé, basculez les flèches haut et bas et réglez le paramètre sur ON pour sentir, via vibration, lorsque la lecture est terminée, même si vous pouvez voir l’écran.
2. Transpondeurs de programmes
REMARQUE: Chaque transpondeur implanté doit d’abord être programmé avec une identification de l’animal (identification de l’animal ou identification du transpondeur). Cette nomenclature peut être utilisée comme identification secondaire pour le sujet d’essai (p. ex., quatre chiffres pour l’abréviation de la souche de souris, l’emplacement du transpondeur et trois à quatre chiffres supplémentaires pour indiquer le numéro de l’animal). La programmation peut être complétée des jours avant la chirurgie tout en gardant les transpondeurs stériles avant la chirurgie.
- Entrez le code d’identification sur le transpondeur.
- Appliquez une bobine d’amplification sur la tête du lecteur, un accessoire spécifique pour le modèle DAS 8027-IUS, qui facilite la procédure de programmation.
- À l’aide d’une main gantée, placez le transpondeur (à l’intérieur de l’applicateur) dans la bobine de surpression.
- Allumez l’appareil en appuyant sur le bouton SCAN et attendez que l’écran OLED s’allume. Appuyez sur le bouton RETOUR/MENU et maintenez-le enfoncé pour accéder à l’écran de menu .
- À l’aide du bouton NEXT/ENTER, faites défiler les options jusqu’à WRITE TRANSPONDER ID. Ici, basculez les flèches vers le haut ou vers le bas pour activer OUI.
- À l’aide du bouton SUIVANT/ENTRÉE , basculez vers ENTER ID CODE.
- Utilisez les touches fléchées haut et bas pour faire défiler les chiffres et les lettres. Appuyez sur SUIVANT/ENTRÉE après chaque sélection de caractère pour passer au caractère suivant.
- Lorsque le code d’identification est terminé, appuyez sur SCAN pour écrire le transpondeur.
- Retirez le transpondeur de la bobine d’appoint et répétez l’opération si nécessaire. Vérifiez que le transpondeur lit les changements de température en réchauffant les transpondeurs joints entre les mains gantées et en mesurant à l’aide du scanner de température.
REMARQUE : LES PARAMÈTRES AUTO MULTI WRITE et SEQUENTIAL COUNT peuvent être réglés sur ON pour permettre la programmation de transpondeurs multiples ou séquentiels pendant une session. Chaque transpondeur doit être testé pendant la programmation.
3. Préparez des « boules de cage à domicile »
- Placez une serviette inodore / de contrôle de 5 cm x 5 cm dans une boule de thé.
- Placez ces boules de cage à domicile dans de nouvelles cages après la chirurgie pour commencer à habituer l’animal à la méthode dans laquelle les stimuli contextuels seront présentés pendant les tests. Remplacez ces boules de cage toutes les 2 semaines.
4. Chirurgie et soins postopératoires
- Pesez et notez le poids corporel des sujets avant la chirurgie. À l’aide d’une chambre d’induction, administrer une anesthésie (p. ex. 2 à 5 % d’isoflurane) à l’animal.
- À l’aide de tondeuses électriques, rasez complètement le membre postérieur. Administrer une analgésie (p. ex. 5 mg/kg de kétoprofène, s.c.) conformément aux lignes directrices de l’établissement.
REMARQUE: Une analgésie supplémentaire peut être nécessaire si cette procédure est combinée avec d’autres méthodes chirurgicales. - Nettoyez la zone avec de l’alcool à 70 % (ou une lingette alcoolisée stérile disponible dans le commerce) et du lavage povidone-iode (ou des tampons de bétadine stériles et emballés individuellement disponibles dans le commerce) en alternant au moins trois fois, se terminant par de la povidone iodée.
- Remettez l’animal dans la chambre d’induction et anesthésiez-le à des niveaux chirurgicaux. Ensuite, installez la souris dans un masque facial pour une exposition continue à l’anesthésie. Appliquer une pommade ophtalmique néomycine sur les yeux de l’animal pour prévenir la sécheresse sous anesthésie.
REMARQUE : La procédure ne doit pas commencer tant que la souris ne montre aucun signe de réception de la douleur (c.-à-d. réflexe cornéen, réponse de pincement de la queue, réflexe de pincement des orteils). - En utilisant uniquement des ciseaux chirurgicaux, faites une coupe peu profonde à travers la peau sur le membre postérieur droit.
- En se déplaçant parallèlement au gastrocnémien, placez le bord tranchant d’un transpondeur stérile préprogrammé et non bouché dans l’incision. Assurez-vous que le piston vert est orienté vers le haut et visible. Continuez à pousser l’applicateur transpondeur dans l’incision jusqu’à ce que l’ouverture de l’applicateur transpondeur ne soit plus visible.
REMARQUE: N’appuyez pas accidentellement sur le piston vert de l’applicateur transpondeur pendant l’étape 4.6. Une décharge prématurée du transpondeur entraînera un mauvais placement. - Tournez l’applicateur de 180°, ce qui fait que le piston vert est orienté vers le bas vers le membre de la souris, qui n’est plus visible pour l’expérimentateur. Poussez l’applicateur transpondeur à l’emplacement final. Une fois dans un emplacement idéal, adjacent ou partiellement enfermé dans le gastrocnémien, poussez le piston vert, permettant à la pression de l’applicateur de guider la main de l’investigateur loin de la souris.
- À l’aide d’une pince, maintenez ensemble la peau ouverte et placez un clip de plaie avec un autoclip stérile ou une suture stérile. Si nécessaire, utilisez des sutures résorbables avant l’autoclip stérile pour fermer la couche de fascia. À l’aide du transpondeur-lecteur, vérifiez la température du muscle de la souris.
- Retirez la souris de l’anesthésie et placez-la dans une cage propre placée sur un coussin chauffant circulant d’eau réglé à basse température pour la récupération. Assurez-vous que la cage domestique comprend une boule de thé avec une serviette inodore pour commencer l’accoutumance.
REMARQUE: La souris devrait se réveiller de la chirurgie dans les 15 minutes. La nourriture peut être placée au fond de la cage pour un accès facile pendant les jours de récupération. - Soins postopératoires
- Enregistrer quotidiennement le poids et la température des souris à l’aide d’un transpondeur-lecteur pendant au moins 2 jours après la chirurgie ou jusqu’à ce que les souris retrouvent ou stabilisent leur poids corporel.
- Administrer une analgésie non narcotique (par ex. 5 mg/kg de kétoprofène, s.c.) une fois par jour aux souris pendant au moins 2 jours après la chirurgie, avec des doses supplémentaires fournies au besoin.
REMARQUE: Les souris et les rats devraient se rétablir complètement dans les 5 à 8 jours suivant la chirurgie et peuvent subir des procédures d’accoutumance et de test.
5. Préparation des tests - cage à domicile
- Construction de risers
REMARQUE: L’étape ci-dessous est basée sur des cages filtrantes de souris de 194 mm x 181 mm x 398 mm. Pour s’adapter à des cages plus grandes (par exemple, une cage domestique pour rats), la largeur devra être ajustée.- Couper le tuyau en PVC à l’aide d’une fraise en PVC à cliquet en huit sections et assembler en suivant la figure 1C. Cela donnera une structure de table ouverte pouvant contenir environ quatre cages. Faites le nombre souhaité de contremarches.
- Configuration de la salle
- Attribuez un emplacement à chaque riser dans la salle de test. Séparez les contremarches réglées pour recevoir différents stimuli contextuels (c.-à-d. odeurs) d’au moins 2 m pour éviter les variables confondantes.
REMARQUE: Chaque souris doit avoir un emplacement de test assigné dans la salle d’essai et sur les colonnes montantes physiques autant que possible pour éviter de développer des associations entre différents emplacements et stimuli thermogéniques. - À l’aide de bandes magnétiques, attachez des feuilles ou des blouses chirurgicales sur les contremarches, créant ainsi une barrière visuelle entre le chercheur et les sujets testés. Réglez cette barrière pour minimiser les changements de température résultant de l’activité de la souris lorsque vous observez les expérimentateurs se déplaçant vers la cage ou autour de la salle d’essai.
- (Facultatif) Placez des miroirs sur la surface sous les colonnes montantes pour faciliter la visualisation du fond de la cage pendant les essais.
REMARQUE: Les contremarches peuvent être désinfectées par un système de lavage en cage. Les draps en tissu ou chirurgicaux doivent être lavés avant l’accoutumance et les tests.
- Attribuez un emplacement à chaque riser dans la salle de test. Séparez les contremarches réglées pour recevoir différents stimuli contextuels (c.-à-d. odeurs) d’au moins 2 m pour éviter les variables confondantes.
- Préparation de boules de thé
- Préparez des boules de thé avec contrôle et serviettes PO (environ 5 cm x 5 cm). Pour éviter la contamination croisée, préparez d’abord des boules de thé de contrôle des odeurs.
REMARQUE: Les serviettes à odeur de prédateur doivent être testées contre les agents pathogènes avant utilisation. Ces serviettes doivent également être confinées et les matériaux qui interagissent avec elles doivent être immédiatement désinfectés (c.-à-d. lavage de la cage), empêchant l’exposition de l’odeur à d’autres animaux.
- Préparez des boules de thé avec contrôle et serviettes PO (environ 5 cm x 5 cm). Pour éviter la contamination croisée, préparez d’abord des boules de thé de contrôle des odeurs.
6. Test de température - cage domestique
NOTE: Les animaux doivent être habitués à l’ensemble de la procédure d’essai, à l’exclusion des stimuli contextuels expérimentaux ou pharmacologiques. Cela doit être complété au moins 4x avant le test.
- Transférer les animaux dans la salle d’essai préparée. Placez les animaux à un endroit prédéterminé sur la contremarche. Cet emplacement devrait être le même tout au long de toutes les procédures d’accoutumance et de test.
- Retirez la « boule de la cage à domicile » de la cage de la souris et recouvrez les cages avec un chiffon ou une feuille chirurgicale. Laissez les souris s’acclimater à l’espace de test pendant 1-2 h.
- Une fois l’acclimatation terminée, utilisez le scanner pour mesurer et enregistrer la température de base de chaque sujet. Évitez de manipuler les revêtements en tissu pendant les mesures.
NOTE: Les agents pharmacologiques peuvent être appliqués ici. Le temps d’attente après l’injection ou l’application peut être ajouté au besoin avant le test. Il est recommandé d’enregistrer une ligne de base secondaire directement avant le test après l’ajout d’un agent pharmacologique pour surveiller la réponse aux stimuli pharmacologiques. Si la réponse olfactive n’est pas testée, les mesures de température des souris peuvent commencer directement après l’injection. La randomisation doit être utilisée lors de la fourniture de stimuli. - Découvrez la cage et placez la boule de thé (témoin ou PO) sur le sol de la cage familiale. Remplacez le couvercle de la cage et le revêtement en tissu.
- Commencez le chronomètre. Mesurer les températures des sujets testés dans le même ordre de placement des boules de thé. Enregistrez les températures et le temps d’horloge des mesures en suivant les points de temps souhaités.
- Lorsque l’expérience est terminée, retirez la boule de traitement. Placez les souris qui ont reçu PO dans une nouvelle cage domestique avec la « boule de cage à domicile » originale. Retournez la « boule de cage à domicile » dans la cage des souris qui ont reçu l’odeur de contrôle. Transférez les souris à l’emplacement du logement.
REMARQUE: La procédure ci-dessus peut être traduite en modèles de rats dans des cages de taille appropriée. Des ajustements aux mesures suggérées à la figure 1C peuvent être nécessaires pour permettre un meilleur accès au fond de la cage domestique.

Figure 1 : Essais de température des transpondeurs et des cages domestiques. (A) Schéma de la mise en place unilatérale du transpondeur pour tester la température chez un gastrocnémien de souris. Une fois programmé et placé, le transpondeur-lecteur (DAS-8027-IUS, illustré) peut être utilisé pour mesurer la température. (B) À gauche, photo d’une boule à thé en acier inoxydable à mailles ouvertes et d’une serviette de 5 cm x 5 cm. À droite, boule de thé fermée, utilisée pour tenir les serviettes d’accoutumance et d’odeur dans les tests de cage à domicile. C) Schéma des colonnes montantes construites avec des tuyauteries en PVC pour les essais en cage domestique. (D) Déroulement du protocole d’essai des cages domestiques. (E) Images de l’installation de la zone d’essai de la cage domestique. À gauche, quatre cages à souris au sommet d’une contremarche. Des bandes magnétiques sont situées sur le mur adjacent, et des aimants et du tissu chirurgical sont sur la table. À droite, cages à souris couvertes sur des contremarches. (A), (C) et (D) ont été créés avec Biorender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
7. Test de température - marche sur tapis roulant
- Attribuez à chaque animal un tapis roulant comme emplacement assigné pour les procédures d’accoutumance et de test.
- Préparez les tapis roulants pour les tests, en vous assurant que les chocs sont fonctionnels.
REMARQUE: Pour la marche sur tapis roulant, les tapis roulants doivent être réglés au rythme le plus bas disponible qui favorise le mouvement continu, mais pas la course pour l’accoutumance et les tests. Pour le tapis roulant métabolique fermé modulaire 1012M-2, il s’agit de 5,2 m/min pour les souris et de 7 m/min pour les rats. Ce rythme peut devoir être ajusté en fonction de l’obésité du sujet. Les chocs doivent être réglés sur une intensité et un taux de répétition de 5,0. - Accoutumance
- Déplacez les souris dans la salle de test. Laissez les souris 1-2 h s’acclimater au transfert de la chambre dans leurs cages domestiques.
- Après l’acclimatation, guidez les souris jusqu’à l’ouverture du tapis roulant qui leur a été assigné et fermez le tapis roulant. Démarrez la ceinture, le choc et le chronomètre.
- Laissez les souris marcher sur les tapis roulants pendant 15 minutes, en utilisant le stimulus de choc comme motivation pour le mouvement. Arrêtez immédiatement le test si un animal reste sous choc actif pendant une période prolongée.
- Après le test, retirez les souris et remettez-les dans les cages domestiques.
- Nettoyez les tapis roulants avec un détergent liquide et de l’eau.
- Test
- Déplacez les souris dans la salle de test. Laissez les souris 1-2 h s’acclimater au transfert de la pièce dans leurs cages domestiques.
- Mesurez et enregistrez la température de base avant de déplacer la souris sur le tapis roulant.
NOTE: Pour les tests incluant des agents pharmacologiques, appliquez-les ou injectez-les ici, en suivant le schéma illustré à la figure 2A. Le temps d’attente après l’injection peut être ajouté au besoin avant que les souris ne soient placées sur le tapis roulant. La randomisation doit être utilisée lors de la fourniture de stimuli. - Placez des carrés de contrôle ou des serviettes PO de 5 cm x 5 cm dans le tapis roulant le plus proche de l’avant du tapis roulant. Collez les serviettes au plafond du tapis roulant ou en dessous pour faciliter le placement et le retrait.
- Guidez les souris dans le tapis roulant assigné. Allumez la ceinture du tapis roulant et le choc.
- Démarrez le chronomètre. Prenez les mesures des sujets testés dans le même ordre que celui dans lequel les souris ont été installées dans les tapis roulants. Enregistrez les températures et l’heure d’horloge des mesures en suivant les points de temps souhaités.
REMARQUE: La température peut être mesurée de manière fiable de l’extérieur du tapis roulant pendant qu’une souris est à l’intérieur d’un tapis roulant fermé pendant l’activité de marche. Pour les rats, la taille du tapis roulant et les limites de distance du transpondeur-lecteur peuvent nécessiter qu’un expérimentateur garde l’arrière du tapis roulant ouvert pour insérer le lecteur à l’intérieur du tapis roulant, plus près du sujet. - Lorsque le test est terminé, éteignez les chocs et les tapis roulants; Remettez les souris dans leurs cages d’origine. Transférez les souris à l’emplacement du logement.
- Nettoyez les tapis roulants avec un détergent liquide et de l’eau, en accordant une attention particulière à éliminer tout PO résiduel.
- Lorsque les expériences sont terminées, euthanasier les animaux (p. ex., en inhalant du CO2 ) et confirmer visuellement l’emplacement du transpondeur.
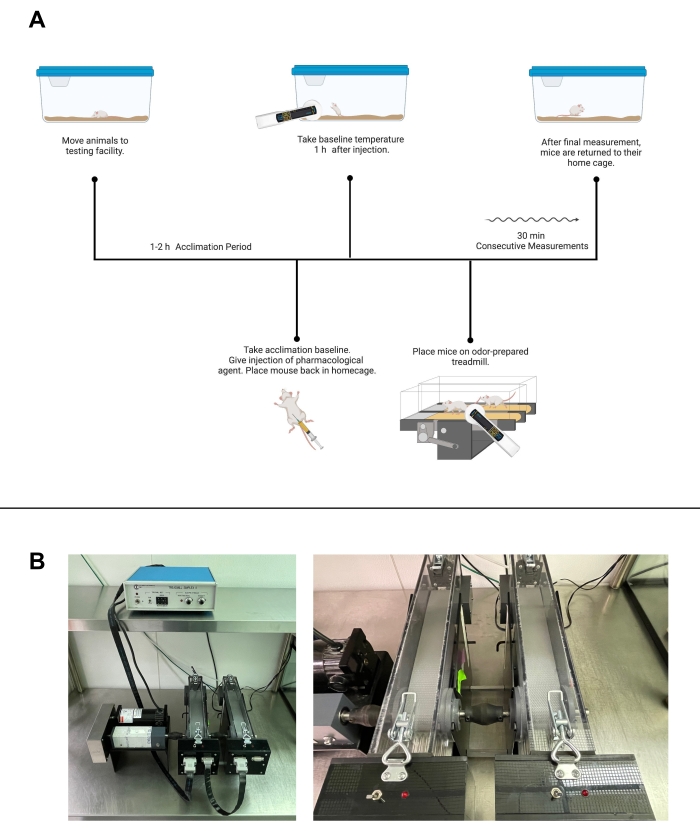
Figure 2 : Essais de température contrôlée par l’activité. (A) Déroulement des essais de température contrôlée par activité avec un agent pharmacologique utilisant la marche sur tapis roulant. (B) Images d’installations de tapis roulants. À gauche, une image de la configuration complète de l’équipement. À droite, une image plus rapprochée de tapis roulants individuels et de chocs. (A) a été créé avec Biorender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Des transpondeurs ont été implantés unilatéralement dans le gastrocnémien droit de dix souris de type sauvage (WT) âgées de 4 à 6 mois issues de la souche SF1-Cre (Tg(Nr5a1-cre)7Lowl/J, souche #012462, C57BL/6J et FVB; femelle N = 5; mâle N = 5). Après la récupération, les souris étaient habituées à une procédure d’analyse de la température de la cage domestique qui n’incluait pas de stimulus contextuel (p. ex. PO). Les mesures de température à l’aide d’une baguette transpondeur ont été enreg...
Discussion
Ce protocole de test de température fournit au domaine un moyen de mesurer directement la thermogenèse des muscles squelettiques. Ceci est essentiel alors que la recherche se penche sur l’identification des mécanismes sous-jacents à la thermogenèse musculaire33. La méthode fournit deux protocoles rentables pour mesurer la thermogenèse des muscles squelettiques dans des conditions contextuelles et pharmacologiques. Ce protocole souligne l’importance de l’accoutumance et de l’acclimat...
Déclarations de divulgation
Les auteurs déclarent n’avoir aucun conflit d’intérêts.
Remerciements
Ce travail est soutenu par R15 DK097644 et R15 DK108668. Nous remercions la Dre Chaitanya K Gavini et la Dre Megan Rich pour leurs contributions antérieures et le Dr Stanley Dannemiller pour avoir veillé à ce que nous respections les lignes directrices institutionnelles sur l’utilisation des animaux. Un merci spécial au Dr Tim Bartness pour avoir fourni la recherche fondamentale nécessaire à la construction de cette méthode et des études associées. Les figures 1A, C, D et 2A ont été créées à l’aide de Biorender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 1012M-2 Modular Enclosed Metabolic Treadmill for Mice, 2 Lanes w/ Shock | Columbus Instruments | ||
| 1012R-2 Modular Enclosed Metabolic Treadmill for Rats, 2 Lanes w/ Shock | Columbus Instruments | ||
| 1-1/4 in. Ratcheting PVC Cutter | BrassCraft | ||
| 1 mL Syringes | Fisher Scientific | BD 309659 | |
| Betadine Swabs | Fisher Scientific | 19-898-945 | |
| Booster Coil | BioMedic Data Systems | Transponder Accessory | |
| Electric Clippers | Andis | 40 Ultraedge Clipper Blade | |
| Flexible Mirror Sheets | Amazon | Self Adhesive Non Glass Mirror Tiles | |
| Forceps | Fisher Scientific | 89259-940 | |
| Heating Pad | |||
| Induction Chamber (isoflurane) | Kent Scientific | VetFlo-0730 | 3.0 L Low Cost Chambers for Traditional Vaporizers |
| Ketoprophen | Med-Vet Intl. | RXKETO-50 | |
| Magnetic Strips | Amazon | ||
| Magnets | Amazon | DIYMAG Magnetic Hooks 40lbs | |
| Needles | Med-Vet Intl. | 26400 | |
| Neomycin/Polymixin/Bacitracin with Hydrocortisone Ophthalmic Ointment, 3.5 g | Med-Vet Intl. | RXNPB-HC | |
| Oasis Absorbable Suture | Med-Vet Intl. | MV-H821-V | |
| Predator (Ferret) Odor Towels | Marshall BioResources | ||
| PVC pipe | |||
| Reflex Wound Clip Remover | CellPoint Scientific | ||
| Reflex Wound Clip, 7 mm (mouse) | CellPoint Scientific | ||
| Reflex Wound Clip, 9 mm (rat) | CellPoint Scientific | ||
| Srerile Autoclip, 7 mm (mouse) | CellPoint Scientific | Wound Clip Applier (mouse) | |
| Stainless Strainers Interval Seasonings Tea Infuser | Amazon | ||
| Sterile Autoclip, 9 mm (rat) | CellPoint Scientific | Wound Clip Applier (rat) | |
| Sterile Saline | Med-Vet Intl. | RX0.9NACL-10 | |
| Surgical Scissors | Fisher Scientific | 08-951-5 | |
| Surgical Sheets | |||
| Towels (Control/Habituation) | Amazon | 100% Cotton Towels, white | |
| Transponders | BioMedic Data Systems | Model: IPTT-300 | |
| Transponders Reader | BioMedic Data Systems | Model: DAS-8027-IUS/ DAS-7007R | |
| Versaclean | Fisher Scientific | 18-200-700 | liquid detergent |
| Webcol Alcohol Preps | Covidien | 22-246-073 | |
| Wedge pieces for PVC pipe |
Références
- Periasamy, M., Herrera, J. L., Reis, F. C. G. Skeletal muscle thermogenesis and its role in whole body energy metabolism. Diabetes Metabolism Journal. 41 (5), 327-336 (2017).
- Rowland, L. A., Bal, N. C., Periasamy, M. The role of skeletal-muscle-based thermogenic mechanisms in vertebrate endothermy. Biological Reviews of the Cambridge Philosophical Society. 90 (4), 1279-1297 (2015).
- Maurya, S. K., et al. Sarcolipin is a key determinant of the basal metabolic rate, and its overexpression enhances energy expenditure and resistance against diet-induced obesity. Journal of Biological Chemistry. 290 (17), 10840-10849 (2015).
- Grigg, G., et al. Whole-body endothermy: Ancient, homologous and widespread among the ancestors of mammals, birds and crocodylians. Biological Reviews of the Cambridge Philosophical Society. 97 (2), 766-801 (2022).
- Franck, J. P. C., Slight-Simcoe, E., Wegner, N. C. Endothermy in the smalleye opah (Lampris incognitus): A potential role for the uncoupling protein sarcolipin. Comparative Biochemistry and Physiology - Part A: Molecular & Integrative Physiology. 233, 48-52 (2019).
- Nowack, J., et al. Muscle nonshivering thermogenesis in a feral mammal. Scientific Reports. 9, 6378 (2019).
- Oliver, S. R., Anderson, K. J., Hunstiger, M. M., Andrews, M. T. Turning down the heat: Down-regulation of sarcolipin in a hibernating mammal. Neuroscience Letters. 696, 13-19 (2019).
- Gorrell, E., et al. Skeletal muscle thermogenesis induction by exposure to predator odor. The Journal of Experimental Biology. 223, (2020).
- Gavini, C. K., et al. Leanness and heightened nonresting energy expenditure: Role of skeletal muscle activity thermogenesis. The American Journal of Physiology - Endocrinology and Metabolism. 306 (6), 635-647 (2014).
- Almundarij, T. I., Gavini, C. K., Novak, C. M. Suppressed sympathetic outflow to skeletal muscle, muscle thermogenesis, and activity energy expenditure with calorie restriction. Physiological Reports. 5 (4), 13171 (2017).
- Harshaw, C., Lanzkowsky, J., Tran, A. D., Bradley, A. R., Jaime, M. Oxytocin and 'social hyperthermia': Interaction with beta3-adrenergic receptor-mediated thermogenesis and significance for the expression of social behavior in male and female mice. Hormones and Behavior. 131, 104981 (2021).
- Caldwell, H. K. Oxytocin and vasopressin: Powerful regulators of social behavior. The Neuroscientist. 23 (5), 517-528 (2017).
- Harshaw, C., Leffel, J. K., Alberts, J. R. Oxytocin and the warm outer glow: Thermoregulatory deficits cause huddling abnormalities in oxytocin-deficient mouse pups. Hormones and Behavior. 98, 145-158 (2018).
- Gavini, C. K., Britton, S. L., Koch, L. G., Novak, C. M. Inherently lean rats have enhanced activity and skeletal muscle response to central melanocortin receptors. Obesity. 26 (5), 885-894 (2018).
- Gavini, C. K., Jones, W. C., Novak, C. M. Ventromedial hypothalamic melanocortin receptor activation: regulation of activity energy expenditure and skeletal muscle thermogenesis. The Journal of Physiology. 594 (18), 5285-5301 (2016).
- Zaretsky, D. V., Romanovsky, A. A., Zaretskaia, M. V., Molkov, Y. I. Tissue oxidative metabolism can increase the difference between local temperature and arterial blood temperature by up to 1.3(o)C: Implications for brain, brown adipose tissue, and muscle physiology. Temperature. 5 (1), 22-35 (2018).
- Yoo, Y., et al. Exercise activates compensatory thermoregulatory reaction in rats: A modeling study. Journal of Applied Physiology. 119 (12), 1400-1410 (2015).
- Langer, F., Fietz, J. Ways to measure body temperature in the field. Journal of Thermal Biology. 42, 46-51 (2014).
- Pence, S., et al. Central apolipoprotein A-IV stimulates thermogenesis in brown adipose tissue. International Journal of Molecular Sciences. 22 (3), 1221 (2021).
- Li, D., et al. Homeostatic disturbance of thermoregulatory functions in rats with chronic fatigue. Journal of Neuroscience Research. 165, 45-50 (2021).
- Carlier, J., et al. Pharmacodynamic effects, pharmacokinetics, and metabolism of the synthetic cannabinoid AM-2201 in male rats. Journal of Pharmacology and Experimental Therapeutics. 367 (3), 543-550 (2018).
- Pato, A. M., Romero, D. M., Sosa Holt, C. S., Nemirovsky, S. I., Wolansky, M. J. Use of subcutaneous transponders to monitor body temperature in laboratory rats. Journal of Pharmacological and Toxicological Methods. 114, 107145 (2022).
- Almeida, D. L., et al. Lean in one way, in obesity another: Effects of moderate exercise in brown adipose tissue of early overfed male Wistar rats. International Journal of Obesity. 46 (1), 137-143 (2022).
- Brito, M. N., Brito, N. A., Baro, D. J., Song, C. K., Bartness, T. J. Differential activation of the sympathetic innervation of adipose tissues by melanocortin receptor stimulation. Endocrinology. 148 (11), 5339-5347 (2007).
- Vaughan, C. H., Shrestha, Y. B., Bartness, T. J. Characterization of a novel melanocortin receptor-containing node in the SNS outflow circuitry to brown adipose tissue involved in thermogenesis. Brain Research. 1411, 17-27 (2011).
- Kort, W. J., Hekking-Weijma, J. M., TenKate, M. T., Sorm, V., VanStrik, R. A microchip implant system as a method to determine body temperature of terminally ill rats and mice. Laboratory Animals. 32 (3), 260-269 (1998).
- Mei, J., et al. Body temperature measurement in mice during acute illness: Implantable temperature transponder versus surface infrared thermometry. Scientific Reports. 8, 3526 (2018).
- Warn, P. A., et al. Infrared body temperature measurement of mice as an early predictor of death in experimental fungal infections. Laboratory Animals. 37 (2), 126-131 (2003).
- Hargreaves, K., Dubner, R., Brown, F., Flores, C., Joris, J. A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia. Pain. 32 (1), 77-88 (1988).
- Fiebig, K., Jourdan, T., Kock, M. H., Merle, R., Thone-Reineke, C. Evaluation of infrared thermography for temperature measurement in adult male NMRI nude mice. Journal of the American Association for Laboratory Animal Science. 57 (6), 715-724 (2018).
- Franco, N. H., Geros, A., Oliveira, L., Olsson, I. A. S., Aguiar, P. ThermoLabAnimal - A high-throughput analysis software for non-invasive thermal assessment of laboratory mice. Physiology & Behavior. 207, 113-121 (2019).
- Koganti, S. R., et al. Disruption of KATP channel expression in skeletal muscle by targeted oligonucleotide delivery promotes activity-linked thermogenesis. Molecular Therapy. 23 (4), 707-716 (2015).
- Bal, N. C., Periasamy, M. Uncoupling of sarcoendoplasmic reticulum calcium ATPase pump activity by sarcolipin as the basis for muscle non-shivering thermogenesis. Philosophical Transactions of the Royal Society B. 375 (1793), 20190135 (2020).
- Hicks, C., et al. Body temperature and cardiac changes induced by peripherally administered oxytocin, vasopressin and the non-peptide oxytocin receptor agonist WAY 267,464: a biotelemetry study in rats. British Journal of Pharmacology. 171 (11), 2868-2887 (2014).
- Kasahara, Y., et al. Oxytocin receptor in the hypothalamus is sufficient to rescue normal thermoregulatory function in male oxytocin receptor knockout mice. Endocrinology. 154 (11), 4305-4315 (2013).
- Kasahara, Y., et al. Role of the oxytocin receptor expressed in the rostral medullary raphe in thermoregulation during cold conditions. Frontiers in Endocrinology. 6, 180 (2015).
- Yuan, J., Zhang, R., Wu, R., Gu, Y., Lu, Y. The effects of oxytocin to rectify metabolic dysfunction in obese mice are associated with increased thermogenesis. Molecular and Cellular Endocrinology. 514, 110903 (2020).
- Scholl, J. L., Afzal, A., Fox, L. C., Watt, M. J., Forster, G. L. Sex differences in anxiety-like behaviors in rats. Physiology & Behavior. 211, 112670 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon