Method Article
Domuz Beyin Dokusundan Tübülin Veriminin Optimize Edilmesi
Bu Makalede
Özet
Bu protokol, küçük ölçekli enstrümantasyon için optimize edilmiş domuz beyninden tübülinin yüksek verimli izolasyonu için bir tekniği açıklar. İzolasyon prosedürleri, ko-sedimantasyon deneyleri ve transmisyon elektron mikroskobu kullanılarak in vitro olarak tübülin polimerizasyon aktivitesinin belirlenmesi için prosedürlerle tamamlanmaktadır.
Özet
Herhangi bir kaynaktan gelen nöral doku, tübülin izolasyonu için mükemmel bir malzemedir, çünkü nöronların dendritleri ve aksonları mikrotübüller açısından zengindir. Burada, birden fazla kaynaktan nöral doku için küçük değişikliklerle kullanılabilecek tübülin ekstraksiyonu için bir prosedür sunuyoruz. Sunulan protokolde, ham lizatın yeni bir arıtma adımı tanıtılmıştır, bu da ilk polimerizasyon aşaması meydana gelmeden önce başlangıçtaki çözünmeyen kalıntı miktarında önemli bir azalmaya yol açmıştır. Bu ek adım, aynı enstrümantasyon kullanılırken ek dokunun işlenmesine ve böylece işlenmiş homojenatın nispi hacminin arttırılmasına izin verdi. Yeni tanıtılan adımın, in vitro aktivite deneyleri ve transmisyon elektron mikroskobu ile onaylandığı gibi, saflaştırılmış tübülinin kalitesi üzerinde önemli bir etkisi yoktur. Açıklanan prosedür, doku toplama, taşıma, doku homojenizasyonu, tübülin izolasyon döngüleri ve FPLC ve müteakip aktivite ölçüm deneyleri kullanılarak iyon değişim kromatografisi ile son parlatma dahil olmak üzere tüm önemli adımları içerir. Saflaştırılmış tübülinin homojenliği, elektrosprey iyonizasyonu ve MALDI-TOF kullanan MS/MS analizi ile onaylandığı üzere %97'den fazlaydı.
Giriş
Alfa- ve beta-tübülin heterodimerleri tarafından oluşturulan içi boş protein filamentleri (24 nm çapında) olan mikrotübüller, çeşitli temel hücresel süreçlerde rol oynar. Hücre içi yapıların oluşturulmasına, motiliteye, hücre bölünmesine, hücre farklılaşmasına, hücresel taşınmaya, şekil bakımına ve sekresyonakatılırlar 1. Mikrotübüllerin hücresel fonksiyonları, mikrotübül ile ilişkili proteinler (MAP'ler) ve diğer proteinlerle doğrudan veya dolaylı etkileşimlerden veya tübülin kodu2'de tanımlanan karmaşık translasyon sonrası modifikasyonlardan etkilenebilir.
Tübülin lifleri, çekirdeklenme-uzama mekanizmasındaki alfa ve beta alt birimleri arasındaki dinamik kovalent olmayan etkileşimlerden kaynaklanır. Kısa mikrotübüller oluşturulur ve tübülin liflerinin müteakip büyümesi, her iki uçta tersinir uzama ile elde edilir ve paralel protofilamentler2 halinde düzenlenmiş tübülin heterodimerlerinden oluşan silindirler oluşturur. Dinamik kararsızlık, birleştirilmiş mikrotübüllerin genellikle alt birimleriyle dengede olmadığı, ancak kararlı bir durumu korurken uzun bir büyüme ve büzülme periyodu arasında faz geçişine uğrayabileceği gerçeğini ifade eder 1,2.
Tübülin liflerinin dinamik kararsızlığı, esas olarak, yüksek saflıkta gliserol, DMSO, GTP / ATP, Mg2 + veya diğer kimyasal ajanlar (taksol veya polikatyonlar gibi) ortamında yüksek sıcaklıkta polimerizasyon ve düşük sıcaklıkta depolimerizasyon döngüleri kullanılarak birçok tübülin ayırma ve saflaştırma prosedüründe kullanılır3. Ayırma prosedürlerinin4 çoğunu, tübülin ile ilişkili proteinlerin nükleozit difosfokinaz ve ATPaz aktivitesi 5 ile ayrılmasını sağlayan protein kromatografisi 5,6,7,8,9 takip eder. Yüksek tuzlu tamponlar10 kullanılarak da benzer sonuçlar elde edilebilir. Nöral 11,12,13,14 ve nöral olmayan 15 doku, balıklar16 (hem tatlı su hem de deniz), mayalar veya rekombinant varyantlar 17 dahil olmak üzere çoklu kaynaklar farklı üretim suşlarında aşırı eksprese edildi11,12,13,14 ve diğer kaynaklar 9,18 fraksiyonlama için kullanıldı ve Arıtma.
Sunulan protokol, tübülini domuz beyninden yüksek homojenliğe izole etmek için çökeltme ve protein kromatografisini kullanır (Şekil 1). Ana avantaj, rutin moleküler biyoloji deneyleri için donatılmış laboratuvarlarda bulunan enstrümantasyon ile elde edilen nispeten yüksek bir verimdir.
Protokol
Tüm çözeltilerin ve enstrümantasyonun bileşimi Malzeme Tablosunda açıklanmıştır. Tüm çözeltiler FPLC dereceli kimyasallar kullanılarak hazırlandı ve kullanımdan önce 0,22 μm'lik bir filtreden süzüldü. Tüm operasyonlar sırasında laboratuvar önlüğü, eldiven ve koruyucu gözlük gibi kişisel koruyucu ekipman kullanıldı. Tüm aletler temizdi ve deterjan izleri yoktu. Prosedürler sırasında, uygun hayvan bakımı yönergelerine (kurum tarafından onaylandığı şekilde) uyuldu. Beyin dokusu da dahil olmak üzere tüm biyolojik materyaller hammadde olarak bir mezbahadan satın alındı. Protokolün hiçbir aşamasında canlı hayvan kullanılmamıştır.
1. Hızlı protein sıvı kromatografisi için bir fosfo-selüloz kolonunun aktivasyonu
- 15 g kuru fosfoselüloz reçinesine 700 mL %50 etanol ekleyin ve bir kaşıkla beherde hafifçe karıştırın.
- Süspansiyonu uygun hacimde (700 mL) uygun bir kromatografik kolona dökün. Kolonu fritlerle donatılmış pistonlarla kapatın. Boş kafa boşluğunun en az %10'unu bırakın.
NOT: Diğer kaplar da kullanılabilir, ancak FPLC kolonu, peristaltik bir pompa ile birlikte, reçine aktivasyonu ve reçine kayıpları için gereken süreyi önemli ölçüde azaltır. - 30 dakika boyunca 60 rpm'de bir rocker-shaker üzerinde inkübe edin.
- Akış 3 mL/dk'ya ayarlanmış peristaltik pompayı kullanarak reçinenin çökelmesine ve fazla %50 etanolü çıkarmasına izin verin. Reçinenin kurumasına izin vermeyin.
- Üst pistonu çıkarın ve 300 mL %50 etanol ekleyin. Sütunu kapatın, kısaca sallayın ve fazla etanolü peristaltik bir pompa ile çıkarın.
- Kalan etanolü çıkarın. Kolona 300 mL ultra saf su ekleyin, kolonu pistonla kapatın ve reçine yeniden süspanse olana kadar eğin. Peristaltik bir pompa kullanarak fazla sıvıyı çıkarın. Bu adımı üç kez tekrarlayın.
- Üstteki sütunu açın, 500 mL 0,5 M HCl ekleyin, sütunu kapatın ve reçineyi hafifçe eğerek yeniden süspanse edin. 30 dakika boyunca 60 rpm'de bir rocker-shaker üzerinde inkübe edin.
- Peristaltik bir pompa kullanarak fazla sıvıyı çıkarın. 300 mL 0.5 M HCl ekleyin, reçineyi tekrar süspanse edin ve fazla sıvıyı çıkarın.
- Kalan HCl'yi çıkarın. Kolona 300 mL ultra saf su ekleyin, kolonu pistonla kapatın ve reçine yeniden askıda kalana kadar eğin. Peristaltik bir pompa kullanarak fazla sıvıyı çıkarın. Bu adımı üç kez tekrarlayın.
- 700 mL MES tamponunu (25 mM MES, 0.1 mM EGTA, 0.5 mM MgCl2) kolona dökün ve reçineyi eğerek yeniden süspanse edin. Süspansiyonu behere dökün, 1 M NaOH ile pH'ı 6.1'e ayarlayın ve hafif çalkalama altında 2 saat inkübe edin.
- Reçinenin çökelmesine izin verin, sıvıyı boşaltın, 300 mL MES tamponu, pH 6.4 ekleyin ve gece boyunca 4 °C'de inkübe edin.
- Fazla sıvıyı boşaltın,% 20 nihai konsantrasyona% 96 etanol ekleyin ve% 20 kullanın ve kullanılana kadar 4 ° C'de saklayın.
2. Fosfo-selüloz kolon salmastrası
- Kapalı bir alt tapa ile temiz kromatografik kolona 12 mL aktif reçine dökün. Reçinenin oturmasına izin verin. Çökelmiş reçinenin hacmi yaklaşık 5 mL'dir. Daha hafif kırık matris parçalarının birikebileceği reçine üst tabakasını (yaklaşık 2-3 mm) çıkarın.
- Alt tapayı çıkarın ve depolama solüsyonunun damla damla serbestçe boşalmasına izin verin. Reçinenin kurumasına izin vermeyin.
- Sütunu kapatın ve FPLC sistemine bağlayın. Kolonu PEM tamponu ile (100 mM BORULAR pH 6.9, 1 mM EGTA, 1 mMMgS4) 1 mL/dk'da (maks. basınç 1 bar) 30 dakika boyunca yıkayın, piston yüksekliğini ayarlayın, kolonu ters çevirin ve kolonu sonraki 30 dakika boyunca aynı koşullar altında ters akışta yıkayın.
- Aktif fosfo-selüloz ile doldurulmuş sütunu birkaç gün boyunca 4 ° C'de saklayın.
3. Tübülin ayırma ve saflaştırma
NOT: Tubulin bozulmaya oldukça eğilimlidir ve hızlı bir şekilde ilerlemek çok önemlidir. Tüm çözeltiler, aletler ve ekipman önceden hazırlanmalı, soğutulmalı veya gerekirse ısıtılmalıdır. Prosedürler, önerilen sıcaklıklardaki değişimlere karşı hassastır. Beyin dokusu, saflaştırma sırasında üretilen biyolojik atık miktarı göz önünde bulundurularak, diseksiyondan mümkün olan en kısa sürede işlenmelidir. Prosedür, altı adet 75 mL ultrasantrifüj küveti ile rotor için optimize edildi. İşlenen doku miktarı mevcut ultrasantrifüje göre arttırılabilir veya azaltılabilir.
- Doku taşımacılığı
- 500 g taze disseke edilmiş domuz beynini (6-8 parça) 3 L'lik bir taşıma kabına koyun ve buz gibi soğuk Taşıma tamponunu (4.1 mM MES pH 7, 320 mM Sakkaroz, 1 mM EGTA) tamamen daldırılana kadar dökün. 5 dakika buz üzerinde bekletin ve ısı dağılımını kolaylaştırmak için Taşıma tamponunu yenisiyle değiştirin. Daha sonraki işlemler için buz üzerinde hızlı bir şekilde taşıyın.
- Doku homojenizasyonu
NOT: Doku homojenizasyonu soğuk bir odada buz üzerinde gerçekleştirilir. Spontan polimerizasyonu önlemek için tüm aletler önceden soğutulmalıdır. Tübülinin birincil kaynağı gri maddedir ve geri kalanı aşağıdaki adımlarda çıkarılır.- 100 mL Ekstraksiyon tamponunu (4.1 mM MES pH 7, 520 mM Sakkaroz, 1 mM EGTA, 1 mM ATP ve 0.1 mM GTP) 1 L'lik bir plastik behere dökün ve kap dahil ağırlığı W1 (g) belirleyin. ATP ve GTP, kullanımdan hemen önce eklenir.
- Domuz beynini taşıma kabından çıkarın ve mütevazı bir kuvvet uygulayarak tüm beyinciği, yağı, büyük beyaz madde parçalarını, meninksleri ve kan damarlarını parmaklarınızla çıkarın. Makas veya cımbız da kullanılabilir. İstenmeyen dokulardan arındırılmış domuz beyinlerini 100 mL soğuk Ekstraksiyon tamponu ile behere yerleştirin. Tüm doku işlenene kadar devam edin.
- Beheri işlenmiş beyin dokusu ile tartın ve W2 (g) ağırlığını belirleyin.
- Ekstraksiyon tamponu formülüne göre ekleyin, Ekstraksiyon tamponu ağırlığı = W2 - W1 (örneğin, 400 g doku için 300 g ek Ekstraksiyon tamponu eklenir).
- Ekstraksiyon tamponu ile beyin dokusunu önceden soğutulmuş mutfak blenderine aktarın ve 4-8 kısa, üç saniyelik darbelerle işleyin.
- Kısmen homojenize edilmiş dokuyu yüksek hızlı dispersiyon homojenizatörü (18 000 rpm) ile 1 dakika boyunca işleyin. Süspansiyonu 3-5 dakika buz üzerinde bırakın, ara sıra bir kaşıkla karıştırın. Beş kez veya tamamen homojenleşene kadar tekrarlayın.
- Önceden soğutulmuş ultrasantrifüj tüplerine dökün ve 4 °C ve 50.000 x g'da 10 dakika döndürün. Süpernatanı saklayın ve peleti atın. 430 mL arıtılmış ekstrakt toplanana kadar tekrarlayın.
- Arıtılmış ekstraktı önceden soğutulmuş ultrasantrifüj tüplerine (her biri 70 mL) dökün ve 60 dakika boyunca 4 ° C ve 75.000 x g'da döndürün. Süpernatanı toplayın ve S1 hacmini belirleyin.
NOT: Yalnızca bir rotor varsa, bir sonraki santrifüjleme adımı (37 °C) için ılık su banyosunda ısıtın.
- İlk polimerizasyon
- V = S1/9 mL formülüne göre 10x MEM tamponu (1 M MES pH 6.8, 10 mM EGTA, 10 mM MgCl2) ekleyin (585 mL süpernatan için 65 mL 10x MEM tamponu ekleyin). İyice karıştırın ve 3,5 M'ye gliserol ve 0,1 mM nihai konsantrasyona GTP ekleyin. Süspansiyonu ultrasantrifüj tüplerine dökün (süpernatantın hacmi tüplerin hacmini aşıyor; geri kalanı atılıyor).
- Tüpleri süpernatan ile birlikte 37 ° C'de 45 dakika boyunca bir su banyosunda inkübe edin.
- Tüpleri 37 °C ve 75.000 x g'da 90 dakika döndürün. MEM tamponunun hacmini belirlemek için süpernatantın (S2) hacmini ölçün, adım 3.3.4'te peletlere ekleyin ve ardından süpernatanı atın. Peletleri polimerize tübülinin bulunduğu yerde tutun.
- 0,5 x S2 hacimde buz gibi soğuk 1x MEM tamponu hazırlayın. Pelet ile her bir ultrasantrifüj tüpüne eşit miktarda 1x MEM tamponu ekleyin. Eklenen 1x MEM tamponundaki peletleri yeniden askıya alın, süspansiyonları dereceli silindire aktarın ve toplam hacmi belirleyin.
- GTP'yi 1 mM nihai konsantrasyona ekleyin. Süspansiyonu bir Dounce cam homojenizatöre aktarın ve çözeltiyi buz üzerinde 45 dakika boyunca her 10 dakikada bir homojenize edin. Pistonun kolayca kırılabileceği için dikkatli bir şekilde çalıştırılması gerekir.
NOT: Bu arada rotoru buzlu suda soğutun.
- GTP'yi 1 mM nihai konsantrasyona ekleyin. Süspansiyonu bir Dounce cam homojenizatöre aktarın ve çözeltiyi buz üzerinde 45 dakika boyunca her 10 dakikada bir homojenize edin. Pistonun kolayca kırılabileceği için dikkatli bir şekilde çalıştırılması gerekir.
- Homojenize çözeltiyi önceden soğutulmuş ultrasantrifüj tüplerine dökün ve 75.000 x g ve 4 °C'de 60 dakika döndürün. Santrifüjlemeden sonra, süpernatan hacmini (S3) belirleyin.
- İkinci polimerizasyon
- Süpernatanı 0.35 x S3 mL gliserol ile karıştırın ve GTP'yi 1 mM nihai konsantrasyona ekleyin. Süpernatanı ultrasantrifüj tüplerine dökün ve 37 ° C'de 45 dakika inkübe edin.
NOT: Bu arada rotoru su banyosunda 37 °C'ye ısıtın. - Polimerize süpernatanı adım 3.4.1'den itibaren 75.000 x g ve 37 °C'de 60 dakika santrifüjleyin. Süpernatantın hacmini belirleyin (S4).
NOT: Bu isteğe bağlı bir durma noktasıdır. Tübülinli pelet, sıvı nitrojen içinde şokla dondurulabilir ve -80 °C'de saklanabilir. - Dondurulmuş peletlerin 30 dakika buz üzerinde yavaşça çözülmesine izin verin. 0.25 x S4 mL PIPES tamponu hazırlayın (500 mM PIPES pH 6.9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0.1 mM ATP), peletli tüplere eşit olarak bölün, peletleri bir kaşıkla yeniden süspanse edin ve çözeltiyi bir Dounce cam homojenizatöre aktarın. Her 10 dakikada bir buz üzerinde 45 dakika homojenize edin.
NOT: Bu arada rotoru buzlu suda soğutun. - Depolimerize tübülin içeren çözeltiyi ultrasantrifüj tüplerine dökün ve 4 ° C ve 75.000 x g'da 60 dakika döndürün.
- Süpernatanı 0.35 x S3 mL gliserol ile karıştırın ve GTP'yi 1 mM nihai konsantrasyona ekleyin. Süpernatanı ultrasantrifüj tüplerine dökün ve 37 ° C'de 45 dakika inkübe edin.
- Üçüncü polimerizasyon
- Süpernatantın (S5) hacmini belirleyin ve S5 / 9 mL DMSO ekleyin. Süspansiyonu ultrasantrifüj tüplerine dökün ve polimerize etmek için 37 ° C'de 20 dakika inkübe edin.
NOT: Bu arada rotoru su banyosunda 30 °C'ye ısıtın. - Polimerize tübülini 75.000 x g ve 30 °C'de 60 dakika santrifüjleyin. Süpernatantın (S6) hacmini belirleyin ve peletleri saklayın.
- Peletleri 0.25 x S6 mL PEM tamponunda çözün (100 mM BORULAR pH 6.9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0.1 mM ATP). Çözünürlüğü artırmak için bir Dounce cam homojenizatör kullanın. Peletler tamamen çözülene kadar PEM tamponu eklemeye devam edin (artık yanardöner parçacık görünmüyor).
- Süpernatantın (S5) hacmini belirleyin ve S5 / 9 mL DMSO ekleyin. Süspansiyonu ultrasantrifüj tüplerine dökün ve polimerize etmek için 37 ° C'de 20 dakika inkübe edin.
- İyon değişim kromatografisi saflaştırması
NOT: Ters iyon değişim kromatografisi, mikrotubulin ile ilişkili proteinleri uzaklaştırmak için kullanılır. Tübülin, verilen pH'ta kolon boyunca serbestçe akar ve kirletici proteinler fosfo-selüloz reçinesi üzerinde tutulur. Tüm adımlar 4 ° C'ye yakın sıcaklıklarda veya buz üzerinde gerçekleştirilir. Filtrasyon veya santrifüjleme yoluyla FPLC saflaştırmasından önce tübülin ekstraktını arıtmayın. - FPLC'yi ve kolonu PEM tamponu ile dengeleyin (100 mM BORULAR pH 6.9, 1 mM EGTA, 1 mMMgSO4, 1 mM DTT, 0.1 mM ATP). Dengeleme için en az 10 sütun hacmi kullanın. Pompa akışı, kolon salmastrası için kullanılan akışı (1 mL/dak) aşmamalıdır.
- Tübülin süspansiyonunu yavaşça (0,5 mL / dak) kolona yükleyin ve reçineden akan bağlanmamış proteini toplayın.
- Tübülin proteini içeren her 1 mL fraksiyona 10 μL 100 mM GTP ekleyin.
- Tübülin içeren fraksiyonları sıvı nitrojen içinde dondurun ve hemen sıvı nitrojen içeren kabın içine aktarın. Tubulin bu koşullar altında birkaç yıl saklanabilir. Tübülin - 80 ° C'de saklanırsa stabilite birkaç ay içinde hızla azalır.
Sonuçlar
Ayırma ve saflaştırma adımları sırasında, SDS-PAGE elektroforezi için numuneler alındı ve daha sonra Coomassie-blue boyama kullanılarak analiz edildi (Şekil 2). Her numunenin 20 μL'si 10 μL Laemmli numune tamponu (188 mM Tris-HCl pH 6.8, %3 SDS (a/a), %30 gliserol (h/h), 0.01 bromofenol mavisi (a/a), %15 β-merkaptoetanol) ile karıştırıldı ve 95 °C'de 15 dakika inkübe edildi. Her numunenin 4 μL'si %12.5 akrilamid SDS jel üzerine yüklendi ve indirgeme ve denatüre etme koşullarında jel başına 30 mA'lık sabit bir akım altında ayrıldı.
Sonuçlar, kirletici proteinlerde bir azalma ile birlikte nispi tübülin konsantrasyonunda artımlı bir artışı doğruladı. Ayrıca, ilk santrifüjlemede (adım 3.2.7) arıtılmış lizatta, bu adımın atlanmasına kıyasla önemli bir tubulin kaybı olmamıştır (Şekil 2A, B).
Protein konsantrasyonu üç bağımsız yöntem kullanılarak belirlendi: BCA testi, Bradford protein testi ve SDS-PAGE jel dansitometri analizi19 (Şekil 3). Tarif edilen prosedürü kullanarak toplam tübülin verimi, 250 g nöral dokudan 123 mg saflaştırılmış tübülin idi. Ölçümler sırasında, depolama tamponundaki yüksek DTT konsantrasyonunun BCA testi üzerinde önemli bir etkiye sahip olduğunu dikkate almak gerekir. Hem PEM tamponu hem de PBS tamponu, DTT ilavesiyle, arka plan emilimini yaklaşık 0.900 A595 arttırır, bu da BCA testinin kapasitesini önemli ölçüde azaltır (Şekil 3A). DTT'nin olumsuz etkisi, saf su ile on kez seyreltildikten sonra bile tespit edilebilir (veriler gösterilmemiştir). Bradford testi, dansitometri analizi ile onaylandığı gibi, depolama tamponundan etkilenmiş gibi görünmedi (Şekil 3B).
Tübülin preparatının saflığı, iki bağımsız tesiste (VRI Brno, Çek Cumhuriyeti; CEITEC MU Brno, Çek Cumhuriyeti) elektrosprey iyonizasyonu ve MALDI-TOF kullanılarak. Her iki analiz de çeşitli izoformlarda domuz tübülinleri alfa ve beta'nın varlığını doğruladı. Genel saflık %97.07'den fazlaydı (PSM'ler 1065), en yaygın safsızlıklar Homo sapiens Keratin Tip II'den (PSM'ler 246, safsızlıkların% 2.24'ü) kaynaklanıyordu ve bunlar büyük olasılıkla tübülin izolasyonu ve MS / MS analizi için numune hazırlama sırasında ortaya çıktı. 322 PSM ve sadece Sus skrofa kökenli, serum albümin, Aktin gama ve Tripsinojen'den oluşan diğer safsızlıklar bir peptit çözünürlüğü ile (%0.0069) tanımlandı.
Daha sonraki deneylerde, ani dondurma ve sıvı nitrojen içinde depolamadan sonra polimerizasyon kapasitesinin korunması doğrulandı. 10 mg / mL alikot sıvı nitrojenden çıkarıldı ve buz üzerinde yavaşça çözüldü. Farklı konsantrasyonlarda numuneler (10 mg / mL, 8 mg / mL, 6 mg / mL, 4 mg / mL ve 2 mg / mL), kendi kendine montaj deneyi için alikotların DTT, ATP ve GTP içeren PEM tamponunda seyreltilmesiyle hazırlandı. Bir seyreltme serisi 37 ° C'de 60 dakika inkübe edildi ve ikincisi 60 dakika boyunca buz üzerinde inkübe edildi. Her iki seri de 21.000 x g'de ve karşılık gelen sıcaklıkta (4 °C veya 37 °C) 60 dakika boyunca santrifüjlendi. 30 μL süpernatan çıkarıldı ve SDS-PAGE için kullanıldı. Kalan süpernatant, bir pipet kullanılarak dikkatlice çıkarıldı ve atıldı. Peletler, 100 μM PEM tamponu eklenerek kısa bir süre yıkandı, ardından bir pipet kullanılarak hemen çıkarıldı. Daha sonra, peletler 50 μL 1x konsantre SDS yükleme tamponu içinde yeniden süspanse edildi, böylece pelet ve süpernatantın nispi konsantrasyonu korundu. Her süpernatanıma 10 μL SDS yükleme tamponu eklendi. Tüm örnekler SDS-PAGE ve Coomassie Boyama kullanılarak analiz edildi (Şekil 4). SDS-PAGE'e yüklenen her numunenin hacmi, başlangıç konsantrasyonuna göre ayarlandı, bu nedenle konsantrasyondan kaynaklanan yağış farkı daha belirgindir. Tübülinin PEM tamponunda kendi kendine montaj testi, sıcaklığa bağlı bir şekilde tübülin lifleri oluşturma yeteneğini doğruladı.
Tübülinin diğer proteinlerle etkileşime girme yeteneğini doğrulayan MAP2c tahrikli tübülin20,21 montaj deneyi gerçekleştirildi22. MAP2c'nin seri dilüsyonları, 100 μL 1 mg / mL tübülin alikotunun MAP2c ile 0 μM ila 8 μM arasında değişen nihai konsantrasyona karıştırıldığı yerde hazırlandı. Tüm numuneler buz üzerinde taze hazırlanmış PEM tamponunda 1 mM DTT ve 1 mM GTP ile seyreltilerek hazırlandı. Tübülin, farklı MAP2c konsantrasyonları ile 37 ° C'de 15 dakika inkübe edildi ve 21.000 x g ve 37 ° C'de 60 dakika boyunca santrifüjlendi. Peletin son yıkaması, 100 μL PEM tamponu ile iki kez gerçekleştirildi. Deney, hazırlanan tübülinin MAP2c güdümlü polimerizasyona uğrama kapasitesini doğruladı, çünkü sadece MAP2c içermeyen numune bir pelet oluşturmadı (Şekil 5).
Transmisyon elektron mikroskobu, ko-polimerizasyon deneylerinden elde edilen tübülin filamentlerinin varlığını doğrulamak için ayrıca kullanıldı. MAP2c ile çökeltilmiş saflaştırılmış tübülin süspansiyonları, negatif boyama kullanılarak transmisyon elektron mikroskobu için hazırlandı. Numuneler Formvar kaplı, karbon stabilize bakır ızgaralar üzerine adsorbe edildi. Izgaralar daha sonra %2NH4MoO4 ile negatif olarak boyandı ve elektron mikroskobu altında 18.000x büyütme ve 80 kV'luk bir hızlanma geriliminde incelendi. Berrak filamentli bir yapıya ve uygun boyuta sahip homojen mikrotübüllerin varlığı, doğal konformasyonda mikrotübüller oluşturma yeteneğini göstermiştir (Şekil 6).
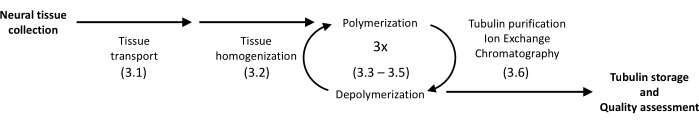
Şekil 1: Tübülin ayırma ve saflaştırmanın şematik bir diyagramı. Parantez içindeki sayı protokol adımını ifade eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
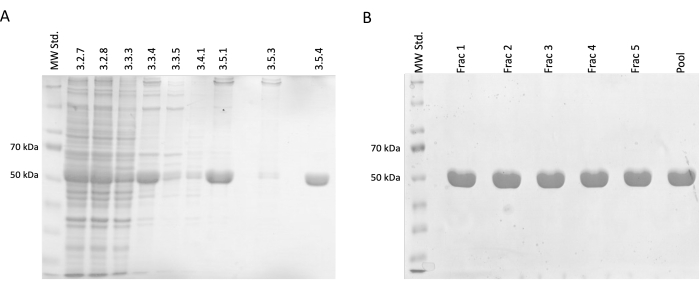
Şekil 2: Tübülin ayırma ve saflaştırma. (A) Sıcaklık güdümlü polimerizasyon (hat başına 3 μL) kullanılarak tübülinin ayrılması sırasında alınan numunelerin SDS-PAGE analizi. Bağıl tübülin bolluğunda (yaklaşık 50 kDa) stabil bir artışla birlikte safsızlıklardaki azalma görülebilir. Her satırın üzerindeki sayılar, protokoldeki adım numarasına karşılık gelir. (B) Fosfo-selüloz reçinesi (hat başına 4 μL) üzerinde protein kromatografisinden sonra elde edilen fraksiyonların SDS-PAGE analizi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
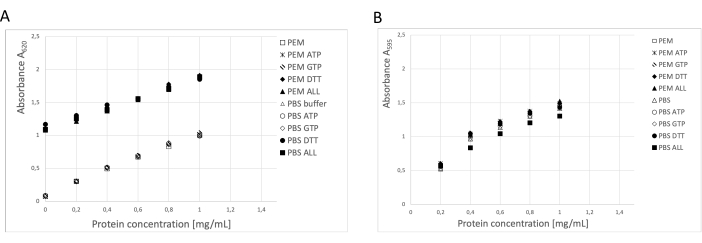
Şekil 3: Protein konsantrasyonu. PEM tamponunda veya PBS'de 1 mg / mL'ye kadar sığır serum albümininin seyreltme serisi, ayrı ayrı veya kombinasyon halinde 0.1 ATP, 1 mM GTP, 1 mM DTT içeren BSA seyreltme serisi ile karşılaştırıldı (0.1 mM ATP, 1 mM GTP ve 1 mM DTT) PEM veya PBS tamponunda. (A) BCA testi kullanıldığında, DTT (katı semboller) içeren numunelerin arka planında önemli bir kayma oldu. (B) Bradford testinde konsantrasyonlar ölçüldüğünde bu etki tespit edilmedi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
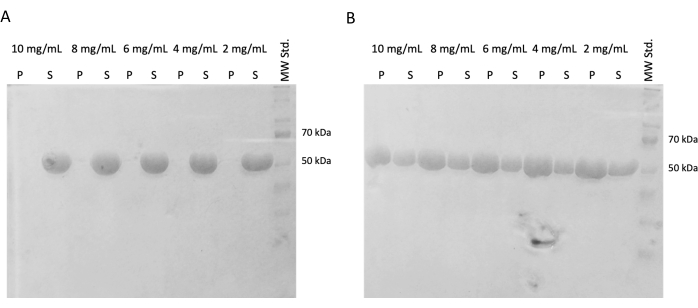
Şekil 4: Tübülin kendi kendine montaj testi. Kendi kendine montaj testinin SDS-PAGE analizi, (A) 4 ° C veya (B) 37 ° C'de inkübe edilen depolanmış tübülinin geniş bir konsantrasyon spektrumunda sıcaklığa bağlı bir şekilde polimerize olma kapasitesini doğruladı. (P - pelet, S - süpernatant; ilgili tübülin konsantrasyonu her çizgi çiftinin üzerinde belirtilir; yüklenen her numunenin miktarı 10 μg idi). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
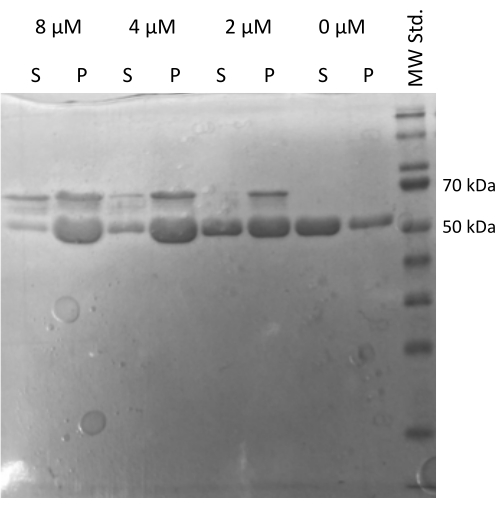
Şekil 5: Tubulin ko-sedimantasyon testi. MAP2c destekli tübülin düzeneğinin SDS-PAGE analizi, depolanan tübülinin konsantrasyona bağlı bir şekilde mikrotübül ile ilişkili protein ile etkileşime bağlı olarak polimerizasyona uğrama kapasitesini doğruladı. MAP2c'nin molar konsantrasyonu her satırın üzerinde belirtilmiştir. (P - pelet, S - süpernatant). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
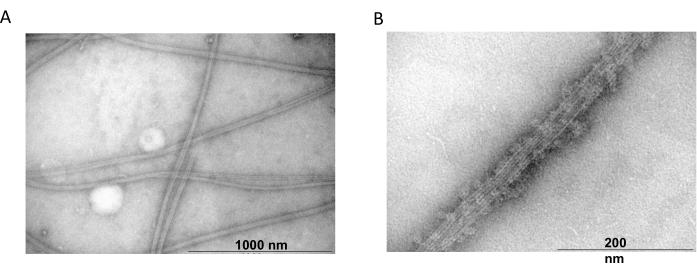
Şekil 6: Transmisyon elektron mikroskobu. TEM mikrofotografları, tübülinin (A) MAP2c proteinleri ile süslenmiş homojen tübülin filamentlerinden oluşan uygun çapta (B) mikrotübüller halinde birleştiğini gösterdi. Çubuk 1000 nm (A) ve 200 nm (B)'ye karşılık gelir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Herhangi bir kaynaktan gelen nöral doku, nöronların dendritleri ve aksonları mikrotübüller açısından zengin olduğundan (%40'a kadar) tübülin izolasyonu için mükemmel bir malzemedir23. Beyin dokusu yeterli miktarlarda nispeten kolay bir şekilde elde edilebilir. Ana dezavantaj, sonraki deneylerietkileyebilecek belirsiz bir translasyon sonrası modifikasyon seviyesi olabilir 24,25. Aksi takdirde, tek endişe, özellikle sıcak koşullarda, başlangıç malzemesinin hızlı bir şekilde bozulmasıdır. Nakliye öncesi ısı dağılımını ve mümkün olan en kısa sürede başlayan işleme için hızlı nakliyeyi iyileştirmek için birkaç transfer-tampon değişimi kullandık. Taze doku, ısıtmayı önleyen koşullarda diseke edilir ve tübülin26'yı daha da stabilize eden GTP ve gliserol içeren bir tamponda homojenize edilir.
Sunulan protokolde, ham lizatın açıklama adımı (adım 3.2.7) tanıtılmıştır. İlk polimerizasyondan önce uzun süreli santrifüjleme, tübülinin geri dönüşü olmayan modifikasyonlara ve proteazlara duyarlılığı nedeniyle genellikle önerilmez. Öte yandan, mevcut deneyler, yüksek G-kuvvetinde kısa bir dönüşün döküntüyü azalttığını ve böylece tübülin kalitesini önemli ölçüde etkilemeden işlenmiş homojenatın nispi hacmini artırdığını göstermiştir.
Kesin protein konsantrasyonunun belirlenmesi, esas olarak tübülin bağlayıcı proteinler veya inhibitörler ile etkileşimler incelendiğinde, daha ileri deneyler için gereklidir. İncelemeler sırasında, protein konsantrasyonu analizlerinin sonuçlarında önemli farklılıklarla karşılaştık. Bunun ana nedeni, tahlillere müdahale eden yüksek konsantrasyonlarda DTT, GTP ve ATP'nin varlığıydı. BCA testi, depolama tamponundaki yüksek DTT miktarı nedeniyle üst sınırlara kaydırıldı ve test kapasitesi azaldı. Ayrıca, proteinlerin ve ATP veya GTP'nin benzer absorbans maksimumları, 280 nm'de absorbans kullanılarak protein konsantrasyonu tayininde tutarsızlıklara neden olmuştur. Aynı sorun, FPLC UV dedektöründen gelen okumalarda da fark edildi. Stabil sonuçları olan en güvenilir tahlil, tampon bileşiklerinin hiçbir etkisinin gözlenmediği Bradford protein tahliliydi. Bununla birlikte, protein standart seyreltme serisinin depolama tamponunda hazırlanması esastır.
Saflaştırılmış tübülinin uygun düzenlemeler oluşturma yeteneği, sonraki deneyler için bir ön koşuldur. Tübülin, doğası gereği, gliserol-GTP açısından zengin ortamda bile bozulmaya oldukça eğilimlidir ve bu da homojen filamentler oluşturma kapasitesinin azalmasına neden olur. Saflaştırma sürecini takip etmek ve depolanan tübülinin kararlı düzenli filamentlere polimerize olma yeteneğini deneysel olarak doğrulamak çok önemlidir. Tübülin durumunu doğrulayan birkaç bağımsız yöntem in vivo ve in vitro olarak tanıtılmıştır. En öne çıkanlar arasında, dairesel dikroizm spektroskopisi27, yüzey plazmon rezonans deneyi28, termal kayma deneyi29, polimerizasyon inhibisyonu deneyi30, immünofloresan boyama31,32, koçökeltme22,33 ve transmisyon elektron mikroskobu analizi32 denilebilir. Bu protokolde kullanılan polimerizasyon testi ve tübülinin birlikte çökeltilmesinin gerçekleştirilmesi kolaydır. Tüpün dibinde meydana gelen peletler veya SDS-PAGE kullanılarak hızlı bir şekilde değerlendirilebilirler. Öte yandan, çökeltilmiş tübülin agrega şeklinde olabilir. Kalite kontrol için mikrotübül liflerinin varlığını doğrulamak için transmisyon elektron mikroskobu gibi daha karmaşık yöntemler dahil edilmelidir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Çalışma, Çek Cumhuriyeti Teknoloji Ajansı (proje nr. TN02000017 - Veteriner Hekimliği Ulusal Biyoteknoloji Merkezi - NaCeBiVet).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | --- | --- | Common material |
| 10 mL tubes | --- | --- | Common material |
| 50 mL tubes | --- | --- | Common material |
| ATP | ROTH | HN35.2 | Analytical grade |
| DMSO | ROTH | A994.2 | Analytical grade |
| Dounce glass homogenizer | P-LAB | H244043 | Homogenizer |
| DTT | ROTH | 6908.1 | Analytical grade |
| EGTA | ROTH | 3054.3 | Analytical grade |
| Ethanol | PENTA | 70390-11001 | Analytical grade |
| Glycerol | ROTH | 6967.2 | Analytical grade |
| Graduated beakers | --- | --- | Common equipment |
| Graduated cilinders | --- | --- | Common equipment |
| GTP | MERCK | 36051-31-7 | Very high quality |
| HCl | PENTA | 19360-11000 | Analytical grade |
| Izolated box for tissue transport | --- | --- | Common equipment |
| Kitchen blender | Waring | 7011HB | Glass or plastic vessel |
| Liquid nitrogen | --- | --- | Common material |
| MES | ROTH | 6066.4 | Analytical grade |
| MgCl2 | MERCK | 814733 | Analytical grade |
| MgSO4 | PENTA | 43180-31000 | Analytical grade |
| NaOH | PENTA | 15650-11000 | Analytical grade |
| Optima XPN100 | Beckman Coulter | A94469 | Ultracentrifuge |
| Phosphocellulose column | VWR | GENO786-1291 | Empty column |
| Phosphocellulose resin | Creative - Biomart, inc | Phosphate-001C | Ion exchange resin |
| PIPES | ROTH | 9156.2 | Analytical grade |
| Saccharose | PENTA | 24970-31000 | Analytical grade |
| Scales | --- | --- | Common equipment |
| Scissors | --- | --- | Common equipment |
| Spoons | --- | --- | Plastic or glass |
| Ti45 rotor | Beckman Coulter | 339160 | Rotor for Ultracentrifuge |
| Tweezers | --- | --- | Common equipment |
| Ultra turrax IKA T18 basic | IKA | 356 1000 | Laboratory dispenser |
| Water bath 37 °C | --- | --- | Stirred |
Referanslar
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Murphy, D. B., Hiebsch, R. R. Purification of microtubule protein from beef brain and comparison of the assembly requirements for neuronal microtubules isolated from beef and hog. Anal Biochem. 96 (1), 225-235 (1979).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann NY Acad Sci. 253, 107-132 (1975).
- Weisenberg, R. C. Microtubule formation in vitro in solutions containing low calcium concentrations. Science. 177 (4054), 1104-1105 (1972).
- Roychowdhury, S., Gaskin, F. Separation of assembly-competent tubulin from brain microtubule protein preparations using a fast-performance liquid chromatography procedure. J Neurochem. 46 (5), 1399-1405 (1986).
- Weingarten, M. D., Suter, M. M., Littman, D. R., Kirschner, M. W. Properties of the depolymerization products of microtubules from mammalian brain. Biochemistry. 13 (27), 5529-5537 (1974).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nat Protoc. 14 (5), 1634-1660 (2019).
- Jacobs, M., Huitorel, P. Tubulin-associated nucleoside diphosphokinase. Eur J Biochem. 99 (3), 613-622 (1979).
- Munguía, B., et al. Purification of native M. vogae and H. contortus tubulin by TOG affinity chromatography. Exp Parasitol. 182, 37-44 (2017).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein ExpPurif. 32 (1), 83-88 (2003).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Lett. 587 (21), 3450-3455 (2013).
- Liu, C., Yao, J., Yin, J., Xue, J., Zhang, H. Recombinant α- and β-tubulin from Echinococcus granulosus: Expression, purification and polymerization. Parasite. 25, 62 (2018).
- Ti, S. -. C., Wieczorek, M., Kapoor, T. M. Purification of affinity tag-free recombinant tubulin from insect cells. STAR protoc. 1 (1), 100011 (2020).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled post-translational modifications and isotypes from limited sources by polymerization-depolymerization cycles. JVisExp. (165), e61826 (2020).
- Sackett, D. L., Werbovetz, K. A., Morrissette, N. S. Isolating tubulin from nonneural sources. Methods Cell Biol. 95, 17-32 (2010).
- Modig, C., Strömberg, E., Wallin, M. Different stability of posttranslationally modified brain microtubules isolated from cold-temperate fish. Mol Cell Biochem. 130 (2), 137-147 (1994).
- Fourest-Lieuvin, A. Purification of tubulin from limited volumes of cultured cells. Protein Exp Purif. 45 (1), 183-190 (2006).
- MacRae, T. H., Gull, K. Purification and assembly in vitro of tubulin from Trypanosoma brucei. Biochem J. 265 (1), 87-93 (1990).
- Jansen, S., et al. Quantitative mapping of microtubule-associated protein 2c (MAP2c) phosphorylation and regulatory protein 14-3-3ζ-binding sites reveals key differences between MAP2c and its homolog Tau. JBiol Chem. 292 (24), 3-3 (2017).
- Melková, K., et al. Structure and functions of microtubule associated proteins Tau and MAP2c: Similarities and differences. Biomolecules. 9 (3), E105 (2019).
- Herzog, W., Weber, K. Fractionation of brain microtubule-associated proteins: Isolation of two different proteins which stimulate tubulin polymerization in vitro. Eur J Biochem. 92 (1), 1-8 (1978).
- Castle, A. G., Crawford, N. Isolation of tubulin from pig platelets. FEBS Lett. 51 (1), 195-200 (1975).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. Int J Mol Sci. 18 (10), E2207 (2017).
- Lafanechère, L., Job, D. The third tubulin pool. Neurochem Res. 25 (1), 11-18 (2000).
- Arai, T., Ihara, Y., Arai, K., Kaziro, Y. Purification of tubulin from bovine brain and its interaction with guanine nucleotides. J Biochem. 77 (3), 647-658 (1975).
- Mahaddalkar, T., et al. Structural investigations into the binding mode of a novel noscapine analogue, 9-(4-vinylphenyl) noscapine, with tubulin by biochemical analyses and molecular dynamic simulations. J Biomol Struct Dyn. 35 (11), 2475-2484 (2017).
- Chen, H., et al. Structure-activity relationship study of novel 6-Aryl-2-benzoyl-pyridines as tubulin polymerization inhibitors with potent antiproliferative properties. J Med Chem. 63 (2), 827-846 (2020).
- Yao, D., et al. Ferulin C triggers potent PAK1 and p21-mediated anti-tumor effects in breast cancer by inhibiting Tubulin polymerization in vitro and in vivo. Pharmacol Res. 152, 104605 (2020).
- Sweetnam, P. M., et al. The role of receptor binding in drug discovery. JNat Prod. 56 (4), 441-455 (1993).
- Qi, Z. -. Y., et al. Synthesis and biological evaluation of 1-(benzofuran-3-yl)-4-(3,4,5-trimethoxyphenyl)-1H-1,2,3-triazole derivatives as tubulin polymerization inhibitors. Bioorg Chem. 94, 103392 (2020).
- Sáez-Calvo, G., et al. Triazolopyrimidines are microtubule-stabilizing agents that bind the vinca inhibitor site of tubulin. Cell Chem Bio. 24 (6), 737-750 (2017).
- Bellocq, C., et al. Purification of assembly-competent tubulin from Saccharomyces cerevisiae. EurJ Biochem. 210 (1), 343-349 (1992).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır