Method Article
Optimisation du rendement en tubuline à partir de tissu cérébral porcin
Dans cet article
Résumé
Ce protocole décrit une technique d’isolement à haut rendement de la tubuline dans le cerveau porcin, optimisée pour l’instrumentation à petite échelle. Les procédures d’isolement sont complétées par des procédures de détermination de l’activité de polymérisation de la tubuline in vitro à l’aide d’essais de co-sédimentation et de microscopie électronique à transmission.
Résumé
Le tissu neural, quelle qu’en soit la source, est un excellent matériau pour l’isolement de la tubuline, car les dendrites et les axones des neurones sont riches en microtubules. Ici, nous présentons une procédure d’extraction de la tubuline qui peut être utilisée, avec des modifications mineures, pour le tissu neural à partir de sources multiples. Dans le protocole présenté, une nouvelle étape de clarification du lysat brut a été introduite, ce qui a conduit à une réduction significative de la quantité initiale de débris insolubles avant la première étape de polymérisation. Cette étape supplémentaire a permis de traiter des tissus supplémentaires tout en utilisant la même instrumentation et, ainsi, d’augmenter le volume relatif de l’homogénat traité. L’étape nouvellement introduite n’a pas d’effet significatif sur la qualité de la tubuline purifiée, comme le confirment les tests d’activité in vitro et la microscopie électronique à transmission. La procédure décrite contient toutes les étapes cruciales, y compris la collecte des tissus, le transport, l’homogénéisation des tissus, les cycles d’isolement de la tubuline et le polissage final par chromatographie échangeuse d’ions à l’aide de la FPLC et les tests de mesure d’activité ultérieurs. L’homogénéité de la tubuline purifiée était supérieure à 97 %, comme l’a confirmé l’analyse MS/MS utilisant l’ionisation par électronébulisation et le MALDI-TOF.
Introduction
Les microtubules, filaments protéiques creux (24 nm de diamètre) formés par des hétérodimères alpha- et bêta-tubulines, sont impliqués dans divers processus cellulaires essentiels. Ils participent à la formation des structures intracellulaires, à la motilité, à la division cellulaire, à la différenciation cellulaire, au transport cellulaire, au maintien de la forme et à la sécrétion1. Les fonctions cellulaires des microtubules peuvent être affectées par des interactions directes ou indirectes avec des protéines associées aux microtubules (MAP) et d’autres protéines, ou via des modifications post-traductionnelles complexes définies dans le code2 de la tubuline.
Les fibres de tubuline résultent d’interactions dynamiques non covalentes entre les sous-unités alpha et bêta dans le mécanisme de nucléation-élongation. De courts microtubules se forment et la croissance ultérieure des fibres de tubuline est obtenue par un allongement réversible aux deux extrémités, formant des cylindres constitués d’hétérodimères de tubuline disposés en protofilaments parallèles2. L’instabilité dynamique fait référence au fait que les microtubules assemblés ne sont souvent pas en équilibre avec leurs sous-unités, mais peuvent subir une transition de phase entre une période prolongée de croissance et de rétrécissement tout en maintenant un état d’équilibre 1,2.
L’instabilité dynamique des fibres de tubuline est principalement utilisée dans de nombreuses procédures de séparation et de purification de la tubuline à l’aide de cycles de polymérisation à haute température et de dépolymérisation à basse température dans l’environnement de glycérol de haute pureté, de DMSO, GTP/ATP, Mg2+ ou d’autres agents chimiques (tels que le taxol ou les polycations)3. La plupart des procédures de séparation4 sont suivies d’une chromatographie protéique 5,6,7,8,9, qui assure la séparation des protéines associées à la tubuline avec l’activité nucléosidique diphosphokinase et ATPase5. Des résultats similaires peuvent être obtenus en utilisant des tampons à haute teneur en sel10. De multiples sources, y compris des tissus neuronaux11, 12, 13, 14 et non neuronaux15, des poissons16 (d’eau douce et marins), des levures ou des variantes recombinantes17 surexprimées dans différentes souches de production11, 12, 13, 14, et d’autres sources9, 18 ont été utilisées pour le fractionnement et purification.
Le protocole présenté utilise la précipitation et la chromatographie protéique pour isoler la tubuline du cerveau porcin jusqu’à une homogénéité élevée (figure 1). Le principal avantage est un rendement relativement élevé obtenu avec des instruments disponibles dans des laboratoires équipés pour des expériences de biologie moléculaire de routine.
Protocole
La composition de toutes les solutions et de tous les instruments est décrite dans la Table des matériaux. Toutes les solutions ont été préparées à l’aide de produits chimiques de qualité FPLC et filtrées à travers un filtre de 0,22 μm avant utilisation. De l’équipement de protection individuelle, p. ex. une blouse de laboratoire, des gants et des lunettes de sécurité, a été utilisé pendant toutes les opérations. Tous les instruments étaient propres et exempts de traces de détergents. Au cours des procédures, les lignes directrices appropriées en matière de soins aux animaux (approuvées par l’établissement) ont été suivies. Tout le matériel biologique, y compris le tissu cérébral, a été acheté à un abattoir en tant que matière première. Aucun animal vivant n’a été utilisé à aucune étape du protocole.
1. Activation d’une colonne de phospho-cellulose pour la chromatographie liquide protéique rapide
- Ajoutez 700 ml d’éthanol à 50 % à 15 g de résine phospho-cellulosique sèche et mélangez doucement dans le bécher à l’aide d’une cuillère.
- Verser la suspension dans une colonne chromatographique appropriée de volume approprié (700 mL). Fermez la colonne avec des pistons équipés de frittes. Laissez au moins 10 % de l’espace libre libre.
REMARQUE : D’autres récipients peuvent être utilisés, mais la colonne FPLC, en combinaison avec une pompe péristaltique, réduit considérablement le temps nécessaire à l’activation de la résine et aux pertes de résine. - Incuber sur un agitateur à bascule à 60 tr/min pendant 30 min.
- Laissez la résine se déposer et éliminez l’excès d’éthanol à 50 % à l’aide de la pompe péristaltique avec un débit réglé à 3 mL/min. Ne laissez pas la résine sécher.
- Retirez le piston supérieur et ajoutez 300 ml d’éthanol à 50 %. Fermez la colonne, secouez-la brièvement et éliminez l’excès d’éthanol à l’aide d’une pompe péristaltique.
- Retirez l’éthanol restant. Ajoutez 300 ml d’eau ultra-pure dans la colonne, fermez la colonne avec le piston et inclinez-la jusqu’à ce que la résine soit remise en suspension. Éliminez l’excès de liquide à l’aide d’une pompe péristaltique. Répétez cette étape trois fois.
- Ouvrez la colonne en haut, ajoutez 500 ml de HCl 0,5 M, fermez la colonne et remettez la résine en suspension en l’inclinant doucement. Incuber sur un agitateur à bascule à 60 tr/min pendant 30 min.
- Éliminez l’excès de liquide à l’aide d’une pompe péristaltique. Ajoutez 300 ml de HCl 0,5 M, remettez la résine en suspension et retirez l’excès de liquide.
- Retirez le HCl restant. Ajoutez 300 ml d’eau ultra-pure dans la colonne, fermez la colonne avec le piston et inclinez-la jusqu’à ce que la résine se remette en suspension. Éliminez l’excès de liquide à l’aide d’une pompe péristaltique. Répétez cette étape trois fois.
- Versez les 700 mL de tampon MES (25 mM MES, 0,1 mM EGTA, 0,5 mM MgCl2) dans la colonne et remettez la résine en suspension par inclinaison. Versez la suspension dans le bécher, ajustez le pH à 6,1 avec 1 M de NaOH et laissez incuber pendant 2 h sous une légère agitation.
- Laissez la résine se déposer, décantez le liquide, ajoutez 300 ml de tampon MES, pH 6,4, et incubez toute la nuit à 4 °C.
- Décantez l’excès de liquide, ajoutez de l’éthanol à 96 % à 20 % de concentration finale et conservez-le à 4 °C jusqu’à l’utilisation.
2. Garniture de colonne phospho-cellulose
- Verser 12 mL de résine activée dans la colonne chromatographique propre avec un bouchon inférieur fermé. Laissez la résine se déposer. Le volume de résine décantée est d’environ 5 ml. Retirez la couche supérieure de résine (environ 2-3 mm) où des fragments de matrice brisés plus légers pourraient se déposer.
- Retirez le bouchon inférieur et laissez la solution de stockage s’écouler librement, goutte à goutte. Ne laissez pas la résine sécher.
- Fermez la colonne et connectez-la au système FPLC. Laver la colonne avec un tampon PEM (100 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4) à 1 mL/min (pression max. 1 bar) pendant 30 min, régler la hauteur du piston, retourner la colonne et laver la colonne dans les mêmes conditions pendant les 30 minutes suivantes dans le flux inverse.
- Conservez la colonne remplie de phosphocellulose activée à 4 °C pendant plusieurs jours.
3. Séparation et purification des tubulines
REMARQUE : La tubuline est très sujette à la dégradation, et il est crucial de procéder rapidement. Toutes les solutions, tous les instruments et tous les équipements doivent être préparés, refroidis ou chauffés, si nécessaire, à l’avance. Les procédures sont sensibles aux changements de température recommandés. Le tissu cérébral doit être traité le plus tôt possible après la dissection, compte tenu de la quantité de déchets biologiques produits lors de la purification. La procédure a été optimisée pour le rotor avec six cuvettes d’ultracentrifugation de 75 ml. La quantité de tissu traité peut être augmentée ou diminuée en fonction de l’ultracentrifugeuse disponible.
- Transport de tissus
- Mettez 500 g de cervelle de porc fraîchement disséquée (6 à 8 morceaux) dans un récipient de transport de 3 L et versez le tampon de transport glacé (4,1 mM MES pH 7, 320 mM Saccharose, 1 mM EGTA) jusqu’à ce qu’il soit complètement immergé. Laisser reposer sur la glace pendant 5 min et changer le tampon de transport pour un nouveau pour faciliter la dissipation de la chaleur. Transport rapide sur la glace pour un traitement ultérieur.
- Homogénéisation tissulaire
REMARQUE : L’homogénéisation des tissus est effectuée sur de la glace dans une chambre froide. Tous les instruments doivent être pré-refroidis pour éviter la polymérisation spontanée. La principale source de tubuline est la matière grise, et le reste est éliminé dans les étapes suivantes.- Versez 100 ml de tampon d’extraction (4,1 mM MES pH 7, 520 mM Saccharose, 1 mM EGTA, 1 mM ATP et 0,1 mM GTP) dans un bécher en plastique de 1 L et déterminez le poids W1 (g) y compris le récipient. L’ATP et le GTP sont ajoutés juste avant l’utilisation.
- Retirez le cerveau porcin du vaisseau de transport et retirez tout le cervelet, la graisse, les gros morceaux de substance blanche, les méninges et les vaisseaux sanguins avec les doigts en appliquant une force modeste. Des ciseaux ou une pince à épiler peuvent également être utilisés. Placez la cervelle de porc dépourvue de tissu indésirable dans le bécher avec 100 ml de tampon d’extraction froid. Continuez jusqu’à ce que tous les tissus soient traités.
- Pesez le bécher avec du tissu cérébral traité et déterminez le poids de W2 (g).
- Ajouter le tampon d’extraction selon la formule, Poids du tampon d’extraction = W2 - W1 (par exemple, pour 400 g de tissu, 300 g de tampon d’extraction supplémentaire sont ajoutés).
- Transférez le tissu cérébral avec le tampon d’extraction dans le mélangeur de cuisine pré-réfrigéré et traitez en 4 à 8 impulsions courtes de trois secondes.
- Traitez le tissu partiellement homogénéisé à l’aide d’un homogénéisateur à dispersion à grande vitesse (18 000 tr/min) pendant 1 min. Laissez la suspension sur de la glace pendant 3 à 5 min, en mélangeant de temps en temps avec une cuillère. Répétez l’opération cinq fois ou jusqu’à homogénéisation complète.
- Verser dans des tubes d’ultracentrifugation pré-refroidis et essorer pendant 10 min, à 4 °C et 50 000 x g. Conservez le surnageant et jetez la pastille. Répéter l’opération jusqu’à ce que 430 ml d’extrait clarifié soient recueillis.
- Verser l’extrait clarifié dans des tubes d’ultracentrifugation pré-refroidis (70 ml chacun) et essorer à 4 °C et 75 000 x g pendant 60 min. Prélever le surnageant et déterminer le volume S1.
REMARQUE : S’il n’existe qu’un seul rotor, chauffez-le dans un bain d’eau chaude pour l’étape de centrifugation suivante (37 °C).
- Première polymérisation
- Ajouter 10 tampons MEM (1 M MES pH 6,8, 10 mM EGTA, 10 mM MgCl2) selon la formule V = S1/9 mL (pour 585 mL de surnageant, ajouter 65 mL de 10 tampons MEM). Bien mélanger et ajouter le glycérol à 3,5 M et le GTP à la concentration finale de 0,1 mM. Versez la suspension dans des tubes d’ultracentrifugation (le volume de surnageant dépasse le volume des tubes, le reste est jeté).
- Incuber les tubes avec le surnageant dans un bain-marie pendant 45 min à 37 °C.
- Faites tourner les tubes pendant 90 min à 37 °C et 75 000 x g. Mesurez le volume du surnageant (S2) pour déterminer le volume du tampon MEM, ajoutez-le aux pastilles à l’étape 3.3.4, puis jetez le surnageant. Conservez la pastille là où se trouve la tubuline polymérisée.
- Préparez 0,5 volume x S2 de tampon MEM glacé. Ajoutez une quantité égale de 1 tampon MEM dans chaque tube d’ultracentrifugation avec la pastille. Remettez les granulés en suspension dans le tampon 1x MEM ajouté, transférez les suspensions dans le cylindre gradué et déterminez le volume total.
- Ajouter le GTP à la concentration finale de 1 mM. Transférez la suspension dans un homogénéisateur en verre Dounce et homogénéisez la solution toutes les 10 minutes environ pendant 45 minutes sur de la glace. Le piston doit être actionné avec précaution car il peut se casser facilement.
REMARQUE : Pendant ce temps, refroidissez le rotor dans de l’eau avec de la glace.
- Ajouter le GTP à la concentration finale de 1 mM. Transférez la suspension dans un homogénéisateur en verre Dounce et homogénéisez la solution toutes les 10 minutes environ pendant 45 minutes sur de la glace. Le piston doit être actionné avec précaution car il peut se casser facilement.
- Verser la solution homogénéisée dans des tubes d’ultracentrifugation pré-refroidis et essorer à 75 000 x g et 4 °C pendant 60 min. Après centrifugation, déterminer le volume surnageant (S3).
- Deuxième polymérisation
- Mélangez le surnageant avec les 0,35 x S3 mL de glycérol et ajoutez du GTP à 1 mM de concentration finale. Verser le surnageant dans des tubes d’ultracentrifugation et incuber pendant 45 min à 37 °C.
REMARQUE : Pendant ce temps, réchauffez le rotor à 37 °C dans le bain-marie. - Centrifuger le surnageant polymérisé à partir de l’étape 3.4.1 pendant 60 min à 75 000 x g et 37 °C. Déterminer le volume du surnageant (S4).
REMARQUE : Il s’agit d’un point d’arrêt facultatif. La pastille à la tubuline peut être congelée sous forme choquante dans de l’azote liquide et stockée à -80 °C. - Laissez les granulés congelés décongeler lentement sur de la glace pendant 30 min. Préparez 0,25 x S4 mL de tampon PIPES (500 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP), divisez-les uniformément dans des tubes avec des granulés, remettez les granulés en suspension avec une cuillère et transférez la solution dans un homogénéisateur en verre Dounce. Homogénéiser toutes les 10 min sur glace pendant 45 min.
REMARQUE : Pendant ce temps, refroidissez le rotor dans de l’eau avec de la glace. - Verser la solution avec de la tubuline dépolymérisée dans des tubes d’ultracentrifugation et essorer pendant 60 min à 4 °C et 75 000 x g.
- Mélangez le surnageant avec les 0,35 x S3 mL de glycérol et ajoutez du GTP à 1 mM de concentration finale. Verser le surnageant dans des tubes d’ultracentrifugation et incuber pendant 45 min à 37 °C.
- Troisième polymérisation
- Déterminer le volume de surnageant (S5) et ajouter S5/9 mL de DMSO. Verser la suspension dans des tubes d’ultracentrifugation et incuber pendant 20 min à 37 °C pour polymériser.
REMARQUE : Pendant ce temps, réchauffez le rotor à 30 °C dans le bain-marie. - Centrifuger la tubuline polymérisée pendant 60 min à 75 000 x g et 30 °C. Déterminer le volume de surnageant (S6) et conserver les granulés.
- Dissoudre les pastilles dans 0,25 x S6 mL de tampon PEM (100 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP). Utilisez un homogénéisateur en verre Dounce pour améliorer la solubilisation. Continuez à ajouter du tampon PEM jusqu’à ce que les granulés soient complètement dissous (plus aucune particule opalescente n’est visible).
- Déterminer le volume de surnageant (S5) et ajouter S5/9 mL de DMSO. Verser la suspension dans des tubes d’ultracentrifugation et incuber pendant 20 min à 37 °C pour polymériser.
- Purification par chromatographie échangeuse d’ions
REMARQUE : La chromatographie échangeuse d’ions inverse est utilisée pour éliminer les protéines associées à la microtubuline. La tubuline s’écoule librement dans la colonne au pH donné, et les protéines contaminantes sont retenues sur la résine phospho-cellulosique. Toutes les étapes sont effectuées à des températures proches de 4°C ou sur glace. Ne pas clarifier l’extrait de tubuline avant la purification par FPLC, que ce soit par filtration ou par centrifugation. - Équilibrez le FPLC et la colonne avec le tampon PEM (100 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP). Utilisez au moins 10 volumes de colonnes pour l’équilibre. Le débit de la pompe ne doit pas dépasser le débit utilisé pour l’emballage de la colonne (1 mL/min).
- Chargez lentement la suspension de tubuline (0,5 mL/min) sur la colonne et récupérez la protéine non liée qui s’écoule à travers la résine.
- Ajouter 10 μL de 100 mM GTP à chaque fraction de 1 mL contenant la protéine de tubuline.
- Congelez les fractions contenant de la tubuline dans de l’azote liquide et transférez-les immédiatement dans le récipient contenant de l’azote liquide. La tubuline peut être conservée pendant plusieurs années dans ces conditions. La stabilité diminue rapidement sur plusieurs mois si la tubuline est stockée à - 80 °C.
Résultats
Au cours des étapes de séparation et de purification, des échantillons pour l’électrophorèse SDS-PAGE ont été prélevés, puis analysés à l’aide de la coloration au bleu de Coomessie (figure 2). 20 μL de chaque échantillon ont été mélangés avec 10 μL de tampon d’échantillon Laemmli (188 mM Tris-HCl pH 6,8, 3 % SDS (p/p), 30 % de glycérol (v/v), 0,01 bleu de bromophénol (p/p), 15 % β-mercaptoéthanol) et incubés à 95 °C pendant 15 min. 4 μL de chaque échantillon ont été chargés sur un gel SDS d’acrylamide à 12,5 % et séparés sous un courant constant de 30 mA par gel dans des conditions réductrices et dénaturantes.
Les résultats ont confirmé une augmentation progressive de la concentration relative de tubuline accompagnée d’une réduction des protéines contaminantes. De plus, il n’y a pas eu de perte significative de tubuline dans le lysat clarifié lors de la première centrifugation (étape 3.2.7) par rapport à l’omission de cette étape (Figure 2A, B).
La concentration en protéines a été déterminée à l’aide de trois méthodes indépendantes : l’analyse des BCA, l’analyse des protéines Bradford et l’analyse densitométrique sur gel SDS-PAGE19 (figure 3). Le rendement global de tubuline selon la procédure décrite était de 123 mg de tubuline purifiée à partir de 250 g de tissu neural. Lors des mesures, il est nécessaire de prendre en compte que la forte concentration de DTT dans le tampon de stockage a un impact significatif sur le dosage de la BCA. Le tampon PEM et le tampon PBS, avec l’ajout de DTT, augmentent l’absorbance de fond d’environ 0,900 A595, ce qui réduit considérablement la capacité du test BCA (Figure 3A). L’effet négatif du DTT est détectable même après une dilution dix fois supérieure avec de l’eau pure (données non présentées). Le test Bradford n’a pas semblé être affecté par le tampon de stockage (figure 3B), comme l’a confirmé l’analyse densitométrique.
La pureté de la préparation de la tubuline a été vérifiée par spectrométrie de masse dans deux installations indépendantes (VRI Brno, République tchèque ; CEITEC MU Brno, République tchèque) par ionisation par électronébulisation et MALDI-TOF. Les deux analyses ont confirmé la présence de tubulines porcines alpha et bêta dans plusieurs isoformes. La pureté globale était supérieure à 97,07 % (PSM 1065), les impuretés les plus répandues provenant de la kératine d’Homo sapiens de type II (PSM 246, 2,24 % d’impuretés) qui ont été introduites très probablement lors de l’isolement de la tubuline et de la préparation de l’échantillon pour l’analyse MS/MS. D’autres impuretés composées de 322 PSM et uniquement de l’albumine sérique, de l’actine gamma et du trypsinogène provenant de Sus scrofa ont été identifiées avec une résolution peptidique (0,0069 %).
Dans des expériences ultérieures, la préservation de la capacité de polymérisation après congélation instantanée et stockage dans de l’azote liquide a été vérifiée. L’aliquote de 10 mg/mL a été retirée de l’azote liquide et décongelée lentement sur de la glace. Des échantillons de différentes concentrations (10 mg/mL, 8 mg/mL, 6 mg/mL, 4 mg/mL et 2 mg/mL) ont été préparés en diluant les aliquotes dans un tampon PEM contenant du DTT, de l’ATP et du GTP pour l’expérience d’auto-assemblage. Une série de dilutions a été incubée à 37 °C pendant 60 min, et la seconde a été incubée sur glace pendant 60 min. Les deux séries ont été centrifugées pendant 60 min à 21 000 x g et à la température correspondante (4 °C ou 37 °C). 30 μL de surnageant ont été retirés et utilisés pour SDS-PAGE. Le surnageant restant a été soigneusement retiré à l’aide d’une pipette et jeté. Les granulés ont été brièvement lavés à l’aide de 100 μM de tampon PEM, puis immédiatement retirés à l’aide d’une pipette. Par la suite, les granulés ont été remis en suspension dans 50 μL de tampon de chargement SDS concentré afin de préserver la concentration relative de granulés et de surnageant. 10 μL de tampon de chargement SDS ont été ajoutés à chaque surnageant. Tous les échantillons ont été analysés à l’aide de la méthode SDS-PAGE et de Coomassie Staining (figure 4). Le volume de chaque échantillon chargé dans SDS-PAGE a été ajusté en fonction de la concentration de départ, de sorte que la différence de précipitation due à la concentration est plus évidente. L’essai d’auto-assemblage de la tubuline dans le tampon PEM a confirmé la capacité à former des fibres de tubuline en fonction de la température.
Le test d’assemblage de la tubuline20,21 piloté par MAP2c, vérifiant la capacité de la tubuline à interagir avec d’autres protéines, a été réalisé22. Les dilutions en série de MAP2c ont été préparées en mélangeant 100 μL d’aliquotes de tubuline de 1 mg/mL avec de la MAP2c jusqu’à la concentration finale allant de 0 μM à 8 μM. Tous les échantillons ont été préparés sur glace en les diluant dans un tampon PEM fraîchement préparé avec 1 mM DTT et 1 mM GTP. La tubuline a été incubée pendant 15 min à 37 °C avec différentes concentrations de MAP2c, et centrifugée pendant 60 min à 21 000 x g et 37 °C. Le lavage final de la pastille a été effectué deux fois avec 100 μL de tampon PEM. L’expérience a confirmé la capacité de la tubuline préparée à subir une polymérisation induite par MAP2c, car seul l’échantillon sans MAP2c ne formait pas de pastille (Figure 5).
La microscopie électronique à transmission a ensuite été utilisée pour confirmer la présence de filaments de tubuline à partir d’expériences de copolymérisation. Des suspensions de tubuline purifiée précipitée avec MAP2c ont été préparées pour la microscopie électronique à transmission à l’aide d’une coloration négative. Les échantillons ont été adsorbés sur des grilles de cuivre recouvertes de Formvar et stabilisées au carbone. Les grilles ont ensuite été colorées négativement avec 2% de NH4MoO4 et examinées au microscope électronique à un grossissement de 18 000x et à une tension d’accélération de 80 kV. La présence de microtubules homogènes avec une structure filamenteuse claire et une taille appropriée a montré la capacité de former des microtubules en conformation native (Figure 6).
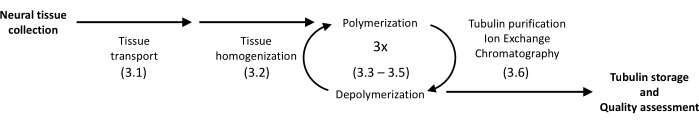
Figure 1 : Schéma de principe de la séparation et de la purification des tubulines. Le nombre entre parenthèses fait référence à l’étape du protocole. Veuillez cliquer ici pour voir une version agrandie de cette figure.
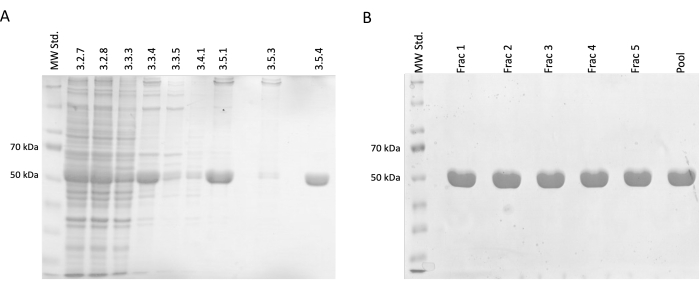
Figure 2 : Séparation et purification des tubulines (A) L’analyse SDS-PAGE des échantillons prélevés lors de la séparation de la tubuline à l’aide de la polymérisation en fonction de la température (3 μL par ligne). La diminution des impuretés avec une augmentation stable de l’abondance relative de la tubuline (environ 50 kDa) est visible. Les chiffres au-dessus de chaque ligne correspondent au numéro d’étape dans le protocole. (B) L’analyse SDS-PAGE des fractions obtenues après chromatographie protéique sur résine phospho-cellulosique (4 μL par ligne). Veuillez cliquer ici pour voir une version agrandie de cette figure.
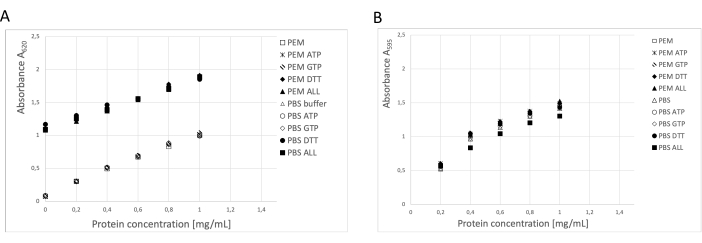
Figure 3 : Concentration en protéines. La série de dilution de l’albumine sérique bovine allant jusqu’à 1 mg/mL dans le tampon PEM ou le PBS a été comparée à la série de dilution BSA contenant 0,1 ATP, 1 mM GTP, 1 mM DTT séparément ou en combinaison (0,1 mM ATP, 1 mM GTP et 1 mM DTT) dans le tampon PEM ou PBS. (A) Lorsque le test BCA a été utilisé, il y a eu un changement significatif dans le bruit de fond des échantillons contenant des DTT (symboles solides). (B) Cet effet n’a pas été détecté lorsque les concentrations ont été mesurées dans l’essai de Bradford. Veuillez cliquer ici pour voir une version agrandie de cette figure.
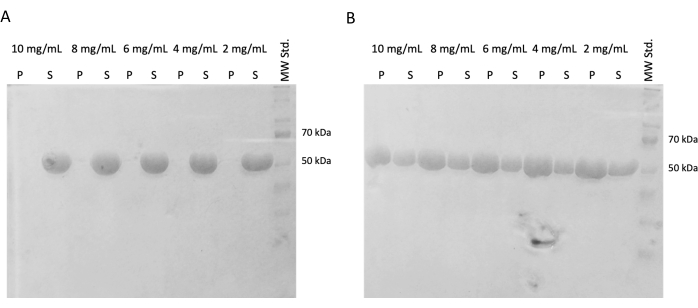
Figure 4 : Essai d’auto-assemblage de la tubuline. L’analyse SDS-PAGE de l’essai d’auto-assemblage a confirmé la capacité de la tubuline stockée incubée à (A) 4 °C ou (B) à 37 °C à polymériser de manière dépendante de la température dans un large spectre de concentrations. (P - pastille, S - surnageant ; la concentration respective de tubuline est indiquée au-dessus de chaque paire de lignes ; la quantité de chaque échantillon chargée était de 10 μg). Veuillez cliquer ici pour voir une version agrandie de cette figure.
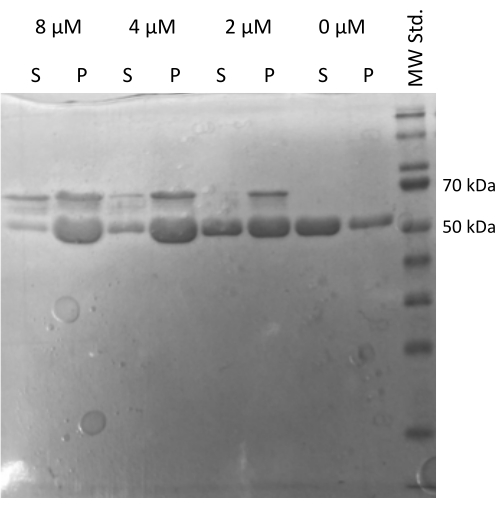
Figure 5 : Essai de cosédimentation de la tubuline. L’analyse SDS-PAGE de l’assemblage de la tubuline assistée par MAP2c a confirmé la capacité de la tubuline stockée à subir une polymérisation entraînée par l’interaction avec la protéine associée aux microtubules d’une manière dépendante de la concentration. La concentration molaire de MAP2c est indiquée au-dessus de chaque ligne. (P - pastille, S - surnageant). Veuillez cliquer ici pour voir une version agrandie de cette figure.
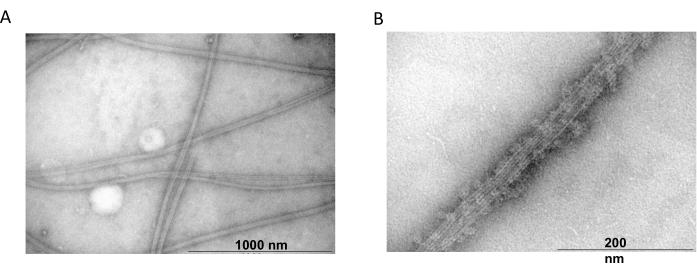
Figure 6 : Microscopie électronique à transmission. Les microphotographies TEM ont montré que la tubuline s’assemble (A) en microtubules de diamètre approprié (B) constitués de filaments de tubuline homogènes décorés de protéines MAP2c. La barre correspond à 1000 nm (A) et 200 nm (B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le tissu neural, quelle qu’en soit la source, est un excellent matériau pour l’isolement de la tubuline, car les dendrites et les axones des neurones sont riches en microtubules (jusqu’à 40 %)23. Le tissu cérébral peut être obtenu relativement facilement en quantités suffisantes. Le principal inconvénient pourrait être un niveau non spécifié de modifications post-traductionnelles, ce qui peut avoir un impact sur les expériences ultérieures24,25. Sinon, la seule préoccupation est la dégradation rapide du matériau de départ, en particulier dans des conditions chaudes. Nous avons utilisé plusieurs échanges de tampon de transfert pour améliorer la dissipation de la chaleur avant le transport et le transport rapide pour le traitement, qui commence dès que possible. Le tissu frais est disséqué dans des conditions empêchant l’échauffement et homogénéisé dans un tampon contenant du GTP et du glycérol, ce qui stabilise davantage la tubuline26.
Dans le protocole présenté, l’étape de clarification (étape 3.2.7) du lysat brut a été introduite. Une centrifugation prolongée avant la première polymérisation n’est généralement pas recommandée en raison de la sensibilité de la tubuline aux modifications irréversibles et aux protéases. D’autre part, les expériences actuelles ont démontré qu’une rotation courte en force G élevée réduit les débris et augmente ainsi le volume relatif de l’homogénat traité sans affecter de manière significative la qualité de la tubuline.
La détermination exacte de la concentration en protéines est essentielle pour d’autres expériences, principalement lorsque des interactions avec des protéines de liaison à la tubuline ou des inhibiteurs sont étudiées. Au cours des investigations, nous avons constaté des différences significatives dans les résultats des dosages de concentration en protéines. La raison principale était la présence de DTT, de GTP et d’ATP à des concentrations élevées interférant avec les tests. Le dosage de l’ACB a été déplacé vers les limites supérieures en raison de la grande quantité de DTT dans le tampon de stockage, ce qui a réduit la capacité de dosage. De plus, les maxima d’absorbance similaires des protéines et de l’ATP ou du GTP ont provoqué des incohérences dans la détermination de la concentration en protéines à l’aide de l’absorbance à 280 nm. Le même problème a été remarqué dans les lectures du détecteur UV FPLC. L’essai le plus fiable, avec des résultats stables, a été l’essai sur les protéines de Bradford, où aucune influence des composés tampons n’a été observée. Néanmoins, il est essentiel de préparer la série de dilution standard de protéines dans le tampon de stockage.
La capacité de la tubuline purifiée à créer des arrangements appropriés est une condition préalable aux expériences ultérieures. La tubuline est, par nature, très sujette à la dégradation, même dans l’environnement riche en glycérol-GTP, ce qui entraîne une capacité réduite à former des filaments homogènes. Il est essentiel de suivre le processus de purification et de vérifier expérimentalement la capacité de la tubuline stockée à polymériser en filaments réguliers stables. Plusieurs méthodes indépendantes de vérification de l’état de la tubuline ont été introduites in vivo et in vitro. Parmi les plus importants, citons la spectroscopie de dichroïsme circulaire27, le test de résonance plasmoniquede surface 28, le test de décalage thermique29, le test d’inhibition de polymérisation30, la coloration par immunofluorescence31,32, la coprécipitation22,33 et l’analyse au microscope électronique à transmission32 peut être mentionné. Le test de polymérisation et la coprécipitation de la tubuline utilisés dans ce protocole sont faciles à réaliser. Ils peuvent être rapidement évalués soit par les pastilles présentes au fond du tube, soit à l’aide de SDS-PAGE. D’autre part, la tubuline précipitée peut se présenter sous forme d’agrégats. Des méthodes plus sophistiquées, telles que la microscopie électronique à transmission, doivent être incluses pour confirmer la présence de fibres de microtubules pour le contrôle de la qualité.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
L’étude a été financée par l’Agence technologique de la République tchèque (projet nr. TN02000017 - Centre National de Biotechnologie en Médecine Vétérinaire - NaCeBiVet).
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | --- | --- | Common material |
| 10 mL tubes | --- | --- | Common material |
| 50 mL tubes | --- | --- | Common material |
| ATP | ROTH | HN35.2 | Analytical grade |
| DMSO | ROTH | A994.2 | Analytical grade |
| Dounce glass homogenizer | P-LAB | H244043 | Homogenizer |
| DTT | ROTH | 6908.1 | Analytical grade |
| EGTA | ROTH | 3054.3 | Analytical grade |
| Ethanol | PENTA | 70390-11001 | Analytical grade |
| Glycerol | ROTH | 6967.2 | Analytical grade |
| Graduated beakers | --- | --- | Common equipment |
| Graduated cilinders | --- | --- | Common equipment |
| GTP | MERCK | 36051-31-7 | Very high quality |
| HCl | PENTA | 19360-11000 | Analytical grade |
| Izolated box for tissue transport | --- | --- | Common equipment |
| Kitchen blender | Waring | 7011HB | Glass or plastic vessel |
| Liquid nitrogen | --- | --- | Common material |
| MES | ROTH | 6066.4 | Analytical grade |
| MgCl2 | MERCK | 814733 | Analytical grade |
| MgSO4 | PENTA | 43180-31000 | Analytical grade |
| NaOH | PENTA | 15650-11000 | Analytical grade |
| Optima XPN100 | Beckman Coulter | A94469 | Ultracentrifuge |
| Phosphocellulose column | VWR | GENO786-1291 | Empty column |
| Phosphocellulose resin | Creative - Biomart, inc | Phosphate-001C | Ion exchange resin |
| PIPES | ROTH | 9156.2 | Analytical grade |
| Saccharose | PENTA | 24970-31000 | Analytical grade |
| Scales | --- | --- | Common equipment |
| Scissors | --- | --- | Common equipment |
| Spoons | --- | --- | Plastic or glass |
| Ti45 rotor | Beckman Coulter | 339160 | Rotor for Ultracentrifuge |
| Tweezers | --- | --- | Common equipment |
| Ultra turrax IKA T18 basic | IKA | 356 1000 | Laboratory dispenser |
| Water bath 37 °C | --- | --- | Stirred |
Références
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Murphy, D. B., Hiebsch, R. R. Purification of microtubule protein from beef brain and comparison of the assembly requirements for neuronal microtubules isolated from beef and hog. Anal Biochem. 96 (1), 225-235 (1979).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann NY Acad Sci. 253, 107-132 (1975).
- Weisenberg, R. C. Microtubule formation in vitro in solutions containing low calcium concentrations. Science. 177 (4054), 1104-1105 (1972).
- Roychowdhury, S., Gaskin, F. Separation of assembly-competent tubulin from brain microtubule protein preparations using a fast-performance liquid chromatography procedure. J Neurochem. 46 (5), 1399-1405 (1986).
- Weingarten, M. D., Suter, M. M., Littman, D. R., Kirschner, M. W. Properties of the depolymerization products of microtubules from mammalian brain. Biochemistry. 13 (27), 5529-5537 (1974).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nat Protoc. 14 (5), 1634-1660 (2019).
- Jacobs, M., Huitorel, P. Tubulin-associated nucleoside diphosphokinase. Eur J Biochem. 99 (3), 613-622 (1979).
- Munguía, B., et al. Purification of native M. vogae and H. contortus tubulin by TOG affinity chromatography. Exp Parasitol. 182, 37-44 (2017).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein ExpPurif. 32 (1), 83-88 (2003).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Lett. 587 (21), 3450-3455 (2013).
- Liu, C., Yao, J., Yin, J., Xue, J., Zhang, H. Recombinant α- and β-tubulin from Echinococcus granulosus: Expression, purification and polymerization. Parasite. 25, 62 (2018).
- Ti, S. -. C., Wieczorek, M., Kapoor, T. M. Purification of affinity tag-free recombinant tubulin from insect cells. STAR protoc. 1 (1), 100011 (2020).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled post-translational modifications and isotypes from limited sources by polymerization-depolymerization cycles. JVisExp. (165), e61826 (2020).
- Sackett, D. L., Werbovetz, K. A., Morrissette, N. S. Isolating tubulin from nonneural sources. Methods Cell Biol. 95, 17-32 (2010).
- Modig, C., Strömberg, E., Wallin, M. Different stability of posttranslationally modified brain microtubules isolated from cold-temperate fish. Mol Cell Biochem. 130 (2), 137-147 (1994).
- Fourest-Lieuvin, A. Purification of tubulin from limited volumes of cultured cells. Protein Exp Purif. 45 (1), 183-190 (2006).
- MacRae, T. H., Gull, K. Purification and assembly in vitro of tubulin from Trypanosoma brucei. Biochem J. 265 (1), 87-93 (1990).
- Jansen, S., et al. Quantitative mapping of microtubule-associated protein 2c (MAP2c) phosphorylation and regulatory protein 14-3-3ζ-binding sites reveals key differences between MAP2c and its homolog Tau. JBiol Chem. 292 (24), 3-3 (2017).
- Melková, K., et al. Structure and functions of microtubule associated proteins Tau and MAP2c: Similarities and differences. Biomolecules. 9 (3), E105 (2019).
- Herzog, W., Weber, K. Fractionation of brain microtubule-associated proteins: Isolation of two different proteins which stimulate tubulin polymerization in vitro. Eur J Biochem. 92 (1), 1-8 (1978).
- Castle, A. G., Crawford, N. Isolation of tubulin from pig platelets. FEBS Lett. 51 (1), 195-200 (1975).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. Int J Mol Sci. 18 (10), E2207 (2017).
- Lafanechère, L., Job, D. The third tubulin pool. Neurochem Res. 25 (1), 11-18 (2000).
- Arai, T., Ihara, Y., Arai, K., Kaziro, Y. Purification of tubulin from bovine brain and its interaction with guanine nucleotides. J Biochem. 77 (3), 647-658 (1975).
- Mahaddalkar, T., et al. Structural investigations into the binding mode of a novel noscapine analogue, 9-(4-vinylphenyl) noscapine, with tubulin by biochemical analyses and molecular dynamic simulations. J Biomol Struct Dyn. 35 (11), 2475-2484 (2017).
- Chen, H., et al. Structure-activity relationship study of novel 6-Aryl-2-benzoyl-pyridines as tubulin polymerization inhibitors with potent antiproliferative properties. J Med Chem. 63 (2), 827-846 (2020).
- Yao, D., et al. Ferulin C triggers potent PAK1 and p21-mediated anti-tumor effects in breast cancer by inhibiting Tubulin polymerization in vitro and in vivo. Pharmacol Res. 152, 104605 (2020).
- Sweetnam, P. M., et al. The role of receptor binding in drug discovery. JNat Prod. 56 (4), 441-455 (1993).
- Qi, Z. -. Y., et al. Synthesis and biological evaluation of 1-(benzofuran-3-yl)-4-(3,4,5-trimethoxyphenyl)-1H-1,2,3-triazole derivatives as tubulin polymerization inhibitors. Bioorg Chem. 94, 103392 (2020).
- Sáez-Calvo, G., et al. Triazolopyrimidines are microtubule-stabilizing agents that bind the vinca inhibitor site of tubulin. Cell Chem Bio. 24 (6), 737-750 (2017).
- Bellocq, C., et al. Purification of assembly-competent tubulin from Saccharomyces cerevisiae. EurJ Biochem. 210 (1), 343-349 (1992).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon