Method Article
Оптимизация выхода тубулина из ткани мозга свиньи
В этой статье
Резюме
Этот протокол описывает метод выделения тубулина из мозга свиньи с высоким выходом, оптимизированный для использования с помощью мелкомасштабных инструментов. Процедуры выделения дополняются процедурами определения активности полимеризации тубулина in vitro с использованием методов коседиментации и просвечивающей электронной микроскопии.
Аннотация
Нервная ткань из любого источника является отличным материалом для выделения тубулина, так как дендриты и аксоны нейронов богаты микротрубочками. Здесь мы представляем процедуру экстракции тубулина, которая может быть использована, с незначительными модификациями, для нервной ткани из нескольких источников. В представленном протоколе введен новый этап осветления сырого лизата, что привело к значительному снижению начального количества нерастворимого мусора до того, как произошла первая стадия полимеризации. Этот дополнительный этап позволил обработать дополнительную ткань с использованием того же инструментария и, таким образом, увеличить относительный объем перерабатываемого гомогената. Вновь введенный этап не оказывает существенного влияния на качество очищенного тубулина, что подтверждено анализами активности in vitro и просвечивающей электронной микроскопией. Описанная процедура включает в себя все важнейшие этапы, включая сбор ткани, транспортировку, гомогенизацию тканей, циклы выделения тубулина и окончательную полировку с помощью ионообменной хроматографии с использованием FPLC и последующие анализы измерения активности. Гомогенность очищенного тубулина составила более 97%, что подтверждено анализом МС/МС с использованием ионизации электроспреем и MALDI-TOF.
Введение
Микротрубочки, полые белковые филаменты (24 нм в диаметре), образованные гетеродимерами альфа- и бета-тубулина, участвуют в различных важных клеточных процессах. Они участвуют в формировании внутриклеточных структур, подвижности, делении клеток, дифференцировке клеток, клеточном транспорте, поддержании формы и секреции1. Клеточные функции микротрубочек могут быть затронуты прямым или косвенным взаимодействием с микротрубочками, ассоциированными с белками (MAP) и другими белками, или посредством сложных посттрансляционных модификаций, определенных в коде тубулина2.
Волокна тубулина возникают в результате динамических нековалентных взаимодействий между альфа- и бета-субъединицами в механизме зародышеобразования-элонгации. Образуются короткие микротрубочки, а последующий рост волокон тубулина достигается обратимым удлинением на обоих концах, образуя цилиндры, состоящие из гетеродимеров тубулина, расположенных в параллельных протофиламентах2. Динамическая неустойчивость относится к тому факту, что собранные микротрубочки часто не находятся в равновесии со своими субъединицами, но могут претерпевать фазовый переход между продолжительным периодом роста и сжатия, сохраняя при этом устойчивое состояние 1,2.
Динамическая нестабильность тубулиновых волокон в основном используется во многих процедурах разделения и очистки тубулина с использованием циклов высокотемпературной полимеризации и низкотемпературной деполимеризации в среде высокочистого глицерина, ДМСО, ГТФ/АТФ, Mg2+ или других химических агентов (таких как таксол или поликатионы)3. За большинством процедур разделения4 следует белковая хроматография 5,6,7,8,9, которая обеспечивает разделение тубулин-ассоциированных белков с нуклеозиддифосфокиназой и активностью АТФазы 5. Аналогичные результаты могут быть получены при использовании буферов с высоким содержанием соли10. Для фракционирования использовались многочисленные источники, включая нейронные 11,12,13,14 и ненейронные15 ткани, рыбы16 (как пресноводные, так и морские), дрожжи или рекомбинантные варианты17, сверхэкспрессируемые в различных производственных штаммах11,12,13,14, и другие источники 9,18 очистка.
Представленный протокол использует осаждение и белковую хроматографию для выделения тубулина из мозга свиньи до высокой гомогенности (рис. 1). Основным преимуществом является относительно высокая производительность, достигаемая с помощью приборов, имеющихся в лабораториях, оборудованных для рутинных экспериментов в области молекулярной биологии.
протокол
Состав всех растворов и контрольно-измерительных приборов описан в Таблице материалов. Все растворы были приготовлены с использованием химических реагентов класса FPLC и перед использованием отфильтрованы через фильтр 0,22 мкм. Во время всех операций использовались средства индивидуальной защиты, например, лабораторный халат, перчатки и защитные очки. Все инструменты были чистыми и без следов моющих средств. Во время процедур соблюдались соответствующие рекомендации по уходу за животными (утвержденные учреждением). Весь биологический материал, включая мозговую ткань, был куплен на скотобойне в качестве сырья. Ни на одном из этапов протокола не использовались живые животные.
1. Активация фосфоцеллюлозной колонки для быстрой белковой жидкостной хроматографии
- Добавьте 700 мл 50% этанола к 15 г сухой фосфоцеллюлозной смолы и аккуратно перемешайте ее в стакане ложкой.
- Налейте суспензию в подходящую хроматографическую колонку соответствующего объема (700 мл). Закройте колонку поршнями, оснащенными фритами. Оставьте не менее 10% пустого пространства над головой.
ПРИМЕЧАНИЕ: Можно использовать и другие емкости, но колонна FPLC в сочетании с перистальтическим насосом значительно сокращает время, необходимое для активации смолы и потерь смолы. - Инкубировать на коромысле при 60 об/мин в течение 30 минут.
- Дайте смоле отстояться и удалите избыток 50% этанола с помощью перистальтического насоса с расходом 3 мл/мин. Не давайте смоле высохнуть.
- Снимите верхний поршень и добавьте 300 мл 50% этанола. Закройте колонку, кратковременно встряхните ее и удалите излишки этанола с помощью перистальтического насоса.
- Удалите оставшийся этанол. Добавьте в колонку 300 мл сверхчистой воды, закройте колонку поршнем и наклоняйте до тех пор, пока смола не будет повторно суспендирована. Удалите лишнюю жидкость с помощью перистальтического насоса. Повторите этот шаг три раза.
- Откройте колонку вверху, добавьте 500 мл 0,5 M HCl, закройте колонку и снова суспендируйте смолу, осторожно наклоняя. Инкубировать на коромысле при 60 об/мин в течение 30 минут.
- Удалите лишнюю жидкость с помощью перистальтического насоса. Добавьте 300 мл 0,5 М HCl, повторно суспендируйте смолу и удалите лишнюю жидкость.
- Добавьте в колонку 300 мл сверхчистой воды, закройте колонку поршнем и наклоняйте, пока смола не восстановится. Удалите лишнюю жидкость с помощью перистальтического насоса. Повторите этот шаг три раза.
- Налейте 700 мл MES-буфера (25 мМ MES, 0,1 мМ EGTA, 0,5 мМ MgCl2) в колонку и повторно суспендируйте смолу, наклоняя. Налейте суспензию в стакан, отрегулируйте pH до 6,1 с помощью 1 М NaOH и дайте поинкубироваться в течение 2 часов при слабом перемешивании.
- Дайте смоле отстояться, сцедите жидкость, добавьте 300 мл буфера MES, pH 6,4, и выдерживайте в течение ночи при 4 °C.
- Сцедите лишнюю жидкость, добавьте 96% этанола до 20% конечной концентрации и храните при температуре 4 °C до использования.
2. Фосфоцеллюлозная колонная насадка
- Налейте 12 мл активированной смолы в чистую хроматографическую колонку с закрытой нижней пробкой. Дайте смоле отстояться. Объем осевшей смолы составляет около 5 мл. Удалите верхний слой смолы (примерно 2-3 мм), где могут отложиться более легкие фрагменты разорванной матрицы.
- Снимите нижнюю пробку и дайте раствору для хранения свободно стечь, капля за каплей. Не давайте смоле высохнуть.
- Закройте колонку и подключите ее к системе FPLC. Промойте колонку буфером PEM (100 мМ ТРУБЫ pH 6,9, 1 мМ EGTA, 1 мМ MgSO4) со скоростью 1 мл/мин (макс. давление 1 бар) в течение 30 минут, отрегулируйте высоту поршня, переверните колонну вверх дном и промойте колонку в тех же условиях в течение следующих 30 минут в обратном потоке.
- Храните колонку, заполненную активированной фосфоцеллюлозой, при температуре 4 °C в течение нескольких дней.
3. Отделение и очистка тубулина
ПРИМЕЧАНИЕ: Тубулин очень подвержен деградации, и крайне важно действовать быстро. Все растворы, инструменты и оборудование должны быть подготовлены, охлаждены или разогреты, при необходимости, заранее. Процедуры чувствительны к изменениям рекомендуемых температур. Мозговая ткань должна быть обработана как можно скорее после вскрытия, учитывая количество биологических отходов, образующихся во время очистки. Процедура была оптимизирована для ротора с шестью ультрацентрифугирующими кюветами объемом 75 мл. Количество обрабатываемой ткани может быть увеличено или уменьшено в зависимости от имеющейся ультрацентрифуги.
- Транспортировка тканей
- Положите 500 г свежепрепарированных свиных мозгов (6-8 штук) в транспортировочный сосуд объемом 3 л и залейте ледяным транспортным буфером (4,1 мМ MES pH 7, 320 мМ сахарозой, 1 мМ EGTA) до полного погружения. Дайте постоять на льду 5 минут и поменяйте транспортный буфер на свежий, чтобы облегчить рассеивание тепла. Быстрая транспортировка по льду для дальнейшей обработки.
- Гомогенизация тканей
ПРИМЕЧАНИЕ: Гомогенизация тканей проводится на льду в холодном помещении. Все инструменты должны быть предварительно охлаждены, чтобы предотвратить самопроизвольную полимеризацию. Основным источником тубулина является серое вещество, а остальное удаляется на следующих этапах.- Налейте 100 мл экстракционного буфера (4,1 мМ MES pH 7, 520 мМ сахарозы, 1 мМ EGTA, 1 мМ АТФ и 0,1 мМ ГТФ) в пластиковый стакан объемом 1 л и определите вес W1 (г) вместе с сосудом. АТФ и ГТФ добавляются непосредственно перед использованием.
- Извлеките мозг свиньи из транспортного сосуда и удалите весь мозжечок, жир, большие куски белого вещества, мозговые оболочки и кровеносные сосуды пальцами, приложив умеренную силу. Также можно использовать ножницы или пинцет. Поместите в стакан очищенные от ненужной ткани мозги свиньи со 100 мл буфера для холодной экстракции. Продолжайте до тех пор, пока не будут обработаны все ткани.
- Взвесьте стакан с обработанной мозговой тканью и определите вес W2(г).
- Добавляем буфер для экстракции по формуле, вес буфера для экстракции = W2 - W1 (например, на 400 г ткани добавляется 300 г дополнительного буфера для экстракции).
- Перенесите мозговую ткань с помощью буфера Extraction в предварительно охлажденный кухонный блендер и обработайте 4-8 короткими трехсекундными импульсами.
- Обработайте частично гомогенизированную ткань высокоскоростным дисперсионным гомогенизатором (18 000 об/мин) в течение 1 минуты. Оставьте суспензию на льду на 3-5 минут, периодически перемешивая ложкой. Повторите пять раз или до полной гомогенизации.
- Перелейте в предварительно охлажденные ультрацентрифужные пробирки и вращайте в течение 10 минут при температуре 4 °C и 50 000 x g. Оставьте надосадочную жидкость и выбросьте гранулы. Повторяйте до тех пор, пока не будет собрано 430 мл осветленного экстракта.
- Разлейте осветленный экстракт в предварительно охлажденные ультрацентрифужные пробирки (по 70 мл каждая) и вращайте при температуре 4 °C и 75 000 x g в течение 60 минут. Соберите надосадочную жидкость и определите объем S1.
ПРИМЕЧАНИЕ: Если существует только один ротор, нагрейте его на теплой водяной бане для следующего этапа центрифугирования (37 °C).
- Первая полимеризация
- Добавьте 10x MEM буфер (1 M MES pH 6,8, 10 mM EGTA, 10 mM MgCl2) по формуле V = S1/9 мл (на 585 мл надосадочной жидкости добавьте 65 мл 10x MEM буфера). Хорошо перемешайте и добавьте глицерин до 3,5 М и ГТФ до 0,1 мМ конечной концентрации. Разлить суспензию по ультрацентрифужным пробиркам (объем надосадочной жидкости превышает объем пробирок, остальное отбраковывается).
- Инкубировать пробирки с надосадочной жидкостью на водяной бане в течение 45 мин при температуре 37 °С.
- Вращайте пробирки в течение 90 минут при температуре 37 °C и 75 000 x g. Измерьте объем надосадочной жидкости (S2), чтобы определить объем буфера MEM, добавьте его в гранулы на шаге 3.3.4, а затем выбросьте надосадочную жидкость. Храните гранулу там, где содержится полимеризованный тубулин.
- Приготовьте 0,5 x S2 объема ледяного 1x MEM буфера. Добавьте равное количество 1x MEM буфера в каждую ультрацентрифужную пробирку с гранулой. Повторно суспензируйте гранулы в добавленном буфере 1x MEM, перенесите суспензию в градуированный цилиндр и определите общий объем.
- Добавьте ГТФ до конечной концентрации 1 мМ. Перелейте суспензию в гомогенизатор стекла Dounce и гомогенизируйте раствор каждые 10 минут или около того в течение 45 минут на льду. Поршень должен эксплуатироваться осторожно, так как он может легко сломаться.
ПРИМЕЧАНИЕ: Тем временем охладите ротор в воде со льдом.
- Добавьте ГТФ до конечной концентрации 1 мМ. Перелейте суспензию в гомогенизатор стекла Dounce и гомогенизируйте раствор каждые 10 минут или около того в течение 45 минут на льду. Поршень должен эксплуатироваться осторожно, так как он может легко сломаться.
- Налейте гомогенизированный раствор в предварительно охлажденные ультрацентрифужные пробирки и вращайте при температуре 75 000 x g и 4 °C в течение 60 минут. После центрифугирования определяют объем надосадочной жидкости (S3).
- Вторая полимеризация
- Смешайте надосадочную жидкость с 0,35 x S3 мл глицерина и добавьте ГТФ до конечной концентрации 1 мМ. Надосадочную жидкость разлить в ультрацентрифужные пробирки и инкубировать в течение 45 мин при 37 °C.
ПРИМЕЧАНИЕ: Тем временем прогрейте ротор до 37 °C на водяной бане. - Центрифугирование полимеризованного надосадочной жидкости на стадии 3.4.1 в течение 60 мин при 75 000 x g и 37 °C. Определите объем надосадочной жидкости (S4).
ПРИМЕЧАНИЕ: Это необязательный пункт остановки. Гранулу с тубулином можно шокировать в жидком азоте и хранить при температуре -80 °C. - Дайте замороженным гранулам медленно оттаять на льду в течение 30 мин. Приготовьте 0,25 x S4 мл буфера PIPES (500 мМ PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP), равномерно разделите на пробирки с гранулами, повторно суспендируйте гранулы ложкой и перелейте раствор в гомогенизатор стекла Dounce. Гомогенизируйте каждые 10 минут на льду в течение 45 минут.
ПРИМЕЧАНИЕ: Тем временем охладите ротор в воде со льдом. - Разлейте раствор с деполимеризованным тубулином в ультрацентрифужные пробирки и вращайте в течение 60 мин при 4 °C и 75 000 x g.
- Смешайте надосадочную жидкость с 0,35 x S3 мл глицерина и добавьте ГТФ до конечной концентрации 1 мМ. Надосадочную жидкость разлить в ультрацентрифужные пробирки и инкубировать в течение 45 мин при 37 °C.
- Третья полимеризация
- Определите объем надосадочной жидкости (S5) и добавьте S5/9 мл ДМСО. Разлейте суспензию в ультрацентрифужные пробирки и инкубируйте в течение 20 минут при 37 °C для полимеризации.
ПРИМЕЧАНИЕ: Тем временем прогрейте ротор до 30 °C на водяной бане. - Полимеризованный тубулин центрифугируют в течение 60 мин при 75 000 x g и 30 °C. Определите объем надосадочной жидкости (S6) и сохраните гранулы.
- Растворите гранулы в 0,25 x S6 мл буфера PEM (100 мМ PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM АТФ). Используйте гомогенизатор стекла Dounce для улучшения солюбилизации. Продолжайте добавлять буфер PEM до тех пор, пока гранулы полностью не растворятся (опалесцирующие частицы больше не будут видны).
- Определите объем надосадочной жидкости (S5) и добавьте S5/9 мл ДМСО. Разлейте суспензию в ультрацентрифужные пробирки и инкубируйте в течение 20 минут при 37 °C для полимеризации.
- Ионообменная хроматографическая очистка
ПРИМЕЧАНИЕ: Обратная ионообменная хроматография используется для удаления белков, связанных с микротубулином. Тубулин свободно течет по колонне при заданном рН, а загрязняющие белки задерживаются на фосфоцеллюлозной смоле. Все этапы выполняются при температуре, близкой к 4° С, или на льду. Не осветляйте экстракт тубулина перед очисткой FPLC с помощью фильтрации или центрифугирования. - Уравновесить FPLC и колонку с буфером PEM (100 мМ ТРУБКИ pH 6,9, 1 мМ EGTA, 1 мМ MgSO4, 1 мМ DTT, 0,1 мМ АТФ). Для уравновешивания используйте не менее 10 колоночных объемов. Расход насоса не должен превышать расход, используемый для насадки колонн (1 мл/мин).
- Медленно (0,5 мл/мин) загрузите суспензию тубулина в колонку и соберите несвязанный белок, протекающий через смолу.
- Добавьте 10 мкл 100 мМ ГТФ к каждой фракции 1 мл, содержащей белок тубулина.
- Фракции, содержащие тубулин, заморозьте в жидком азоте и сразу же переложите их в емкость с жидким азотом. В этих условиях тубулин может храниться в течение нескольких лет. Стабильность быстро снижается в течение нескольких месяцев, если тубулин хранится при температуре -80 °C.
Результаты
На этапах разделения и очистки отбирались образцы для электрофореза SDS-PAGE, которые впоследствии анализировались с помощью окрашивания синим цветом Кумасси (рис. 2). 20 мкл каждого образца смешивали с 10 мкл буфера для проб Laemmli (188 мМ Tris-HCl pH 6,8, 3% SDS (w/w), 30% глицерина (v/v), 0,01 бромфенола синего (w/w), 15% β-меркаптоэтанола) и инкубировали при 95 °C в течение 15 мин. 4 мкл каждого образца загружали на 12,5% акриламид SDS gel и разделяли под постоянным током 30 мА на гель в восстановительных и денатурирующих условиях.
Полученные результаты подтвердили постепенное увеличение относительной концентрации тубулина, сопровождающееся снижением концентрации загрязняющих белков. Кроме того, не наблюдалось существенной потери тубулина в осветленном лизате при первом центрифугировании (стадия 3.2.7) по сравнению с пропуском этой стадии (рис. 2А, В).
Концентрацию белка определяли с помощью трех независимых методов: анализа БЦА, анализа белка Брэдфорда и анализа гелевой денситометрии SDS-PAGE19 (рис. 3). Общий выход тубулина при использовании описанной методики составил 123 мг очищенного тубулина из 250 г нервной ткани. При проведении измерений необходимо учитывать, что высокая концентрация ДТТ в буфере хранения оказывает существенное влияние на анализ БЦА. Как буфер PEM, так и буфер PBS с добавлением DTT увеличивают фоновую абсорбцию примерно на 0,900 A595, что значительно снижает емкость анализа BCA (рис. 3A). Отрицательный эффект ДТТ обнаруживается даже после десятикратного разбавления чистой водой (данные не показаны). Анализ Брэдфорда, по-видимому, не подвержен влиянию буфера хранения (рис. 3B), что подтверждено денситометрическим анализом.
Чистота препарата тубулина была проверена методом масс-спектрометрического анализа на двух независимых установках (VRI Brno, Чехия; CEITEC MU Brno, Чехия) с использованием ионизации электроспреем и MALDI-TOF. Оба анализа подтвердили наличие свиных тубулинов альфа и бета в нескольких изоформах. Общая чистота составила более 97,07% (ПСМ 1065), при этом преобладали примеси, происходящие из кератина II типа Homo sapiens (ПСМ 246, 2,24% примесей), которые были введены наиболее вероятно при выделении тубулина и пробоподготовке для анализа МС/МС. Другие примеси, состоящие из 322 ПСМ и только сывороточного альбумина, актина гамма и трипсиногена, происходящих из Sus scrofa , были идентифицированы с одним пептидным разрешением (0,0069%).
В последующих экспериментах было проверено сохранение способности к полимеризации после мгновенной заморозки и хранения в жидком азоте. Аликвоту 10 мг/мл удаляли из жидкого азота и медленно размораживали на льду. Образцы различных концентраций (10 мг/мл, 8 мг/мл, 6 мг/мл, 4 мг/мл и 2 мг/мл) получали путем разведения аликвот в буфере ПЭМ, содержащем ДТТ, АТФ и ГТФ, для эксперимента по самосборке. Одну серию разведения инкубировали при 37 °С в течение 60 мин, а вторую инкубировали на льду в течение 60 мин. Обе серии центрифугировали в течение 60 мин при 21 000 x g и соответствующей температуре (4 °C или 37 °C). 30 мкл надосадочной жидкости удаляли и использовали для SDS-PAGE. Оставшуюся надосадочную жидкость осторожно удаляли с помощью пипетки и выбрасывали. Гранулы кратковременно промывали путем добавления 100 мкМ буфера PEM с последующим немедленным удалением с помощью пипетки. Затем гранулы повторно суспендировали в 50 мкл 1x концентрированного буфера для загрузки SDS, чтобы сохранить относительную концентрацию гранул и надосадочной жидкости. В каждую надосадочную жидкость добавляли 10 мкл буфера, загружающего SDS. Все образцы были проанализированы с помощью SDS-PAGE и Coomassie Staining (рис. 4). Объем каждого образца, загруженного в SDS-PAGE, регулировался в соответствии с начальной концентрацией, поэтому разница в осадках из-за концентрации более очевидна. Тест на самосборку тубулина в буфере ПЭМ подтвердил способность формировать волокна тубулина температурно-зависимым образом.
Проведен анализ сборки тубулина, вызванный MAP2c20,21, подтверждающий способность тубулина взаимодействовать с другими белками22. Серийные разведения MAP2c получали, в которых 100 мкл 1 мг/мл аликвот тубулина смешивали с MAP2c до конечной концентрации в диапазоне от 0 мкМ до 8 мкМ. Все образцы готовили на льду путем разведения в свежеприготовленном буфере ПЭМ с 1 мМ DTT и 1 мМ GTP. Тубулин инкубировали в течение 15 мин при 37 °C с различными концентрациями MAP2c и центрифугировали в течение 60 мин при 21 000 x g и 37 °C. Окончательную промывку гранул дважды проводили со 100 мкл буфера PEM. Эксперимент подтвердил способность полученного тубулина подвергаться полимеризации, вызванной MAP2c, так как только образец без MAP2c не образовывал гранулу (рис. 5).
Просвечивающая электронная микроскопия была дополнительно использована для подтверждения наличия нитей тубулина, полученных в экспериментах по совместной полимеризации. Суспензии очищенного тубулина, осажденные MAP2c, готовили для просвечивающей электронной микроскопии с использованием негативного окрашивания. Образцы были адсорбированы на медных сетках с покрытием Formvar, стабилизированных углеродом. Затем сетки были отрицательно окрашены 2% NH4MoO4 и исследованы под электронным микроскопом при 18 000-кратном увеличении и ускоряющем напряжении 80 кВ. Наличие однородных микротрубочек с четкой нитевидной структурой и соответствующими размерами показало способность образовывать микротрубочки в нативной конформации (рис. 6).
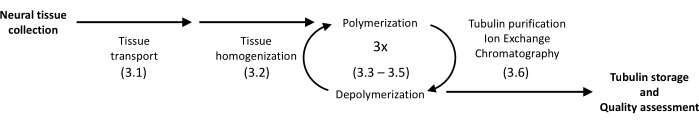
Рисунок 1: Принципиальная схема разделения и очистки тубулина. Число в скобках относится к этапу протокола. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
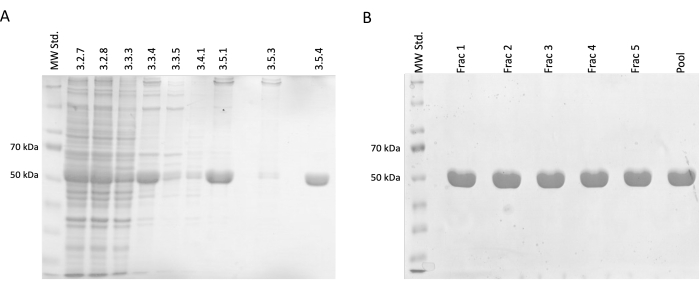
Рисунок 2: Отделение и очистка тубулина. (A) Анализ образцов, взятых во время разделения тубулина с использованием полимеризации, вызванной температурой, (3 мкл на линию). Наблюдается снижение примесей при стабильном увеличении относительной численности тубулина (примерно 50 кДа). Цифры над каждой строкой соответствуют номеру шага в протоколе. (B) Анализ фракций SDS-PAGE, полученных после хроматографии белка на фосфоцеллюлозной смоле (4 мкл на линию). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
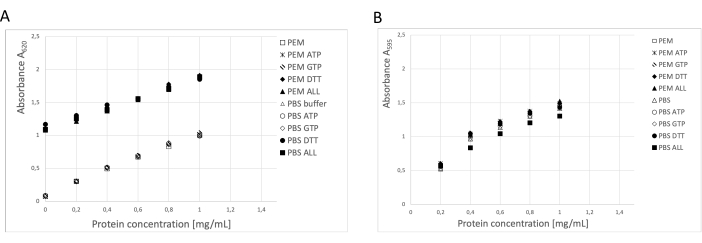
Рисунок 3: Концентрация белка. Серию разведения бычьего сывороточного альбумина до 1 мг/мл в буфере ПЭМ или PBS сравнивали с серией разведения БСА, содержащей 0,1 АТФ, 1 мМ ГТФ, 1 мМ ДТТ отдельно или в комбинации (0,1 мМ АТФ, 1 мМ ГТФ и 1 мМ ДТТ) в буфере ПЭМ или ПБС. (А) Когда использовался анализ BCA, наблюдался значительный сдвиг фона образцов, содержащих DTT (твердые символы). (B) Этот эффект не был обнаружен при измерении концентраций в Брэдфордском анализе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
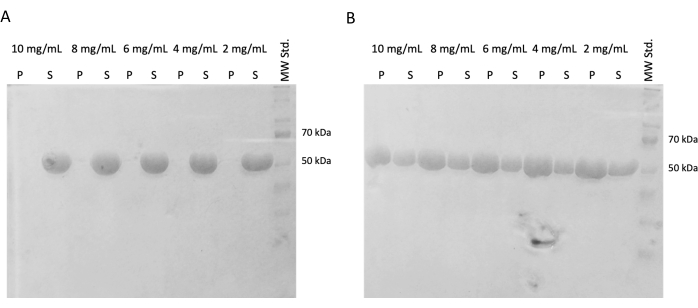
Рисунок 4: Анализ самосборки тубулина. Анализ анализа самосборки SDS-PAGE подтвердил способность хранящегося тубулина, инкубированного при (А) 4 °С или (В) 37 °С, полимеризоваться в зависимости от температуры в широком спектре концентраций. (P - гранула, S - надосадочная жидкость; соответствующая концентрация тубулина обозначена над каждой парой линий; количество каждого загруженного образца составило 10 мкг). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
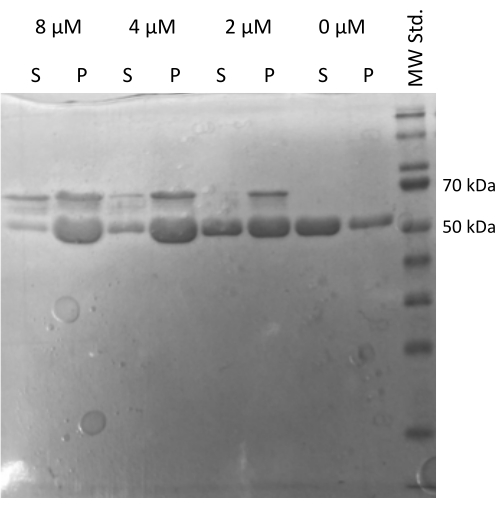
Иллюстрация 5: Анализ коседиментации тубулина. Анализ сборки тубулина с помощью MAP2c с помощью SDS-PAGE подтвердил способность хранящегося тубулина подвергаться полимеризации, вызванной взаимодействием с белком, связанным с микротрубочками, в зависимости от концентрации. Молярная концентрация MAP2c указана над каждой строкой. (- гранула, С - надосадочная жидкость). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
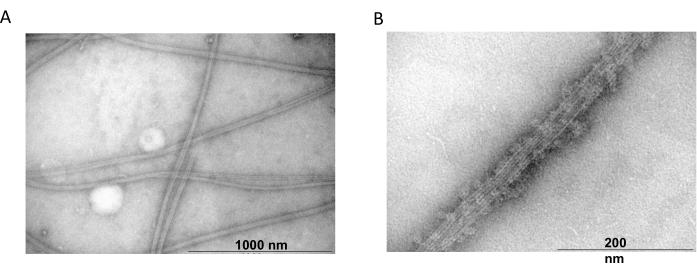
Рисунок 6: Просвечивающая электронная микроскопия. Микрофотографии ПЭМ показали, что тубулин собирается (А) в микротрубочки соответствующего диаметра (В), состоящие из однородных тубулиновых нитей, украшенных белками MAP2c. Стержень соответствует 1000 нм (А) и 200 нм (В). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Нервная ткань из любого источника является отличным материалом для выделения тубулина, так как дендриты и аксоны нейронов богаты микротрубочками (до 40%)23. Мозговую ткань можно относительно легко получить в достаточном количестве. Основным недостатком может быть неопределенный уровень посттрансляционных модификаций, которые могут повлиять на последующие эксперименты 24,25. В противном случае единственной проблемой является быстрая деградация исходного материала, особенно в теплых условиях. Мы применили несколько буферных замен для улучшения рассеивания тепла перед транспортировкой и быстрой транспортировки для обработки, которая начинается как можно скорее. Свежая ткань рассекается в условиях, препятствующих нагреванию, и гомогенизируется в буфере, содержащем ГТФ и глицерин, который дополнительно стабилизирует тубулин26.
В представленном протоколе введена стадия осветления (стадия 3.2.7) лизата сырой нефти. Длительное центрифугирование перед первой полимеризацией, как правило, не рекомендуется из-за восприимчивости тубулина к необратимым модификациям и протеазам. С другой стороны, настоящие эксперименты показали, что короткий спин с большой перегрузкой уменьшает количество мусора и, таким образом, увеличивает относительный объем обрабатываемого гомогената без существенного влияния на качество тубулина.
Точное определение концентрации белка имеет важное значение для дальнейших экспериментов, в основном при изучении взаимодействия с тубулин-связывающими белками или ингибиторами. В ходе исследований мы столкнулись со значительными различиями в результатах анализов концентрации белка. Основной причиной стало присутствие ДТТ, ГТФ и АТФ в высоких концентрациях, мешающих анализам. Анализ БЦА был смещен к верхним пределам из-за большого количества DTT в буфере хранения, что привело к снижению емкости анализа. Более того, сходные максимумы поглощения белков и АТФ или ГТФ вызывали несогласованность в определении концентрации белка с использованием абсорбции при 280 нм. Та же проблема была заметна при считывании показаний с УФ-детектора FPLC. Наиболее надежным анализом со стабильными результатами был анализ белка Брэдфорда, в котором не наблюдалось влияния буферных соединений. Тем не менее, важно готовить серию стандартного разведения белка в буфере для хранения.
Способность очищенного тубулина создавать соответствующие аранжировки является обязательным условием для последующих экспериментов. Тубулин по своей природе очень подвержен деградации даже в среде, богатой глицерином-ГТФ, что приводит к снижению способности образовывать однородные нити. Очень важно следить за процессом очистки и экспериментально проверить способность хранящегося тубулина полимеризоваться в стабильные регулярные нити. Несколько независимых методов проверки состояния тубулина были введены in vivo и in vitro. Среди наиболее известных из них спектроскопия кругового дихроизма27, анализ поверхностного плазмонного резонанса28, анализ теплового сдвига29, анализ ингибирования полимеризации30, иммунофлуоресцентное окрашивание31,32, соосаждение22,33 и анализ с помощью просвечивающего электронного микроскопа32 Можно упомянуть. Полимеризационный анализ и соосаждение тубулина, используемые в этом протоколе, просты в выполнении. Их можно быстро оценить либо по гранулам, находящимся на дне пробирки, либо с помощью SDS-PAGE. С другой стороны, выпавший в осадок тубулин может быть в виде агрегатов. Более сложные методы, такие как просвечивающая электронная микроскопия, должны быть включены для подтверждения наличия волокон микротрубочек для контроля качества.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Исследование проводилось при поддержке Технологического агентства Чешской Республики (проект nr. TN02000017 - Национальный центр биотехнологии в ветеринарной медицине - NaCeBiVet).
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | --- | --- | Common material |
| 10 mL tubes | --- | --- | Common material |
| 50 mL tubes | --- | --- | Common material |
| ATP | ROTH | HN35.2 | Analytical grade |
| DMSO | ROTH | A994.2 | Analytical grade |
| Dounce glass homogenizer | P-LAB | H244043 | Homogenizer |
| DTT | ROTH | 6908.1 | Analytical grade |
| EGTA | ROTH | 3054.3 | Analytical grade |
| Ethanol | PENTA | 70390-11001 | Analytical grade |
| Glycerol | ROTH | 6967.2 | Analytical grade |
| Graduated beakers | --- | --- | Common equipment |
| Graduated cilinders | --- | --- | Common equipment |
| GTP | MERCK | 36051-31-7 | Very high quality |
| HCl | PENTA | 19360-11000 | Analytical grade |
| Izolated box for tissue transport | --- | --- | Common equipment |
| Kitchen blender | Waring | 7011HB | Glass or plastic vessel |
| Liquid nitrogen | --- | --- | Common material |
| MES | ROTH | 6066.4 | Analytical grade |
| MgCl2 | MERCK | 814733 | Analytical grade |
| MgSO4 | PENTA | 43180-31000 | Analytical grade |
| NaOH | PENTA | 15650-11000 | Analytical grade |
| Optima XPN100 | Beckman Coulter | A94469 | Ultracentrifuge |
| Phosphocellulose column | VWR | GENO786-1291 | Empty column |
| Phosphocellulose resin | Creative - Biomart, inc | Phosphate-001C | Ion exchange resin |
| PIPES | ROTH | 9156.2 | Analytical grade |
| Saccharose | PENTA | 24970-31000 | Analytical grade |
| Scales | --- | --- | Common equipment |
| Scissors | --- | --- | Common equipment |
| Spoons | --- | --- | Plastic or glass |
| Ti45 rotor | Beckman Coulter | 339160 | Rotor for Ultracentrifuge |
| Tweezers | --- | --- | Common equipment |
| Ultra turrax IKA T18 basic | IKA | 356 1000 | Laboratory dispenser |
| Water bath 37 °C | --- | --- | Stirred |
Ссылки
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Murphy, D. B., Hiebsch, R. R. Purification of microtubule protein from beef brain and comparison of the assembly requirements for neuronal microtubules isolated from beef and hog. Anal Biochem. 96 (1), 225-235 (1979).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann NY Acad Sci. 253, 107-132 (1975).
- Weisenberg, R. C. Microtubule formation in vitro in solutions containing low calcium concentrations. Science. 177 (4054), 1104-1105 (1972).
- Roychowdhury, S., Gaskin, F. Separation of assembly-competent tubulin from brain microtubule protein preparations using a fast-performance liquid chromatography procedure. J Neurochem. 46 (5), 1399-1405 (1986).
- Weingarten, M. D., Suter, M. M., Littman, D. R., Kirschner, M. W. Properties of the depolymerization products of microtubules from mammalian brain. Biochemistry. 13 (27), 5529-5537 (1974).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nat Protoc. 14 (5), 1634-1660 (2019).
- Jacobs, M., Huitorel, P. Tubulin-associated nucleoside diphosphokinase. Eur J Biochem. 99 (3), 613-622 (1979).
- Munguía, B., et al. Purification of native M. vogae and H. contortus tubulin by TOG affinity chromatography. Exp Parasitol. 182, 37-44 (2017).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein ExpPurif. 32 (1), 83-88 (2003).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Lett. 587 (21), 3450-3455 (2013).
- Liu, C., Yao, J., Yin, J., Xue, J., Zhang, H. Recombinant α- and β-tubulin from Echinococcus granulosus: Expression, purification and polymerization. Parasite. 25, 62 (2018).
- Ti, S. -. C., Wieczorek, M., Kapoor, T. M. Purification of affinity tag-free recombinant tubulin from insect cells. STAR protoc. 1 (1), 100011 (2020).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled post-translational modifications and isotypes from limited sources by polymerization-depolymerization cycles. JVisExp. (165), e61826 (2020).
- Sackett, D. L., Werbovetz, K. A., Morrissette, N. S. Isolating tubulin from nonneural sources. Methods Cell Biol. 95, 17-32 (2010).
- Modig, C., Strömberg, E., Wallin, M. Different stability of posttranslationally modified brain microtubules isolated from cold-temperate fish. Mol Cell Biochem. 130 (2), 137-147 (1994).
- Fourest-Lieuvin, A. Purification of tubulin from limited volumes of cultured cells. Protein Exp Purif. 45 (1), 183-190 (2006).
- MacRae, T. H., Gull, K. Purification and assembly in vitro of tubulin from Trypanosoma brucei. Biochem J. 265 (1), 87-93 (1990).
- Jansen, S., et al. Quantitative mapping of microtubule-associated protein 2c (MAP2c) phosphorylation and regulatory protein 14-3-3ζ-binding sites reveals key differences between MAP2c and its homolog Tau. JBiol Chem. 292 (24), 3-3 (2017).
- Melková, K., et al. Structure and functions of microtubule associated proteins Tau and MAP2c: Similarities and differences. Biomolecules. 9 (3), E105 (2019).
- Herzog, W., Weber, K. Fractionation of brain microtubule-associated proteins: Isolation of two different proteins which stimulate tubulin polymerization in vitro. Eur J Biochem. 92 (1), 1-8 (1978).
- Castle, A. G., Crawford, N. Isolation of tubulin from pig platelets. FEBS Lett. 51 (1), 195-200 (1975).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. Int J Mol Sci. 18 (10), E2207 (2017).
- Lafanechère, L., Job, D. The third tubulin pool. Neurochem Res. 25 (1), 11-18 (2000).
- Arai, T., Ihara, Y., Arai, K., Kaziro, Y. Purification of tubulin from bovine brain and its interaction with guanine nucleotides. J Biochem. 77 (3), 647-658 (1975).
- Mahaddalkar, T., et al. Structural investigations into the binding mode of a novel noscapine analogue, 9-(4-vinylphenyl) noscapine, with tubulin by biochemical analyses and molecular dynamic simulations. J Biomol Struct Dyn. 35 (11), 2475-2484 (2017).
- Chen, H., et al. Structure-activity relationship study of novel 6-Aryl-2-benzoyl-pyridines as tubulin polymerization inhibitors with potent antiproliferative properties. J Med Chem. 63 (2), 827-846 (2020).
- Yao, D., et al. Ferulin C triggers potent PAK1 and p21-mediated anti-tumor effects in breast cancer by inhibiting Tubulin polymerization in vitro and in vivo. Pharmacol Res. 152, 104605 (2020).
- Sweetnam, P. M., et al. The role of receptor binding in drug discovery. JNat Prod. 56 (4), 441-455 (1993).
- Qi, Z. -. Y., et al. Synthesis and biological evaluation of 1-(benzofuran-3-yl)-4-(3,4,5-trimethoxyphenyl)-1H-1,2,3-triazole derivatives as tubulin polymerization inhibitors. Bioorg Chem. 94, 103392 (2020).
- Sáez-Calvo, G., et al. Triazolopyrimidines are microtubule-stabilizing agents that bind the vinca inhibitor site of tubulin. Cell Chem Bio. 24 (6), 737-750 (2017).
- Bellocq, C., et al. Purification of assembly-competent tubulin from Saccharomyces cerevisiae. EurJ Biochem. 210 (1), 343-349 (1992).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены