Method Article
돼지 뇌 조직에서 Tubulin 수율 최적화
요약
이 프로토콜은 소규모 기기에 최적화된 돼지 뇌에서 튜불린을 고수율로 분리하는 기술을 설명합니다. 분리 절차는 동시 침강 분석 및 투과 전자 현미경을 사용하여 시험관에서 튜불 린 중합 활성을 측정하는 절차로 보완됩니다.
초록
모든 출처의 신경 조직은 뉴런의 수상돌기와 축삭돌기에 미세소관이 풍부하기 때문에 튜불린 분리를 위한 훌륭한 재료입니다. 여기에서는 여러 소스에서 신경 조직에 대해 약간의 수정으로 사용할 수 있는 튜불린을 추출하는 절차를 제시합니다. 제시된 프로토콜에서, 조처리 용해물의 새로운 정화 단계가 도입되었으며, 이는 첫 번째 중합 단계가 발생하기 전에 불용성 파편의 초기 양을 크게 감소시켰습니다. 이 추가 단계를 통해 동일한 기기를 사용하면서 추가 조직을 처리할 수 있었고, 따라서 처리된 균질액의 상대적 부피를 증가시킬 수 있었습니다. 새로 도입된 단계는 체외 활성 분석 및 투과 전자 현미경에 의해 확인된 바와 같이 정제된 튜불린의 품질에 큰 영향을 미치지 않습니다. 설명된 절차에는 조직 수집, 수송, 조직 균질화, 튜불린 분리 주기, FPLC를 사용한 이온 교환 크로마토그래피 및 후속 활성 측정 분석을 통한 최종 연마를 포함한 모든 중요한 단계가 포함되어 있습니다. 정제된 튜불린의 균질성은 97% 이상이었으며, 이는 전기분무 이온화 및 MALDI-TOF를 활용한 MS/MS 분석으로 확인되었습니다.
서문
알파 및 베타-튜불린 이종체에 의해 형성된 중공 단백질 필라멘트(직경 24nm)인 미세소관은 다양한 필수 세포 과정에 관여합니다. 이들은 세포내 구조 형성, 운동성, 세포 분열, 세포 분화, 세포 수송, 형태 유지 및 분비에 관여합니다1. 미세소관의 세포 기능은 미세소관 관련 단백질(MAP) 및 기타 단백질과의 직간접적인 상호 작용 또는 튜불린 코드2에 정의된 복잡한 번역 후 변형을 통해 영향을 받을 수 있습니다.
튜불린 섬유(Tubulin fibers)는 핵형성-신장 메커니즘(nucleation-elongation mechanism)에서 알파(alpha)와 베타(beta) 소단위(subunit) 사이의 역동적인 비공유 상호작용(non-covalent interaction)에서 발생합니다. 짧은 미세소관이 형성되고, 튜불린 섬유의 후속 성장은 양쪽 끝에서 가역적 신장에 의해 달성되어 평행한 프로토필라멘트2로 배열된 튜불린 이종체로 구성된 실린더를 형성합니다. 동적 불안정성은 조립된 미세소관이 종종 소단위체와 평형을 이루지 못하지만 정상 상태 1,2를 유지하면서 장기간 성장과 수축 사이의 상전이를 겪을 수 있다는 사실을 나타냅니다.
튜불린 섬유의 동적 불안정성은 주로 고순도 글리세롤, DMSO, GTP/ATP, Mg2+ 또는 기타 화학 약품(예: 탁솔 또는 폴리양이온)3의 환경에서 고온 중합 및 저온 해중합 사이클을 사용하는 많은 튜불린 분리 및 정제 절차에서 사용됩니다. 대부분의 분리 절차4 후에는 단백질 크로마토그래피 5,6,7,8,9가 뒤따르며, 이는 뉴클레오시드 디포스포키나아제 및 ATPase 활성5을 가진 튜불린 관련 단백질의 분리를 보장합니다. 고염 완충액(10)을 이용함으로써 유사한 결과를 얻을 수 있다. 신경 11,12,13,14 및 비신경15 조직, 어류(16)(담수 및 해양 모두), 효모 또는 다른 생산 균주(11,12,13,14)에서 과 발현되는 재조합 변이체(17) 및 기타 공급원(9,18)을 포함한 여러 공급원이 분획에 사용되었고, 정화.
제시된 프로토콜은 침전 및 단백질 크로마토그래피를 활용하여 돼지 뇌에서 튜불린을 높은 균질성으로 분리합니다(그림 1). 주요 장점은 일상적인 분자 생물학 실험을 위해 장비를 갖춘 실험실에서 사용할 수 있는 기기를 사용하여 상대적으로 높은 수율을 얻을 수 있다는 것입니다.
프로토콜
모든 용액과 기기의 구성은 재료 표에 설명되어 있습니다. 모든 용액은 FPLC 등급 화학 물질을 사용하여 준비되었으며 사용 전에 0.22μm 필터를 통해 여과되었습니다. 실험실 가운, 장갑 및 보안경과 같은 개인 보호 장비가 모든 작업 중에 사용되었습니다. 모든 기기는 깨끗하고 세제의 흔적이 없었습니다. 절차 중에 적절한 동물 관리 지침(기관에서 승인한 대로)을 따랐습니다. 뇌 조직을 포함한 모든 생물학적 물질은 도축장에서 원료로 구입했습니다. 프로토콜의 어떤 단계에서도 살아있는 동물이 사용되지 않았습니다.
1. 빠른 단백질 액체 크로마토그래피를 위한 포스포-셀룰로오스 컬럼의 활성화
- 건조 포스포-셀룰로오스 수지 700g에 50% 에탄올 15mL를 넣고 숟가락으로 비커에 부드럽게 섞습니다.
- 현탁액을 적절한 용량(700mL)의 적절한 크로마토그래피 컬럼에 붓습니다. 프릿이 장착 된 피스톤으로 컬럼을 닫으십시오. 빈 헤드 공간의 최소 10%를 남겨 두십시오.
참고: 다른 vessel을 사용할 수 있지만 FPLC 컬럼을 연동 펌프와 함께 사용하면 수지 활성화 및 수지 손실에 필요한 시간을 크게 줄일 수 있습니다. - 60rpm의 로커 셰이커에서 30분 동안 배양합니다.
- 수지를 가라앉히고 유량을 3mL/min으로 설정한 상태에서 연동 펌프를 사용하여 50% 에탄올을 초과하여 제거합니다. 수지가 마르지 않도록 하십시오.
- 상단 피스톤을 제거하고 50% 에탄올 300mL를 추가합니다. 컬럼을 닫고 잠시 흔든 다음 연동 펌프를 통해 과도한 에탄올을 제거합니다.
- 남아 있는 에탄올을 제거합니다. 초순수 300mL를 컬럼에 넣고 피스톤으로 컬럼을 닫은 다음 수지가 다시 부유될 때까지 기울입니다. 연동 펌프를 사용하여 과도한 액체를 제거하십시오. 이 단계를 세 번 반복합니다.
- 상단의 컬럼을 열고 500mL의 0.5M HCl을 첨가한 다음 컬럼을 닫고 부드럽게 기울여 수지를 재현탁합니다. 60rpm의 로커 셰이커에서 30분 동안 배양합니다.
- 연동 펌프를 사용하여 과도한 액체를 제거하십시오. 300mL의 0.5M HCl을 첨가하고 수지를 재현탁시키고 여분의 액체를 제거합니다.
- 남아 있는 HCl을 제거합니다. 초순수 300mL를 컬럼에 넣고 피스톤으로 컬럼을 닫은 다음 수지가 재현탁될 때까지 기울입니다. 연동 펌프를 사용하여 과도한 액체를 제거하십시오. 이 단계를 세 번 반복합니다.
- 700mL의 MES 완충액(25mM MES, 0.1mM EGTA, 0.5mM MgCl2)을 컬럼에 붓고 틸팅하여 수지를 재현탁시킵니다. 현탁액을 비커에 붓고 1M NaOH로 pH를 6.1로 조정한 다음 부드러운 교반하에 2시간 동안 배양합니다.
- 수지를 가라앉히고 액체를 디캔팅한 다음 300mL의 MES 완충액(pH 6.4)을 넣고 4°C에서 밤새 배양합니다.
- 여분의 액체를 디캔팅하고 96% 에탄올을 최종 농도 20%에 첨가하고 사용할 때까지 4°C에서 보관합니다.
2. 인-셀룰로오스 컬럼 패킹
- 12mL의 활성 레진을 닫은 하단 플러그가 있는 깨끗한 크로마토그래피 컬럼에 붓습니다. 수지를 가라앉히십시오. 침전된 수지의 부피는 약 5mL입니다. 더 가벼운 깨진 매트릭스 조각이 침전될 수 있는 수지 상부층(약 2-3mm)을 제거합니다.
- 하단 플러그를 제거하고 저장 용액이 한 방울 한 방울 자유롭게 배수되도록 합니다. 수지가 마르지 않도록 하십시오.
- 컬럼을 닫고 FPLC 시스템에 연결합니다. PEM 완충액(100mM PIPES pH 6.9, 1mM EGTA, 1mM MgSO4)으로 1mL/min(최대 압력 1bar)으로 30분 동안 컬럼을 세척하고 피스톤 높이를 조정하고 컬럼을 거꾸로 뒤집어 역류로 다음 30분 동안 동일한 조건에서 컬럼을 세척합니다.
- 활성 포스포-셀룰로오스로 채워진 컬럼을 4°C에서 며칠 동안 보관합니다.
3. 튜불린 분리 및 정제
참고: Tubulin은 분해되기 쉬우므로 신속하게 진행하는 것이 중요합니다. 모든 용액, 기기 및 장비는 필요한 경우 미리 준비하거나 냉각하거나 가열해야 합니다. 이 절차는 권장 온도의 변화에 민감합니다. 뇌 조직은 정제 과정에서 생성되는 생물학적 폐기물의 양을 고려하여 절개 후 가능한 한 빨리 처리해야 합니다. 이 절차는 6개의 75mL 초원심분리 큐벳이 있는 로터에 최적화되었습니다. 처리된 조직의 양은 사용 가능한 초원심분리기에 따라 증가하거나 감소할 수 있습니다.
- 조직 수송
- 갓 해부한 돼지 뇌 500g(6-8개)을 3L 운반 용기에 넣고 얼음처럼 차가운 수송 완충액(4.1mM MES pH 7, 320mM 사카로스, 1mM EGTA)을 완전히 잠길 때까지 붓습니다. 얼음 위에 5분 동안 두었다가 열 발산을 용이하게 하기 위해 운송 버퍼를 새 것으로 교체하십시오. 추가 처리를 위해 얼음 위에 신속하게 운반하십시오.
- 조직 균질화
참고: 조직 균질화는 추운 방에서 얼음 위에서 수행됩니다. 모든 기기는 자연 중합을 방지하기 위해 사전 냉각해야 합니다. 튜불린의 주요 공급원은 회백질이며 나머지는 다음 단계에서 제거됩니다.- 추출 완충액 100mL(4.1mM MES pH 7, 520mM Saccharose, 1mM EGTA, 1mM ATP 및 0.1mM GTP)를 1L 플라스틱 비커에 붓고 용기를 포함한 중량 W1(g)을 측정합니다. ATP와 GTP는 사용 직전에 추가됩니다.
- 수송 용기에서 돼지의 뇌를 꺼내고 적당한 힘을 가하여 소뇌 전체, 지방, 큰 백질 덩어리, 수막, 혈관 등을 손가락으로 제거합니다. 가위나 핀셋도 사용할 수 있습니다. 원치 않는 조직이 줄무늬가 있는 돼지 뇌를 100mL의 저온 추출 완충액이 있는 비커에 넣습니다. 모든 조직이 처리될 때까지 계속 진행합니다.
- 가공된 뇌 조직으로 비커의 무게를 측정하고 W2(g) 무게를 측정합니다.
- 추출 완충액 중량 = W2 - W1 공식에 따라 추출 완충액을 추가합니다(예: 조직 400g의 경우 추가 추출 완충액 300g이 추가됨).
- 추출 완충액이 있는 뇌 조직을 미리 냉각된 주방 믹서기로 옮기고 4-8개의 짧은 3초 펄스로 처리합니다.
- 고속 분산 균질화기(18,000rpm)로 부분적으로 균질화된 조직을 1분 동안 처리합니다. 서스펜션을 얼음 위에 3-5분 동안 그대로 두고 가끔 숟가락으로 섞습니다. 5회 또는 완전히 균질화될 때까지 반복합니다.
- 사전 냉각된 초원심분리 튜브에 붓고 4°C 및 50,000 x g에서 10분 동안 회전합니다. 상층액을 유지하고 펠릿을 버리십시오. 430mL의 정제 추출물이 수집될 때까지 반복합니다.
- 정제된 추출물을 사전 냉각된 초원심분리 튜브(각 70mL)에 붓고 4°C 및 75,000 x g 에서 60분 동안 회전합니다. 상층액을 수집하고 부피 S1을 결정하십시오.
알림: 로터가 하나만 있는 경우 다음 원심분리 단계(37°C)를 위해 따뜻한 수조에서 가열하십시오.
- 첫 번째 중합 반응
- 공식 V = S1/9mL에 따라 10x MEM 완충액(1M MES pH 6.8, 10mM EGTA, 10mM MgCl2)을 추가합니다(585mL의 상층액의 경우 65mL의 10x MEM 완충액 추가). 잘 섞고 글리세롤을 3.5M에 첨가하고 GTP를 0.1mM 최종 농도에 첨가합니다. 현탁액을 초원심분리 튜브에 붓습니다(상층액의 부피가 튜브의 부피를 초과하고 나머지는 폐기됨).
- 상층액이 있는 튜브를 37°C에서 45분 동안 수조에서 배양합니다.
- 37 °C 및 75,000 x g에서 90분 동안 튜브를 회전합니다. 상층액(S2)의 부피를 측정하여 MEM 완충액의 부피를 측정하고, 3.3.4단계에서 펠릿에 추가한 다음 상층액을 폐기합니다. 중합된 튜불린이 들어 있는 펠릿을 보관하십시오.
- 0.5 x S2 부피의 얼음처럼 차가운 1x MEM 버퍼를 준비합니다. 펠릿과 함께 각 초원심분리기 튜브에 동일한 양의 1x MEM 버퍼를 추가합니다. 추가된 1x MEM 버퍼에 펠릿을 재현탁하고, 현탁액을 눈금이 매겨진 실린더로 옮기고, 총 부피를 결정합니다.
- GTP를 1mM 최종 농도에 첨가합니다. 현탁액을 Dounce 유리 균질화기로 옮기고 얼음 위에서 10분 동안 45분 동안 약 45분마다 용액을 균질화합니다. 피스톤은 쉽게 파손될 수 있으므로 조심스럽게 작동해야 합니다.
알림: 그 동안 로터를 얼음과 함께 물에 식히십시오.
- GTP를 1mM 최종 농도에 첨가합니다. 현탁액을 Dounce 유리 균질화기로 옮기고 얼음 위에서 10분 동안 45분 동안 약 45분마다 용액을 균질화합니다. 피스톤은 쉽게 파손될 수 있으므로 조심스럽게 작동해야 합니다.
- 균질화된 용액을 사전 냉각된 초원심분리 튜브에 붓고 75,000 x g 및 4°C에서 60분 동안 회전합니다. 원심분리 후 상층액 부피(S3)를 결정합니다.
- 두 번째 중합
- 상층액을 0.35 x S3 mL의 글리세롤과 혼합하고 GTP를 1mM 최종 농도에 첨가합니다. 상층액을 초원심분리 튜브에 붓고 37°C에서 45분 동안 배양합니다.
알림: 그 동안 수조에서 로터를 37°C로 예열하십시오. - 3.4.1단계에서 중합된 상층액을 75,000 x g 및 37°C에서 60분 동안 원심분리합니다. 상층액(S4)의 부피를 결정한다.
참고: 이 지점은 선택적 중지 지점입니다. 튜불린이 함유된 펠릿은 액체 질소에서 충격 냉동하고 -80°C에서 보관할 수 있습니다. - 얼어 붙은 펠릿을 얼음에서 30 분 동안 천천히 해동시킵니다. 0.25 x S4 mL의 PIPES 완충액 (500 mM PIPES pH 6.9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0.1 mM ATP)을 준비하고, 펠릿이 있는 튜브로 균등하게 나누고, 숟가락으로 펠릿을 재현탁하고, 용액을 Dounce 유리 균질화기로 옮깁니다. 얼음에서 10분마다 45분 동안 균질화합니다.
알림: 그 동안 로터를 얼음과 함께 물에 식히십시오. - 해중합된 튜불린이 포함된 용액을 초원심분리 튜브에 붓고 4°C 및 75,000 x g에서 60분 동안 회전시킵니다.
- 상층액을 0.35 x S3 mL의 글리세롤과 혼합하고 GTP를 1mM 최종 농도에 첨가합니다. 상층액을 초원심분리 튜브에 붓고 37°C에서 45분 동안 배양합니다.
- 3차 중합
- 상층액(S5)의 부피를 측정하고 S5/9mL의 DMSO를 추가합니다. 현탁액을 초원심분리 튜브에 붓고 37°C에서 20분 동안 배양하여 중합합니다.
알림: 그 동안 수조에서 로터를 30°C로 예열하십시오. - 중합된 튜불린을 75,000 x g 및 30°C에서 60분 동안 원심분리합니다. 상층액(S6)의 부피를 측정하고 펠릿을 보관합니다.
- 펠릿을 0.25 x S6 mL의 PEM 완충액(100 mM PIPES pH 6.9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0.1 mM ATP)에 용해시킵니다. Dounce 유리 균질화기를 사용하여 용해화를 향상시킵니다. 펠릿이 완전히 용해될 때까지 PEM 버퍼를 계속 추가합니다(더 이상 유백색 입자가 보이지 않음).
- 상층액(S5)의 부피를 측정하고 S5/9mL의 DMSO를 추가합니다. 현탁액을 초원심분리 튜브에 붓고 37°C에서 20분 동안 배양하여 중합합니다.
- 이온 교환 크로마토그래피 정제
참고: 역이온 교환 크로마토그래피는 미세튜불린 관련 단백질을 제거하는 데 사용됩니다. 튜불린은 주어진 pH에서 컬럼을 통해 자유롭게 흐르고 오염 단백질은 포스포-셀룰로오스 수지에 유지됩니다. 모든 단계는 4°C에 가까운 온도 또는 얼음 위에서 수행됩니다. 여과 또는 원심분리로 FPLC 정제 전에 튜불린 추출물을 명확히 하지 마십시오. - FPLC 및 컬럼을 PEM 완충액(100mM PIPES pH 6.9, 1mM EGTA, 1mM MgSO4, 1mM DTT, 0.1mM ATP)으로 평형화합니다. 평형을 위해 최소 10개의 컬럼 부피를 사용합니다. 펌프 유량은 컬럼 패킹에 사용되는 유량(1mL/분)을 초과해서는 안 됩니다.
- 튜불린 현탁액을 컬럼에 천천히(0.5mL/분) 로드하고 수지를 통해 흐르는 결합되지 않은 단백질을 수집합니다.
- 튜불린 단백질을 포함하는 각 1mL 분획에 10μL의 100mM GTP를 추가합니다.
- 튜불린을 함유한 분획을 액체 질소에 얼린 후 즉시 액체 질소와 함께 용기에 옮깁니다. 튜불린은 이러한 조건에서 몇 년 동안 보관할 수 있습니다. 튜불린이 -80 °C에서 보관되면 안정성이 수개월에 걸쳐 급격히 감소합니다.
결과
분리 및 정제 단계에서 SDS-PAGE 전기영동을 위한 샘플을 채취한 후 Coomassie-blue 염색을 사용하여 분석했습니다(그림 2). 각 샘플의 20 μL를 10 μL의 Laemmli 샘플 버퍼 (188 mM Tris-HCl pH 6.8, 3 % SDS (w / w), 30 % 글리세롤 (v / v), 0.01 브로 모페놀 블루 (w / w), 15 % β- 메르 캅토 에탄올)과 혼합하고 95 °C에서 15 분 동안 배양했습니다. 각 샘플의 4 μL를 12.5 % 아크릴 아미드 SDS 겔에로드하고 환원 및 변성 조건에서 겔 당 30mA의 정전류로 분리했습니다.
그 결과, 오염 단백질의 감소와 함께 상대적인 튜불린 농도의 점진적인 증가가 확인되었습니다. 더욱이, 이 단계를 생략한 것에 비해 첫 번째 원심분리(단계 3.2.7)에서 정제된 용해물에서 튜불린의 유의미한 손실이 없었습니다(그림 2A,B).
단백질 농도는 BCA 분석, Bradford 단백질 분석 및 SDS-PAGE 겔 밀도 측정 분석의 세 가지 독립적인 방법을 사용하여 측정되었습니다19 (그림 3). 설명된 절차를 사용한 튜불린의 전체 수율은 250g의 신경 조직으로부터 123mg의 정제된 튜불린이었다. 측정하는 동안 저장 버퍼의 높은 DTT 농도가 BCA 분석에 상당한 영향을 미친다는 점을 고려해야 합니다. DTT를 추가하면 PEM 완충액과 PBS 완충액 모두 배경 흡광도가 약 0.900A595 증가하여 BCA 분석의 용량을 크게 줄입니다(그림 3A). DTT의 부정적인 영향은 순수한 물로 10배 희석한 후에도 감지할 수 있습니다(데이터는 표시되지 않음). Bradford 분석은 밀도 측정 분석에 의해 확인된 바와 같이 저장 버퍼(그림 3B)의 영향을 받지 않는 것으로 보입니다.
튜불린 제제의 순도는 두 개의 독립적인 시설(VRI Brno, Czech Republic; CEITEC MU Brno, 체코 공화국)에서 전기분무 이온화 및 MALDI-TOF를 사용합니다. 두 분석 모두 여러 동형에서 돼지 튜불린 알파 및 베타의 존재를 확인했습니다. 전체 순도는 97.07% 이상(PSMs 1065)이었으며, 가장 흔한 불순물은 Homo sapiens Keratin Type II(PSMs 246, 불순물의 2.24%)에서 유래한 것으로, MS/MS 분석을 위한 튜불린 분리 및 시료 준비 중에 유입되었을 가능성이 가장 높습니다. 322개의 PSM과 Sus scrofa 에서 유래한 혈청 알부민, Actin 감마 및 트립시노겐으로 구성된 기타 불순물은 하나의 펩타이드 분해능(0.0069%)으로 확인되었습니다.
후속 실험에서, 스냅 동결 후 중합 용량의 보존을 확인하고 액체 질소에 보관했습니다. 액체 질소에서 10mg/mL 분취액을 제거하고 얼음 위에서 천천히 해동시켰다. 다양한 농도(10mg/mL, 8mg/mL, 6mg/mL, 4mg/mL 및 2mg/mL)의 샘플은 자가 조립 실험을 위해 DTT, ATP 및 GTP를 함유하는 PEM 완충액에 부분 표본을 희석하여 제조했습니다. 한 가지 희석 시리즈는 37°C에서 60분 동안 배양하고, 두 번째 희석 시리즈는 얼음에서 60분 동안 배양했습니다. 두 시리즈 모두 21,000 x g 및 해당 온도(4°C 또는 37°C)에서 60분 동안 원심분리했습니다. 30μL의 상층액을 제거하고 SDS-PAGE에 사용했습니다. 나머지 상층액은 피펫을 사용하여 조심스럽게 제거하고 폐기했습니다. 펠릿을 100μM의 PEM 완충액을 첨가하여 간단히 세척한 후 피펫을 사용하여 즉시 제거했습니다. 이어서, 펠릿을 50 μL의 1x 농축 SDS-로딩 완충액에 재현탁시켜 펠릿 및 상층액의 상대적 농도가 보존되도록 하였다. 10μL의 SDS-로딩 완충액을 각 상층액에 첨가하였다. 모든 샘플은 SDS-PAGE 및 Coomassie 염색을 사용하여 분석되었습니다(그림 4). SDS-PAGE에 로드된 각 샘플의 부피는 시작 농도에 따라 조정되었으므로 농도로 인한 침전량의 차이가 더 분명합니다. PEM 완충액에서 튜불린의 자체 조립 테스트는 온도에 의존하는 방식으로 튜불린 섬유를 형성하는 능력을 확인했습니다.
튜불린이 다른 단백질과 상호 작용하는 능력을 확인하는 MAP2c 구동 튜불린20,21 조립 분석을 수행했습니다22. MAP2c의 연속 희석액은 100 μL의 1 mg/mL 튜불린 분취액을 MAP2c와 혼합하여 0 μM 내지 8 μM 범위의 최종 농도로 제조하였다. 모든 샘플은 1mM DTT 및 1mM GTP로 갓 제조된 PEM 완충액에 희석하여 얼음 위에서 준비했습니다. 튜불린을 서로 다른 농도의 MAP2c로 37°C에서 15분 동안 배양하고, 21,000 x g 및 37°C에서 60분 동안 원심분리하였다. 펠릿의 최종 세척은 100μL의 PEM 완충액으로 2회 수행했습니다. 이 실험은 MAP2c가 없는 샘플만 펠릿을 형성하지 않았기 때문에 제조된 튜불린이 MAP2c 주도 중합을 거칠 수 있는 능력을 확인했습니다(그림 5).
투과 전자 현미경은 공중 합 실험에서 튜불린 필라멘트의 존재를 확인하기 위해 추가로 사용되었습니다. MAP2c로 침전된 정제된 튜불린의 현탁액을 음성 염색을 사용하여 투과 전자 현미경을 위해 준비했습니다. 샘플은 Formvar 코팅된 탄소 안정화 구리 그리드에 흡착되었습니다. 그런 다음 그리드를 2 % NH4MoO4 로 음의 염색하고 18,000 배 배율과 80kV의 가속 전압으로 전자 현미경으로 검사했습니다. 명확한 필라멘트 구조와 적절한 크기를 가진 균질한 미세소관의 존재는 본래의 형태로 미세소관을 형성할 수 있는 능력을 보여주었습니다(그림 6).
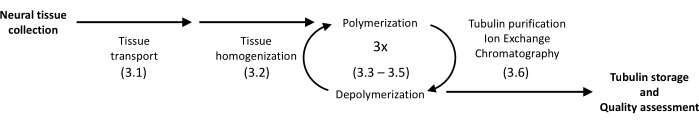
그림 1: 튜불린 분리 및 정제의 개략도. 괄호 안의 숫자는 프로토콜 단계를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
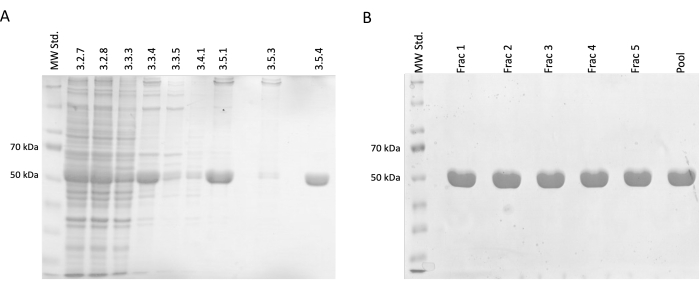
그림 2: 튜불린 분리 및 정제. (A) 온도 기반 중합(라인당 3μL)을 사용하여 튜불린을 분리하는 동안 채취한 샘플의 SDS-PAGE 분석. 상대적인 튜불린 풍부도(약 50kDa)의 안정적인 증가와 함께 불순물의 감소가 눈에 띕니다. 각 줄 위의 숫자는 프로토콜의 단계 번호에 해당합니다. (B) 인산-셀룰로오스 수지(라인당 4μL)에 대한 단백질 크로마토그래피 후 얻은 분획의 SDS-PAGE 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
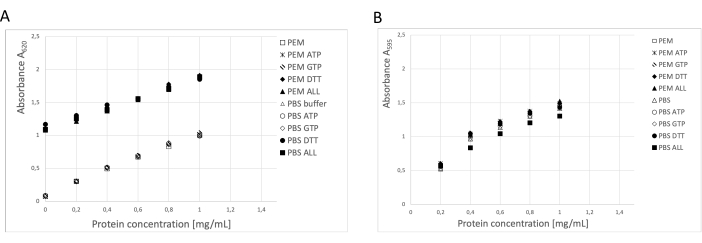
그림 3: 단백질 농도. PEM 완충액 또는 PBS에서 최대 1mg/mL의 소 혈청 알부민 희석 시리즈를 PEM 또는 PBS 완충액에서 0.1 ATP, 1 mM GTP, 1 mM DTT를 개별적으로 또는 조합(0.1 mM ATP, 1 mM GTP, 1 mM DTT)으로 포함하는 BSA 희석 시리즈와 비교하였다. (A) BCA 분석을 사용했을 때 DTT(solid symbols)를 함유한 샘플의 배경에 상당한 변화가 있었습니다. (B) 이 효과는 Bradford 분석에서 농도를 측정했을 때 감지되지 않았습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
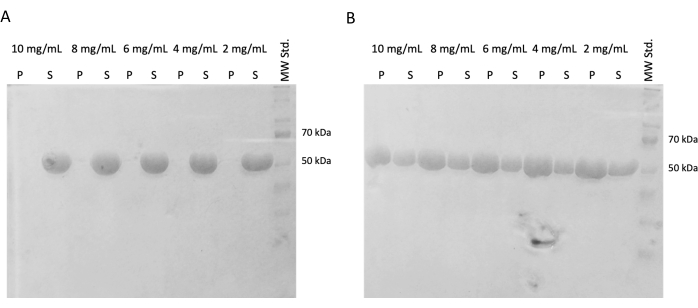
그림 4: Tubulin 자기 조립 분석. 자가 조립 분석의 SDS-PAGE 분석은 (A) 4 °C 또는 (B) 37 °C에서 배양된 저장된 튜불린의 용량이 광범위한 농도 스펙트럼에서 온도 의존적 방식으로 중합될 수 있음을 확인했습니다. (P - 펠릿, S - 상등액, 튜불린의 각 농도는 각 라인 쌍 위에 표시되며, 로드된 각 샘플의 양은 10μg이었다). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
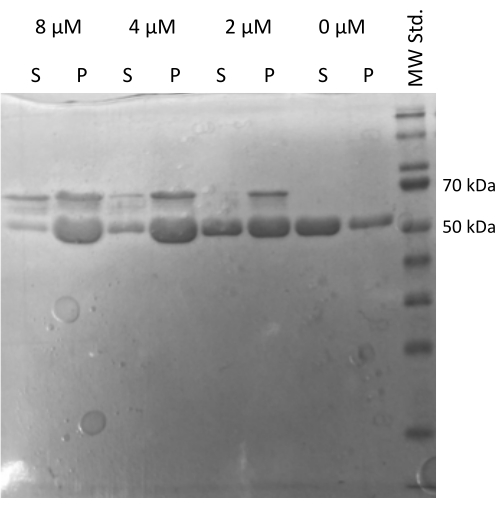
그림 5: Tubulin 동시 침강 분석. MAP2c 보조 튜불린 어셈블리의 SDS-PAGE 분석은 농도 의존적 방식으로 미세소관 관련 단백질과의 상호 작용에 의해 중합을 거칠 수 있는 저장된 튜불린의 용량을 확인했습니다. MAP2c의 몰 농도는 각 라인 위에 표시됩니다. (P - 펠릿, S - 상층액). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
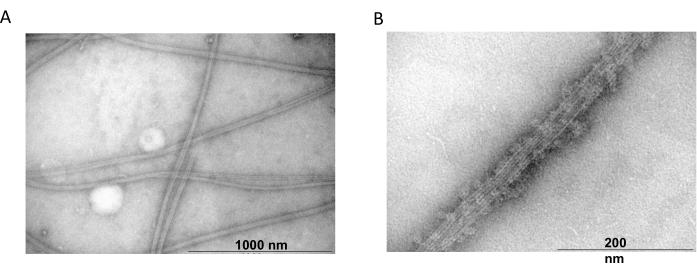
그림 6: 투과 전자 현미경. TEM 현미경 사진은 튜불린이 MAP2c 단백질로 장식된 균질한 튜불린 필라멘트로 구성된 적절한 직경(B)의 미세소관으로 (A)를 조립한다는 것을 보여주었습니다. 막대는 1000nm(A) 및 200nm(B)에 해당합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
모든 소스의 신경 조직은 뉴런의 수상돌기와 축삭돌기에 미세소관(최대 40%)이 풍부하기 때문에 튜불린 분리를 위한 훌륭한 재료입니다23. 뇌 조직은 충분한 양으로 비교적 쉽게 얻을 수 있습니다. 주요 단점은 후속 실험에 영향을 미칠 수 있는 불특정 수준의 번역 후 변형일 수 있습니다(24,25). 그렇지 않으면, 유일한 우려는 특히 따뜻한 조건에서 시작 물질의 급속한 분해입니다. 우리는 운송 전에 열 방출을 향상시키고 가능한 한 빨리 시작되는 처리를 위한 신속한 운송을 향상시키기 위해 여러 가지 전송-버퍼 교환을 사용했습니다. 신선한 조직을 가열을 방해하는 조건에서 절개하고 GTP 및 글리세롤을 함유하는 완충액에서 균질화하여 튜불린26을 더욱 안정화시킵니다.
제시된 프로토콜에서, 조용해물의 정화 단계(단계 3.2.7)가 소개되었다. 첫 번째 중합 전에 장기간 원심분리하는 것은 일반적으로 비가역적 변형 및 프로테아제에 대한 튜불린 민감성 때문에 권장되지 않습니다. 반면에, 본 실험은 높은 G-force에서 짧은 스핀이 파편을 감소시켜 튜불린 품질에 큰 영향을 미치지 않으면서 처리된 균질액의 상대적 부피를 증가시킨다는 것을 보여주었습니다.
정확한 단백질 농도 측정은 주로 튜불린 결합 단백질 또는 억제제와의 상호 작용을 연구할 때 추가 실험에 필수적입니다. 조사 과정에서 단백질 농도 분석 결과에서 상당한 차이가 발생했습니다. 주된 이유는 DTT, GTP 및 ATP가 고농도로 존재하여 분석을 방해했기 때문입니다. BCA 분석은 저장 버퍼에 DTT의 양이 많아 분석 용량이 감소했기 때문에 상한으로 이동되었습니다. 더욱이, 단백질과 ATP 또는 GTP의 유사한 흡광도 최대값은 280nm에서 흡광도를 사용하여 단백질 농도 측정에서 불일치를 일으켰습니다. FPLC UV 검출기의 판독값에서도 동일한 문제가 두드러졌습니다. 안정적인 결과를 제공하는 가장 신뢰할 수 있는 분석법은 Bradford 단백질 분석법으로, 완충 화합물의 영향이 관찰되지 않았습니다. 그럼에도 불구하고, 저장 버퍼에서 단백질 표준 희석 시리즈를 준비하는 것이 필수적입니다.
정제된 튜불린이 적절한 배열을 생성하는 능력은 후속 실험의 전제 조건입니다. 튜불린은 본질적으로 글리세롤-GTP가 풍부한 환경에서도 분해되기 쉬우므로 균질한 필라멘트를 형성하는 능력이 감소합니다. 정제 과정을 따르고 저장된 튜불린이 안정적인 일반 필라멘트로 중합되는 능력을 실험적으로 검증하는 것이 중요합니다. 튜불린 상태를 확인하는 몇 가지 독립적인 방법이 in vivo 및 in vitro에서 도입되었습니다. 그 중 가장 두드러진 것은 원형 이색성 분광법27, 표면 플라즈몬 공명 분석28, 열 이동 분석29, 중합 억제 분석30, 면역 형광 염색31,32, 코퍼렉티페이션22,33 및 투과 전자 현미경 분석32 를 언급 할 수 있습니다. 이 프로토콜에 사용된 튜불린의 중합 분석 및 코침전은 수행하기 쉽습니다. 튜브 바닥에서 발생하는 펠릿 또는 SDS-PAGE를 사용하여 신속하게 평가할 수 있습니다. 반면에, 침전된 튜불린은 응집체 형태일 수 있습니다. 품질 관리를 위해 미세소관 섬유의 존재를 확인하기 위해 투과 전자 현미경과 같은 보다 정교한 방법을 포함해야 합니다.
공개
저자는 밝힐 것이 없습니다.
감사의 말
이 연구는 체코 공화국 기술청(Technology Agency of the Czech Republic, project nr. TN02000017 - 국립 수의학 생명 공학 센터 - NaCeBiVet).
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | --- | --- | Common material |
| 10 mL tubes | --- | --- | Common material |
| 50 mL tubes | --- | --- | Common material |
| ATP | ROTH | HN35.2 | Analytical grade |
| DMSO | ROTH | A994.2 | Analytical grade |
| Dounce glass homogenizer | P-LAB | H244043 | Homogenizer |
| DTT | ROTH | 6908.1 | Analytical grade |
| EGTA | ROTH | 3054.3 | Analytical grade |
| Ethanol | PENTA | 70390-11001 | Analytical grade |
| Glycerol | ROTH | 6967.2 | Analytical grade |
| Graduated beakers | --- | --- | Common equipment |
| Graduated cilinders | --- | --- | Common equipment |
| GTP | MERCK | 36051-31-7 | Very high quality |
| HCl | PENTA | 19360-11000 | Analytical grade |
| Izolated box for tissue transport | --- | --- | Common equipment |
| Kitchen blender | Waring | 7011HB | Glass or plastic vessel |
| Liquid nitrogen | --- | --- | Common material |
| MES | ROTH | 6066.4 | Analytical grade |
| MgCl2 | MERCK | 814733 | Analytical grade |
| MgSO4 | PENTA | 43180-31000 | Analytical grade |
| NaOH | PENTA | 15650-11000 | Analytical grade |
| Optima XPN100 | Beckman Coulter | A94469 | Ultracentrifuge |
| Phosphocellulose column | VWR | GENO786-1291 | Empty column |
| Phosphocellulose resin | Creative - Biomart, inc | Phosphate-001C | Ion exchange resin |
| PIPES | ROTH | 9156.2 | Analytical grade |
| Saccharose | PENTA | 24970-31000 | Analytical grade |
| Scales | --- | --- | Common equipment |
| Scissors | --- | --- | Common equipment |
| Spoons | --- | --- | Plastic or glass |
| Ti45 rotor | Beckman Coulter | 339160 | Rotor for Ultracentrifuge |
| Tweezers | --- | --- | Common equipment |
| Ultra turrax IKA T18 basic | IKA | 356 1000 | Laboratory dispenser |
| Water bath 37 °C | --- | --- | Stirred |
참고문헌
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Murphy, D. B., Hiebsch, R. R. Purification of microtubule protein from beef brain and comparison of the assembly requirements for neuronal microtubules isolated from beef and hog. Anal Biochem. 96 (1), 225-235 (1979).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann NY Acad Sci. 253, 107-132 (1975).
- Weisenberg, R. C. Microtubule formation in vitro in solutions containing low calcium concentrations. Science. 177 (4054), 1104-1105 (1972).
- Roychowdhury, S., Gaskin, F. Separation of assembly-competent tubulin from brain microtubule protein preparations using a fast-performance liquid chromatography procedure. J Neurochem. 46 (5), 1399-1405 (1986).
- Weingarten, M. D., Suter, M. M., Littman, D. R., Kirschner, M. W. Properties of the depolymerization products of microtubules from mammalian brain. Biochemistry. 13 (27), 5529-5537 (1974).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nat Protoc. 14 (5), 1634-1660 (2019).
- Jacobs, M., Huitorel, P. Tubulin-associated nucleoside diphosphokinase. Eur J Biochem. 99 (3), 613-622 (1979).
- Munguía, B., et al. Purification of native M. vogae and H. contortus tubulin by TOG affinity chromatography. Exp Parasitol. 182, 37-44 (2017).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein ExpPurif. 32 (1), 83-88 (2003).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Lett. 587 (21), 3450-3455 (2013).
- Liu, C., Yao, J., Yin, J., Xue, J., Zhang, H. Recombinant α- and β-tubulin from Echinococcus granulosus: Expression, purification and polymerization. Parasite. 25, 62 (2018).
- Ti, S. -. C., Wieczorek, M., Kapoor, T. M. Purification of affinity tag-free recombinant tubulin from insect cells. STAR protoc. 1 (1), 100011 (2020).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled post-translational modifications and isotypes from limited sources by polymerization-depolymerization cycles. JVisExp. (165), e61826 (2020).
- Sackett, D. L., Werbovetz, K. A., Morrissette, N. S. Isolating tubulin from nonneural sources. Methods Cell Biol. 95, 17-32 (2010).
- Modig, C., Strömberg, E., Wallin, M. Different stability of posttranslationally modified brain microtubules isolated from cold-temperate fish. Mol Cell Biochem. 130 (2), 137-147 (1994).
- Fourest-Lieuvin, A. Purification of tubulin from limited volumes of cultured cells. Protein Exp Purif. 45 (1), 183-190 (2006).
- MacRae, T. H., Gull, K. Purification and assembly in vitro of tubulin from Trypanosoma brucei. Biochem J. 265 (1), 87-93 (1990).
- Jansen, S., et al. Quantitative mapping of microtubule-associated protein 2c (MAP2c) phosphorylation and regulatory protein 14-3-3ζ-binding sites reveals key differences between MAP2c and its homolog Tau. JBiol Chem. 292 (24), 3-3 (2017).
- Melková, K., et al. Structure and functions of microtubule associated proteins Tau and MAP2c: Similarities and differences. Biomolecules. 9 (3), E105 (2019).
- Herzog, W., Weber, K. Fractionation of brain microtubule-associated proteins: Isolation of two different proteins which stimulate tubulin polymerization in vitro. Eur J Biochem. 92 (1), 1-8 (1978).
- Castle, A. G., Crawford, N. Isolation of tubulin from pig platelets. FEBS Lett. 51 (1), 195-200 (1975).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. Int J Mol Sci. 18 (10), E2207 (2017).
- Lafanechère, L., Job, D. The third tubulin pool. Neurochem Res. 25 (1), 11-18 (2000).
- Arai, T., Ihara, Y., Arai, K., Kaziro, Y. Purification of tubulin from bovine brain and its interaction with guanine nucleotides. J Biochem. 77 (3), 647-658 (1975).
- Mahaddalkar, T., et al. Structural investigations into the binding mode of a novel noscapine analogue, 9-(4-vinylphenyl) noscapine, with tubulin by biochemical analyses and molecular dynamic simulations. J Biomol Struct Dyn. 35 (11), 2475-2484 (2017).
- Chen, H., et al. Structure-activity relationship study of novel 6-Aryl-2-benzoyl-pyridines as tubulin polymerization inhibitors with potent antiproliferative properties. J Med Chem. 63 (2), 827-846 (2020).
- Yao, D., et al. Ferulin C triggers potent PAK1 and p21-mediated anti-tumor effects in breast cancer by inhibiting Tubulin polymerization in vitro and in vivo. Pharmacol Res. 152, 104605 (2020).
- Sweetnam, P. M., et al. The role of receptor binding in drug discovery. JNat Prod. 56 (4), 441-455 (1993).
- Qi, Z. -. Y., et al. Synthesis and biological evaluation of 1-(benzofuran-3-yl)-4-(3,4,5-trimethoxyphenyl)-1H-1,2,3-triazole derivatives as tubulin polymerization inhibitors. Bioorg Chem. 94, 103392 (2020).
- Sáez-Calvo, G., et al. Triazolopyrimidines are microtubule-stabilizing agents that bind the vinca inhibitor site of tubulin. Cell Chem Bio. 24 (6), 737-750 (2017).
- Bellocq, C., et al. Purification of assembly-competent tubulin from Saccharomyces cerevisiae. EurJ Biochem. 210 (1), 343-349 (1992).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유