撤退の血私
概要
ソース: ケイ ・ スチュワート、RLATG、RVT CMAR;ヴァレリー A. シュレーダー、RVT、RLATG。ノートルダムのノートルダム大学
採血は、マウスやラットを含む研究のための一般的な要件です。マウスおよびラットの血液回収の方法は、必要血液量、サンプリングの頻度、抽気される動物の健康状態と、技術者のスキルレベルに依存です。1すべてのメソッド説明レトロ軌道洞裁ち落とし位置、初期尻尾切り取り領域の出血、および心腔内の出血・全身麻酔の使用を必要とします。
原則
出血の手続きの前に必要なサンプルの種類を決定する必要があります。実験手順は、全血、血漿または血清を必要があります。全血などの抗凝固剤をサンプルに追加されていなければなりません。フィブリノゲンと赤の血液細胞から分離したとき、他の凝固因子を含む血漿高血圧症サンプルから抽出できます。血清は抗凝固剤なしの血のコレクションを通じて取得されます。血栓形成後、血清サンプルの遠心からなります。サンプルはクロテッド クリームてい、フィブリノゲンあるいは他凝固因子血清は含まれません。血漿、血清は 2200-2500 RPM で 15 分の最小値を実行する遠心分離機を使用して取得されます。
全血または血漿をもたらす必要がありますサンプルでは、適切な抗凝固剤を使用する必要があります。実験動物の一般的に使用される抗凝固剤はヘパリン、クエン酸ナトリウム、エチレンジアミン四酢酸 (EDTA);選択は、リサーチのニーズに基づいています。EDTA、ヘパリン、クエン酸ナトリウムが液状を隔離、表面をコートする注射器に直接読み込みます。これにより、抗凝固薬の接触直接血液を描画すると、凝固の防止で助けます。ほとんどの哺乳類の血よりも高速のラット血液凝固として適切な割合の血液に抗凝固剤の血のコレクションを使用することが不可欠です。
針の選択は、動物のサイズと静脈穿刺のサイトに基づいています。一般的には、穴径が大きいほど針のより急速にサンプルが収集することができます。血液細胞以下のダメージは大きい針にもう一つの利点です。しかし、大口径針の主な欠点は、船が損傷する可能性です。マウス、ラットに 0.5 1.5 20 29 ゲージ針からサイズの範囲の選択肢インチ長さ。針が長すぎる場合だけでなく、使いにくいですが、凝固針で余分なスペースを持っている可能性があります。適切な針のサイズは、プロシージャ セクションのメソッドごとに表示されます。
必要なサンプルのサイズを事前にする必要がありますもはあります。マウスまたはラットのサイズが小さいため生存ブリードの血のコレクションの最大の量を計算する必要があります。25 グラムの重量を量る平均マウスは 1.8 ml の全血液量250 グラムの重量を量る平均ラットは 16 ml の総血液量です。マウスまたはラット水分補給せずに単一の血液サンプル、安全に削除することができます最大血液量は総血液量または 7.7 8 μ l/g の 10% です。 このように平均的なマウスの血液量の 10% は 193-200 μ l です。250 グラムの平均ラット、これは相当に 1.9 2.0 ml. 研究血液量の 15% 以上を削除乏血性ショックを引き起こすことが示されています。1, 2とエンガード、ただし、全血液量の 15% まで- または 12 μ l/g-缶が削除されます。25 グラムのマウス、これは 300 μ l; に相当250 グラムのラットを 3 ml と同じです。水分補給のため流体で暖め、注射は皮下投与します。
複数のサンプルを取るべきだ、描かれた血液量は減少します。週描画可能性があります最大の血液量は総血液量または 6 μ l/g の 7.5% です。 25 グラム マウスこれ、週 145-150 μ l に相当します。250 グラムのラットでは、この、週 1.45 1.50 ml に相当します。 2 週間毎、サンプリングが発生する総血液量 (8 μ l/g) の 10% までが描かれるかもしれません。これは 200 μ l 平均マウスに 2 週間ごとに相当、最大 2.00 ml 250 グラムのラットに 2 週間ごと。250 グラムの平均重量とラットに対して、1 つの研究では、血液量の 15-20% が削除されたときそれは血糖を正常化するため 29 日以上を取ったことを明らかにしました。1, 2繰り返し採血のため水分補給はできません血液量が多いまたはより頻繁に採血のボリュームだけ代わりになります。動物は、血液細胞を補充するための時間を必要があります。
レトロな軌道神経叢の使用は、過去に一般的な練習をされています。ただし、この手順の挫折について多くの懸念が生じています。中には、目の眼に一度置かれてヘマトクリット管の過剰な運動は、まぶたや結膜膜の腫脹をもたらす周囲の組織への損傷を引き起こす可能性が。腫れた組織眼球突出まで十分なので、まぶたの閉鎖は妨げ、角膜乾燥に至るおそれと損傷する可能性があります。腫れの痛みは、傷、自傷による眼球摘出の結果をトリガーできます。レトロな軌道出血中にヘマトクリット管の不適切な配置は、失明の生じる視神経を断ち切ることができます。ヘマトクリット管は不適切な角度で高度な目が眼球の後ろに落下するまぶたをできるように、軌道を外れて強制できます。この場合、ソケットに目を正しく交換する非常に困難です。壊れやすい軌道骨、ガラス質ユーモアの損失または目の圧力のために極度の痛みにつながる目の奥に血腫の形成の結果の眼球の浸透の破砕とその周辺に発生する他の問題が含まれて構造。すべてのこれらの懸念にもかかわらず、熟練した技術者は、手順を実行、動物イソフルレン吸入麻酔などの一般的な麻酔薬で麻酔をかけられ完全にレトロな軌道出血に示されている血の効果的な方法齧歯動物のコレクションです。
マウスとラットとの間は、軌道領域の解剖学的構造が違います。マウスには、眼窩領域の副鼻腔を作成する血管のコレクション洞、レトロな軌道があります。ネズミ目の軌道上では、その目の背後に流れる血管の神経叢です。しかし、彼らはマウスのように、副鼻腔を形成しません。したがって、マウスでこの手順を実行する方が簡単です。レトロ軌道神経叢を介して繰り返しサンプリング コレクション、最低 10 日間の出血を癒すために地区組織を許可する必要です。全身麻酔をお勧めします、プロパラカイン、テトラカインなどの局所点眼麻酔が手続きの前に適用される場合、プロシージャをマウス全身麻酔なしで実行できます。ラットは、レトロな軌道洞を持っていないと、軌道の周りの膜が非常に強いので、この手順のためそれらを麻酔する必須です。
少量のシリアルのサンプルは、尾 clip メソッドを使用して取得できます。尾の最初の切断は尻尾の先端、約 0.5 〜 1.0 mm のマウスとラットの 2.0 mm 長さに制限されなければなりません。かさぶたか元の塊を破壊してシリアル コレクション、採血の尻尾切り取り領域手順1尾の端でカットします。一般的には、尾の先端の追加の切断は必要ではありません。血液量は、20-100 μ L マウス用とラット用 75 150 μ L から範囲を収集しました。収集量は動物間の変数を年齢、健康状態、および体重の影響を受けます。
尻尾切り取り領域から採取された試料は、組織製品汚染と一緒に、動脈、静脈の血液を含めることができます。尻尾を撫でまたは「搾乳」より多くの血液を取得する場合、サンプルの質が低下します。血流を増やす、温湿布、熱ランプ、または暖かい水に浸された尾を加熱できます。止血、尾の先端に圧力を適用して、動物は、止血が達成されていることを確認するすべての 5 〜 10 分をチェック必要があります。止血が繰り返しサンプリングとよく遅れています。Styptic 粉は止血に使用可能性があります。初期の切断の麻酔 (一般的なまたはローカル) の使用をお勧めします。その後出血は必要麻酔、動物手順に慣れるように特にありません。麻酔血圧、この手法での採血が困難でドロップが発生します。
尻尾切り取り領域する代わりに、尾容器ニック。この手順を簡単にマウスとラットの両方で実行します。ただし、尻尾切り取り領域と同様、サンプルが組織製品、特にマウスと汚染されます。ラットの血管に注射針を挿入し、は採血針のハブから。1 つの研究は、直上の針穿刺血のコレクションを支援する止血帯の使用を認めた。3注射器は注射器から作成された圧力容器は崩壊するでしょう、容器から採血を使いません。このメソッドは、再び出血しサイトを引き起こす血栓を削除できるよう、シリアルのサンプリングで使用もできます。尻尾切り取り領域と同様、サイトに圧力をかけて、5-10 分ごとに動物を再確認して止血を確認することが不可欠です。
多くの場合、研究 nonsurvival、心腔内の出血または後大静脈経由で外れると出血により収集されて大規模な血液サンプルを必要とします。4約全体の血液量の半分から収集できますマウスまたはラット心臓穿刺によって。これは 40 μ l/g または平均 25 グラムのマウスの約 1 ml と同じです。250 グラムのラットでは、血液の約 10 ml をもたらすでしょう。急激な多量の麻酔動物必要があります。熟練の技術者による吸入麻酔や CO2麻酔を使用できます。注射麻酔を使用もできます。ただし、血圧や血液の量を減らすことができる循環の減少があります。
後大静脈メソッドは、動物が外科的血管を公開する深く麻酔が必要です。CO2麻酔が不十分、心する必要があり、血の撤退中に呼吸動物です。中も血撤退の急速なは遮蔽開口の予防および採血、注射器の傾斜面に崩壊する船を可能性があります。また、血管壁が薄く、破裂や針の穿刺部位からの血液の漏れを防ぐためにこのように手と針の動きを避ける必要があります。針は皮膚を通過しない、このメソッドは、滅菌サンプルのコレクションの結果します。動物が麻酔から回復しないように補助安楽死の方法を用いなければなりません。このメソッドは、多くの場合心臓や大動脈の血流が続きます。
心臓内のメソッドがすることができますそれが麻酔 (閉鎖法) は、または、中心部を手術後大静脈血コレクション法 (オープン法) のためのプロトコルに従って公開すること手動で拘束された動物のいずれかを実行します。クローズ メソッドの針の配置のランドマークまで動物の左側の剣状突起、肋骨で形成される溝です。
手順
1. レトロ軌道出血します。
- 機器
- ベルジャー、または麻酔導入室、イソフルランなど麻酔ガスを管理するためを準備します。ガラスベル ジャーを使用すると、液体の麻酔薬は、皮膚からの吸収を避けるために、動物に接しないことが不可欠です。小さな穴をプラットフォームを使用することができます。
- 50-75 マイクロリットルを保持 Microhematocrit チューブが優先されます。マイラー ラップ管オペレーターの指の間を破る可能性は低く、安全対策として見なす必要があります。
- いくつかの紙タオルの厚さ、または他の絶縁材料は、プロシージャの間に動物の体の熱を維持するために作業面に配置されます。
- 準備と動物の位置決め
- 動物は麻酔効果、ベルジャーやガスの麻酔誘導室におけるイソフルランなどの吸入麻酔します。
- 動物完全に麻酔をかけられ、それが削除され、外側臥床に配置。
- 目の爆風と、下顎の輪郭に沿って頭の上に指を置くことで、バックアップ上下の皮膚を引っ張るします。
- 崩壊または窒息によって死を引き起こす気道を閉塞する可能性、気管に圧力を適用することを避けるため。
- 血液回収
- Microhematocrit、目の眼と鼻の面から 30-45 ° の角度で尾側監督します。
- ヘマトクリット管をゆっくり回転させながら圧力を適用します。結膜膜を切って、眼の神経叢を破壊します。
- 毛管作用によってヘマトクリット管に血液が流れます。
- 眼の空洞の後ろに骨を叩くので、深いプッシュされないように。
- 血は流れを開始、一度はみ出した目を維持する圧力を維持します。
- 血の複数のチューブを収集する必要はありません眼神経叢に次の管を配置する、血は流れ続けますと眼から来て収集することができます。
- 出血を止める、皮を解放でき、目正常な位置に戻ります。止血を確認するために軌道に圧力を適用されます。
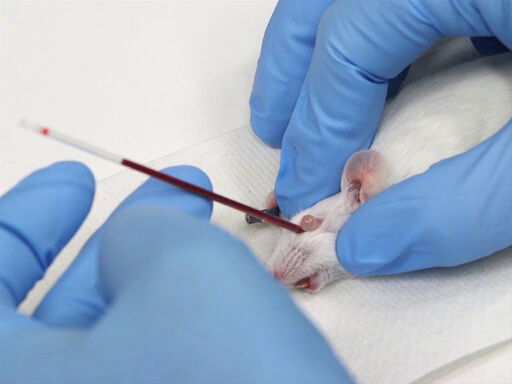
図 1。マウスでレトロな軌道血回収。
2. 尾ブリード プロシージャ: 尾ちょきんと尾ニック
- 機器
- 生殖不能のメスの刃、好ましくは 11 番ブレードまたは片面かみそりの刃は、尻尾切り取り領域法の最初の切断に使用されます。はさみでカットを粉砕すると、凝固し、血流を減らすことを促進するため、はさみを使用されませんする必要があります。尾ニック プロシージャ数 11、または 15 のメス刃がカットをすること使用されます。
- マウスの尾にアクセスできる拘束チューブを用意しています。
- 吸水紙タオルやガーゼは、尻尾切り取り領域を実行するため、基板として使用されます。
- ヘマトクリット管の収集も必要です。
- Styptic 粉は止血のために使用する必要があります。
- 拘束
- 動物は、尾がアクセスできるようにチューブに配置されます。ブルーム型 restrainers の動物では、チューブにまず尻を引かれます。その他の管の動物の頭を最初に置きます。
- 動物は、その好転したり、尻尾を撤回できない管に保護されます。
- 粗面をつかむために許可されている場合、いくつかのマウスは最小限のマニュアル抑制とテールちょきんと血液コレクションになります。
- いくつかのラット血のコレクションのこのメソッドの吸入麻酔が必要になります。
- 血液回収
- 尾は残骸を削除し、わずかな血管拡張を引き起こすぬるま湯で拭いてください。お湯を使用しないでください。
- 尻尾切り取り領域のテールを延長して尾 (0.5-1 mm マウス用とラット用 mm 2 まで) の非常に端をメス刃で切る。
- 尾尾ニックネームを延長して約 2/3 のメス刃でカットをしている尻を外側尾静脈の真上からの距離。
- 血流を促進する先端に尻から尾の境界線が描画できます。ただし、これはサンプルの品質を低下します。
- 血がヒントまたはヘマトクリット管を使用してニックから収集またはコレクションのバイアルに滴る。
3. 心臓採血
- 機器
- マウスを 3 cc 注射器針 1"x 22 25 ゲージをお勧めします。小さい注射器には同じ背圧がなくより困難な血の撤退を確認することができます。針は 25 ゲージより小さい増加凝固血液の流れを制限して血液細胞にダメージを与えます。1"より短い針は、横隔膜から近づいていく心のレベルを達することができません。
- ラット x 1.5"針 18 ゲージで 10-12 cc 注射器が適しています。ラットのサイズ、に応じて、収集する全体の血液量を保持するかもしれない小さい注射器、従って注射器の処理中に変更するでしょう。20 ゲージより小さい針は、増加血液凝固に至る、血液の流れを制限します。横隔膜から近づくとき針未満 1.5」は心のレベルを達することができません。
- 十分なサイズの採血管は、集められた血を保持するために使用されます。
- 拘束
- 適切な拘束は、このメソッドの成功に不可欠です。動物は、垂直にぶら下がって体と首筋が開催されます。本体は中心部のたわみや胸のねじれを防ぐためにまっすぐであることが重要です。
- 代替位置は、左のわき腹の肋骨の間針を置き背臥床です。これは非常に大きなラットまたは複数の動物が抽気される場合に特に便利です。
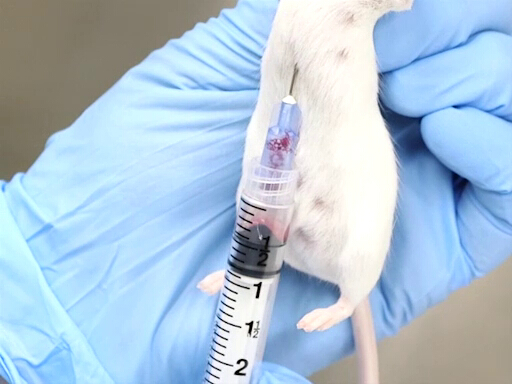
図 2。マウスの心臓血回収は垂直に開催。
- 血液回収
- 首筋をマウスまたはラットが縦向きの場合より簡単に横隔膜を貫通、後面からアプローチできるからです。
- 針がちょうど動物の剣の左に切り込みに進んでいます。
- 針は背骨に平行でなければなりません、肋骨のすぐ下に配置します。
- 中心部が肘のレベルにおよそあります。
- 針を置き、胸に、ベベル中心部を穿刺します。
- 注射器でわずかなバック プレッシャを適用します。中心部に針がある場合は、血液が注射器に流れます。
- 血液が注射器に追加の背圧を追加する前に、シリンジをいっぱいまで待ちます。
- 動物の左側から側方進入背臥床での動物の配置が必要です。
- エントリ ポイントは、胸部に肘のポイントに対して測定されます。中心部が肘のレベルにおよそあります。
- 針は胸壁のポイント中間でテーブルの平面に垂直に挿入された dorsoventrally を測定です。
- 針を置き、胸に、ベベル中心部を穿刺します。
- 注射器でわずかなバック プレッシャを適用します。中心部に針がある場合は、血液が注射器に流れます。
- 血液が注射器に追加の背を追加する前に、シリンジをいっぱいまで待ちます。
- 首筋をマウスまたはラットが縦向きの場合より簡単に横隔膜を貫通、後面からアプローチできるからです。
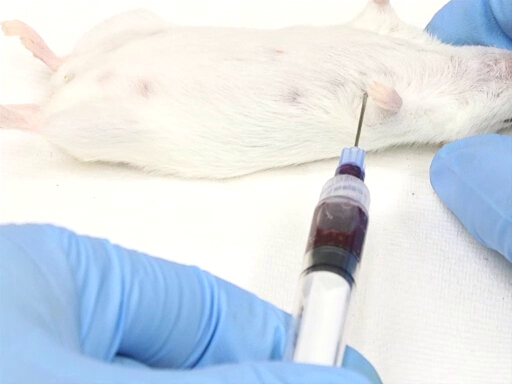
図 3。背臥床位置でマウスと心臓血回収。
- 技術的なヒント
- 正常な心臓は左を指している頂点が位置しています。まれに、心臓が反転されるので、中心部に穴を開けるの困難を伴います。
- 注射器に過度の背圧針ベベルを遮蔽と注射器への血流を停止、心に崩壊するかもしれない。
- 背圧と繰り返し、それを解放、注射器で血液凝固が開始されますを適用します。
- 肝臓に優しく圧力をかけて強制的に撤退可能にする循環系に追加血液量できます。
4. 後部上大静脈血撤退
- 機器
- 25 29 g 針付き TB 注射器は、マウスの採血に使用されます。ラット、22-25 ゲージ針 1"x と 10-12 cc 注射器が必要です。
- 手術のプラットフォーム、郭清のトレイ、または動物を保護する他の表面に必要な関係、テープ、またはピンの位置に手足を押さなければなりません。
- 注射麻酔や麻酔は必要。吸入麻酔を使用している場合それは麻酔薬を鼻の円錐形の精度気化器を介して配信されることが望ましいです。プロシージャの長さは、追加の麻酔ガスの配達せず誘導チャンバーを使用しても、動物が復活する前に血の撤退を完了するための十分な時間は得られないようです。
- マウスのアイリスはさみや、ラットの手術室シャープ鈍はさみ、必要ですに沿って小さな非外科的親指鉗子と 2"x 2"ガーゼ スポンジ。
- 拘束
- ときにつま先ピンチまたは尾ピンチによって決定される、動物完全に麻酔をかけられ、動物は背臥位に。
- 手足は、テープやピンでプラットフォームに固定されます。手足は、身体から拡張する必要があります。
- 撤退
- 皮膚を持ち上げて、女性の骨盤のすぐ上またはすぐ上男性の包皮の皮膚を通して作られる小さな横カット。
- はさみのポイントは、カットに配置され、正中切開は、剣に骨盤/包皮から皮膚を介して行われます。
- 皮膚は、それぞれの側に横方向に反映されます。鈍的切離基になる筋肉から緩める必要があります。
- 筋肉を持ち上げたし、皮膚切り取り上筋小横のカットが行われます。
- はさみのポイントは腹部に配置され、剣への筋肉を介して正中切開を作成します。はさみのポイントすべての器官を切断を避けるために上向きの角度を必ず。
- 両側の肋骨の曲線に沿って横にカットします。肝臓を穿刺しないように余分な注意を行使します。
- 優しく腸を後部の上大静脈を公開する動物の左に移動します。
- 肝臓にガーゼのパッドを配置し、肝臓に人差し指と中指を休ませます。
- もう一方の手で、針を挿入し、腎血管の接合部と腸骨の分岐上大静脈の中間に上向き、ベベルします。
- ゆっくりと肝臓に加圧しながら血を撤回します。
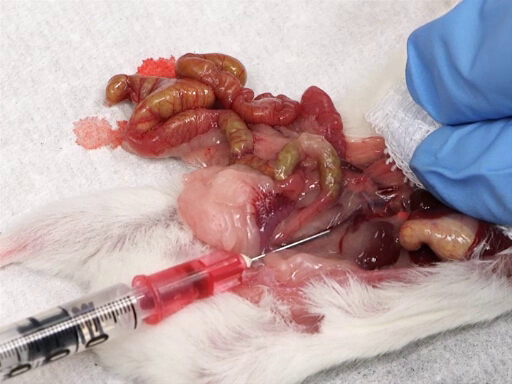
図 4。後部下大静脈から血液回収。
申請書と概要
マウス、ラットの採血は、さまざまな手法を実現できます。サンプル サイズ、サンプリング、周波数、サイズ、動物の年齢など、多くの要因で影響を及ぼす、最も重要なコンポーネントはサンプルの収集を実行する技術者のスキルレベル。 ここで説明する方法の麻酔薬の適切な使用は、また品質のサンプルと動物の健康のために重要。
参考文献
- Guidelines for the survival bleeding of mice and rats. 2010.
- Diehl, K.H., Hull, R., Morton, D., Pfister, R., Rabemampianina, Y., Smith, D., Vidal, J.M., and van de Vorstenbosch, C. 2001. A good practical guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21. 15-23.
- Omaye, S.T., Skala, J.H., Gretz, M.D., Schaus, E.E., and Wade, C.E. 1987. Simple method for bleeding the unanaesthetized rat by tail venipuncture. Laboratory Animals. 21. 261-264.
- Adeghe, A.J-H. and Cohen, J. 1986. A better method for terminal bleeding of mice. Laboratory Animals. 20. 70-72.
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
撤退の血私
Lab Animal Research
171.0K 閲覧数

齧歯動物の処理と抑制技術
Lab Animal Research
173.6K 閲覧数

基本的なケア手順
Lab Animal Research
27.9K 閲覧数

繁殖と離乳の基本
Lab Animal Research
35.6K 閲覧数

齧歯動物識別私
Lab Animal Research
54.5K 閲覧数

齧歯動物識別 II
Lab Animal Research
25.5K 閲覧数

化合物の管理私
Lab Animal Research
100.1K 閲覧数

複合管理 II
Lab Animal Research
34.7K 閲覧数

複合行政 III
Lab Animal Research
31.3K 閲覧数

化合物の管理 IV
Lab Animal Research
51.4K 閲覧数

血液回収 II
Lab Animal Research
72.9K 閲覧数

麻酔導入とメンテナンス
Lab Animal Research
50.1K 閲覧数

齧歯動物の外科に関する考慮事項
Lab Animal Research
22.4K 閲覧数

剖検診断と組織の収穫
Lab Animal Research
57.8K 閲覧数

滅菌のティッシュの収穫
Lab Animal Research
34.7K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved