A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الميكروسكوب الضوئي مبعثر استنادا فلاتر غابور ثنائي الأبعاد
In This Article
Summary
نظهر طريقة المجهر داكنة ميدانية على غابور مثل تصفية لقياس ديناميكية التحت خلوية داخل الخلايا الحية واحد. تقنية حساسة للتغيرات في بنية العضيات ، مثل تجزئة الميتوكوندريا.
Abstract
نظهر صك المجهرية التي يمكن قياس الملمس التحت خلوية الناشئة عن مورفولوجيا عضية والتنظيم داخل الخلايا الحية غير ملوثين. الصك المقترح تمتد حساسية التسمية خالية المجهر الضوئي للتغيرات في حجم النانو عضية والشكل ، ويمكن استخدامها للتعجيل في دراسة العلاقة بين الهيكل وظيفة تتعلق ديناميات العمليات البيولوجية الكامنة العضية الأساسية ، مثل موت الخلايا المبرمج أو الخلوية التمايز. ويمكن تنفيذها بسهولة المجهر على منصات المجهري القائمة ، وبالتالي يمكن توزيعها على المختبرات الفردية ، حيث يمكن للعلماء تنفيذ واستخدام الأساليب المقترحة مع وصول غير مقيد.
التقنية المقترحة قادرة على توصيف هيكل التحت خلوية من خلال مراقبة الخلية من خلال ثنائية الأبعاد غابور الفلاتر الضوئية. يمكن ضبطها لهذه الفلاتر الشعور بحساسية (10 من نانومتر) النانوية ، والصفات المورفولوجية محددة تتعلق حجم واتجاه غير كروية العضيات التحت خلوية. في حين تستند على النقيض تم إنشاؤها بواسطة نثر المرنة ، وهذه التقنية لا تعتمد على نموذج تشتت معكوس مفصلة أو على نظرية لاستخراج مي morphometric القياسات. هذا الأسلوب هو ذلك ينطبق على غير كروية العضيات التي ليست دقيقة نظرا وصف مبعثر النظرية بسهولة ، وتوفر المعلمات morphometric المميزة التي يمكن الحصول عليها داخل الخلايا الحية غير ملوثين لتقييم وظائفها. هذه التقنية هو مفيد مقارنة مع معالجة الصور الرقمية في أنه يعمل مباشرة على حقل للكائن بدلا من تحويل كثافة الكائن في discretized. انها لا تعتمد على معدلات عالية صورة المعاينة وبالتالي يمكن استخدامها لشاشة بسرعة المورفولوجية النشاط ضمن مئات من الخلايا في وقت واحد ، وبالتالي يسهل كثيرا على دراسة بنية وراء تقسيم عضية عضية الفردية وإعادة الإعمار التي المجهري متحد البؤر مضان من الصور الرقمية تضخيم للغاية حقول محدود من العرض.
في هذه التظاهرة التي قمنا تظهر البيانات من المشطورة البحرية لتوضيح المنهجية. نعرض أيضا البيانات الأولية التي تم جمعها من الخلايا الحية لإعطاء فكرة عن الكيفية التي يمكن بها تطبيق الأسلوب في سياق البيولوجية ذات الصلة.
Protocol
1. الحصول على خلايا جاهزة
- الخلايا التي كانت مطلية قبل يوم واحد بحاجة إلى أن يكون المسمى مع الأخضر Mitotracker التصوير مضان من الميتوكوندريا.
- إزالة 100 ميكرومتر حل الأسهم الخضراء في Mitotracker DMSO متخذا من الفريزر 4 درجات مئوية ، وإلى درجة حرارة الغرفة الدافئة مع اليد. تأخذ أيضا الأبقار الخلايا البطانية الأبهر (BAEC) الخلية مستنبت أيضا معدة مسبقا ودافئة إلى 37 درجة مئوية في الفوق بالحمام المائي.
- حالما يتم تسخين Mitotracker والمتوسطة والثقافة ، ووضع هذه في غطاء محرك السيارة والتأكد من تعقيم اليدين القفاز وجميع الأسطح الخارجية للحاويات مع الحل الايثانول 70 ٪. لم تقم بدورها على ضوء هود ، كتسمية الفلورسنت خفيفة حساسة وسوف photobleach بسرعة في ضوء الغرفة المحيطة.
- جعل التركيز المناسب لوضع العلامات الميتوكوندريا مهم جدا. والقليل جدا لا تسمية بفعالية الميتوكوندريا ، في حين Mitotracker الكثير يمكن أن يكون لها آثار سامة. وتركيز 100 نيوتن متر من Mitotracker المحتضنة لمدة 45 دقيقة مع الخلايا تعمل بشكل جيد. يعد هذا التركيز من خلال إضافة 100 ميكرولتر من الأسهم إلى 10 مل Mitotracker مستنبت في أنبوب 15 مل. وهذا جعل الكثير من أجل تجربة واحدة على الأقل.
- استبدال المتوسطة القائمة مع المتوسط المسمى بواسطة امتصاص المتوسط القديم مع ماصة باستير متصلا خط فراغ. ثم تضيف على الفور 2 مل من المتوسط المسمى لكل ثقافة المحتلة بشكل جيد في لوحة 6 جيدا.
- لأن التسمية الفلورسنت حساس للضوء ، وتحل محل الخلايا في الحاضنة بسرعة دون تعريض للضوء الغرفة مباشرة. تغطي لوحة 6 جيدا مع يد تعمل بشكل جيد لهذا الغرض. وسوف تبقى هذه الخلايا في الحاضنة لمدة 45 دقيقة.
2. الحصول على الإعداد البصرية جاهزة
- في حين أن خلايا الانتظار في الحاضنة ، لدينا لتشغيل الإعداد البصرية. في غرفة والبصريات ، أولا تشغيل مصباح قوس الزئبق ، تليها الكمبيوتر ، المجهر ، والكاميرات ، والليزر. ثم سد العجز في الجهاز micromirror الرقمية (DMD) والناشر الغزل.
- تحقق للتأكد من أن يتم إطلاق محاذاة البصرية من خلال النظر من خلال العدسة المجهر للتأكد من أن يضيء الزاهية في مجال الرؤية من ضوء الليزر.
- تنظيف الهدف عن طريق للطي قطعة واحدة من الورق في عدسة مربع ضيق وفهم بإحكام مع مرقئ. تراجع هذه الورقة إلى عدسة خالية من الأمونيا محلول تنظيف الزجاج لاستيعاب كمية ضئيلة في ورقة. الراب في مرقئ على يدك الحرة عدة مرات لإزالة أي فائض. مسح الهدف من خلال تطبيق بحزم one نظيفة ، وانتقد المستمر عبر هدف واحدة من نهاية إلى أخرى ، يذهب أكثر من العدسة في الوسط. لا إعادة انتقاد أو فرك. تجاهل الورق المستخدم.
- لتحميل عينة ، ضع graticule على النفط الهدف الغمر 63x بإسقاط 1-2 قطرات صغيرة من النفط أكثر من الانغماس في حين أن الهدف الهدف من ذلك هو على طول الطريق. ثم ضع graticule في مرحلة من المراحل. ثم رفع الهدف بحيث النفط "الاستيلاء" على عينة. تركيز العينة في العدسة.
- لمحاذاة المكثف ، وضبط ارتفاع المكثف بحيث يتم محاذاة في إنارة كولر المركزية من خلال التركيز على حافة سداسية المكثف وقف الميدان. مركز الحقل المكثف وقف على مجال الرؤية إذا لزم الأمر عن طريق تحويل المقابض المكثف التمركز. يجب اغلاق الفتحة وقف المكثف.
- بدء تشغيل البرنامج والمدخلات IPlab الإعدادات لتشغيل RoperScientific تتالي 512 الكاميرا. تأكيد أن يتم تعيين الكاميرا إلى واسطة نقل الإطار. بدء المعاينة المباشرة عن طريق تشغيل "الحصول على التركيز" الأوامر. تعيين بادئة مؤشر وموقع الملف الذي سيتم حفظ الصور.
- بدء تشغيل البرنامج والمدخلات RSImage الإعدادات لتشغيل برنامج CoolSnap. يجب تعيين وضع قطع مسافة السباق إلى وضعها الطبيعي.
- بدء تشغيل البرنامج ونائب العضو المنتدب للوضع الميداني قزحية الظلام النصي في القائمة ، تليها "تحميل وإعادة تعيين" القيادة وتشغيل البرنامج النصي.
- ترسل الضوء إلى الكاميرا وتتالي 512 DMD بواسطة إعداد optovar المجهر وviewport إلى LSM. هذا وسوف ترسل صورة من خلال DMD والبصريات الانحياز ، إبراز الصورة مدافع على اتفاقية مكافحة التصحر. ينبغي الظلام الميدان (مدافع) صورة تظهر على المعاينة المباشرة التي بدأت بالفعل في IPlab. ضبط التركيز غرامة المجهر اذا دعت الضرورة لتركيز الصورة على المعاينة المباشرة.
- أخذ لقطة من مجال الرؤية باستخدام "الحصول على واحد" القيادة. ضبط وقت التعرض مرتفعة بما يكفي لضمان ما لا يقل عن 10000 تهم إشارة في الصورة. بعد شراء ، واستخدام "حفظ فهرسة بأنه" أمر لحفظ الصور على القرص. هذه الصورة من graticule يقيس حجم مجال الرؤية (FOV).
- الآن ، نقل عينة graticule بحيث graticule هو أبعد من ذلك FOV هذه الخلفية فقط مرئيا. الحصول على صورة خلفية في مجالالتعرض لوقت طويل بما فيه الكفاية لضمان أن يتم الحصول على ما لا يقل عن 5000 تهمة الإشارة. وهذا الطرح في صورة مساعدات خلفية الصور فلتر.
3. تحميل filterbank واستخدام برنامج الإعداد للحصول على الصور الخلفية ، التي تمت تصفيتها
- الآن ، نحن بحاجة للحصول على غابور مفلتر صور الخلفية. تحميل البرنامج النصي غابور تصفية البنك لبرامج التحكم DMD. تشغيل البرنامج النصي بأكمله للتخفيف من المرشحات إلى الذاكرة على متن الطائرة من DMD ، وهذا قد يستغرق بضع دقائق.
- حالما يتم تخزينها السيناريو بأكمله ، يمكننا الآن الحصول على الصور التي تمت تصفيتها من الخلفية. استخدام علامات بدء ووقف في داخل البرنامج DMD تكليف نائب العضو المنتدب لتحميل مجموعة واحدة فقط من المرشحات المقابلة لتصفية غابور مثل واحد في وقت واحد ، وتشغيل البرنامج النصي. ينبغي للمعاينة صورة حية تتغير من حقل مظلم لصورة تصفيتها لهذا المرشح.
- فتح البرنامج النصي في اقتناء IPlab من القرص. ضبط الوقت التعرض لضمان أن يتم الحصول عليها لا يقل عن 2000 تهمة الإشارة. كما النصي DMD قيد التشغيل ، إلغاء المعاينة المباشرة في IPlab وتشغيل البرنامج النصي الاستحواذ. وهذا يكتسب تلقائيا ، مؤشر وحفظ الصور على القرص تصفيتها.
- مرة واحدة يتم الحصول على أول صورة ، ووقف تشغيل البرنامج النصي في برنامج DMD وحذف الأوامر المستخدمة من البرنامج النصي. بدء استبدال وعلامات التوقف عند بداية ونهاية المجموعة تصفية المقبل. تكرار في اقتناء IPlab.
- كرر الخطوة حتى 3،4 استخدمت filterbank بأكمله واكتسبت كل الصور التي تمت تصفيتها وحفظها.
4. طلاء الخلايا
- الآن ، سوف تكون الخلايا جاهزة قريبا لوحة للتجربة. سد العجز في لحام الحديد على الفوق المختبر. إزالة عرض L15 المتوسطة والحرارة إلى 37 درجة مئوية. جعل محطة عمل مع منشفة ورقية وKimwipe ملف. جعل الفتائل عدة تمزيق والتدوير Kimwipes. سوف تساعد في نقل الفتائل السائل من وإلى لوحة الخلية.
- بعد هذا ، نحن بحاجة إلى لوحة العينة. نستخدم عينة معدنية تشكيله لوحة أصحاب خلايانا ، مما يجعل "شطيرة ساترة" مع لوحة معدنية بينهما. تطبيق حبة رقيقة من الشحوم فراغ من حقنة حول هامش العلوي من لوحة معدنية ثقب في منتصف الطريق حول تمديد لينتهي من الأخاديد على كل جانب. اضغط بلطف لا النظيف. 1 ساترة على الشحوم. لوحة على الوجه وتطبيق الشحوم حول الثقب. إطفاء الأنوار الغرفة.
- ونحن الآن الحصول على خلايا من الحاضنة ، والتعامل مع محتويات حاضنة مع القفازات الامتحان نيتريلي تعقيمها مع الايثانول 70 ٪. إزالة لوحة من الخلية الحاضنة ، تحبس أنفاسك في حين أن الباب مفتوح حاضنة. نكون حذرين للحد من التعرض للضوء الغرفة.
- إزالة ساترة التي سيتم استخدامها لتجربة لوحة من ستة جيدا ، مشيرا الى ان الجانب الذي كان وجها حتى في البئر هو جنب مع خلايا المرفقة. الجافة بعناية ساترة على كلا الجانبين حتى يكاد يجف تماما ، في حين تتبع أي جانب من ساترة لديها خلايا. ثم اضغط على الجانب ساترة الخلية ، باستمرار ، في صفيحة معدنية مدهونة بالزبدة على حفرة عرضها ، مع التأكد من عدم وجود فجوات الهواء تبقى داخل طبقة الشحوم. يجب أن الشحوم شكل خاتم للماء للسماح لنا للتحميل مع الخلايا المتوسطة L15. ذات مرة كنت متأكدا من هذا ، والوجه الخلفي على لوحة.
- ماصة المتوسط L15 في الخلايا مطلي عن طريق إجبار السائل من خلال الأخدود بين العلوي وساترة لوحة معدنية. Pipetting 200 ميكروليتر في وقت يعمل بشكل جيد. ينبغي للماصة المجلد الأول ملء الفراغ تقع بين coverslips مع السائل تمتد تقريبا إلى أخدود على الجانب الآخر.
- ماصة أخرى ميكرولتر 200 من متوسطة إلى خلايا مطلي ، ولكن هذا الوقت ، عقد الفتيل في بستان يعارضون المتوسطة بحيث يتدفق من جانب واحد إلى آخر. هذا يغسل الخلايا ويزيل أي آثار المتوسط القديم. توخي الحذر لمنع أي من تشكيل فقاعات داخل السائل خلال هذه الخطوة. كرر هذه العملية 2-3 مرات باستخدام فتيلة جديدة لكل الشطف.
- نتذكر أننا حام الحديد في الوتر؟ الآن هو الوقت يعتاد عليه. لوحة الوجه رأسا على عقب مرة أخرى ، ودعم لوحة من الحواف بحيث يتم المحاصرين أن السائل في خزان الخلية ولا يمكن بالتنقيط أسفل. تراجع الحديد لحام في الدورق valap. هذا وسوف تذوب بسرعة بعض valap التي سوف تتشبث ثم الى الطرف حام الحديد. تطبق بعناية valap المنصهر حول حواف ساترة السفلي (والذي يواجه الآن التصاعدي) باستخدام رأس حام الحديد بمثابة قضيب. تواصل غمس وتطبيق حتى تذهب كل الطريق حول محيط ساترة ، وختم ساترة لوحة معدنية.
- في أسفل ساترة لديه خلايا المتزايد عليه ، وربما بقايا من المتوسط جفت على الجانب عرضة للخطر. تنظيف أي بقايا من السطح بواسطة ساترة التكور بإعداد Kimwipe وcleaninز وساترة في حركة واحدة مثل الكثير من الانزلاق تنظيف الهدف. هذا يضمن أن ساترة هو أنظف في المركز حيث سيتم عرضها.
- افصل حام الحديد والعودة لوحة 6 - جيدا للحاضنة مراقبة الاحتواء والإجراءات نفسها العقم. تأخذ الخلايا مطلي إلى مختبر البصريات وجبل على الهدف كما هو موضح في الخطوات 2.4 و 2.5.
5. إجراء التجربة
- العثور على حقل لطيفة المظهر الصحي الخلايا.
- الحصول على صورة الحقل المظلم من مجال الرؤية. محاذاة المجهر في المقابل تدخل الفرق (DIC) والحصول على صورة مدينة دبي للإنترنت. تأكد من أن يتم التعرض أوقات طويلة بما فيه الكفاية لضمان إشارة كافية.
- الآن لدينا للحصول على صور الفلورسنت على الكاميرا الأخرى. للحصول على صور مدينة دبي للإنترنت على CoolSnap ، ونحن نستخدم LED زرقاء المرفقة إلى المكثف ، والاستعاضة عنه وإزالته عند الضرورة. بينما لا يزال الانحياز المجهر في مدينة دبي للإنترنت ، بعث الضوء على CoolSnap بواسطة إعداد optovar المجهر ل1.0X وviewport إلى مجهر 100 ٪. تحويل الصورة من العدسة للكاميرا. مكان الصمام خلال مكثف لتسليط الضوء على مجال ومعاينة FOV في التركيز وضبط RSimage غرامة إذا لزم الأمر. الحصول على صورة مدينة دبي للإنترنت وحفظ إلى القرص. لاحظ كيف يختلف FOV واحدة حصل عليها من الكاميرا التعاقبي. وهذه الصور يجب أن تكون سجلت خلال مرحلة التحليل بعد التجربة.
- الحصول على الصور من خلال تعديل مضان المكعب إلى تصفية filtercube فلوريسئين. الحصول على صورة من خلال تحويل لفترة وجيزة على الإثارة مضان باستخدام المجهر وبدوره ثم تشغيله بمجرد اكتمال عملية الاستحواذ. منذ ركزنا على عينة في مدينة دبي للإنترنت ، ويركز على صورة مضان كذلك. هذا يوفر في الوقت المناسب التعرض في مضان ، وبالتالي تباطؤ بانخفاض photobleaching. حفظ الصورة على القرص مضان.
- الآن لدينا للحصول على الصور التي تمت تصفيتها. إعادة المجهر لحقل الظلام والضوء من خلال إعادة إرسال منفذ LSM كما في 2.9.
- تشغيل filterbank غابور بأكملها كما هو الحال في 3،3-3،5 النصي. أكملنا الآن الحصول على بيانات عن نقطة زمنية واحدة.
6. تحويل المتوسط إلى كشف الخلايا لstaurosporine (STS) ، والحفاظ على المتوسط في جميع أنحاء التجربة
- في حين أن الخلايا لا تزال على المسرح ، ودون الإخلال مجال الرؤية ، والتحول من أصل العادية L - 15 متوسطة لنفسه يتضمن حلا 1 من STS ميكرومتر المصنوعة من حل ملي 4 من الأسهم في STS DMSO. فتل استخدام الأسلوب هو موضح في الخطوات 4،6 للتبديل وسائل الإعلام.
- الآن ، ونحن نكرر الخطوات للحصول على نقاط 5،2-5،6 وقت لاحق. نكرر هذه العملية حتى يتم الانتهاء من التجربة.
- أثناء التجربة ، سوف يكون أكثر المتوسطة التي يمكن ان تضاف العينة بحيث لا يجفف. ويتم إنجاز هذا بواسطة pipetting المتوسطة في بستان من لوحة الخلية دون إزالة من مرحلة ودون الإخلال FOV.
7. ممثل النتائج
في ختام التجربة ، وسوف تشمل البيانات التي جمعت عددا كبيرا من الصور التي تحتاج إلى تصفية تتم معالجتها لاستخراج البيانات التحت خلوية الهيكلي. وترد مثالين لبنك عامل تصفية المرشحات الضوئية تتألف من غابور تشبه 9 مع فترة التصفية S = 0.95μm ، الضبابي المغلف الانحراف القياسي ق = S / 2 = 0.45μm ، والتوجهات Φ = 0 ° إلى ° Φ في 20 = 160 ° العلاوات. (انظر أيضا [1] لمزيد من التفاصيل).
المثال 1 : البحرية الدياتوم
نحن لدينا توجه أول تطبيق تصفية البنك حساسية لعينة المشطورة البحرية (ولاية كارولينا شركة التموين البيولوجية) مع ميزات الموجهة التي كانت مرئية بوضوح في التصوير (مدافع) داكنة الميدان (الشكل 1). وتظهر الصور التي تمت تصفيتها بصريا إلى جانب صورة فلتر للعينة للمقارنة.
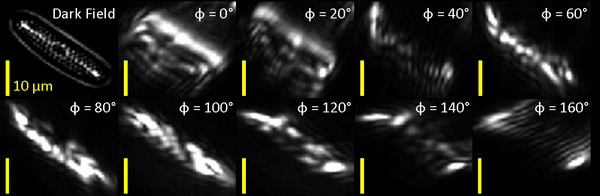
الشكل 1 : حقل الظلام (مدافع) والصورة التي تمت تصفيتها بصريا من الدياتومات البحرية. وسوف نقوم بتحليل المشطورة في أسفل يمين الصورة (السهم الأبيض في اللوحة اليسرى أكثر).
تم تجهيز مجموعة من الصور غابور مفلتر تسعة من المشطورة بكسل حسب بكسل للتوجيه الكائن والاستدارة. تجهيز يتألف من (1) ملخصا لجميع الردود قياس الصور غابور مفلتر تسعة في كل بيكسل لتحديد الحجم الكلي للاستجابة إشارة ترميز بالتالي أهمية ردا على ذلك ، و (2) العثور على التوجه مرشح غابور ، Φ ، حيث كانت الاستجابة مكبر وأخذ نسبة من هذه الاستجابة القصوى للاستجابة المتوسط لجميع الزوايا ترميز وبالتالي إلى أي مدى الكائنات في كل بكسل لديها اتجاه مفضل. يرتبط ارتباطا وثيقا لدرجة الميل إلى نسبة الجانب الهندسي للجسيمات. في الشكل. 2B ، اليتم ترميز البريد الاستجابة الشاملة للبكسل للبنك التصفية (المعلمة 1) ودرجة الميل أو الجانب نسبة (معلمة 2) في تشبع اللون وهوى ، على التوالي. نسبة الجانب بالقرب من 1 (الأزرق) هو الحاضر في المناطق التي لا توجد زاوية استجابة المفضل ، في حين قدر أكبر من القيم (الحمراء) تشير إلى المناطق التي تحتوي على استجابة أعلى الزاوية المفضل هو الحاضر. يتم ترميز طيدة اتجاه الجسيمات في مؤامرة جعبة (الشكل 2C) ، حيث اتفق كل سطر بشكل وثيق مع التوجه كائن محلي الكامنة وضوحا في الحقل الداكنة فلتر (الشكل 2A).

الشكل 2 : A : الصورة المظلمة ميدان المشطورة. باء : كائن صورة التوجه. مقياس درجة اللون يشير إلى التوجه (نسبة الارتفاع) ، في حين سطوع بترميز أهمية استجابة مجموع مرشح غابور. C : توجه الكائنات مع شدة استجابة ≥ 10 ٪ من الحد الأقصى. قطعة خط المحور يشير هيكل المقابلة الطويلة.
مثال 2 : الخلايا أفكارك
هنا نعرض الصور التي تمت تصفيتها من الخلايا البطانية الأبقار تعامل مع staurosporine (STS) التي تم معالجتها في نفس الطريقة المشطورة. التين. 3 يظهر فلتر داكنة الميدان (مدافع) صورة من الخلايا جنبا إلى جنب مع صور nine تصفيتها في الوقت T =- 180 دقيقة. STS قبل العلاج.
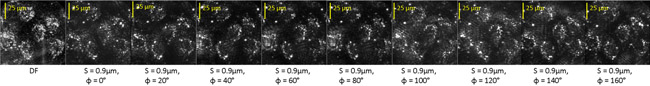
الشكل 3 : حقل الظلام (مدافع) وتصفية الصور بصريا من حقل يحتوي على العديد من الخلايا الحية البطانية.
تم الحصول عليها في وقت لاحق الصور تصفية كل 20 دقيقة لمدة ثلاث ساعات بعد العلاج STS. التين. 4A يظهر خريطة الجانب نسبة الخلايا بوصفها وظيفة من الزمن. في هذه الحالة لونا لون يمثل درجة الميل (orientedness المسمى) كما لونه لون في الشكل. 2B أعلاه. ومع ذلك ، لم تكن مرجحة سطوع نسبة الارتفاع من رد فعل مرشح المتوسط. من خلال تسجيل خرائطنا نسبة الارتفاع مع الصور مضان من الميتوكوندريا المسمى في هذه الخلايا (الشكل 4B) ، توصلنا إلى أن اقتصرت نسبة الارتفاع قياس الانخفاض الى المناطق التي تحتوي على الميتوكوندريا الخلوية وذلك بالتزامن مع تفتت الميتوكوندريا التي يمكن الملاحظة المباشرة في الصور مضان من نفس الخلايا. التين. 5 يبين المؤامرات الوقت تصور التغيير في نسبة الارتفاع بوصفها وظيفة من الوقت في الخلايا التي تمر موت الخلايا المبرمج. داخل كل خلية ، فإن هناك انخفاضا في نسبة الارتفاع في T = 6-10 دقيقة في المناطق التي تسجل مع الفلورسنت الميتوكوندريا ، ولكن ليس في المناطق التي تسجل مع المناطق الخلفية قاتمة مضان.
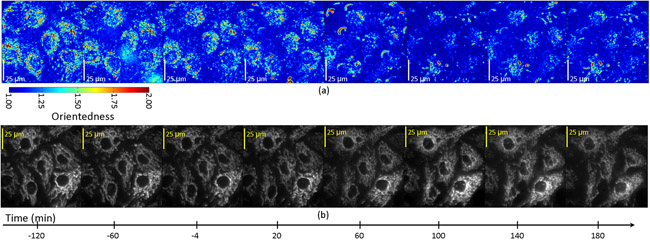
الشكل 4 : نسبة الارتفاع (أ) ومضان (ب) صور من الخلايا البطانية تعامل مع محفز الخلايا ، staurosporine.
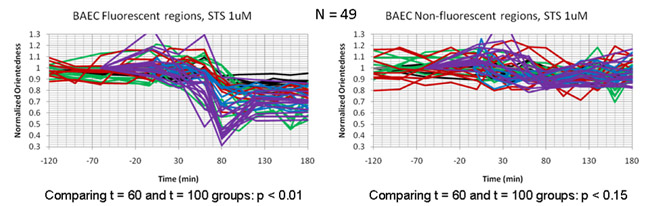
الشكل 5 : مؤامرات الزمن مقارنة انخفاض في نسبة الارتفاع الجسيمات (orientedness) في الخلايا البطانية تعامل مع staurosporine. آثار فردية تمثل المؤامرات وقت واحد داخل الخلايا. ويقتصر الانخفاض في orientedness إلى المناطق الخلايا التي تسجل مع (اللوحة اليسرى) الميتوكوندريا الفلورسنت وغائبة عن المناطق الخلفية المتبقية مضان (اللوحة اليمنى).
الآن أن لدينا العزم على أن انخفاض نسبة الارتفاع يتوافق مع تفتت الميتوكوندريا ، يمكننا أن تحفز الخلايا في هذه الخلايا ، وقياس تجزئة باستخدام طريقة لدينا مبعثر البصرية دون الحاجة إلى تسمية الخلايا ، ودراسة تأثير مختلف الأمراض الوراثية والتجريبية على هذا دينامية.
Discussion
وصف الأسلوب أعلاه خرائط غلة morphometric للكائن الذي قد ترميز حجم الجسيمات أو التوجه على سبيل المثال. ويمكن استخدام هذه المعلومات الهيكلية في عدة طرق :
- ويمكن استخدامه كدليل على شاشة الأولي لتحديد الخلية أو النسيج المناطق ?...
Disclosures
Acknowledgements
وقد تم تمويل الجهاز المرآة الدقيقة في هذه البحوث من خلال منحة مؤسسة ويتاكر RG - 02-0682 إلى بستاني ن. ويتم تمويل الأعمال الجارية من قبل منحة NSF - 0852857 - DBI لبستاني ن. كان مدعوما جزئيا من قبل باسترناك RM زمالة دراسات عليا روتجرز الرئاسي. كما نود أن نشكر الدكتور E. الابيض للخلايا iBMK المستخدمة في دراساتنا وMetaxas الدكتور DN لمناقشة مفيدة حول الاستراتيجيات البصرية التصفية.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | Low glucose DMEM | |
| Liebowitz L15 medium | Invitrogen | Without phenol red | |
| L-glutamine | Invitrogen | ||
| Mitotracker Green | Invitrogen | ||
| Bovine Brain Extract | Clonetics | ||
| Fetal Bovine Serum | Gemini Bio Products | ||
| Heparin | Sigma-Aldrich | ||
| Staurosporine | Sigma-Aldrich | ||
| Dymethylsulfoxide | Sigma-Aldrich | ||
| Inverted microscope | Carl Zeiss, Inc. | Axiovert 200M | |
| DMD | Texas Instruments | TI 0.7 XGA DMD 1100 | |
| CCD | Roper Scientific | Cascase 512B | High (16 bit) dynamic range CCD |
| CCD | Roper Scientific | Coolsnap cf |
References
- Pasternack, R. M., Qian, Z., Zheng, J. -. Y., Metaxas, D. N., White, E., Boustany, N. N. Measurement of Subcellular Texture by Optical Gabor-Like Filtering with a Digitial Micromirror Device. Optics Letters. 33 (19), 2209-2211 (2008).
- Pasternack, R. M., Qian, Z., Zheng, J. -. Y., Metaxas, D. N., Boustany, N. N. Highly sensitive size discrimination of submicron objects using optical Fourier filtering based on two-dimensional Gabor filters. Optics Express. 17 (14), 12001-12012 (2009).
- Zheng, J. -. Y., Pasternack, R. M., Boustany, N. N. Optical scatter imaging with a digital micromirror device. Optics Express. 17 (22), 20401-20414 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved