Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оптическая микроскопия Scatter на основе двумерных фильтров Габора
В этой статье
Резюме
Мы демонстрируем в темном поле микроскопа методом, основанным на Габор типа фильтрации для измерения субклеточных динамики в пределах одного живых клеток. Техника чувствительна к изменениям в структуре органелл, таких как митохондриальный фрагментации.
Аннотация
Мы демонстрируем микроскопических инструмент, который может измерить субклеточных текстуры, вытекающие из органелл морфологии и организации в неокрашенных живых клеток. Предлагаемый документ расширяет чувствительность без наклеек оптической микроскопии в наномасштабе изменения в органелл размер и форму и может быть использован для ускорения изучения структурно-функциональных отношений, относящихся к органелл динамика основных фундаментальных биологических процессов, таких как запрограммированная гибель клеток или клеточных дифференциации. Микроскоп может быть легко реализованы на существующих платформах микроскопии, и поэтому могут быть распространены среди отдельных лабораторий, где ученые могут реализовать и использовать предлагаемые методы с неограниченным доступом.
Предложенная методика может характеризовать субклеточные структуры, наблюдая клетку через двумерные оптические фильтры Габора. Эти фильтры могут быть настроены на чувства с наноразмерными (10 о нм), чувствительность, специфические морфологические признаки, касающиеся размера и ориентации несферических субклеточных органелл. Будучи основан на контрасте порожденных упругого рассеяния, метод не опирается на подробный обратная модель рассеяния или по теории Ми для извлечения морфометрических измерений. Эта техника может быть применена к несферической органелл, для которых точное теоретическое описание разброс не легко дается, и обеспечивает отличительные морфометрические параметры, которые могут быть получены в неокрашенных живых клеток для оценки их функции. Технику выгодно по сравнению с цифровой обработкой изображения, что он работает непосредственно на поле объекта преобразования, а не интенсивности дискретизированным объекта. Он не опирается на высокую частоту дискретизации изображения и поэтому может быть использован для быстрого экране морфологических деятельности в сотни клеток на время, что существенно облегчает изучение структуры органелл за рамки отдельных органелл сегментации и реконструкции флуоресцентной конфокальной микроскопии сильно увеличенных цифровых изображений ограниченное поле зрения.
В этой демонстрации мы показываем данные из морских диатомовых, чтобы проиллюстрировать методологию. Мы также показываем, предварительные данные, полученные из живых клеток, чтобы дать представление о том, как метод может быть применен в соответствующие биологические контексте.
протокол
1. Получение клетки готовы
- Клетки, которые были покрыты за день до этого должны быть помечены зеленым Mitotracker флуоресценции митохондрий.
- Удалить 100 мкМ исходного раствора Mitotracker зеленый в ДМСО, сделанные ранее из морозильника 4 ° С, а нагреться до комнатной температуры с руки. Также вывезти бычьей аорты эндотелиальных клеток (Британская корпорация по атомной энергии) клетки культуральной среде также заранее подготовленные и теплой до 37 ° С в настольный водяной бани.
- После Mitotracker и культуральной среде утеплены, место их в капот убедившись, что для стерилизации вашей руки в перчатках и все наружные поверхности контейнеров с 70% растворе этанола. Не включайте капот света, как люминесцентные метки светочувствительных и быстро photobleach в освещенности комнаты.
- Правильный концентрации для митохондриальных маркировки является очень важным. Слишком мало не будет этикетке митохондрий эффективно, в то время слишком много Mitotracker может оказывать токсическое воздействие. Концентрации 100 нМ Mitotracker инкубировали в течение 45 минут с клетками работает хорошо. Подготовка этой концентрации путем добавления 100 мкл Mitotracker акции до 10 мл культуральной среды в 15 мл трубки. Это позволит сделать много, по крайней мере один эксперимент.
- Заменить существующую среду с меченой среды, высасывая из старой среды с пипеткой Пастера подключены к вакуумной линии. Затем сразу же добавьте 2 мл меченой среды в каждой оккупированной культуры и в 6-луночный планшет.
- Потому что флуоресцентной метки чувствителен к свету, замените клеток в инкубаторе быстро, не подвергая прямому светлая комната. Покрытие 6-луночный планшет с рук работает хорошо для этого. Клетки останутся в инкубаторе в течение 45 минут.
2. Получение оптической схемы готовы
- В то время как клетки ждать в инкубаторе, мы должны включить оптические установки. В комнате оптики, в первую очередь на дуговой ртутной лампы, а затем компьютер, микроскоп, камер и лазера. Затем подключить цифровое устройство микрозеркальным (DMD) и спиннинг диффузора.
- Убедитесь в том, что оптическая запуска выравнивается, глядя через окуляр микроскопа, чтобы поле зрения ярко освещенной лазерным светом.
- Чистая цели, сворачивая одну часть линзы бумаги в плотный квадрат и понять плотно кровоостанавливающего. Опустите объектив бумаги в без аммиака раствор для очистки стекла поглощают небольшое количество в бумагу. Рэп кровоостанавливающего о свободной рукой несколько раз, чтобы удалить лишнюю. Протрите цели, твердо применив один чистый, непрерывный ударить по цели от одного конца до другого, переходя линзы в середине. Запрещается повторно салфетки или скраба. Утилизация использованных бумаги.
- Для загрузки образца, место сетки над 63x цель погружения нефти путем отказа от 1-2 капельки масла на погружение в то время как цель цель все время вниз. Затем поместите сетки в сцене. Затем поднять цель, чтобы масло "захватывает" образца. Фокус образца в окуляр.
- Для выравнивания конденсатора, отрегулируйте высоту конденсатора так, чтобы оно располагалось в освещении центральных Колер, сосредоточив внимание гексагональной краю остановить поле конденсатора. Центр поля конденсатора остановку поля зрения, если необходимо, повернув конденсатора центрирование ручки. Остановить конденсатора отверстия должна быть закрыта.
- Начало IPlab программы и входные параметры для работы RoperScientific Каскад 512 камеры. Убедитесь, что камера настроена на режим передачи кадров. Начать предварительный просмотр, запустив "приобретает фокус" команды. Установить префикс индекса и файлов папку, в которой изображения будут сохранены.
- Запустите программу RSImage и входные параметры для работы CoolSnap программы. Синхронизация режим должен быть установлен в нормальное русло.
- Начало DMD программного обеспечения и место темные диафрагмы поля на скрипт меню, а затем "Load и сброс" командой и запустить скрипт.
- Отправить света DMD и Каскад 512 камеры, установив микроскопом optovar и окна, чтобы МНК. Это пошлет образ с помощью МДД и выровнены оптики, проектирование DF изображение на ПЗС. Темного поля (DF) изображение должно появиться на предварительный просмотр уже ведется в IPlab. Настройка точной фокусировки микроскопа при необходимости сосредоточиться изображение на предварительный просмотр.
- Сделать снимок поле зрения использования "приобрести сингл" команды. Установить время экспозиции достаточно высокой, чтобы обеспечить по крайней мере 10000 пунктам сигнала в изображение. После приобретения, использования "сохранить как индексироваться" команду, чтобы сохранить изображение на диск. Этот образ сетки мер размер поля зрения (FOV).
- Теперь перейдите сетки образец так, чтобы сетка находится вне поля зрения так, что только виден фон. Приобретать фоновое изображение поледостаточно долгое время экспозицию, чтобы гарантировать, что не менее 5000 пунктам сигнал приобрел. Это изображение будет помощь в фоновом режиме вычитания нефильтрованное изображений.
3. Загрузка filterbank и используя установки, чтобы приобрести фильтруется, фоновые изображения
- Теперь нам нужно приобрести Габор фильтра изображения фона. Нагрузка Габор фильтр банка сценарий DMD программным управлением. Выполнить весь сценарий в буфер фильтры для встроенной памяти из ДМД, это может занять несколько минут.
- Как только весь сценарий в буфер, теперь мы можем приобрести фильтруется изображения фона. Используйте запуска и остановки маркеров в ДМД программного обеспечения поручить DMD, чтобы загрузить только один набор фильтров, соответствующих одному Габор как-фильтра за один раз, и запустить скрипт. Предварительный просмотр изображения должны меняться от темно-поле отфильтрованного изображения с фильтром.
- Открытое приобретения скрипта в IPlab с диска. Отрегулируйте время экспозиции, чтобы по крайней мере 2000 пунктам сигнал которой приобретаются. Как DMD скрипт работает, отменить предварительный просмотр в IPlab и запустить приобретения скрипта. Это автоматически приобретать, индекс и сохранить отфильтрованное изображение на диск.
- Как только первое изображение приобретается, остановить скрипт работает в ДМД программного обеспечения и удалять используемые команды из сценария. Замените запуска и остановки маркерами в начале и в конце следующего набора фильтров. Повторите приобретения в IPlab.
- Повторите шаг 3,4, пока весь filterbank использовался, а все отфильтрованные изображения были приобретены и сохранены.
4. Покрытие клетки
- К настоящему времени, клетки в скором времени будет готова пластина для эксперимента. Подключите паяльник на настольный лаборатории. Удалить L15 среду просмотра и тепла до 37 ° C. Сделать работу станции с бумажным полотенцем и Kimwipe. Сделайте несколько фитилей, разорвав и вертела Kimwipes. Фитили поможет в передаче жидкости и из ячейки пластины.
- После этого, мы должны пластине образца. Мы используем обрабатываемых держатели образцов металла пластины наших клеток, что делает "покровное сэндвич" с металлической пластиной посередине. Нанесите тонкий валик вакуумной смазки из шприца вокруг верхней периферии отверстия металлической пластины расширения примерно на полпути до края канавки с каждой стороны. Аккуратно нажмите чистой нет. 1 покровное на смазку. Флип пластиной и применять смазку вокруг отверстия. Выключите комнате свет.
- Теперь мы получаем клетки из инкубатора, обработки инкубатора содержимое нитрила экзамена перчатки стерилизуют 70% этанола. Удалить ячейки пластины из инкубатора, задерживая дыхание, когда дверь инкубатор открыт. Будьте осторожны, чтобы минимизировать воздействие освещения.
- Удалить покровное, который будет использоваться для проведения эксперимента с шестью лунками, отметив, что сторона, которая была лицом вверх в яме на стороне клетки прилагается. Тщательно высушите покровное с обеих сторон, пока не будет почти полностью сухим, сохраняя при этом историю, какая сторона имеет покровное клеток. Затем нажмите покровное, сотовые стороной вниз, на смазанную металлической пластине за просмотр отверстие, убедившись, что нет воздушных зазоров оставаться в смазку слоем. Смазка должна образовывать водонепроницаемый печать, чтобы для нас, чтобы загрузить клеток с L15 среды. Как только вы не уверены в этом, флип назад над пластиной.
- Внесите L15 среды в покрытие клетки, заставляя жидкость через паз между верхним покровным и металлической пластины. Пипетирование 200 мкл в то время, работает хорошо. Первый пипетки объем должен заполнить пространство зажатой между покровные с жидкостью простирается почти до паз на другой стороне.
- Внесите еще 200 мкл среды в покрытие клетки, но на этот раз, удерживая фитиль в роще выступать против так, чтобы среда перетекает из одной стороны в другую. Это моет клеток и удаляет все следы старой среде. Будьте осторожны, чтобы предотвратить любые пузырей в жидкости во время этого шага. Повторите эту процедуру 2-3 раз, используя новый фитиль для каждого полоскания.
- Помните паяльник мы подключили? Сейчас самое время он привыкает. Флип пластины с ног на голову еще раз, поддержку пластинки от края так, чтобы жидкость удерживается в клетке резервуара и не может капать вниз. Dip паяльником в стакане valap. Это будет быстро таять некоторые из valap которые затем будут цепляться за жалом паяльника железа. Осторожно применять расплавленный valap по краям нижней покровное (в настоящее время вверх) с помощью паяльника железа аппликатора. Продолжить погружения и применения пока вы пройти весь путь по всему периметру покровное, герметизация покровное к металлической пластине.
- Нижней покровное имеет клетки, растущие на ней, и, возможно, остатки из высушенных среду на открытой стороне. Очистите от остатков покровного поверхности сальников до Kimwipe и cleaninг покровное в одном скользящее движение так же, как чистка цели. Это гарантирует, что покровное является чистым в центр, где будет рассматриваться.
- Отключите паяльником и возвращение 6-луночный планшет для инкубатора наблюдения же локализации и стерильность процедуры. Возьмите покрытием клетки оптики лаборатории и установки на цель, как описано в пунктах 2.4 и 2.5.
5. Проведение эксперимента
- Найти хороший области, выглядящий здоровым клеткам.
- Приобретать темное изображение области поля зрения. Совместите микроскопом в дифференциальных интерференционного контраста (DIC) и приобрести DIC изображение. Убедитесь, что время экспозиции достаточно длинные, чтобы сигнал является адекватной.
- Теперь мы должны приобрести флуоресцентные изображения на другие камеры. Для получения изображения на ДИК CoolSnap, мы используем синий светодиод придается конденсатора, заменив его и удаляя его по мере необходимости. Хотя микроскопом еще выровнены в ДВС, Отправить свет CoolSnap, установив микроскопом optovar к 1.0x и просмотра до 100% бинокль. Переадресация изображения от окуляра к камере. Место светодиодной над конденсатором, чтобы осветить поле и предварительный просмотр в поле зрения RSimage и корректировать точной фокусировки при необходимости. Приобретать DIC изображения и сохранить на диск. Обратите внимание, как угол обзора, отличается от той, которая получена из Каскад камеры. Эти изображения должны быть зарегистрированы в течение фазы анализа после эксперимента.
- Получить флуоресценции изображения, настраивая фильтр куб флуоресцеина filtercube. Приобретать изображение кратко включения возбуждения флуоресценции использованием микроскопа, а затем отключить его, как только приобретения будет завершена. Так как мы сосредоточились образца в DIC, флуоресценция изображение сфокусировано, а также. Это экономит время экспозиции в флуоресценции, замедляя тем самым фотообесцвечивания. Сохранить флуоресценции образ на диск.
- Теперь мы должны приобрести фильтруется изображений. Сброс микроскоп темного поля и отправить света через LSM порт в 2,9.
- Выполнить весь filterbank Габор сценарий, как в 3.3-3.5. Мы завершили сбор данных для одной временной точке.
6. Переключение среды подвергать клетки стауроспорин (STS), и поддержание среды в течение всего эксперимента
- В то время как клетки все еще на сцене и без нарушения поля зрения, переключиться на регулярной основе L-15 средой для той же содержащей 1 мкМ решение STS из 4 мМ исходный раствор STS в ДМСО. Использование метода, описанного влагу с шагом 4,6 для переключения СМИ.
- Теперь повторите шаги 5.2-5.6 для последующих моментов времени. Мы повторяем этот процесс, пока эксперимент завершен.
- В ходе эксперимента, среда будет более должны быть добавлены таким образец не пересушивает. Это достигается с помощью пипетки среды в роще ячейки пластины без удаления со сцены и, не нарушая FOV.
7. Представитель Результаты
По завершении эксперимента, сбор данных будет включать в себя большое количество изображений, которые фильтруются должны быть обработаны для извлечения субклеточных структурных данных. Два примера показаны для оптического фильтра банка, состоящий из 9 Габор подобные фильтры с = фильтр период S 0.95μm, гауссовские конверт стандартное отклонение S = S / 2 = 0.45μm и ориентации Φ = 0 ° до Φ = 160 ° в 20 ° шагом. (См. также [1] более подробно).
Пример 1: Морские Диатомовые
Мы впервые применили нашу ориентацию чувствительные фильтры банка морских диатомовых образцов (Каролина Биологические Компания питания) с ориентированными функциями, которые были хорошо видны в темном поле (DF) томографии (рис. 1). Оптически фильтруется изображения отображаются рядом с нефильтрованное изображение образца для сравнения.
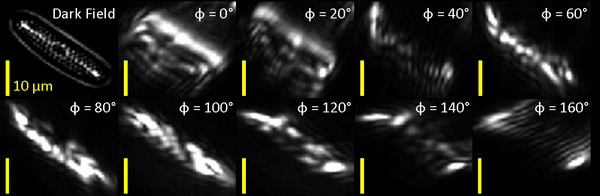
Рисунок 1: Темные поля (DF) и оптически отфильтрованного изображения морских диатомовых водорослей. Мы будем анализировать диатомовых в правом нижнем углу изображения (белая стрелка в левом наиболее панели).
Набор из девяти Габор фильтра изображения диатомовых были обработаны пикселей на пиксель для ориентации объекта и округлость. Обработка состояла из (1) суммирование измеренными всех девяти Габор фильтра изображений в каждом пикселе, чтобы определить общую величину сигнала ответа тем самым кодирования ответ значение, и (2) нахождение ориентации Габор фильтр, Φ, при котором ответ максимальную и принимая отношение этого максимальный ответ на средний ответ для всех углов тем самым кодирования, в какой степени объекты в каждом пикселе имеют преимущественную ориентацию. Степень ориентации тесно связано с геометрическим соотношением сторон частицы. На рис. 2B, тыс.электронной общей реакции пикселя в банк фильтра (параметр 1) и степень ориентации или соотношение сторон (параметр 2) кодируются в насыщенность и оттенок, соответственно. Соотношение сторон около 1 (синий) присутствует в районах, где нет нужного угла ответа, в то время как большие значения (красный), указывают области, в которых выше нужного угла ответ присутствует. Основание ориентации частиц кодируется в колчане участка (рис. 2), где каждая строка тесно согласованы с основной ориентацией на местный уровень объекта, видимого в нефильтрованного темного поля (рис. 2).

Рисунок 2:: Dark полю изображения диатомовых. В: изображение объекта ориентации. Цветовая гамма указывает степень ориентации (соотношение сторон), а яркость кодирует значение общего ответа Габор фильтр. C: Ориентация объектов с ответом интенсивности ≥ 10% от максимума. Отрезок длинной оси указывает соответствующие структуры.
Пример 2: апоптоза клетки
Здесь мы показываем, фильтруется изображения бычьих эндотелиальных клетках, обработанных стауроспорин (STS), которые были обработаны таким же образом, как диатомовых водорослей. Рис. 3 показана нефильтрованное темного поля (DF) образ клетки вместе с девятью фильтруется изображений в момент Т =- 180 мин. до начала лечения STS.
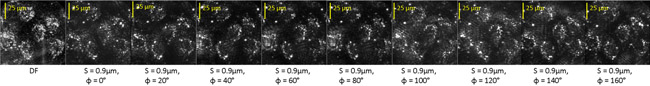
Рисунок 3: Темные поля (DF) и оптически фильтруется образы поле, содержащее несколько живой клетки эндотелия.
Фильтруется изображения были впоследствии приобрел каждые 20 минут в течение трех часов после лечения STS. Рис. 4а показана карта соотношением сторон клетки в зависимости от времени. В этом случае оттенок отражает степень ориентации (обозначенный ориентированность), как для цветового тона на рис. 2b выше. Тем не менее, яркость соотношение сторон не было, взвешенных по средней фильтр ответа. Регистрируясь наши карты с соотношением сторон изображения флуоресценции меченых митохондрий в этих клетках (рис. 4б), мы определили, что падение измеряется соотношением сторон была приурочена к сотовой областей, содержащих митохондрии и одновременно с митохондриальной фрагментации которое можно было наблюдать непосредственно в флуоресцентные изображения одного и того же клеток. Рис. 5 показывает время участки изображающие изменение пропорций в зависимости от времени в клетках апоптоза. Внутри каждой клетки, есть падение соотношения сторон при Т = 60-100 мин в регионах, которые регистрируются с люминесцентными митохондрий, но не в регионах, которые зарегистрированы в тусклом фоне флуоресценции областей.
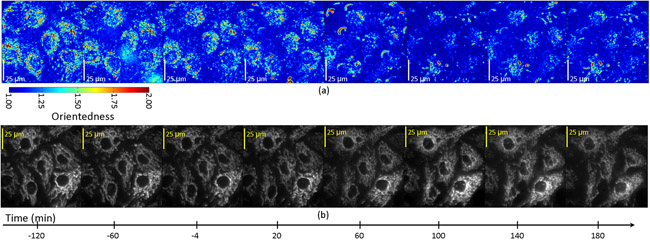
Рисунок 4: Формат кадра (а) и флуоресценции (б) изображений эндотелиальных клетках, обработанных апоптоз индуктора, стауроспорин.
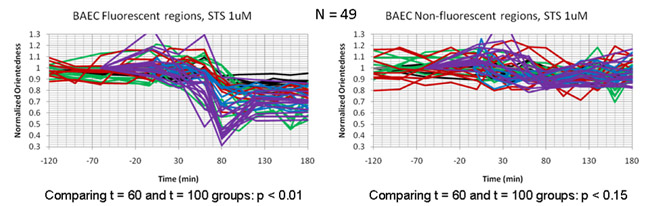
Рисунок 5: Время участков сравнения уменьшение частиц соотношение сторон (ориентированность) в эндотелиальных клетках, обработанных стауроспорин. Отдельные следы представляют время участки в пределах одной клетки. Падение ориентированности сводится к регионам клетки, которые регистрируются с люминесцентными митохондрий (слева) и отсутствует в оставшийся фоновой флуоресценции регионов (правая панель).
Теперь, когда мы определили, что падение соотношение сторон соответствует митохондриальной фрагментации, мы можем вызывать апоптоз в этих клетках, измерять фрагментации с помощью нашего метода оптической разброс без этикетки клеток, и изучения влияния различных генетических и экспериментальных условиях на этом динамичным.
Обсуждение
Описанный выше метод дает морфометрические карты объекта, который может кодировать размер частиц или ориентации, например. Эта структурная информация может быть использована в нескольких направлениях:
- Она может быть использована в качестве начального экрана для идентификаци?...
Раскрытие информации
Благодарности
Микро-зеркала устройство в это исследование было профинансировано Уитакер грант Фонда RG-02-0682 Н. Boustany. Текущая работа финансируется за счет гранта NSF-DBI-0852857 Н. Boustany. RM Pasternack при частичной финансовой поддержке стипендии Президента Rutgers Высшее. Мы также хотели бы поблагодарить д-ра E. White для iBMK клетки, используемые в наших исследованиях и д-р Д. Н. Метаксас за полезные обсуждения относительно оптической фильтрации стратегий.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | Low glucose DMEM | |
| Liebowitz L15 medium | Invitrogen | Without phenol red | |
| L-glutamine | Invitrogen | ||
| Mitotracker Green | Invitrogen | ||
| Bovine Brain Extract | Clonetics | ||
| Fetal Bovine Serum | Gemini Bio Products | ||
| Heparin | Sigma-Aldrich | ||
| Staurosporine | Sigma-Aldrich | ||
| Dymethylsulfoxide | Sigma-Aldrich | ||
| Inverted microscope | Carl Zeiss, Inc. | Axiovert 200M | |
| DMD | Texas Instruments | TI 0.7 XGA DMD 1100 | |
| CCD | Roper Scientific | Cascase 512B | High (16 bit) dynamic range CCD |
| CCD | Roper Scientific | Coolsnap cf |
Ссылки
- Pasternack, R. M., Qian, Z., Zheng, J. -. Y., Metaxas, D. N., White, E., Boustany, N. N. Measurement of Subcellular Texture by Optical Gabor-Like Filtering with a Digitial Micromirror Device. Optics Letters. 33 (19), 2209-2211 (2008).
- Pasternack, R. M., Qian, Z., Zheng, J. -. Y., Metaxas, D. N., Boustany, N. N. Highly sensitive size discrimination of submicron objects using optical Fourier filtering based on two-dimensional Gabor filters. Optics Express. 17 (14), 12001-12012 (2009).
- Zheng, J. -. Y., Pasternack, R. M., Boustany, N. N. Optical scatter imaging with a digital micromirror device. Optics Express. 17 (22), 20401-20414 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены