A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التوسيم وخلايا الدماغ المؤخر التصوير في اسماك الزرد
In This Article
Erratum Notice
Summary
المفتاح لفهم العمليات التي تشكل تخلقية الجنين في وقت مبكر هو القدرة على الخلايا في صورة عالية الدقة. نحن هنا وصف تقنية لوضع العلامات خلايا مفردة أو مجموعات صغيرة من الخلايا في الأجنة الزرد كله مع غشاء استهداف بروتين الفلورية الخضراء.
Abstract
المفتاح لفهم العمليات التي تشكل تخلقية الجنين في وقت مبكر الفقاريات هي القدرة على الخلايا في صورة عالية الدقة. في الأجنة الزرد ، وحقن من نتائج فحص الحمض النووي البلازميد الفسيفساء في التعبير ، والسماح لتصور واحد من الخلايا أو مجموعات صغيرة من الخلايا
Protocol
1.Microinjection
- تمييع بلازميد ترميز الغشاء الذي يستهدف البروتين الأخضر نيون (mGFP ، من باب المجاملة هارلاند ريتشارد) إلى تركيز 40 نانوغرام / مل. أعد بواسطة الحمض النووي linearizing البلازميد (mGFP/PCS2 + ، من باب المجاملة هارلاند ريتشارد) تنقية باستخدام الإعدادية ماكسي Qiagen كيت. ويفضل إضافة أحمر الفينول (مخفف 10/01 الحجم الكلي) إلى حل لتصور الحل. الحل إبقاء الحمض النووي على الجليد.
- تحت stereomicroscope ، معايرة إبرة الحقن (ضربات 90mm الزجاج من الشعيرات الدموية العلمية Narishinge ؛ القط رقم NA - GD - 1) عن طريق مواءمة الإبرة على شريحة تخرج والتنصت بلطف جزءا من الإبرة حيث القطر 1μm باستخدام شفرة حلاقة نظيفة شفرة (للحصول على معلومات سرية من الحجم المناسب).
- من أجل معايرة إبرة لحقن حجم المعروفة (2nl) ، وربط الإبرة إلى الأجهزة microinjection (PCI 100 Microinjector ؛ جهاز هارفارد) ، والجبهة ملء الإبرة مع 0.5μl من محلول يحتوي على أحمر الفينول والماء وضعها على قطعة من البارافين. ويمكن الاستغناء عن حل باستخدام دواسة القدم. ضبط ضغط الجيش الشعبي الكوري إلى 7 وتختلف الوقت (10msec 30msec) بحيث يستغرق 250 الدواسات الاستغناء 0.5μl من الحل.
- بعناية مكان الإبرة معايرة على شريط من الشمع في ترطيب 100 مم طبق بتري. لترطيب الطبق ، ومكان Kimwipes الرطب حول حواف (وهذا يمنع التبخر من الحل في الإبرة).
- استخدام micropipette لتحميل 0.5 1μl من الحمض النووي في نهاية الإبرة (النهاية التي لم تكن محسوبة).
- بمجرد أن وصلت إلى حل غيض الإبرة ، وربط نهاية الإبرة التي كانت تستخدم لتحميل لجهاز microinjection. ضبط الإعدادات على microinjector لتقديم ما يقرب من 2 NL / الحقن باستخدام دواسة القدم.
- القادم الزرد موقف والأجنة في وسط طبق بيتري مليئة متوسطة الأجنة (ألبوم 1.0 مل هانك # 1 ، 0.1 مل هانك الاسهم # 2 ، ألبوم 1.0 مل هانك في رقم 4 ، 95.9 مل DDH 2 O ، ألبوم 1.0 مل هانك و# 5 ، ألبوم 1.0 مل الطازجة وهانك # 6 ، استخدم حوالي 10 قطرات هيدروكسيد الصوديوم M 1 إلى 7.2 درجة الحموضة).
- مرة واحدة في طور الأجنة إلى مرحلة المرجوة ، وقبضة بلطف المشيماء بالملقط الجميلة وضعه الإبرة في المنطقة المستهدفة عن طريق الحقن. لمجموعة واسعة التعبير mGFP ، وضخ الحمض النووي في صفار البيض أو السيتوبلازم في المرحلة 1cell. لتقييد حرية التعبير من mGFP إلى أصغر والمنطقة ، وحقن الحمض النووي في 4 (أو أكثر) مرحلة الخلايا إلى السيتوبلازم من خلية واحدة.
- اضغط على دواسة القدم لجهاز microinjection وتقديم ما يقرب من 2 NL ، وضمان أن يتم حقن صحيح الحل (مرئية بسبب إضافة أحمر الفينول).
- إزالة الإبرة بعناية من الجنين.
- أكرر للجميع الأجنة في صحن بتري.
- السماح لتطوير اجنة في 28.5 درجة مئوية إلى المرحلة المطلوبة.
- Dechorionate الأجنة بواسطة التقشير بلطف قبالة المشيماء باستخدام الملقط غرامة (إذا كان أصغر سنا من أجنة 24hpf ، dechorionating في طبق بتري الزجاج يزيد من معدل بقاء الأجنة).
- إزالة المشيماء فارغة من طبق بيتري باستخدام ماصة الزجاج.
2. التصوير mGFP المسمى المقاطع vibratome
- استخدام ماصة الزجاج لنقل الأجنة في بارافورمالدهيد (4 ٪ تثبيتي في 1X الفوسفات حل العازلة (PBS). فيكس الأجنة عند 4 درجات مئوية خلال الليل.
- غسل الأجنة في برنامج تلفزيوني 1X 3 مرات لمدة 5 دقائق لكل منهما.
- وضع الأجنة في طبق بتري و، وذلك باستخدام ملقط غرامة ، وإزالة صفار دون الإضرار بالجنين. إزالة صفار قدر الإمكان.
- إعداد 4 ٪ منخفضة ذوبان agarose في H 2 O.
- مكان agarose المصهور الى قالب من البلاستيك sectioning.
- استخدام ملقط لرفع الغرامة حقن الجنين من طبق بيتري ، ووضع وتوجيه في agarose. ينبغي وضع الجنين نحو نهاية واحدة من العفن.
- بمجرد تصلب agarose ، استخدم أداة سطح مستو ، مثل ملعقة ، لإزالة كتلة agarose من العفن.
- خفض الحد الادنى من كتلة agarose بشفرة الحلاقة بحيث يكون أكبر.
- إضافة قطرة من الصمغ السوبر إلى مرحلة vibratome ومكان كتلة agarose على ذلك (إلى جانب الكتلة التي كان استقر مع أسلاك شائكة ينبغي مواجهة الغراء). لsectioning أجنة متعددة ، يشن عدة agarose جزءا لا يتجزأ من العينات على المسرح.
- نعلق المرحلة vibratome إلى vibratome (Vibratome ، وشركة).
- تعيين المعلمات من vibratome (إعدادات الشائعة : سرعة 3 ؛ سماكة - 50μm). إذا sectioning أجنة متعددة ، محاذاة كتل agarose على المسرح والتأكد من أن نصل يمر الجنين كلها ولكن ليس من خلال عرض كامل للكتل agarose (مثل تلك المقاطع المقابلة لنفس جنين ستبقى معا).
- صب 1X PBS في المرحلة vibratome.
- المقطع.
- مرة واحدة في الأجنة التقطيعةنيد ، إزالة كتلة agarose (ق) من المرحلة vibratome.
- منفصلة بعناية كل قسم عن طريق قطع الجزء الخلفي من كتلة agarose (ق).
- استخدام ملقط غرامة لتحديد الأجزاء المطلوبة والمكان الى صحن 1X متعددة مملوءة جيدا PBS (استخدام الآبار مختلفة عن الأجزاء المقابلة لأجنة مختلفة).
- كرر لكل الجنين.
- المضي قدما في وضع العلامات الأضداد ، على الرغم من الخطوات 19 23 ، لتعزيز mGFP التصوير (هذه الخطوة قد لا يكون ضروريا إذا كانت المقاطع المصورة في غضون يوم أو يومين من الإعداد).
- أقسام علاج لمدة 30 دقيقة في درجة حرارة الغرفة مع الحل حظر في برنامج تلفزيوني 1X إلى كتلة غير محددة وملزمة.
- احتضان المقاطع مع الأجسام المضادة الأولية (أرنب ، GFP ، Invitrogen القط رقم A11122) المخفف @ 1:200 في حل حظر على شاكر لمدة 5 ساعات في درجة حرارة الغرفة أو بين عشية وضحاها في 4 درجات مئوية.
- غسل أربع مرات (10 دقيقة ، 15 دقيقة ، 30 دقيقة و 60 دقيقة ، ولكل منهما) في 1 ٪ BSA/1X PBS / 1 ٪ حل DMSO.
- علاج الأجسام المضادة الثانوية مع أقسام مناسبة في حل حظر لمدة 5 ساعات في درجة حرارة الغرفة أو بين عشية وضحاها في 4 درجات مئوية.
- غسل أربع مرات (10 دقيقة ، 15 دقيقة ، 30 دقيقة و 60 دقيقة ، ولكل منهما) في 1 ٪ BSA/1X PBS / 1 ٪ حل DMSO.
- علاج المقاطع مع دابي (0.1 ٪ في دابي PBS 1X 50ml ؛ Invitrogen القط رقم D1306) لمدة 30 دقيقة للصمة النوى.
- يغسل ثلاث مرات في برنامج تلفزيوني 1X لمدة 5 دقائق لكل منهما.
- جبل على الشريحة.
- صورة باستخدام المجهر مبائر.
3. يعيش التصوير
- Dechorionate العيش والأجنة حقن 30 دقيقة قبل ان تصل الى مرحلة تنموية المرجوة. وضع الأجنة في حل المهدئة (0.01 ٪ Tricaine متوسطة في جنين) لمدة 15 دقيقة.
- وضع قطرة من agarose 1 ٪ على طبق زجاج 35mm الثقافة القاع (ماتيك ؛ الجزء رقم P35G - O - 20 - C).
- السماح لترسيخ agarose.
- أنبوب الحرارة الشعرية أكثر من اللهب لجعل 3 ثقوب في agarose (يمكن استخدام كائنات أخرى مثل micropipette نصائح لجعل الثقوب). ضمان عدم وجود agarose المتبقية في قعر حفرة.
- ملء طبق بيتري مع متوسطة الأجنة.
- استخدام ماصة الزجاج لوضع الجنين في حفرة.
- المقبل ، توجيه باستخدام ملقط الجنين الغرامة بحيث المنطقة المراد تصويره (رئيس الظهرية) في اتصال مع الزجاج.
- النقل بعناية طبق بيتري إلى مرحلة المجهر (وضع غطاء على طبق بيتري لمنع التبخر).
- بينما التصوير ، وضمان أن الأجنة في 28.5 درجة مئوية.
4. النتائج
نحن هنا وصف نهج مباشرة لصورة واحدة في خلايا الأنبوب العصبي الزرد باستخدام التعبير الفسيفساء. على الرغم من الشفافية البصرية الجنين الزرد ، وجدنا أن يتعزز كثيرا من التصور الخلايا العصبية في الأجزاء التي تم الحصول عليها عبر استخدام vibratome. هذه المقاطع هي سميكة (50 ملم) مما يتيح للتصوير التمديد الخلوية من خلية معينة في طائرات التنسيق المختلفة باستخدام المجهر مبائر. وقد نشرت نتائج استخدام هذه المنهجية في أماكن أخرى 2 ، ولكن الصور ممثل الخلايا في الأنبوب العصبي للجنين WT (الشكل 1) وN - كادهيرين (N - CAD) وتقدم متحولة (الشكل 2). ويظهر الاخير ان الخلايا في المناطق الجانبية من لوحة العصبية في N - نذل المسوخ تفشل في توجيه سليم نحو خط الوسط (الشكل 2). على النقيض من هذا الوسم الفسيفساء ، والظهارة العصبية immunostaining مع علامة سطح الخلية عامة مثل بيتا catenin لا يسمح مورفولوجيا الخلايا الفردية أن تصور (الشكل 3).
وقت التصوير انقضاء الأجنة الحية تكمل فسيفساء من العلامات الثابتة العينات ، مما يمكن من فهم أفضل للديناميات الخلوية التي تحدث أثناء neurulation. وكشف الفيلم أن الخلايا 1 WT بنشاط من أجل ترحيل خط الوسط من خلال توسيع نتوءات غشاء إعلامي المنحى.
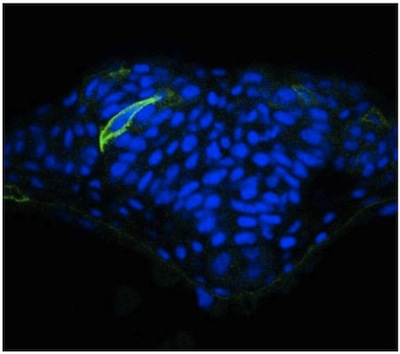
التعبير mGFP الرقم 1. في الأنبوب العصبي للجنين الزرد WT.

التعبير mGFP الرقم 2. في الأنبوب العصبي للجنين الزرد N - كادهيرين.
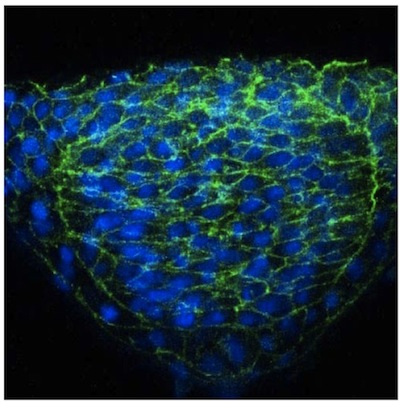
الشكل 3. تلطيخ المناعية B - catenin من الظهارة العصبية.
Discussion
في الختام ، وصفت تقنيات الوسم هنا يسمح للتحليل خلية واحدة من عمليات التخلق في الجنين الزرد. التركيز الأساسي لهذا البروتوكول هو على أساليب التصوير للخلايا المسمى في الأنبوب العصبي باستخدام mGFP تحت سيطرة أحد المروجين في كل مكان. وينبغي للتطبيقات إضافية من هذا التعبير ا...
Disclosures
Acknowledgements
وأيد هذا العمل عن طريق منحة المعاهد الوطنية للصحة التي منحت لبروستر R. (1R01GM085290 - 01A1).
Materials
الحلول
- هانك الاسهم # 1 : 8.0 جرام كلوريد الصوديوم ، 0.4 غرام في 100 مل بوكل د O 2 H
- هانك الاسهم # 2 : 0.358 ز نا 2 هبو اللامائى 4 ، 0،60 ز KH 2 PO 4 في 100 مل O 2 DDH
- هانك الاسهم # 4 : 0،72 ز CaCl 2 في 50 مل O 2 DDH
- هانك الاسهم # 5 : 1،23 ز MgSO 4 x7H 2 O في 50 مل د O 2 H
- 1 العازلة الفوسفات X : 0.8 ٪ كلوريد الصوديوم ، بوكل 0.02 ٪ ، 0.02 M PO4 ، ودرجة الحموضة 7.3
- حجب الحل : 2 ٪ مصل الماعز العادية ، الأبقار مصل الزلال 1 ٪ (BSA) ، dimethysulfoxide 1 ٪ (DMSO)
References
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish Practical approach series. , (2002).
- Hong, E., Brewster, R. N-cadherin is required for the polarized cell behaviors that drive neurulation in the zebrafish. Development. 133, 3895-3905 (2006).
- Andersen, E., Asuri, N., Clay, M., Halloran, M. Live Imaging of Cell Motility and Actin Cytoskeleton of Individual Neurons and Neural Crest Cells in Zebrafish Embryos. J Vis Exp. , (2010).
Erratum
Formal Correction: Erratum: Labeling and Imaging Cells in the Zebrafish Hindbrain
Posted by JoVE Editors on 9/16/2010. Citeable Link.
A correction was made to Labeling and Imaging Cells in the Zebrafish Hindbrain. There was an error in the authors affiliations. The authors have been corrected to:
Pradeepa Jayachandran1, Elim Hong2, Rachel Brewster1
1Department of Biological Sciences, University of Maryland, Baltimore County
2Center for Neuroscience, Children's National Medical Center
instead of:
Pradeepa Jayachandran1, Elim Hong2, Rachel Brewster2
1Center for Neuroscience, Children's National Medical Center
2Department of Biological Sciences, University of Maryland Baltimore County
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved