Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Маркировка и работы с изображениями Ячейки в задний мозг данио рерио
В этой статье
Erratum Notice
Резюме
Ключ к пониманию морфогенетических процессов, которые формируют раннего эмбриона является способность ячеек изображения с высоким разрешением. Мы описываем здесь технику для маркировки отдельных клеток или небольших скоплений клеток в целом эмбрионов данио с мембраной ориентированных зеленый флуоресцентный белок.
Аннотация
Ключ к пониманию морфогенетических процессов, которые формируют раннего эмбриона позвоночных является способность ячеек изображения с высоким разрешением. В данио эмбрионов, введение плазмиды результаты ДНК в мозаике выражение, что позволяет визуализировать отдельные клетки или небольшие скопления клеток
протокол
1.Microinjection
- Развести плазмиды, кодирующей мембраны ориентированных зеленый флуоресцентный белок (mGFP, любезно Ричард Харланд) до концентрации 40 нг / мл. ДНК подготовленных линеаризации плазмиды (mGFP/PCS2 +, любезно Ричард Харланд) очищают, используя Prep Qiagen Maxi Kit. Добавление фенола красного (разбавленного 1 / 10 общего объема), чтобы решение является предпочтительным для визуализации решения. Хранить раствор ДНК на льду.
- Под стереомикроскопа, калибровки инъекционной иглой (90 мм стеклянных капилляров из Narishinge Научно; № по NA-GD-1), совместив иглу на окончила слайдов и аккуратным постукиванием часть иглы, где диаметром 1 мкм, используя чистую бритвы Лезвие (для получения кончик соответствующего размера).
- Для того, чтобы калибровать иглы для введения известного объема (2nl), подключите иглы микроинъекции аппарата (PCI 100 Microinjector; Гарвардского аппарата) и передней заполнить игла с 0.5μl раствора, содержащего фенол красный и воды помещается на листе парафина. Решение можно обойтись использованием педали. Установить давление до 7 кПа и меняться времени (10 мсек 30msec), так что она занимает 250 педали обойтись 0.5μl решения.
- Осторожно поместите калиброванные иглы на полосу воска в увлажненный 100 мм блюдо Петри. Чтобы увлажнить блюдо, место мокрой Kimwipes по краям (это предотвращает испарение раствора в иглу).
- Используйте микропипетки для загрузки 0,5-1 мкл ДНК в конец стрелки (конец, который не был калиброван).
- Как только решение достигла иглы, подключить конце иглы, которая была использована для загрузки микроинъекции аппарата. Настройка параметров microinjector доставить около 2 п / инъекций применяют педали.
- Далее, положение данио эмбрионов в середине чашки Петри заполнены эмбрионов среднего (Stock 1,0 мл Хэнка № 1, 0,1 сток мл Хэнка № 2, Stock 1,0 мл Хэнка № 4, 95,9 мл DDH 2 O, Stock 1,0 мл Хэнка # 5 , Stock 1,0 мл свежей Хэнка № 6, Используйте около 10 капель 1 М NaOH до рН 7,2).
- После эмбрионов развились до желаемой стадии, мягко сцепление хориона с мелкими щипцов и расположить иглу в области целевых для инъекций. Для широких выражение mGFP диапазон, ввести ДНК в желтка или цитоплазмы в стадии 1cell. Чтобы ограничить выражение mGFP в меньшей области, ввести ДНК в 4 (или более) клетки стадии в цитоплазме одной клетки.
- Пресс ногой педаль микроинъекции аппарат и поставить примерно 2 п, гарантируя, что решение (видимый из-за того фенола красного) правильно вводили.
- Осторожно выньте иглу из эмбриона.
- Повторите эти действия для всех эмбрионов в чашке Петри.
- Разрешить эмбрионов развиваться на 28,5 ° С до желаемой стадии.
- Dechorionate эмбрионов, мягко отшелушивающим хориона с использованием тонких щипцов (если эмбрионы моложе 24hpf, dechorionating в стеклянном блюде Петри увеличивает выживаемость эмбрионов).
- Удалить пустые хориона из чашки Петри с помощью стеклянной пипетки.
2. Изображений mGFP меченных vibratome разделы
- Используйте стеклянную пипетку для транспортировки эмбрионов в фиксатор (4% параформальдегида в 1X раствор фосфатного буфера (PBS). Fix эмбрионов при 4 ° С в течение ночи.
- Вымойте эмбрионов в 1X PBS 3 раза по 5 минут каждый.
- Место эмбрионов в чашку Петри и, используя тонкий пинцет, удалите желток, не повреждая эмбрион. Удалить столько желтка насколько это возможно.
- Подготовка 4% легкоплавкой агарозы в H 2 O.
- Место расплавленной агарозы в пластиковые секционирования плесени.
- Используйте тонкий пинцет, чтобы поднять вводят эмбриона от чашки Петри и на место и сориентироваться в агарозы. Эмбрион должен быть расположен на одном конце формы.
- После агарозном затвердел, использовать плоские поверхности инструмента, например, шпателем, чтобы удалить блок агарозы из формы.
- Отрежьте нижнюю часть блока агарозном бритвой, так что это даже.
- Добавить каплю супер клей vibratome сцену и место блока агарозы на нем (стороне блока, который был выровнялся с бритвой приходится сталкиваться клей). Для секционирования нескольких эмбрионов, смонтировать несколько агарозном встраиваемый образцов на сцене.
- Прикрепить vibratome этапе vibratome (Vibratome, Inc.)
- Установите параметры vibratome (общие параметры: скорость-3, толщина 50 мкм-). Если секционирования нескольких эмбрионов, выровнять агарозном блоков на этапе и обеспечить, чтобы лезвие проходит через весь эмбрион, но не через всю ширину блоков агарозы (например, что разделы, соответствующие тому же эмбрион будет оставаться вместе).
- Налейте 1X PBS в vibratome стадии.
- Раздел.
- Как только эмбрионы sectioНед, удалить агарозном блок (и) из vibratome стадии.
- Аккуратно отделите каждую секцию за счет сокращения задней агарозном блок (и).
- Использование тонких щипцов для выбора нужного раздела и поместить в 1X PBS заполненный несколькими хорошо блюдо (использование различных скважин на разделы, соответствующие различным эмбрионов).
- Повторите для каждого эмбриона.
- Приступить к маркировке антител, шагов 19, хотя 23, в целях повышения mGFP томография (этот шаг не может быть необходимым, если разделов в образ будут включены в один или два дня подготовки).
- Лечить разделы в течение 30 минут при комнатной температуре с блокировкой решение в 1X PBS для блокирования неспецифического связывания.
- Инкубируйте секций с первичным антителом (кролик-GFP, Invitrogen Cat номер A11122) разводят @ 1:200 в блокировании решения на шейкере в течение 5 часов при комнатной температуре или на ночь при 4 ° C.
- Промыть в четыре раза (10 мин, 15 мин, 30 мин и 60 мин каждая) в 1% BSA/1X PBS / 1% ДМСО решение.
- Лечить разделы с соответствующими вторичными антителами в блокировании решения в течение 5 часов при комнатной температуре или на ночь при 4 ° C.
- Промыть в четыре раза (10 мин, 15 мин, 30 мин и 60 мин каждая) в 1% BSA/1X PBS / 1% ДМСО решение.
- Лечить секций с DAPI (0,1% DAPI в 50 мл 1X PBS; Invitrogen Cat номер D1306) в течение 30 минут, чтобы пятно ядер.
- Вымойте три раза в 1X PBS в течение 5 минут каждый.
- Горы на слайде.
- Изображение с помощью конфокальной микроскопии.
3. Живая изображений
- Dechorionate жить, вводят эмбрионы 30 минут прежде чем они достигнут желаемого стадии развития. Место эмбрионов в седативным решение (0,01% Tricaine в зачаточном состоянии средней) в течение 15 мин.
- Место падения в 1% агарозном на 35 мм блюдо нижней культуры стекла (Маттек; Номер P35G-о-20-C).
- Разрешить агарозы, чтобы затвердеть.
- Тепло капиллярной трубке над пламенем, чтобы сделать три отверстия в агарозном (другие объекты, такие как подсказки микропипетки могут быть использованы, чтобы сделать отверстия). Убедитесь, что нет остатков агарозы в отверстие внизу.
- Заполните чашки Петри с Эмбрион Средний.
- Используйте стеклянную пипетку поместить эмбрион в отверстие.
- Далее, ориентироваться эмбрион с использованием тонких щипцов так, чтобы область для включения в образ (спинной голова) находится в контакте со стеклом.
- Тщательно транспорта чашке Петри, чтобы столик микроскопа (место крышку над чашке Петри, чтобы предотвратить испарение).
- Хотя изображения, убедитесь, что эмбрионы на 28,5 ° C.
4. Результаты
Мы описываем здесь простой подход к изображению отдельных клеток в нервной трубки рыбок данио использованием мозаики выражения. Несмотря на оптической прозрачности данио эмбриона, мы обнаружили, что визуализация нервных клеток значительно возрастает в поперечных сечениях получены с использованием vibratome. Эти секции толстой (50 мм), что позволяет для работы с изображениями клеточных расширение из данной ячейки в разных фокальных плоскостях использованием конфокальной микроскопии. Результаты использования этой методологии были опубликованы ранее 2, но представитель изображения клеток в нервной трубки из WT эмбриона (рис. 1) и N-кадгерина (N-CAD) мутант (рис. 2) предусмотрены. Последний показал, что клетки в боковых областях нервной пластинки в N-хама мутанты не в состоянии должным образом ориентироваться по отношению к средней линии (рис. 2). В отличие от этой мозаики маркировки, иммунной нейроэпителия с общим маркером клеточной поверхности, такие как бета-катенина не позволяет морфология отдельных клеток для визуализации (рис. 3).
Временной интервал изображения живых эмбрионов дополняют мозаику маркировки фиксированных экземпляров, что позволяет лучше понять клеточной динамики, которые имеют место во время нейруляции. Фильм 1 показали, что WT клетки активно мигрируют в средней линии, расширяя медиально-ориентированных выступов мембраны.
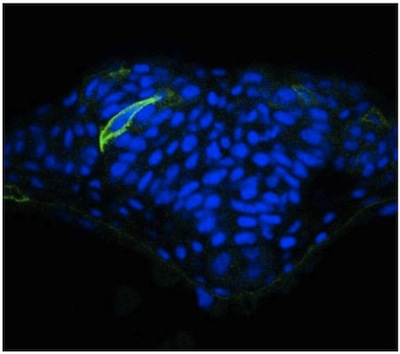
Рисунок 1. MGFP выражение в нервной трубки из WT эмбриона полосатого данио.

Рисунок 2. MGFP выражение в нервной трубки из N-кадгерина эмбрионов данио.
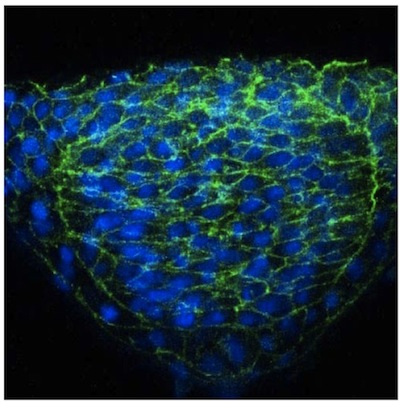
Рисунок 3. Б-катенина иммуно окрашивание нейроэпителия.
Обсуждение
В заключение маркировки методов, описанных здесь, позволяют одном анализе ячейки морфогенетических процессов в данио эмбриона. Основной акцент этого протокола является по методам визуализации меченых клеток в нервной трубки использованием mGFP под контролем вездесущий промоутер. Для ...
Раскрытие информации
Благодарности
Эта работа была поддержана NIH грант присужден R. Брюстер (1R01GM085290-01A1).
Материалы
Решения
- Хэнка Лот № 1: 8,0 г NaCl, 0,4 г хлорида калия в 100 мл дд H 2 O
- Хэнка Лот № 2: 0,358 г Na 2 HPO 4 безводный, 0,60 г KH 2 PO 4 в 100 мл DDH 2 O
- Хэнка Лот № 4: 0,72 г CaCl 2 в 50 мл DDH 2 O
- Хэнка Лот № 5: 1,23 г MgSO 4 x7H 2 O в 50 мл дд H 2 O
- 1 X фосфатного буфера: 0,8% NaCl, 0,02% KCl, 0,02 M PO4, рН 7,3
- Блокировка Решение: 2% нормальной козьей сывороткой, 1% бычьего сывороточного альбумина (БСА), 1% dimethysulfoxide (ДМСО)
Ссылки
- Nüsslein-Volhard, C., Dahm, R. . Zebrafish Practical approach series. , (2002).
- Hong, E., Brewster, R. N-cadherin is required for the polarized cell behaviors that drive neurulation in the zebrafish. Development. 133, 3895-3905 (2006).
- Andersen, E., Asuri, N., Clay, M., Halloran, M. Live Imaging of Cell Motility and Actin Cytoskeleton of Individual Neurons and Neural Crest Cells in Zebrafish Embryos. J Vis Exp. , (2010).
Erratum
Formal Correction: Erratum: Labeling and Imaging Cells in the Zebrafish Hindbrain
Posted by JoVE Editors on 9/16/2010. Citeable Link.
A correction was made to Labeling and Imaging Cells in the Zebrafish Hindbrain. There was an error in the authors affiliations. The authors have been corrected to:
Pradeepa Jayachandran1, Elim Hong2, Rachel Brewster1
1Department of Biological Sciences, University of Maryland, Baltimore County
2Center for Neuroscience, Children's National Medical Center
instead of:
Pradeepa Jayachandran1, Elim Hong2, Rachel Brewster2
1Center for Neuroscience, Children's National Medical Center
2Department of Biological Sciences, University of Maryland Baltimore County
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены