Method Article
التخيل والكمي لالتفاعلات داخل الخلايا النيسرية السحائية والإنسان α - actinin بواسطة التصوير متحد البؤر
In This Article
Summary
يمكن النيسرية السحائية (نيوتن متر) ، وهي سلبية غرام الممرض التنفسي للإنسان على وجه التحديد ، ربط الإنسان actinin - α. هنا نقدم بروتوكول للتصور colocalisation للبكتيريا مع الخلايا α - actinin بعد دخول البكتيريا إلى خلايا الاوعية الدموية الدقيقة في الدماغ البطانية (HBMECs).
Abstract
البروتين بمسانده من النيسرية السحائية (نيوتن متر ، المكورة السحائية) هي أرض لا يتجزأ من البروتين وأعربت الغشاء الخارجي ، والتي يمكن أن تكون بمثابة adhesin وفعالة لالإنفازين الإنسان الخلايا الظهارية والبطانية. حددنا البطانية ارض تقع لل integrins باسم المستقبلات الرئيسية لمكتب أمين المظالم ، وهي عملية تتطلب OPC لربط أول يغاندس إنتغرين مثل vitronectin وعبر هذه إلى خلايا مستقبلات أعرب 1. هذه العملية يؤدي إلى الغزو الجرثومي للخلايا بطانة الأوعية الدموية 2. في الآونة الأخيرة ، لاحظنا التفاعل مع بمسانده من البروتين الموجود في 100kDa lysates خلية كاملة من الخلايا البشرية 3. لاحظنا في البداية هذا التفاعل عندما بروتينات الخلية المضيفة مفصولة الكهربي ونشف إلى النيتروسليلوز كانوا مضافين مع OPC ، معربا عن نيوتن متر. كان التفاعل المباشر ، ولم يتضمن جزيئات متوسطة. بواسطة مطياف الكتلة ، أنشأنا هوية البروتين كما α - actinin. كما أعرب عن أي سطح عثر α - actinin على أي من خطوط الخلايا eight فحصها ، كما والتفاعلات OPC مع الخلايا البطانية في وجود الرصاص في الدم للدخول البكتيريا الى الخلايا المستهدفة ، ونحن دراسة إمكانية التفاعل البروتينين intracellularly. لهذا ، أصيب الاوعية الدموية الدقيقة في الدماغ البشري مثقف الخلايا البطانية (HBMECs) مع OPC ، معربا عن نيوتن متر لفترات طويلة والمواقع من البكتيريا والمنضوية α actinin ، تم فحص المجهري متحد البؤر التي كتبها. لاحظنا الوقت التي تعتمد على زيادة في colocalisation نيوتن متر من البروتين مع هيكل الخلية ، التي كانت كبيرة بعد فترة ثماني ساعات من تدخيل البكتيرية. بالإضافة إلى ذلك ، مكن استخدام برامج التصوير الكمي لنا للحصول على قياس نسبي لcolocalisation نيوتن متر مع α - actinin هيكل الخلية والبروتينات الأخرى. هنا نقدم بروتوكول للمرئيات والكمي لcolocalisation للبكتيريا مع البروتينات داخل الخلايا البكتيرية بعد دخوله إلى الخلايا البطانية الإنسان ، على الرغم من أن هذا الإجراء ينطبق أيضا على الخلايا الظهارية البشرية.
Protocol
1. المناعي البروتوكول
الغرس والعدوى والمناعة تلطيخ -
وتتطلب الإجراءات التالية مناسبة الأنسجة مستوى ثقافة السلامة والمختبرات الميكروبيولوجية.
DAY 1
A. إعداد الخلايا المستهدفة للعدوى
- HBMECs البذور على 50 ٪ التقاء (~ 1.5x10 4 خلايا / سم 2) على الزجاج coverslips (16 مم) توضع في صفيحة ال 12 جيدا (3.8 سم مجال النمو 2 / أيضا).
متوسطة النمو : 1640 RPMI تستكمل مع المعطل للحرارة بنسبة 15 ٪ (56 درجة مئوية ، 30min) FBS ، 2 مم الجلوتامين ، 1 البيروفات الصوديوم مم ، 100 U / مل البنسلين / الستربتوميسين ، 1 ٪ (V / V) MEM غير الأمينية الأساسية الأحماض حل و 1 ٪ حل الفيتامينات MEM. - ثقافة أكثر من ليلة (O / N) في 37 درجة مئوية ، في حاضنة CO 2 5 ٪.
باء ثقافة البكتيرية
- زراعة سلالة من الفائدة O / N (16-18 ساعة) على سبيل المثال المتوسطة المطلوبة تسريب القلب الدماغ (بهي) لوحات أجار تستكمل مع 10 ٪ في الدم الحصان ساخنة في 37 درجة مئوية في الغلاف الجوي بنسبة 5 ٪ CO 2 4.
DAY 2
A. إعداد تعليق (N. السحائية) الجرثومي
- استخدام حلقة 10 ميكرولتر الثقافة ، وجعل وقف ثقافة البكتيرية بين عشية وضحاها في PBSB مل 2 (PBS مع الكالسيوم والمغنيسيوم).
- سماح المجاميع البكتيرية كبيرة لتسوية من خلال ترك تعليق على الوقوف لمدة 5 دقائق في درجة حرارة الغرفة (RT).
- بيليه من دون إزعاج ، ونقل أفضل 1 مل من تعليق (الأسهم قيحة) في أنبوب العقيمة.
- لتقدير أعداد البكتيريا في قيحة الأسهم ، إضافة aliquots (20-50 ميكرولتر) لأنابيب تحتوي على كميات من 1mL SDS 1 ٪ في 0.1M هيدروكسيد الصوديوم واخلطه برفق لsolubilise.
- قياس محتوى الحمض النووي من الحل من خلال تحديد الامتصاصية في 260nm (A260). في أيدينا ، A260 من 1 يناظر 5x10 8 مستعمرة / مل (كفو / مل). ويمكن التحقق من ذلك عن طريق إعداد سلسلة من التخفيفات لقيحة الأسهم في PBSB ، والطلاء على لوحات من أجار والفرز بعد المستعمرات O / N الحضانة.
- تمييع an قسامة من قيحة الأسهم في الإصابة المتوسطة [(M199 تستكمل مع 2 ٪ decomplemented (56 درجة مئوية ، 30min) الإنسان العادي المصل (NHS)] للحصول على الكثافة المطلوبة للعدوى بكتيرية من الخلايا المستهدفة.
- في المختبر لدينا ، وتستخدم بشكل روتيني على نسبة العدوى من 200-300 البكتيريا في الخلية المستهدفة.
باء العدوى خلية ثقافة
- غسل coverslips مع الخلايا المستهدفة مثقف 3 مرات مع هانك المتوسطة لإزالة أي أثر للمضادات الحيوية.
- تصيب الخلايا البكتيرية مع تعليق الطازجة (المذكورة أعلاه) لمدة 3 إلى 8 ح ح عند 37 درجة مئوية ، في 5 ٪ CO 2.
- في نهاية فترة العدوى ، وغسل خلايا ثلاث مرات مع برنامج تلفزيوني والإصلاح في 500 ميليلتر من بارافورمالدهيد 2 ٪ (PFA) عن 30-45 دقيقة في RT أو O / N عند 4 درجات مئوية.
- تم العثور على تثبيت بارافورمالدهيد في التركيز والوقت الموضح أعلاه لتكون مناسبة للحفاظ على مورفولوجيا البكتيرية والخلوية.
- بعد غسله بارافورمالدهيد ، permeabilise الخلايا بارافورمالدهيد الثابتة التي يحتضنها 0.1 ٪ تريتون X - 100 المخفف في برنامج تلفزيوني لمدة 10 دقيقة.
- غسل العينات 3 مرات مع برنامج تلفزيوني.
- انتقل إلى تلطيخ المناعية ، أو بدلا من ذلك ، ترك العينات في 500 ميليلتر من 1 ٪ BSA / PBST O / N عند 4 درجات مئوية.
اليوم 3
المناعية تلطيخ
تلطيخ من البكتيريا داخل الخلايا ويمكن أن يؤديها α - actinin أو بالتتابع في وقت واحد عن طريق استخدام الأجسام المضادة المناسبة الابتدائية والثانوية على النحو التالي ، ويمكن تنفيذ جميع الإجراءات في 12 - جيدا لوحات.
- كتلة الخلايا التي تحتوي على coverslips permeabilised مع 500 ميكرولتر من 3 ٪ BSA / PBST (PBS تحتوي على 0.05 ٪ تريتون X - 100) عن 30-60 دقيقة في RT
- بعد الغسيل مع برنامج تلفزيوني ، ونقل كل ساترة لبئر جاف جديد في صفيحة ال 12 أيضا.
- إضافة أجسام مضادة ضد البكتيريا والابتدائي α actinin ؛ ثمانين 100 ميكرولتر من الأجسام المضادة في ساترة غير كافية إذا أضيف بعناية لتغطية سطح ساترة. لاحتضان 1H في درجة حرارة الغرفة.
- استخدمنا مصل الأرنب النسائل المتعددة ضد النيسرية السحائية (المختبرية التي أثيرت) والفأر ريتوكسيماب (ماب) ضد α - actinin (Abcam) في وقت واحد. في بعض التجارب ، وبدلا من مكافحة α - actinin ، استخدمت ضد MABS الأكتين أو vimentin (سيغما).
- في نهاية الحضانة ، إضافة ميكرولتر من 200 برنامج تلفزيوني إلى البئر ، ورفع ساترة ومكان في برنامج تلفزيوني جديد يحتوي على 500 ميكرولتر جيدا.
- بعد 5 دقائق ، وإزالة PBS التي pipetting ثم إضافة برنامج تلفزيوني جديد. كرر مرتين. نقل إلى coverslipsجفاف آبار جديدة.
- إضافة الأجسام المضادة المناسبة لfluorochromes الثانوية مترافق مختلفة مخففة في 1 ٪ BSA / PBST ؛ في احتضان RT ل1H في الظلام.
- للكشف عن البكتيريا ، كنا المضادة للأرنب الإيج مترافق لTRITC وα - actinin وغيرها من اكتشاف بروتين هيكل الخلية ، التي استخدمناها لمكافحة فأر الإيج مترافق إما FITC - (سيغما) أو فلور اليكسا 488 -- (Invitrogen).
- في نهاية الحضانة ، ويغسل كما هو الحال في الخطوتين 4 و 5.
- مكافحة وصمة عار مع 0،6 ميكروغرام / مل دابي في برنامج تلفزيوني (DNA وصمة عار) لمدة 5 دقائق على RT في الظلام.
- التشطيف مع برنامج تلفزيوني.
- جبل coverslips (خلايا لأسفل) على شرائح مع انخفاض المتوسط تركيب (ه ، ز Mowiol أو Vectashield)
- مخزن في الظلام في 4 درجات مئوية.
- نماذج جاهزة للمراقبة تحت المجهر.
2. الميكروسكوب الضوئي ليزر متحد البؤر (CLSM)
لمراقبة والتقاط الصور من البكتيريا داخل الخلايا والعناصر هيكل الخلية ، استخدمنا عينات immunolabelled والصور الملتقطة باستخدام الليزر لايكا مبائر SP5 - AOBS مجهر المسح موصولة إلى مجهر لايكا DM I6000 epifluorescence مقلوب. وقد تم جمع كل الصور باستخدام 63x NA الغمر النفط 1.4 موضوعية وعملية مع برنامج لايكا.
CLSM الداخلي :
- للبدء في إجراء CLSM ، إضافة قطرة من زيت الغمر للهدف ومكان الشريحة العينة ، ساترة ، الجانب السلبي ، على المسرح المجهر.
- تعيين المجهر لوضع المرئية والعثور على مجال الاهتمام باستخدام قطعة عين المجهر.
- باستخدام برامج لايكا ، حدد النمط اقتناء XYZ.
- حدد 512 × 512 شكل (حجم الإطار). colocalisation للدراسات ، وارتفاع القرار ، وأكثر دقة للصورة ؛ مع الأخذ في الاعتبار الحد من القرار المجهر. ثم حدد الوضع X ثنائية الاتجاه ، الأمر الذي سيزيد من سرعة المسح الضوئي وتساعد على تقليل الصور التبييض.
- إعداد متسلسلة إعدادات المسح الضوئي. انقر في وظيفة "تسلسل" ، واختيار واحد من وسائط المسح الضوئي. نستخدم "بين السطور" واسطة.
- حدد أشعة الليزر وفقا لfluorochromes مترافق مع الأجسام المضادة الثانوية : 405 نانومتر لدابي (أزرق) ، 488 نانومتر لفلور اليكسا 488 (الأخضر) و561 نانومتر لTRITC (الحمراء). تفعيل أنبوب مضخم (PMT) 1 ، 2 ، و 3 على التوالي. ضبط إعدادات PMT للكشف عن الانبعاثات الطول الموجي الصحيح.
- إعداد الأعلى ("بدء") والقاع ("نهاية") من مداخن ض أو سلسلة. المقبل ، تعيين المطلوبة "Z - حجم الخطوة".
- النيسرية السحائية هي المكورة (الشكل 1G) ، ولأن كل مكورة ويبلغ قطرها 0.5 ميكرومتر التقريبي ، وقد تم اختيار حجم ض خطوة من 0.20 ميكرون لتعزيز احتمال مسح كل مكورة مرتين على الأقل. بل هو أيضا ضمن حجم الخطوة القرار الأمثل لل0،1-0،2 ميكرون.
- تعيين المعلمات المسح النهائي عن طريق اختيار خط المتوسط من 3 إلى تحسين إشارة إلى نسبة الضوضاء.
- بالنقر على "بدء" يتم الحصول على الصور المزدوج أو ثلاثة أضعاف عن طريق المسح الضوئي الملون متتابعة عند أطوال موجية مختلفة للقضاء عبر نقاش بين chromophores مختلفة.
- للإشارة colocalisation اثنين من fluorochromes ، حدد "تراكب" وظيفة لدمج القنوات المختارة في صورة واحدة ، على سبيل المثال ، عندما تكون كل اليكسا 488 (الأخضر) وfluorochromes TRITC (الحمراء) colocalise ، واللون الأصفر وسوف تظهر في الصورة مضافين .
- ترجمة Z - المداخن أو سلسلة باستخدام "أقصى قدر من الإسقاط" وظيفة لبناء صورة 2D اللازمة لتصور colocalisation ممكن. ويمكن الحصول على تحليل أكثر تفصيلا للcolocalisation من خلال تحليل كل مقطع البصرية.
- بعد الحصول على Z - المداخن أو سلسلة ، وعملية الحصول على البيانات الخاصة بك على صورة لرؤية متعامد توطين الخلايا من العناصر المختلفة (الشكل 1E).
3. الكمي للColocalisation
يتم إجراء التحليلات الإحصائية للصور مبائر مجهر المسح مع برنامج Volocity (الارتجال ، PerkinElmer). هذا البرنامج يوفر أداة مصممة خصيصا للتحليل colocalisation كما وصفها آخرون Manders (1993) 5. ويمكن وصف Colocalisation في سياق مضان التصوير الرقمية ، الكشف عن إشارة في نفس فوكسل (حجم بكسل) الموقع في كل قناة. وأدلى القناتين حتى من الصور من اثنين fluorochromes مختلفة مأخوذة من نفس العينة في منطقة (Volocity دليل المستخدم). يتم إجراء التحليلات الإحصائية باستخدام برنامج Volocity (الارتجال ، PerkinElmer) باستخدام التحليل الكمي Colocalisation المبينة أدناه.
التحليل الكمي Colocalisation
- إنشاء مكتبة الصور مع CLSM Volocity باستخدام البرمجيات.
- حدد "التركيز الموسعة" من الصورة في الشريط العلوي. وسوف تجمع هذه الأداة Z - المداخن في صورة 2D لتحليلها.
- حدد "Colocalization" الأداة. ينبغي للقناتين لتحليلها وعمق اللون نفسه.
- حدد المنطقة التي أرادت أن يكون كميا. تعيين العتبة لإزالة أي خلفية.
- إنشاء الإخراج colocalisation عن طريق اختيار "توليد colocalization". تتولد الإحصاءات Colocalisation للمناطق ذات الاهتمام المحدد سابقا.
- حدد Manders 'معاملات R (معامل التداخل) و بي (معامل colocalisation)
- معاملات Manders "ليست حساسة لشدة تلوين كما يتم تطبيع ضدهم مجموع كثافة بكسل ، وبالتالي يمكن استخدامها لحين وتلطيخ مستضد واحد أقوى من الآخر.
- R معامل التداخل وفقا لManders 5،6 يمثل درجة الحقيقية للcolocalisation ، أي أن عدد البكسل colocalise بالمقارنة مع العدد الإجمالي للبكسل.
- من ناحية أخرى ، فإن معامل colocalisation ، بلدي ، ويصف مساهمة مضان شاردة من أكثر وفرة (في هذه الحالة α - actinin ، الأخضر) إلى أقل شاردة وفيرة (في هذه الحالة البكتيريا ، والأحمر) ، أي عدد البكسل الحمراء التي تتداخل مع بكسل الخضراء بالمقارنة مع العدد الكلي للخلية حمراء.
- معاملات Manders "تتراوح ما بين 1 و 0 ، 1 مع كونها colocalisation عالية ، 0 لا شيء يجري ، ولكن يمكن التعبير عنها على أنها نسبة لسهولة التفسير.
- تصدير الإحصاءات إلى القيم وثيقة Excel لعرض البيانات.
4. ممثل النتائج
جواني توطين OPC - معربا عن النيسرية السحائية وα - actinin
مبائر التصوير من خلايا الاوعية الدموية الدقيقة في الدماغ البشري البطانية المصابين نيوتن متر لمدة 3 ساعات و 8 على النحو الموصوف أعلاه من colocalisation أشار α - actinin نيوتن متر ، والتي يبدو أنها قد تكون أقل تواترا في 3 تجارب العدوى ح (لا يظهر) مقارنة مع الثقافات المصابة لمدة 8 ساعات ( الشكل 1 AF). ولوحظ وجود واضح للcolocalisation α - actinin مع OPC ، معربا عن المكورات السحائية في كل مرة في التجارب 5> تكرار. وأجري التحليل الإحصائي باستخدام الصور colocalisation مبائر عدة على النحو المبين أعلاه. عموما ، في HBMEC المصابين ، معربا عن OPC السحائية ، وكان الحصول على> التداخل 25 ٪ من الأخضر (α - actinin) بكسل والحمراء (نيوتن متر) (الشكل 2B ، معامل التداخل R). على النقيض من α - actinin التجارب ، التي كان يؤديها في وضع العلامات من البكتيريا وإما داخليا أو أكتين vimentin ، لوحظ في بعض الأحيان مع colocalisation الأكتين ولكن هذا أمر نادر مع vimentin (Figure. 2B).
كما تم تحليل البيانات باستخدام معامل بلدي ، والتي تأخذ في الاعتبار الوفرة النسبية في كل شاردة. بلدي هو مقياس لمدى تواتر حدوث إشارة أكثر وفرة (في هذه الحالة الأخضر ، α - actinin) في كل مرة اشارة أقل وفرة (في هذه الحالة حمراء ، والبكتيريا) ويحدث. هذا الاجراء يدل على مستوى ضرب وقوع α - actinin في محيط المنضوية السحائية (الشكل 2A وجيم).
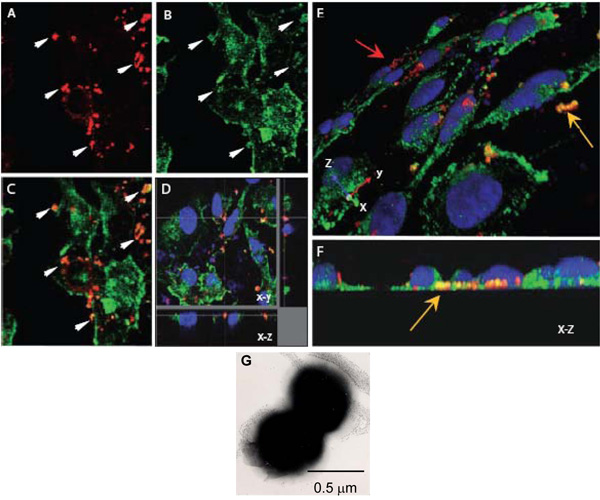
الشكل 1. مبائر المجهري المسح بواسطة أشعة الليزر لتقييم التفاعل بين الخلايا ن. السحائية مع α - actinin. ه. أصيب monolayers البطانية متموجة نمت على coverslips مع OPC ، معربا عن N. (AF) السحائية. بعد 8 ساعات ، تم غسلها غير ملتصقة قبالة البكتيريا ، وخلايا وثابت مع بارافورمالدهيد permeabilised بنسبة 0.1 ٪ تريتون 100 - X. في وقت لاحق ، تم صبغ البكتيريا وα actinin على النحو الموصوف أعلاه (α - actinin ، الخضراء ، البكتيريا ، والأحمر).
سي. حقل واحد تظهر الصور س ص لموقع نيوتن متر (A) أو α - actinin (B). صورة التراكب في (C) إلى العديد من المناطق التي أصفر اللون البرتقالي يوحي colocalisation يبدو. السهام في الفقرة (أ) و (ب) المناطق التي تظهر درجة عالية من α - actinin تراكم على ما يبدو وقع قرابة البكتيريا.
دال تشريح البصرية لcolocalisation المصابة المونولاير HBMEC تشير حول البكتيريا داخل الخلايا الموجودة في قاعدة خلية.
مرة أخرى ، هذا ليس colocalisation نظرا لقربها من عرضية α - actinin ، والجنرال صمة α - actinin في هذه المنطقة منخفضة.
E و F. صورا ثلاثية الابعاد لمعالجة المصابين monolayers HBMEC على النحو الوارد أعلاه. وجهة نظر المائل السطح القمي (E) يبين البكتيريا الملتصقة ملطخة باللون الأحمر (السهم الأحمر) ، في حين يقع العديد من البكتيريا نحو السطوح القاعدية من الخلايا البطانية (السهم الأصفر) والبرتقال واضح / أصفر اللون. ويمكن موقع القاعدية أكثر وضوحا في المشاهدة (F) الذي يشكل في نهاية XZ المقطع العرضي.
G. المجهر الالكتروني الملون سلبا صورة N. السحائية عرضهالمكورة المزدوجة السائدة منه. كل القرمزية هو حوالي 0.5 ميكرون في القطر.
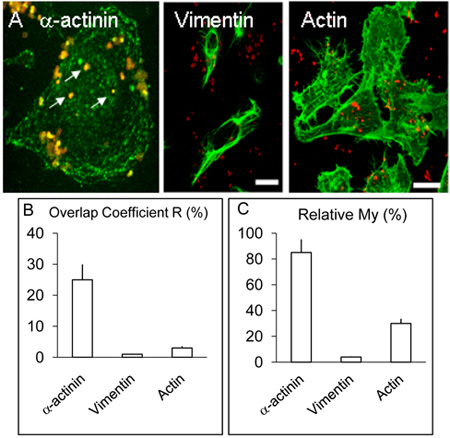
الشكل 2. التوطين وتوزيع α - actinin ، وvimentin الأكتين في الخلايا HBMEC.
تم علاج المصابين من ألف monolayers HBMEC كما هو موضح في أعلاه ولكن الأسطورة ، بالإضافة إلى α - actinin ، استخدمت بعض coverslips للكشف عن الأكتين أو vimentin بإجراءات مماثلة لتلك التي لα - actinin. كما ذكر أعلاه ، α - actinin تتركز حول البكتيريا المنضوية عدة (السهام البيضاء). لم Vimentin وأكتين لا colocalise مع البكتيريا إلى مستويات ملحوظة. شريط يمثل 20 ميكرون.
تم الحصول على B. & C. وقيم ومعاملات R بلدي من أكثر من ثلاث تجارب باستخدام البرمجيات Volocity كما هو موضح أعلاه.
Discussion
إمكانية ربط المنضوية OPC ، معربا عن النيسرية السحائية لα - actinin تم استكشافها من قبل باستخدام HBMEC فحص colocalisation من البكتيريا والبروتين هيكل الخلية في الخلايا المصابة بعد 3 و 8 فترة حضانة ح. بواسطة الفحص المجهري متحد البؤر ، يمكن أن يكون أظهر colocalisation من النيسرية السحائية مع α - actinin. على وجه الخصوص ، على الرغم من أن البكتيريا المنضوية في 3 ساعات ، كان هناك القليل مع colocalisation α - actinin في هذه النقطة الزمنية. وكانت أعداد كبيرة من الجراثيم البكتيرية الجمعيات مع هيكل الخلية البروتين يبدو بحاجة إلى فترة أطول من الإقامة داخل الخلايا وبعد فترة العدوى ح 8 ، α - actinin على ما يبدو في ارتباط وثيق. ألفا actinin هو بروتين متعددة الوظائف ، والتفاعلات البكتيرية مع هيكل الخلية يمكن أن يكون عنصر تأثير كبير على وظيفة خلايا الهدف الذي هو موضوع الدراسات الحالية.
الكمي للcolocalisation على النحو المبين أعلاه يتطلب إعداد دقيق العينة. وينبغي إيلاء اهتمام خاص لتثبيت العينة ، وعرقلة الفترة والتخفيفات الأضداد. للحصول على أفضل إشارة إلى نسبة الضوضاء ، ينبغي معاير كل الأضداد الابتدائية والثانوية في التجارب الأولية لتحديد تركيزات الأمثل. في تجربتنا ، أنتجت Mowiol المتوسطة المتزايدة أفضل الصور.
Disclosures
Acknowledgements
وتم تمويل هذه الدراسات من قبل ويلكوم ترست والمملكة المتحدة والتهاب السحايا. وقدمت HBMEC خط خلية KS الدكتور كيم. أجريت التصوير مبائر والمجهر الإلكتروني في مرفق Bioimaging ولفسون ، جامعة بريستول. نود أيضا أن نشكر السيد آلان Leard ، الدكتور مارك جيبسون (جامعة بريستول) ، والسيد آلان تيلي (PerkinElmer) لما قدموه من مساعدة والمشورة.
Materials
1. الميكروسكوب الضوئي ليزر متحد البؤر (CLSM) :
ايكا SP5 نظام التصوير مبائر : هذا النظام ، وذلك باستخدام مزيج من AOTF (صوتية البصرية تصفية tuneable) وAOBS ملف (صوتية بصرية شعاع التقسيم) ، ويبسط الإثارة مع أطوال موجة معينة.
2 - البرامج :
ايكا مبائر LCS البرنامج ، لايكا مايكروسيستمز ، ألمانيا.
Volocity 5 ، الارتجال ، PerkinElmer ، الولايات المتحدة الأمريكية.
References
- Virji, M., Makepeace, K., Moxon, E. R. Distinct mechanisms of interactions of Opc-expressing meningococci at apical and basolateral surfaces of human endothelial cells; the role of integrins in apical interactions. Molecular Microbiology. 14, 173-184 (1994).
- Virji, M., Makepeace, K., Peak, I. R., Ferguson, D. J., Jennings, M. P., Moxon, E. R. Opc- and pilus- dependent interactions of meningococci with human endothelial cells: molecular mechanisms and modulation by surface polysaccharides. Molecular Microbiology. 18, 741-754 (1995).
- Sa E Cunha, C., Griffiths, N. J., Murillo, I., Virji, M. Neisseria meningitidis Opc invasin binds to the cytoskeletal protein alpha-actinin. Cellular Microbiology. 11, 384-405 (2009).
- Virji, M., Kayhty, H., Ferguson, D. J., Alexandrescu, C., Alexandrescu, J. E., Heckels, E. R. The role of pili in the interactions of pathogenic Neisseria with cultured human endothelial cells. Molecular Microbiology. 5, 1831-1841 (1991).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of colocalization of objects in dual color confocal images. Journal of Microscopy. 6, 357-382 (1993).
- Zinchuk, V., Zinchuk, O., Okada, T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images: pushing pixels to explore biological phenomena. Acta Histochemica et Cytochemica. 40, 101-111 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved