Method Article
의 세포 상호 작용 Visualisation 및 부량 Neisseria meningitidis과 인간
요약
Neisseria meningitidis (NM), g 부정적인 인간 특정 호흡기 병원체가 인간 α - actinin에 바인딩할 수 있습니다. 여기 우리는 인간의 뇌 microvascular 내피 세포 (HBMECs)에 세균 입국 후 α - actinin 세포와 세균의 colocalisation의 시각화를위한 프로토콜을 제시한다.
초록
Neisseria meningitidis (NM, 수막염)의 OPC 단백질은 adhesin 인간 상피 및 내피 세포에 대한 효과적인 invasin 역할을 수있는 표면 표현 적분 외부 막 단백질이다. 우리는 OPC와 같은 vitronectin으로 인테 그린의 리간드 먼저 바인딩하는 OPC을 요구하는 과정을 주요 수용체로 이들에게 휴대 표현 수용체 하나를 통해 내피 표면에 위치한 integrins을 확인했습니다. 이 과정은 내피 세포의 세균 침입이 발생합니다. 최근, 우리는 인간의 세포 3 전체 세포 lysates에서 찾을 100kDa 단백질과 OPC의 상호 작용을 관찰했다. 숙주 세포의 단백질은 전기 영동에 의해 분리하고 nitrocellulose에 blotted OPC - NM 표현과 중첩했을 때 우리는 처음이 상호 작용을 관찰했다. 상호 작용은 직접했고 중간 분자를 포함하지 않았다. 질량 분광법으로, 우리는 α - actinin로 단백질의 신원을 만들었습니다. 어떤 표면이 표현 없기 때문에 α - actinin은 검사 8 셀 라인의 어느 발견하고, 대상 세포에 세균 항목으로 혈청 리드의 면전에서 내피 세포와 OPC의 상호 작용으로, 우리는 intracellularly 상호 작용하는 두 단백질의 가능성을 조사했다. 이를 위해, 교양 인간의 두뇌 microvascular 내피 세포 (HBMECs)는 OPC - 표현 연장 기간과 internalized 세균과 α - actinin의 위치에 대한 NM 것은 공촛점 현미경으로 검사되었습니다에 감염되었습니다. 우리는 박테리아 internalisation의 여덟 시간 동안 후 상당한 있었던 cytoskeletal 단백질과 NM의 colocalisation 시간 종속적인 증가를 관찰했다. 또한, 양적 이미징 소프트웨어의 사용은 우리가 α - actinin 및 기타 cytoskeletal 단백질과 NM의 colocalisation의 상대적인 측정을 얻을 수있었습니다. 절차는 또한 인간의 상피 세포에 적용할 수 있지만 여기서 우리는, 시각화 인간 내피 세포로 세균 입국 후 세포내 단백질과 세균의 colocalisation의 부량을위한 프로토콜을 제시한다.
프로토콜
1. Immunofluorescence 프로토콜
심는 감염 및 단백질 염색법
다음 절차는 적절한 안전 수준의 조직 문화와 미생물 실험실 시설을 필요로합니다.
1 일
감염 대상 세포의 A. 준비
- 유리 coverslips 50 %의 합류 (~ 1.5x10 4 셀 / cm 2) (16mm 직경)에 씨앗 HBMECs은 12 잘 플레이트 (물론 3.8 cm이 성장 지역 /)에 배치.
성장 매체 : RPMI 1640는 15 %의 열 inactivated (56 ° C, 30 분) FBS, 2 MM의 글루타민, 1 MM 나트륨 pyruvate, 100 U / ML 페니실린 / 스트렙토 마이신, 1 % (V / V) 멤 아닌 필수 아미노산과 보충 지방산 솔루션, 1 % 멤 비타민 솔루션입니다. - 37 박 (O / N)를 통해 문화 ° C, 5 % CO 2 배양기 인치
B. 세균성 문화
- 관심의 변형 성장을 37 10 % 온수 말 피가 보충에 필요한 매체 예 : 뇌 심장 주입 (BHI) 한천 플레이트에서 O / N (16-18 H) ° C 5 % CO 2 분위기 4인치
DAY 2
박테리아 (N. meningitidis) 정지 A. 준비
- 10 μL 문화 루프를 사용하여, 2 ML PBSB (칼슘, 마그네슘과 PBS)에서 밤새 세균성 문화의 정지합니다.
- 대형 박테리아 집계는 실온 (RT)에서 5 분 서 정지를 떠나하여 해결하도록 허용합니다.
- 펠렛을 방해하지 않고, 멸균 튜브에 정지의 상위 1 ML (재고 inoculum)를 전송합니다.
- 주식 inoculum에서 박테리아 숫자를 계산하려면, 0.1M NaOH에 1퍼센트 SDS의 1mL 볼륨을 포함하는 튜브에 aliquots (20-50 μL)을 추가하고 solubilise에 부드럽게 섞는다.
- 260nm (A260)에서 흡광도를 결정하여 솔루션의 핵산 함량을 측정. 우리 손에 1에 해당하는 5x10의 A260 8 식민지가 단위를 형성 / ML (cfu / ML). 이것은, PBSB의 재고 inoculum의 dilutions 일련의 준비 한천 플레이트 위에 도금 및 O / N 부화 후 식민지를 세어 확인하실 수 있습니다.
- 감염 매체의 재고 inoculum의 나누어지는을 희석 [(2 %를 보충 M199 decomplemented (56 ° C, 30 분) 정상적인 인간의 혈청 (NHS)] 대상 세포의 감염에 필요한 박테리아 밀도를 얻을 수 있습니다.
- 저희 연구실에서 대상 셀 당 200-300 박테리아의 감염 비율은 일상적으로 사용됩니다.
B. 셀 문화 감염
- 항생제의 모든 흔적을 제거하는 행크의 중간과 교양 대상 세포를 3 회와 coverslips 씻으십시오.
- 5% CO 2, 37 3 H 8 H에 대한 신선한 박테리아 suspensions (위에서 설명한) ° C와 세포를 감염.
- 감염 기간의 끝에, 4 RT 또는 O / N에서 30-45 분 2 % paraformaldehyde 500 μL (PFA)에 PBS로 세포를 세 번 씻고 수정 ° C.를
- 위에 표시된 농도와 시간에 Paraformaldehyde의 고정은 세균과 세포 형태학의 보존에 적합한 것으로 발견되었습니다.
- paraformaldehyde를 세척 후, 트리톤은 X - 100 10 분 PBS에 희석 0.1 %의 잠복기하여 paraformaldehyde - 고정 세포를 permeabilise.
- PBS로 샘플을 3 번이나 씻으십시오.
- 단백질 얼룩을 진행하거나, 또는 4 1% BSA / PBST O / N 500 μL의 시료를 남겨 ° C.
3 일
단백질 얼룩
세포내 박테리아 얼룩 다음과 같이 α - actinin은 적절한 기본 및 보조 항체의 사용에 의해 순차적으로 또는 동시에 수행할 수 있으며 모든 절차는 12 잘 접시에서 진행하실 수 있습니다.
- 3퍼센트 500 μL와 permeabilised 세포를 포함하는 coverslips를 차단 RT에서 30-60 분 BSA / PBST (PBS는 트리톤 X - 100 0.05 %를 포함)
- PBS로 세척 후 12 잘 플레이트의 새로운 드리 웰 각 coverslip을 전송하기만하면됩니다.
- 박테리아와 α - actinin에 대한 기본 항체를 추가하며 coverslip의 표면을 커버하기 위해 신중하게 추가할 경우 coverslip 당 항체의 80 ~ 100 μL가 충분합니다. 실온에서 1 시간을위한 부화.
- 우리는 동시에 α - actinin (Abcam)에 대해 Neisseria meningitidis (연구소 - 사육) 및 마우스 단클론 항체 (mAb)에 대한 토끼 polyclonal 항혈청를 사용합니다. 어떤 실험에서, 안티 α - actinin 대신에, 굴지 또는 vimentin에 대한 mAbs는 (시그마) 사용되었습니다.
- 부화의 마지막에는, 잘하는 PBS 200 μL를 추가할 뉴 웰이 포함된 500 μL PBS에 coverslip과 장소를 리프트.
- 5 분 후 pipetting으로 PBS를 제거한 다음 신선한 PBS를 추가합니다. 두 번 반복합니다. 에 coverslips을 전송새로운 드리 웰.
- 어둠 속에서 1 시간을위한 RT에서 품어, 1% BSA / PBST에 희석 다른 fluorochromes하는 복합 적절한 보조 항체를 추가합니다.
- 세균 검출을 위해 우리가 TRITC에 복합 백신 토끼 IG를 사용하고 α - actinin 및 기타 cytoskeletal 단백질 감지, 우리가 복합 백신 마우스 IG를 사용 중 FITC - (시그마) 또는 알렉사 플루어 488 - (Invitrogen).
- 부화의 끝에, 4 단계와 5 단계에로 씻으십시오.
- 어둠 속에서 RT에서 5 분 0.6 μg / PBS에 ML DAPI (DNA가 얼룩)와 얼룩 카운터.
- PBS와 린스.
- 장착 매체의 한 방울과 함께 슬라이드 (E, G. Mowiol 또는 Vectashield)에 마운트 coverslips (세포가 아래로 향하게)
- 4 어둠 속에 보관 ° C.
- 샘플은 현미경 관찰을위한 준비가되어 있습니다.
2. 공촛점 레이저 스캐닝 현미경 (CLSM)
관찰하고 세포내 세균 및 cytoskeletal 요소의 이미지를 캡처하려면, 우리는 Leica DM I6000 거꾸로 epifluorescence 현미경에 부착된 Leica SP5 - AOBS 공촛점 레이저 스캐닝 현미경을 사용하여 immunolabelled 샘플 촬영된 이미지를 사용합니다. 모든 이미지는 Leica 소프트웨어와 63x NA 1.4 기름 침지 객관적이고 공정을 사용하여 수집되었습니다.
CLSM 절차 :
- CLSM 절차를 시작하려면 목표에 침지 기름 한 방울을 추가하고 현미경 단계에 표본 슬라이드를 coverslip 측 다운 놓으십시오.
- 비주얼 모드로 현미경을 설정하고 현미경의 눈 조각을 사용하여 관심 영역을 찾습니다.
- Leica 소프트웨어를 사용하여 XYZ 수집 모드를 선택합니다.
- 512 X 512 포맷 (프레임 크기)를 선택합니다. colocalisation 연구 들어, 높은 해상도, 더 정확한 이미지, 마음의 현미경의 해상도 제한을 유지. 다음 스캔 속도를 높일 수 양방향 X 모드를 선택하고, 사진 표백을 줄일 도움이됩니다.
- 순차 스캔 설정을 설정할 수 있습니다. "seq"기능을 클릭하여 스캔 모드 중 하나를 선택합니다. 우리는 모드 "라인 사이"를 사용합니다.
- DAPI (파란색), TRITC에 대한 알렉사 플루어 488 (녹색)와 561 nm의 (적색)에 대한 488 nm의에 대한 405 NM : 선택 레이저 보조 항체에 복합 fluorochromes에 따라 들보. Photomultiplier 튜브 (PMT) 각각 1, 2, 3, 활성화. 올바른 방출 파장을 감지하는 PMT 설정을 조정합니다.
- Z - 스택 또는 일련의 상단 ( "시작")와 바닥 ( "종료") 설정합니다. 다음, 필요한 "Z - 단계 크기"를 설정합니다.
- Neisseria meningitidis는 diplococcus (그림 1G)입니다 각 구균은 0.5 μm의의 대략적인 지름을 가지고 있기 때문에, 0.20 μm의의 Z - 단계 크기는 적어도 두 번은 각 구균 스캔의 확률을 향상시키기 위해 선정되었습니다. 0.2 μm의 - 그것은 0.1의 최적 해상도를위한 단계 크기 이내에 있습니다.
- 노이즈 비율로 신호를 향상시키기 위해 3 라인 평균을 선택하여 최종 검사 매개 변수를 설정합니다.
- "시작"을 클릭하여 이중 또는 삼중 묻은 이미지는 다른 chromophores 간의 상호 대화를 제거하는 다른 파장의 연속적인 스캔하여 얻을 수 있습니다.
- 이 fluorochromes의 colocalisation의 표시 들어, 하나의 이미지로 선택한 채널을 병합하려면 '오버레이'기능을 선택합니다 예를 들어, 알렉사 488 (녹색) 및 TRITC (적색) fluorochromes 모두 colocalise 때 노란 색깔은 중첩 이미지에 나타납니다 .
- 가능한 colocalisation를 시각화에 필요한 2D 이미지의 건설을위한 "최대 프로젝션"기능을 이용하여 Z - 스택 또는 시리즈를 컴파일합니다. colocalisation의 더 자세한 분석은 각 광학 부분의 분석에 의해 얻을 수 있습니다.
- Z - 스택 또는 시리즈를 인수 후, 다양한 요소의 세포 지방화 (그림 1E)의 시각화를위한 직교 이미지를 얻기 위해 데이터를 처리합니다.
3. Colocalisation의 부량
공촛점 스캐닝 현미경 이미지의 통계 분석은 Volocity 소프트웨어 (순발력, PerkinElmer)로 수행됩니다. 이 소프트웨어는 멘더스 외. (1993) 5 설명된 colocalisation 분석을 위해 특별히 설계된 도구를 제공합니다. 디지털 형광 이미징의 맥락에서 Colocalisation는 각 채널에 동일한 voxel (픽셀 볼륨) 위치에서 신호의 검출이라고 할 수 있습니다. 두 채널은 동일한 샘플 영역 (Volocity 사용자 가이드)에서 촬영한 두 가지 fluorochromes의 이미지들로 만들어집니다. 통계 분석은 아래에서 설명 양적 Colocalisation 분석을 사용하여 Volocity 소프트웨어 (순발력, PerkinElmer)로 수행됩니다.
양적 Colocalisation 분석
- Volocity 소프트웨어를 사용 CLSM 이미지와 라이브러리를 만듭니다.
- 메뉴 표시줄에있는 이미지에서 "확장 포커스"를 선택하십시오. 이 도구는 분석하는 2D 이미지에서 Z - 스택을 컴파일.
- "Colocalization"도구를 선택합니다. 분석하는 두 채널은 같은 색 농도가 있어야합니다.
- 그것이 계량 될되는 영역을 선택합니다. 어떤 배경을 제거하는 임계값을 설정합니다.
- "colocalization를 생성합니다"를 선택하여 colocalisation 출력을 만듭니다. Colocalisation 통계는 이전에 다음 ID로 선택한 관심 지역에 대해 생성됩니다.
- 선택 멘더스 '계수 R (계수를 중복)와 내 (colocalisation 계수).
- 멘더스 '계수들은 총 픽셀 강도에 대한 표준 있으므로 얼룩의 강도로 구분하지 않습니다, 따라서 그들은 한 항원의 얼룩은 다른보다 강력한 경우 고용 수 있습니다.
- 멘더스 5,6에 따라 계수 R을 중복하는 것은 colocalisation의 진정한 정도를 나타내는 픽셀의 총 개수와 비교 colocalise 픽셀의 수를 즉.
- 반면에, colocalisation 계수, 내이 덜 풍부한 잔기 (이 경우 세균에 빨간색)에 더 풍부한 잔기 (이 경우 α - actinin, 녹색)의 형광 기여를 설명, 빨간색 픽셀의 수를 즉, 그 빨간 픽셀의 총 개수와 비교 녹색 픽셀과 중복됩니다.
- 멘더스 '계수 1 높은 colocalisation, 0중인 없음 있기 때문에 1과 0 사이의 범위,하지만 그들은 쉽게 해석에 대한 비율로 표현할 수있다.
- 데이터를 프레 젠 테이션을위한 Excel 문서로 내보내기 통계 값.
4. 대표 결과
OPC - Neisseria meningitidis 표현과 α - actinin의 세포내 현지화
으로 α - actinin과 (표시되지) 3 H 감염 실험에 덜 자주하는 등장 NM의 표시 colocalisation 위에서 설명한 3 8 시간 NM에 감염된 인간의 두뇌 microvascular 내피 세포의 공촛점 이미징 8 H에 대한 감염 문화에 비해 ( 그림 1 AF). OPC - 표현 meningococci과 α - actinin의 논증할 수있는 colocalisation는> 5 복제 실험에서 각 시간을 관찰했다. 위에서 설명한 여러 공촛점 이미지를 사용 colocalisation의 통계 분석이 수행되었다. 전체 HBMEC에서 OPC - 표현 meningococci를 더 그린 (α - actinin)과 빨간색 (NM) 픽셀의> 25 % 중복이 (그림 2B, 계수 R을 오버랩) 얻은 감염. vimentin은 희귀했다와 internalized 박테리아와 굴지이나 vimentin 중 하나의 라벨이 수행어진 α - actinin, 실험에 대조적으로, 가끔 colocalisation는 굴지과 함께하지만 그 관찰되었다 (Figure. 2B).
데이터는 또한 계정으로 각 잔기의 상대 풍부한 소요 계수 내를 사용하여 분석되었다. 내가 더 풍부한 신호 (이 경우 그린, α - actinin에서) 덜 풍부한 신호 (이 경우 빨강, 박테리아)를 발생 때마다 발생의 빈도를 측정하기위한 한 방법입니다. 이 법안은 internalized meningococci (그림 2A 및 C)의 주변에 α - actinin의 발생의 인상 수준을 보여줍니다.
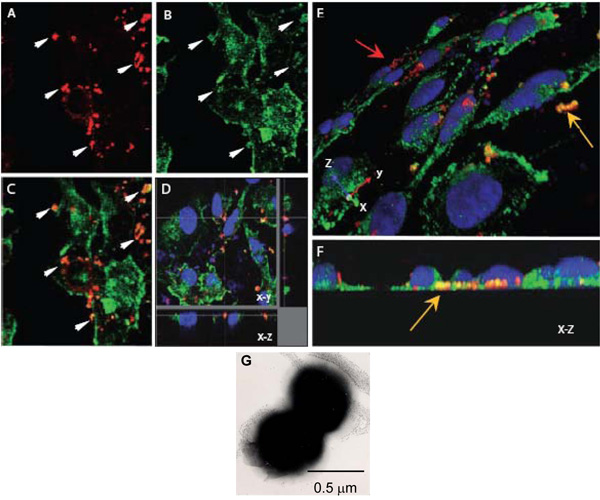
그림 1. N.의 세포 상호 작용을 평가하기 공촛점 레이저 스캐닝 현미경 α - actinin과 meningitidis. AH. coverslips에 성장 콘플루앙 내피 monolayers는 OPC - 표현 (AF) N. 감염된 meningitidis. 8 H 후, 비 점착 성의 박테리아를 씻어 있었다 전지 paraformaldehyde로 고정하고 0.1 % 트리톤 X - 100 permeabilised. 위에서 설명한 후, 박테리아와 α - actinin은 (; 세균, 빨강, α - actinin, 녹색) 스테인드되었습니다.
AC. NM (A) 또는 α - actinin (B)의 위치의 XY 이미지를 보여주는 한 분야. (C)의 오버레이 이미지가 노란색 오렌지색 색상 colocalisation을 제안 나타나는 몇 가지 영역을 나타냅니다. 에서 화살표 (A)와 (B) α - actinin의 축적의 높은 수준은 세균 주위에 발생했을 것으로 보인다 영역을 보여줍니다.
세포의 기지에 위치한 세포내 세균 주위에 감염된 HBMEC의 monolayer 표시 colocalisation의 D. 광학 해부.
일반적인이 지역의 α - actinin의 얼룩으로 다시이 colocalisation 낮은이며, α - actinin의 사고로 인해 근접하지 않습니다.
위와 같이 처리 감염된 HBMEC monolayers의 E와 F.는 3 차원 이미지를 표시합니다. 혀끝의 표면 (E)의 경사보기 자기편 박테리아를 보여줍니다 스테인드 빨간색 (적색 화살표) 내피 세포 (노란색 화살표)의 기저 표면을 향해있는 몇몇 박테리아가 독특한 오렌지 / 색상 노란색 반면. 기초 위치가 좀 더 명확하게 (F) 어떤이 최종에 XZ 단면이다에서 볼 수 있습니다.
G. N.의 부정적인 스테인드 전자 현미경 이미지 그것을 보여주는 meningitidis에서 주된 diplococcal. 각 구균은 직경 약 0.5 μm의 수 있습니다.
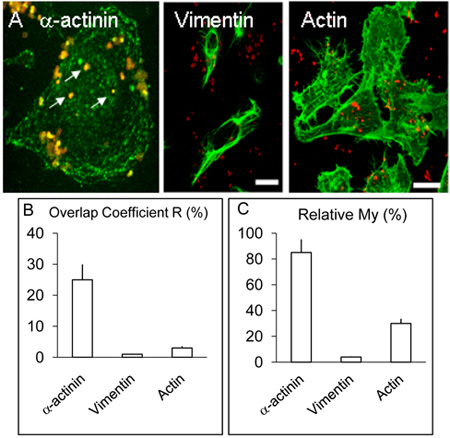
그림 2. HBMEC 세포에 Localisation과 α - actinin, 굴지과 vimentin의 배포.
위의 전설에서 설명한지만, α - actinin 이외에, 일부 coverslips가 α - actinin에 대해 비슷한 절차에 의해 굴지이나 vimentin의 검출에 사용되는 것처럼 HBMEC의 A. 감염된 monolayers이 치료되었습니다. 위와 같이, α - actinin 여러 internalized 박테리아 (흰색 화살표) 주위 집중. Vimentin과 굴지는 감지할 수있을 정도의 수준으로 박테리아와 colocalise하지 않았다. 바 20 μm의를 나타냅니다.
계수 R과 나의위한 B. & C. 값은 위에서 설명한 Volocity 소프트웨어를 사용하여 3 개 실험에서 얻은되었습니다.
토론
의 결합의 가능성 internalized OPC - α - actinin 표현하는 Neisseria meningitidis의 것은 박테리아의 colocalisation의 심사 3과 8 H의 잠복기 후 감염된 세포에서 cytoskeletal 단백질에 의해 HBMEC를 사용하여 탐색했다. 공촛점 현미경으로, α - actinin과 Neisseria meningitidis의 colocalisation은 증명 수 있습니다. 세균은 3 H에 internalized 있었지만 특히,이 시점에서 α - actinin과 작은 colocalisation있었습니다. cytoskeletal 단백질과 박테리아 협회 8 H 감염 기간이 지나면 같은 세포내 체류 긴 기간을 필요로 나타나, 세균의 큰 숫자는 가까운 협회에서 분명히 α - actinin했다. 알파 actinin은 다기능 단백질이며, cytoskeletal 요소 세균 상호 작용은 현재 연구 주제는 대상 세포 기능에 중요한 영향을 수 있습니다.
위에서 설명한대로 colocalisation의 부량는 세심한 표본 준비가 필요합니다. 특히주의가 기간 및 항체 dilutions을 차단, 표본의 고정 부여해야합니다. 노이즈 비율 가장 좋은 신호를 각 주 및 보조 항체가 최적 농도를 결정하는 예비 실험에서 titrated해야합니다. 우리의 경험에서 장착 중간 Mowiol 더 나은 이미지를 생산.
공개
감사의 말
연구는 웰컴 트러스트와 수막염 영국에 의해 투자되었다. HBMEC 세포 라인은 박사 KS 김에 의해 제공되었다. 공촛점 이미징 및 전자 현미경은 울프슨의 Bioimaging 시설, 브리스톨 대학에서 수행되었다. 우리는 또한 그들의 도움과 조언을 미스터 앨런 리어드 박사 마크 젭슨 (브리스톨 대학), 그리고 앨런 씨가 틸리 (PerkinElmer)을 감사드립니다.
자료
1. 공촛점 레이저 스캐닝 현미경 (CLSM) :
Leica SP5 공촛점 이미징 시스템 :이 시스템, AOTF의 조합 (음향 광학 필터 tuneable)과 AOBS (음향 광학 빔 스플리터)를 사용하여이 특정 파장과 함께 여기를 단순화합니다.
2 - 소프트웨어 :
Leica 공촛점 소프트웨어 LCS, Leica 이크로 시스템즈, 독일.
Volocity 5, 순발력, PerkinElmer, 미국.
참고문헌
- Virji, M., Makepeace, K., Moxon, E. R. Distinct mechanisms of interactions of Opc-expressing meningococci at apical and basolateral surfaces of human endothelial cells; the role of integrins in apical interactions. Molecular Microbiology. 14, 173-184 (1994).
- Virji, M., Makepeace, K., Peak, I. R., Ferguson, D. J., Jennings, M. P., Moxon, E. R. Opc- and pilus- dependent interactions of meningococci with human endothelial cells: molecular mechanisms and modulation by surface polysaccharides. Molecular Microbiology. 18, 741-754 (1995).
- Sa E Cunha, C., Griffiths, N. J., Murillo, I., Virji, M. Neisseria meningitidis Opc invasin binds to the cytoskeletal protein alpha-actinin. Cellular Microbiology. 11, 384-405 (2009).
- Virji, M., Kayhty, H., Ferguson, D. J., Alexandrescu, C., Alexandrescu, J. E., Heckels, E. R. The role of pili in the interactions of pathogenic Neisseria with cultured human endothelial cells. Molecular Microbiology. 5, 1831-1841 (1991).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of colocalization of objects in dual color confocal images. Journal of Microscopy. 6, 357-382 (1993).
- Zinchuk, V., Zinchuk, O., Okada, T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images: pushing pixels to explore biological phenomena. Acta Histochemica et Cytochemica. 40, 101-111 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유