Method Article
の細胞内相互作用の可視化と定量化髄膜炎菌と人間
要約
髄膜炎菌 (ナノメートル)、グラム陰性ヒト特異的な呼吸器病原体は、ヒトα-アクチニンに結合することができる。ここでは、人間の脳の微小血管内皮細胞(HBMECs)への細菌侵入後のα-アクチニン細胞と細菌のcolocalisationの可視化のためのプロトコルを提示する。
要約
髄膜炎菌 (ナノメートル、髄膜炎菌)のOPCの蛋白質はアドヘシンとヒト上皮および内皮細胞のための効果的なインベイシンとして作用することができる表面発現に不可欠外膜タンパク質、です。我々は、OPC、そのようなビトロネクチンのようなインテグリンのリガンドへの最初のバインドにOPCを必要とするプロセスのための主要な受容体として、これらの細胞に発現受容体1を介して内皮細胞表面にあるインテグリンを同定した。このプロセスは、内皮細胞の細菌の侵入を2につながる。最近では、我々はヒトの細胞3の全細胞溶解物に見られる100kDaタンパク質とOPCとの相互作用を観察した。宿主細胞のタンパク質は電気泳動によって分離し、ニトロセルロースにブロットOPC発現ナノメートルを重ねていたとき私たちは、最初にこの相互作用を観察した。相互作用は直接的であり、中間分子を伴うものではなかった。質量分析法により、我々はα-アクチニンなどの蛋白質のアイデンティティを確立した。ない面が発現していないとして、α-アクチニンは調べた8枚のセルラインのいずれかに発見され、標的細胞への細菌侵入に対する血中鉛の存在下で内皮細胞とOPCの相互作用として、我々は細胞内で相互作用する2つのタンパク質の可能性を検討した。このため、培養ヒト脳微小血管内皮細胞(HBMECsは)長期間と内部化された細菌とα-アクチニンの位置については、OPC発現Nmで感染させた共焦点顕微鏡で調べた。私たちは、細菌の内部化の8時間後にはかなりいた細胞骨格タンパク質、とNmのcolocalisationにおける時間依存増加を観察した。さらに、定量的なイメージングソフトウェアを使用することにより、α-アクチニンと他の細胞骨格タンパク質とナノメートルのcolocalisationの相対的な尺度を得ることができました。手順を実行すると、ヒト上皮細胞にも適用可能であるが、ここでは、ヒト内皮細胞への細菌侵入後の細胞内タンパク質と細菌のcolocalisationの可視化と定量化のためのプロトコルを提示する。
プロトコル
1。免疫蛍光プロトコル
種まき、感染&免疫染色
次の手順では、適切な安全レベルの組織培養と微生物学的研究施設が必要です。
1日目
感染の標的細胞のA.の準備
- 12ウェルプレート(3.8 cm 2の成長分野/ウェル)に配置されたカバーガラス(直径16mm)の50%コンフルエントのSeed HBMECs(〜1.5 × 10 4細胞/ cm 2)。
増殖培地:15%熱不活化(56℃、30分)FBS、2mMグルタミン、1mMピルビン酸ナトリウム、100 U / mLのペニシリン/ストレプトマイシン、1%(v / v)のMEM非必須アミノ酸を添加したRPMI 1640酸溶液を、1%MEMビタミンソリューション。 - 37℃一晩培養(O / N)℃、5%CO 2インキュベーター内でC、。
B.細菌培養
- 興味のひずみを育てる37、10%加熱ウマ血液を補充、必要な培地の例:ブレインハートインフュージョン(BHI)寒天プレート上でO / N(16-18 H)° C、5%CO 2雰囲気4インチ
2日目
細菌( 髄膜炎菌 )懸濁液のA.の準備
- 10μLの文化のループを使用して、2mLのPBSB(カルシウムとマグネシウムを含むPBS)で一晩細菌培養の懸濁液を作る。
- 大規模な細菌の凝集体は、室温(RT)で5分間放置するサスペンションを残すことによって解決することができます。
- ペレットを乱すことなく、滅菌チューブにサスペンションの上部を1 mL(株接種を)転送する。
- 株式の接種で細菌数を推定するために、0.1M NaOHに1%SDSの1mLのボリュームを含むチューブにアリコート(20〜50μL)を追加し、可溶化するために静かに混ぜる。
- 260nmの(A260)の吸光度を決定することにより、ソリューションの核酸の含有量を測定します。私たちの手で、1 × 10 8コロニー形成単位に対応する/ mlの(CFU / mL)のA260。これは、PBSBの株式の接種の希釈系列を準備する寒天プレート上にプレーティングし、O / Nインキュベーション後にコロニーを計数することによって確認することができます。
- 感染の媒体中で株式の接種のアリコートを希釈する[(2%を添加したM199 decomplemented(56℃、30分)正常ヒト血清(NHS)]標的細胞の感染に必要な細菌密度を得るために。
- 当研究室では、標的細胞当たり200〜300細菌の感染率は、日常的に使用されます。
B.細胞培養の感染
- 抗生物質の痕跡を削除するには、ハンクの培地で培養した標的細胞で3回カバースリップを洗ってください。
- 5%CO 2で、37℃3時間〜8時間のため、新たに調製した細菌懸濁液(上記)° Cで細胞を感染させる。
- 感染期間の終了時に、PBSで細胞を3回洗浄し、4℃、RTまたはO / Nで30〜45分間、2%パラホルムアルデヒド500μL(PFA)で修正℃の
- 上記の濃度と同時にパラホルムアルデヒド固定は、細菌や細胞形態の保存に適していることが判明した。
- パラホルムアルデヒドを洗浄した後、0.1%で10分間PBSで希釈したトリトンX - 100をインキュベートすることにより、パラホルムアルデヒド固定した細胞をpermeabilise。
- サンプルをPBSで3回洗浄する。
- 免疫染色に進むか、代わりに、4℃で1%BSA / PBST O / Nの500μLのサンプルを残す℃に
3日目
免疫染色
細胞内細菌の染色とα-アクチニンは、以下のように適切な一次および二次抗体の使用により、順次または同時に実行することができます。すべての手続きは、12ウェルプレートで行うことができる。
- RTで30〜60分間、3%BSA / PBST(PBS、0.05%トリトンX - 100を含む)の500μLとpermeabilised細胞を含むカバースリップをブロック
- PBSで洗浄後、12ウェルプレートに新しいドライウェルに各カバースリップを転送する。
- 細菌とα-アクチニンに対する一次抗体を追加し、カバースリップの表面を覆うように慎重に追加した場合にカバースリップ当たりの抗体の80〜100μLで十分です。室温で1時間インキュベートする。
- 我々は、同時にα-アクチニン(アブカム)に対する髄膜炎菌 (実験室で育てられた)およびマウスモノクローナル抗体(mAb)に対するウサギポリクローナル抗血清を使用。いくつかの実験で、抗α-アクチニンの代わりに、アクチンやビメンチンに対するモノクローナル抗体(Sigma社)を使用した。
- インキュベーションの終わりに、ウェルにPBS 200μLを追加し、500μLのPBSを含む新しいウェルのカバースリップと場所を持ち上げます。
- 5分後、ピペッティングによりPBSを除去し、新鮮なPBSを加える。二回繰り返します。にカバースリップを転送するよく新しい乾いた。
- 暗闇の中で1時間、室温でインキュベートする、1%BSA / PBSTで希釈した異なる蛍光色素に結合した適切な二次抗体を追加。
- 細菌検出のために、我々はTRITCに結合した抗ウサギIgを使用し、α-アクチニンと他の細胞骨格タンパク質の検出のために、我々はに結合抗マウスIgを使用するのどちらかFITC -(シグマ)又はAlexa Fluor 488 - (Invitrogen社)。
- インキュベーションの終わりには、手順4と5のように洗ってください。
- 暗所で室温で5分間0.6μgの/ PBS中DAPI(DNA染色)で染色されるカウンタ。
- PBSでリンス。
- マウンティング培地のドロップとスライド(E、G. MowiolまたはVectashield)上にマウントカバースリップ(細胞が下向きに)
- 4℃暗所で保管℃に
- サンプルは、顕微鏡下で観察するための準備が整いました。
2。共焦点レーザー走査顕微鏡(CLSM)
観察し、細胞内細菌や細胞骨格要素の画像をキャプチャするために、我々は、ライカDM I6000倒立落射蛍光顕微鏡に取り付けられたライカSP5 - AOBS共焦点レーザー走査型顕微鏡を用いてimmunolabelledサンプルやキャプチャした画像を使用。すべての画像は、ライカのソフトウェアとの63x NA 1.4油浸対物レンズとプロセスを用いて収集した。
CLSMの手順:
- CLSMの手順を開始するには、客観的に液浸オイルのドロップを追加し、顕微鏡のステージ上の標本スライドを、カバースリップ面を下に、置きます。
- ビジュアルモードに顕微鏡をセットし、顕微鏡の接眼を使って関心の領域を見つける。
- ライカのソフトウェアを使用して、XYZの取得モードを選択します。
- 512 × 512形式(フレームサイズ)を選択します。 colocalisation研究のための、より高い分解能、より正確なイメージを、念頭に置いて顕微鏡の解像限界を保つ。その後、スキャン速度を増加させる双方向Xのモードを、選択して、光退色を減らすのに役立ちます。
- シーケンシャルスキャン設定を設定します。 "SEQ"機能をクリックし、スキャンモードのいずれかを選択してください。私たちは、モード"行の間に"使用してください。
- DAPI(青)、TRITC用のAlexa Fluor ® 488(緑色)と561 nmの(赤)のための488 nmのための405 nmの場合:[レーザーは、二次抗体に結合した蛍光色素に応じてビーム。光電子増倍管(PMT)はそれぞれ1,2、および3は、活性化する。正しい発光波長を検出するPMT設定を調整します。
- Z -スタックまたは一連の上部("開始")とボトム("最後の")を設定します。次に、必要な"Z -ステップサイズ"を設定します。
- 髄膜炎菌は、双球菌(図1G)であり、各球菌が0.5μmのおおよその直径を有しているため、0.20μmのZ -ステップサイズは少なくとも二回各球菌をスキャンの確率を高めるために選ばれました。 0.2μmの - それは、0.1の最適な解決のためのステップサイズの範囲内である。
- 信号対雑音比を向上させるために3行の平均を選択することにより、最終的なスキャンパラメータを設定します。
- "スタート"をクリックすることで、ダブルまたはトリプル染色像は異なる発色団間のクロストークを除去するために、異なる波長で順次走査することによって得られる。
- two蛍光色素のcolocalisationの指標については、単一のイメージに選択されたチャネルをマージする"オーバーレイ"機能を選択し、たとえば、アレクサ488(緑)とTRITC(赤)蛍光色素の両方がcolocalise時、黄色の色はオーバーレイ画像に表示されます。 。
- Z -スタックまたは可能colocalisationを可視化するために必要な2次元画像の構築のための"最大値投影"機能を使用してシリーズをコンパイルします。 colocalisationのより詳細な分析は、それぞれの光学部の解析によって得ることができます。
- Z -スタックまたはシリーズを取得した後、様々な要素の細胞内局在(図1E)の可視化のための直交のイメージを取得するには、データを処理する。
3。 Colocalisationの定量化
共焦点走査型顕微鏡の画像の統計的な分析は、Volocityソフトウェア(即興、パーキンエルマー)で実行されます。このソフトウェアは、マンダースら (1993)5で説明したようにcolocalisationの分析用に特別に設計されたツールを提供しています。デジタル蛍光イメージングのコンテキストでColocalisationは、同じボクセル(ピクセルボリューム)各チャンネル内の位置での信号の検出として記述することができます。つのチャネルは、同じサンプルエリア(Volocityのユーザーガイド)から採取した二つの異なる蛍光色素の画像で構成されています。統計解析は以下に説明する定量Colocalisation分析を使用してVolocityソフトウェア(即興、パーキンエルマー)で実行されます。
定量的なColocalisation分析
- Volocityソフトウェアを使用して、CLSM画像とライブラリを作成します。
- 上部のバーにある画像から"拡張フォーカス"を選択します。このツールは、分析する2D画像でのz -スタックをコンパイルします。。
- "局在"ツールを選択します。分析される2つのチャネルは、同じ色深度を持つ必要があります。
- それが定量化される予定であることがエリアを選択してください。どんなバックグラウンドを除去するしきい値を設定します。
- "共局在を生成する"を選択してcolocalisationの出力を作成します。 Colocalisation統計は、以前に選択された関心領域に対して生成されます。
- マンダース"係数R(係数をオーバーラップ)と私(colocalisation係数)を選択します。
- マンダース"の係数は、それらが全体のピクセルの輝度に対して正規化されているとして、染色の強さに敏感ではなく、したがって、それらは、1つの抗原の染色は他よりも強いときに使用することができる。
- 係数をオーバーラップRは、マンダース5,6によるとcolocalisationの真の程度を表し、ピクセルの合計数と比較してcolocalise画素数、すなわち。
- 一方、colocalisation係数は、私の、量の少ない部分(この場合の細菌で、赤)へ、より豊かな部分(この場合はα-アクチニン、緑)の蛍光の寄与を説明し、赤のピクセルの数、すなわちそれは赤のピクセルの合計数と比較して緑のピクセルと重なる。
- マンダース"の係数は1が高いcolocalisation、0がなしていると、1と0の間の範囲、それらは簡単に解釈するためのパーセンテージとして表すことができます。
- データのプレゼンテーションのためのExcel文書への輸出統計値。
4。代表的な結果
OPC発現髄膜炎菌とα-アクチニンの細胞内局在
としてα-アクチニンと(図示せず)3時間の感染実験ではそれほど頻繁であると思われるナノメートルの指示colocalisation上記の3と8時間でのNMを感染させたヒト脳微小血管内皮細胞の共焦点イメージング8時間感染させた培養液と比較して(図1 AF)。 OPC発現髄膜炎菌によるα-アクチニンの実証colocalisationは> 5の反復実験で毎回観察された。上記のようないくつかの共焦点画像を用いたcolocalisationの統計解析を行った。全体的に、HBMECにOPC発現髄膜炎を、緑(α-アクチニン)と赤(ナノメートル)のピクセルの> 25%のオーバーラップが(図2B、係数Rをオーバーラップ)を得たに感染。ビメンチンは稀だと内部化された細菌とアクチンまたはビメンチンのどちらかのラベルが実行されたα-アクチニン、実験とは対照的に、時折colocalisationは、アクチンとが、その観察された(Figure. 2B)。
データも考慮に入れ、各部分の相対量をとる係数マイを、使用して分析した。私はより多くの豊富な信号(この場合は緑、α-アクチニンの)量の少ない信号(この場合は赤、細菌の)が発生するたびに発生頻度の尺度です。この措置は、内部化髄膜炎菌(図2AおよびC)の近傍におけるα-アクチニンの発生の顕著なレベルを示しています。
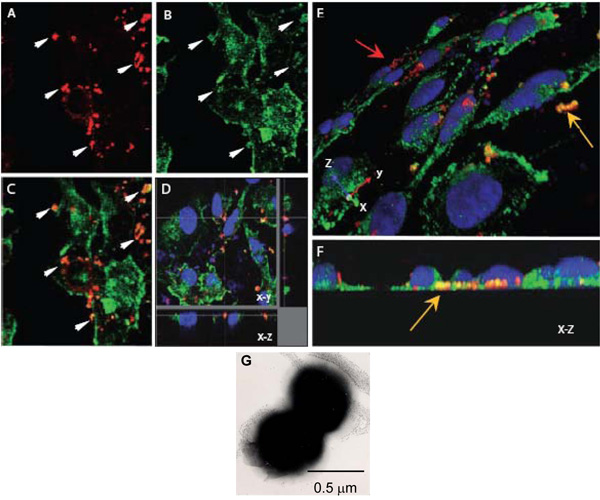
図1。 Nの細胞内相互作用を評価するために共焦点レーザー走査顕微鏡α-アクチニンと髄膜炎菌 。AH。カバースリップ上に成長したコンフルエント内皮単層OPC発現(AF)Nで感染させた髄膜炎菌 。 8時間後、非付着細菌は、細胞はパラホルムアルデヒドで固定し、0.1%トリトンX - 100でpermeabilised、オフ洗浄した。上述のように続いて、細菌とα-アクチニンは(;細菌、赤色のα-アクチニン、緑)に染色した。
AC。 Nmは(A)またはα-アクチニン(B)の位置のXYの画像を示す一つのフィールド。 (C)のオーバーレイイメージは黄色、オレンジ色がcolocalisationを示唆して表示されるいくつかの領域を示している。の矢印(A)と(B)α-アクチニンの蓄積度が高いが、細菌の周囲に発生しているように見える領域を示しています。
セルの底部にある細胞内細菌の周りcolocalisationを示す感染したHBMEC単分子層のD.光学解剖。
再び、このcolocalisationはα-アクチニンの偶発的な近さによるものではない、この地域におけるα-アクチニンの一般的な汚れとして低いです。
上記のように処理感染したHBMEC単分子膜のEとFには、三次元画像。頂端表面の斜視図(E)は、内皮細胞(黄色の矢印)の基底面に向かって位置するいくつかの細菌に対し、付着細菌染色した赤を(赤い矢印)を示す色ではっきりと黄色/オレンジ色です。基底場所がより明確に(F)これは、エンドオンXZ断面であるに見ることができます。
G. N.のネガティブ染色電子顕微鏡像そのを示す髄膜炎から優勢双球菌の。各球菌は、直径約0.5μmである。
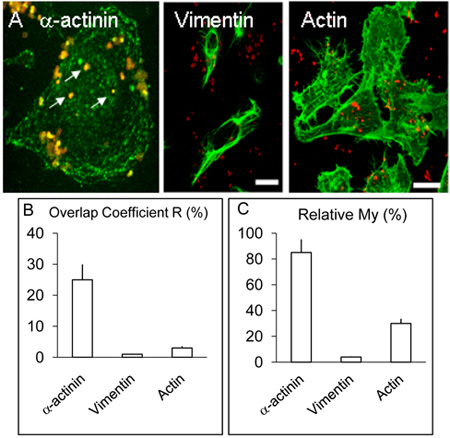
図2。 HBMEC細胞におけるα-アクチニン、アクチンとビメンチンの局在と分布。
上記の凡例に示すが、α-アクチニンに加えて、いくつかのカバーグラスはα-アクチニンの場合と同様の手順により、アクチンやビメンチンの検出に使用されたとしてHBMECのA.感染した単層を処理した。上記のように、α-アクチニン、いくつかの内部化細菌(白矢印)周辺に集中。ビメンチン、アクチンは、かなりのレベルまで細菌をcolocaliseていませんでした。バーは20μmを表す。
係数Rと私のためにB.&C.値は、上述したようにVolocityソフトウェアを使用して、つ以上の実験から得られた。
ディスカッション
内部化の結合の可能性OPC発現α-アクチニンにナイセリア髄膜炎は、細菌のcolocalisationと3と8時間の潜伏期間の後、感染細胞の細胞骨格蛋白質の検査でHBMECを用いて検討した。共焦点顕微鏡により、α-アクチニンと髄膜炎菌のcolocalisationを実証することができます。細菌を3時間で内在化されたが、特に、、この時点でα-アクチニンと少しcolocalisationなかった。細胞骨格タンパク質と細菌の関連が8時間の感染期間の後に細胞内の居住のより長い期間を必要とするように登場し、細菌のかなりの数には密接に関連して明らかにα-アクチニンを持っていた。 α-アクチニンは多機能タンパク質であり、細胞骨格要素を持つ細菌の相互作用は、現在の研究の対象となる標的細胞の機能に重要な影響を与える可能性があります。
上記のようcolocalisationの定量化は、細心の試料の準備が必要です。特に注意が期間と抗体希釈液をブロックし、試料の固定に与えられるべきである。対雑音比最高の信号の場合は、それぞれプライマリとセカンダリの抗体は、最適な濃度を決定するために予備実験で滴定する必要があります。我々の経験では、封入剤のMowiolは、より良いイメージを作り出した。
開示事項
謝辞
研究はWellcome Trustと髄英国で賄われた。 HBMECの細胞株は、博士KS金によって提供されていました。共焦点イメージングと電子顕微鏡は、ウォルフソンのバイオイメージング施設、ブリストル大学で実施された。我々はまた彼らの支援やアドバイスのために氏アランラード、博士マークジェプソン(ブリストル大学)、そしてアランティリー(パーキンエルマー)を感謝したいと思います。
資料
1。共焦点レーザー走査顕微鏡(CLSM):
ライカSP5共焦点イメージングシステム:このシステムは、AOTF(音響光学チューナブルフィルター)とAOBS(音響光学ビームスプリッタ)の組み合わせを使用することにより、特定の波長で励起を簡素化します。
2 - ソフトウェア:
ライカ共焦点ソフトウェアLCS、ライカマイクロシステムズ、ドイツ。
Volocity 5、即興、パーキンエルマー、米国。
参考文献
- Virji, M., Makepeace, K., Moxon, E. R. Distinct mechanisms of interactions of Opc-expressing meningococci at apical and basolateral surfaces of human endothelial cells; the role of integrins in apical interactions. Molecular Microbiology. 14, 173-184 (1994).
- Virji, M., Makepeace, K., Peak, I. R., Ferguson, D. J., Jennings, M. P., Moxon, E. R. Opc- and pilus- dependent interactions of meningococci with human endothelial cells: molecular mechanisms and modulation by surface polysaccharides. Molecular Microbiology. 18, 741-754 (1995).
- Sa E Cunha, C., Griffiths, N. J., Murillo, I., Virji, M. Neisseria meningitidis Opc invasin binds to the cytoskeletal protein alpha-actinin. Cellular Microbiology. 11, 384-405 (2009).
- Virji, M., Kayhty, H., Ferguson, D. J., Alexandrescu, C., Alexandrescu, J. E., Heckels, E. R. The role of pili in the interactions of pathogenic Neisseria with cultured human endothelial cells. Molecular Microbiology. 5, 1831-1841 (1991).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of colocalization of objects in dual color confocal images. Journal of Microscopy. 6, 357-382 (1993).
- Zinchuk, V., Zinchuk, O., Okada, T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images: pushing pixels to explore biological phenomena. Acta Histochemica et Cytochemica. 40, 101-111 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved