Method Article
Visualisierung und Quantifizierung der intrazellulären Wechselwirkungen von Neisseria meningitidis And Human α-Actinin durch konfokale Imaging
In diesem Artikel
Zusammenfassung
Neisseria meningitidis (Nm), ein gram-negative human-spezifische respiratorische Erreger können für die menschliche α-Actinin binden. Hier präsentieren wir ein Protokoll für die Visualisierung von Kolokalisation des Bakteriums mit intrazellulären α-Actinin nach bakteriellen Eintrag in das menschliche Gehirn mikrovaskulären Endothelzellen (HBMECs).
Zusammenfassung
Der OPC-Protein von Neisseria meningitidis (Nm, Meningokokken) ist eine Oberflächen-Ausdruck integralen Protein der äußeren Membran, die als Adhäsin und eine effektive Invasin für die menschliche Epithel-und Endothelzellen wirken können. Wir haben endotheliale Oberflächen-lokalisierten Integrine als wichtigsten Rezeptoren für OPC, ein Prozess, der Opc erfordert zunächst binden an Integrin-Liganden wie Vitronektin und über diese an die Zell-exprimierte Rezeptoren 1 identifiziert. Dieser Prozess führt zu bakteriellen Invasion von Endothelzellen 2. In jüngster Zeit beobachteten wir eine Interaktion von OPC mit einem 100 kDa Protein in Ganzzelllysaten von menschlichen Zellen 3 gefunden. Wir haben uns zunächst beobachtet diese Interaktion, wenn Wirtszellproteinen durch Elektrophorese aufgetrennt und geblottet auf Nitrozellulose wurden mit OPC-exprimierenden Nm überlagert. Das Zusammenspiel war direkt und waren nicht mit Zwischen-Moleküle. Mit der Massenspektrometrie, haben wir die Identität des Proteins als α-Actinin. Da keine Fläche zum Ausdruck α-Actinin wurde auf jedem der acht Zelllinien untersucht gefunden, und als OPC-Interaktionen mit Endothelzellen in Anwesenheit von Serum führen zu bakterieller Eintritt in die Zielzellen, untersuchten wir die Möglichkeit, die beiden Proteine interagieren intrazellulär. Hierzu wurden kultivierte menschliche Gehirn mikrovaskulären Endothelzellen (HBMECs) mit OPC-exprimierenden Nm über einen längeren Zeitraum und die Standorte der verinnerlichten Bakterien und α-Actinin wurden durch konfokale Mikroskopie untersucht infiziert. Wir beobachteten zeitabhängigen Anstieg der Kolokalisation von Nm mit dem Zytoskelett-Protein, das erhebliche nach einem Zeitraum von acht Stunden von bakteriellen Internalisierung wurde. Darüber hinaus ermöglicht der Einsatz von quantitativen Bildbearbeitungssoftware uns ein relatives Maß für die Kolokalisation von Nm mit α-Actinin und anderen Zytoskelett-Proteine zu erhalten. Hier präsentieren wir ein Protokoll für die Visualisierung und Quantifizierung der Kolokalisation des Bakteriums mit intrazellulären Proteinen nach bakteriellen Einstieg in humanen Endothelzellen, obwohl das Verfahren gilt auch für die menschliche Epithelzellen.
Protokoll
1. Immunfluoreszenz-Protokoll
Seeding, Infektion und Immunfärbung
Die folgenden Verfahren erfordern geeignete Sicherheitsniveau Gewebekultur und mikrobiologische Labors.
TAG 1
A. Herstellung von Zielzellen für eine Infektion
- Seed HBMECs bei 50% Konfluenz (~ 1.5x10 4 Zellen / cm 2) auf Deckgläschen (16 mm Durchmesser) in einer 12-Well-Platte (3,8 cm 2 Wachstumsbereich / well) platziert.
Nährmedium: RPMI 1640 mit 15% Hitze-inaktiviertem (56 ° C, 30min) FBS, 2 mM Glutamin, 1 mM Natriumpyruvat, 100 U / ml Penicillin / Streptomycin, 1% (v / v) MEM nicht essentielle Aminosäuren ergänzt Säuren-Lösung und 1% MEM Vitamine Lösung. - Kultur über Nacht (O / N) bei 37 ° C in einer 5% CO 2-Inkubator.
B. Bakterienkultur
- Wachsen die Belastung der Zinsen O / N (16-18 h) auf die gewünschte Medium zB Brain Heart Infusion (BHI)-Agar-Platten mit 10% geheizt Pferdeblut bei 37 ergänzt ° C in 5% CO 2-Atmosphäre 4.
TAG 2
A. Herstellung von Bakterien (N. meningitidis) Suspension
- Mit einem 10 l Kultur-Schleife, eine Aussetzung der Nacht Bakterienkultur in 2 mL PBSB (PBS mit Calcium und Magnesium).
- Lassen großen bakteriellen Aggregaten auf, indem die Suspension für 5 min bei Raumtemperatur (RT) stehen zu begleichen.
- Ohne das Pellet, übertragen die Besten 1 ml der Suspension (stock Inokulum) in einem sterilen Röhrchen.
- Zur Abschätzung Keimzahlen in den Bestand Inokulum, fügen Aliquots (20-50 ul) in Röhrchen mit 1 ml Volumen von 1% SDS in 0,1 M NaOH und vorsichtig mischen, um aufzulösen.
- Messen Sie die Nukleinsäure-Gehalt der Lösung durch Bestimmung der Absorption bei 260nm (A260). In unseren Händen, bilden A260 von 1 entspricht 5x10 8 Kolonie Einheiten / ml (KBE / ml). Dies kann durch die Vorbereitung einer Reihe von Verdünnungen der Aktie Inokulum in PBSB, Ausplattieren auf Agar-Platten und das Zählen der Kolonien nach O / N Inkubation überprüft werden.
- Einen aliquoten der Aktie Inokulum in die Infektion Medium [(M199 mit 2% decomplemented (56 ° C, 30min) normalem menschlichem Serum (NHS)], um die erforderliche bakterielle Dichte für die Infektion der Zielzellen zu erhalten.
- In unserem Labor ist eine Infektion Verhältnis von 200-300 Bakterien pro Zielzelle routinemäßig eingesetzt.
B. Cell Culture Infection
- Waschen Sie die Deckgläser mit kultivierten Zielzellen 3-mal mit Hanks Medium, um jede Spur von Antibiotika zu entfernen.
- Infect Zellen mit frisch zubereiteten Bakteriensuspensionen (oben beschrieben) für 3 h auf 8 h bei 37 ° C, in 5% CO 2.
- Am Ende der Infektion Zeitraum, waschen Sie die Zellen dreimal mit PBS und in 500 ul von 2% Paraformaldehyd (PFA) fix für 30-45 min bei RT oder O / N bei 4 ° C.
- Paraformaldehyd Fixierung an der Konzentration und Zeit oben gezeigt wurde festgestellt, dass für die Erhaltung der bakteriellen und zellulären Morphologie.
- Nach dem Abwaschen Paraformaldehyd, permeabilisieren die Paraformaldehyd-fixierten Zellen durch Inkubation in 0,1% Triton X-100 in PBS für 10 min verdünnt.
- Waschen Sie die Proben 3 mal mit PBS.
- Gehen Sie zur Immunfärbung oder, alternativ, verlassen Proben in 500 ul 1% BSA / PBST O / N bei 4 ° C.
TAG 3
Immuno-Färbung
Färbung von intrazellulären Bakterien und α-Actinin können nacheinander oder gleichzeitig durch den Einsatz geeigneter primären und sekundären Antikörper wie folgt durchgeführt werden, alle Verfahren kann in 12-Well-Platten durchgeführt werden.
- Blockieren Sie die Deckgläser mit den permeabilisierten Zellen mit 500 ul 3% BSA / PBST (PBS mit 0,05% Triton X-100) für 30-60 min bei RT
- Nach dem Waschen mit PBS, Übertragung jedes Deckglas einen neuen trockenen und gut in der 12-Well-Platte.
- Fügen Sie die primäre Antikörper gegen Bakterien und α-Actinin; achtzig bis 100 ul Antikörper pro Deckglas genügt, wenn hinzugefügt sorgfältig auf die Oberfläche des Deckglases zu decken. Inkubieren 1h bei Raumtemperatur.
- Wir verwendeten polyklonalen Kaninchen-Antiserum gegen Neisseria meningitidis (Labor-gehoben) und monoklonalen Maus-Antikörper (mAb) gegen α-Actinin (Abcam) gleichzeitig. In einigen Experimenten an Stelle von anti α-Actinin wurden mAbs gegen Aktin oder Vimentin verwendet (Sigma).
- Am Ende der Inkubation mit 200 ul PBS zum Brunnen, heben Sie das Deckglas und in einen neuen Brunnen mit 500 ul PBS.
- Nach 5 min entfernt PBS durch Pipettieren und fügen Sie dann frisches PBS. Zweimal wiederholen. Transfer Deckgläser zu einemneue gut trocknen.
- Fügen Sie die entsprechenden Sekundärantikörper konjugiert unterschiedlichen Fluorochromen in 1% BSA / PBST verdünnt; inkubieren bei RT für 1h im Dunkeln.
- Für Nachweis von Bakterien, haben wir Anti-Kaninchen-Ig konjugiert TRITC und für α-Actinin und andere Zytoskelettprotein Detektion verwendeten wir Anti-Maus-Ig konjugiert entweder FITC-(Sigma) oder Alexa Fluor 488 - (Invitrogen).
- Am Ende der Inkubationszeit, wie in den Schritten 4 und 5 zu waschen.
- Gegenfärbung mit 0,6 ug / ml DAPI in PBS (DNA-Färbung) für 5 min bei RT im Dunkeln.
- Spülen mit PBS.
- Berg Deckgläser (Zellen nach unten) auf Objektträger mit einem Tropfen Eindeckmedium (e, g Mowiol oder Vectashield)
- Lagerung im Dunkeln bei 4 ° C.
- Die Proben sind bereit für die Beobachtung unter dem Mikroskop.
2. Konfokale Laser Scanning Mikroskopie (CLSM)
Zu beobachten und zu erfassen Bilder von intrazellulären Bakterien und Zytoskelett-Elemente haben wir immunolabelled Proben und Aufnahmen mit einer Leica SP5-AOBS konfokalen Laser-Scanning-Mikroskop an einem Leica DM i6000 invertiert Epifluoreszenzmikroskop. Alle Bilder wurden unter Verwendung eines 63x NA 1,4 Ölimmersionsobjektiv und Prozess mit Leica-Software.
CLSM Verfahren:
- Zu Beginn der CLSM Verfahren, einen Tropfen Immersionsöl auf das Ziel und Ort der Objektträger, Deckglas nach unten, auf dem Mikroskoptisch.
- Set dem Mikroskop zu einem visuellen Modus und finden Sie den Bereich von Interesse über die Okulare des Mikroskops.
- Mit Leica Software, wählen Sie die xyz Akquisition Modus.
- Wählen Sie die 512 x 512 Format (Bildgröße). Für Kolokalisation Studien, die höhere Auflösung, desto genauer das Bild, unter Berücksichtigung der Auflösungsgrenze des Mikroskops. Dann wählen Sie die bidirektionale X-Modus, der die Scan-Geschwindigkeit erhöhen und dazu beitragen, Foto-Bleichen.
- Set up sequentiellen Scan-Einstellungen. Klicken Sie in der "seq"-Funktion und wählen Sie eine der Scan-Modi. Wir verwenden "zwischen den Zeilen"-Modus.
- Wählen Laserstrahlen nach dem Fluorochromen konjugiert dem Sekundärantikörper: 405 nm für DAPI (blau), 488 nm für Alexa Fluor 488 (grün) und 561 nm für TRITC (rot). Aktivieren Photomultiplier (PMT) 1, 2 und 3. Passen Sie PMT-Einstellungen an den richtigen Emissionswellenlänge zu erkennen.
- Set up nach oben ("begin") und unten ("end") von z-Stapeln oder Serien. Als nächstes stellen Sie die gewünschte "z-Schritt-size".
- Neisseria meningitidis ist ein Diplococcus (Abb. 1G) und da jeder coccus hat einen ungefähren Durchmesser von 0,5 mm, die z-Schrittweite von 0,20 &mgr; m wurde gewählt, um die Wahrscheinlichkeit des Scannens jede coccus mindestens zweimal zu verbessern. Es ist auch innerhalb der Schrittweite für optimalen Auflösung von 0,1 bis 0,2 um.
- Stellen Sie den endgültigen Scan-Parameter, indem Sie Zeile Mittelung von 3, um das Signal-Rausch-Verhältnis zu verbessern.
- Durch Klick auf "Start"-Doppel-oder Dreifach-gefärbte Bilder werden durch sequentielles Abtasten bei verschiedenen Wellenlängen erhalten zu cross-talk zwischen verschiedenen Chromophoren zu beseitigen.
- Für einen Hinweis auf Kolokalisation von zwei Fluorochromen, wählen Sie die "Overlay"-Funktion, um ausgewählte Kanäle zu einem einzigen Bild verschmelzen, zum Beispiel, wenn beide Alexa 488 (grün) und TRITC (rot) Fluorochrome colocalise, gelbe Farbe wird in das überlagerte Bild erscheinen .
- Kompilieren z-Stapel oder eine Reihe mit der "maximalen Projektion"-Funktion für den Bau eines 2D-Bildes zur Visualisierung möglich Kolokalisation erforderlich. Weitere detaillierte Analyse der Kolokalisation kann durch Analyse der einzelnen optischen Schnitt erzielt werden.
- Nach dem Erwerb der z-Stacks oder Serie verarbeiten Ihre Daten auf einem orthogonalen Bild zur Visualisierung der intrazelluläre Lokalisation von verschiedenen Elementen (Abb. 1E) zu erhalten.
3. Die Quantifizierung der Kolokalisation
Statistische Analysen der konfokalen Scanning-Mikroskop werden die Bilder mit Volocity Software (Improvisation, PerkinElmer) durchgeführt. Diese Software bietet ein Tool speziell für Kolokalisation Analyse konzipiert, dass durch Manders et al. (1993) 5 beschrieben. Kolokalisation im Kontext der digitalen Fluoreszenzmikroskopie kann die Erkennung eines Signals am gleichen Voxel (Pixel Volumen) Lage in jedem Kanal beschrieben werden. Die beiden Kanäle sind aus Bildern von zwei verschiedenen Fluorochromen aus derselben Probe-Bereich (Volocity Bedienungsanleitung) Bezug genommen. Statistische Analysen werden mit Volocity Software (Improvisation, PerkinElmer) mittels quantitativer Kolokalisation Analysis beschrieben durchgeführt.
Quantitative Analysis Kolokalisation
- Erstellen Sie eine Bibliothek mit CLSM-Bilder mit Volocity Software.
- Wählen Sie "extended focus" vom Bild in der oberen Leiste. Dieses Tool wird z-Stacks in ein 2D-Bild zu analysierenden kompilieren.
- Wählen Sie "Kolokalisation"-Tool. Die beiden Kanäle analysiert werden sollen die gleichen Farbtiefe.
- Wählen Sie den Bereich, es wird quantifiziert werden. Stellen Sie den Schwellenwert auf jedem Hintergrund zu entfernen.
- Erstellen Sie die Kolokalisation Ausgang, indem Sie "zu generieren Kolokalisation". Kolokalisation Statistiken sind für die Regionen von Interesse ausgewählt zuvor generierten.
- Wählen Manders 'Koeffizienten R (Überlappung Koeffizient) und My (Kolokalisation Koeffizient).
- Manders 'Koeffizienten sind nicht empfindlich auf die Intensität der Färbung, wie sie gegen insgesamt Pixelintensität normalisiert, daher können sie eingesetzt werden, wenn die Färbung eines Antigens stärker als die andere ist.
- Overlap Koeffizient R nach Manders 5,6 repräsentiert das wahre Ausmaß der Kolokalisation, dh die Anzahl der Pixel, die mit der Gesamtzahl der Pixel im Vergleich colocalise.
- Auf der anderen Seite, die Kolokalisation Koeffizient, My, die Fluoreszenz Beitrag der häufiger Einheit (in diesem Fall α-Actinin, grün), die weniger häufig Einheit (in diesem Fall Bakterien, rot) beschreibt, dh die Anzahl der roten Pixel dass Überschneidungen mit grünen Pixel verglichen mit der Gesamtzahl der roten Pixel.
- Manders 'Koeffizienten zwischen 1 und 0, wobei 1 die hohe Kolokalisation, wobei 0 keiner, aber sie kann als Prozentsatz zur leichteren Interpretation zum Ausdruck gebracht werden.
- Export Statistik-Werte in eine Excel-Dokument für die Präsentation der Daten.
4. Repräsentative Ergebnisse
Intrazelluläre Lokalisation von OPC-exprimierenden Neisseria meningitidis und α-Actinin
Konfokale Bildgebung des menschlichen Gehirns mikrovaskulären Endothelzellen mit Nm für 3 und 8 Stunden wie oben angegeben Kolokalisation von α-Actinin und Nm, die weniger häufig zu sein in 3 h Infektion Experimente (nicht dargestellt) erschienen beschrieben infiziert verglichen mit Kulturen für 8 h infiziert ( Abbildung 1 AF). Eine nachweisbare Kolokalisation von α-Actinin mit OPC-exprimierenden Meningokokken war jedes Mal in> 5 wiederholten Experimenten beobachtet. Die statistische Analyse der Kolokalisation mit mehreren konfokalen Bildern erfolgte wie oben beschrieben durchgeführt. Insgesamt in HBMEC mit OPC-exprimierenden Meningokokken,> 25% Überlappung der grünen (α-Actinin) und rot (Nm) Pixel erhalten wurde (Abbildung 2B, Overlap Koeffizient R) infiziert. Im Gegensatz zu α-Actinin, Experimenten, in denen die Kennzeichnung von internalisierten Bakterien und entweder Aktin oder Vimentin durchgeführt wurde, wurde gelegentlich Kolokalisation mit Aktin aber beobachtet mit Vimentin war selten (Figure. 2B).
Die Daten wurden darüber hinaus anhand des Koeffizienten My, unter Berücksichtigung der relativen Häufigkeit der einzelnen Einheit. Meine ist ein Maß für die Häufigkeit des Auftretens der häufigeren Signal (in diesem Fall grün, α-Actinin) jedes Mal weniger reichlich Signal (in diesem Fall rot, Bakterien) auftritt. Diese Maßnahme zeigt eine auffallende Höhe des Auftretens von α-Actinin in der Nähe von verinnerlicht Meningokokken (Abb. 2A und C).
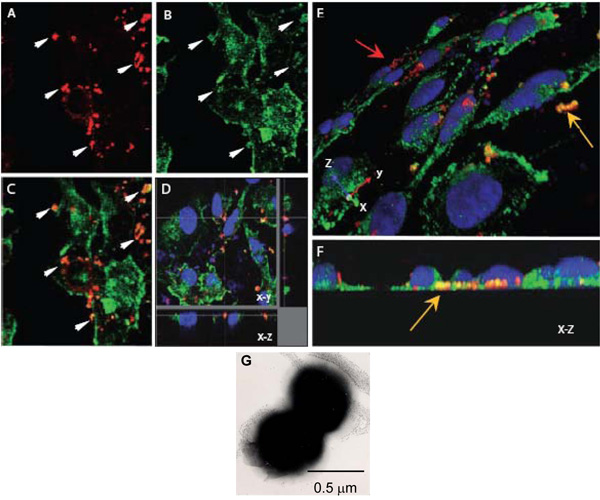
Abbildung 1. Konfokalen Laser-Scanning-Mikroskopie zur intrazellulären Interaktionen von N. bewerten meningitidis mit α-Actinin. AH. Confluent endothelialen Monolayer auf Deckgläsern gezüchtet wurden mit dem OPC-exprimierenden (AF) N. infiziert meningitidis. Nach 8 h, nicht haftende Bakterien gewaschen wurden abgeschnitten, Zellen mit Paraformaldehyd fixiert und permeabilisiert mit 0,1% Triton X-100. Anschließend wurden Bakterien und α-Actinin gefärbt wie oben beschrieben (α-Actinin, grün; Bakterien, rot).
AC. Ein Feld mit xy Bilder vom Standort des Nm (A) oder α-Actinin (B). Das Overlay-Bild in (C) zeigt mehrere Regionen, in denen gelb-orange Farbe anzeigt, dass Kolokalisation. Die Pfeile in (A) und (B) zeigen Regionen, in denen ein hohes Maß an α-Actinin Anhäufung scheint sich um Bakterien aufgetreten sind.
D. Optical Dissektion eines infizierten HBMEC Monoschicht zeigt Kolokalisation um intrazelluläre Bakterien an der Basis der Zelle befindet.
Auch dies ist Kolokalisation nicht durch zufällige Nähe der α-Actinin, als der General der α-Actinin Fleck in dieser Region ist gering.
E und F. Dreidimensionale Bilder von infizierten HBMEC Monoschichten wie oben verarbeitet. Ein schräger Blick auf die apikale Oberfläche (E) zeigt anhaftenden Bakterien rot gefärbt (roter Pfeil), während einige Bakterien auf die Grundflächen von Endothelzellen (gelber Pfeil) liegen deutlich orange / gelb in der Farbe. Basal Lage deutlicher in (F), die eine End-on XZ Querschnitt zu sehen.
G. A negativ gefärbten elektronenmikroskopische Aufnahme von N. meningitidis zeigt seinevorherrschende diplococcal aus. Jeder coccus ist ca. 0,5 m im Durchmesser.
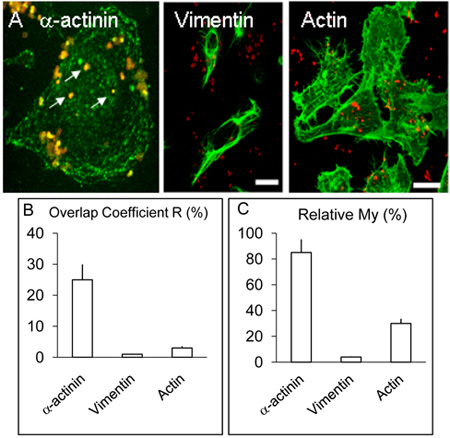
Abbildung 2. Lokalisierung und Verteilung von α-Actinin, Aktin und Vimentin in HBMEC Zellen.
A. Infizierte Monoschichten HBMEC behandelt wurden wie in der Legende oben beschrieben, jedoch zusätzlich zu α-Actinin, einige Deckgläser wurden für den Nachweis von Aktin oder Vimentin durch Verfahren ähnlich dem für α-Actinin verwendet. Wie oben, α-Actinin um mehrere verinnerlicht Bakterien (weiße Pfeile) konzentriert. Vimentin und Aktin nicht mit Bakterien zu nennenswerten Ebenen colocalise. Bar stellt 20 um.
B. & C. Die Werte für die Koeffizienten R und Meine wurden aus mehr als drei Versuche mit Volocity Software wie oben beschrieben erhalten.
Diskussion
Die Möglichkeit der Bindung von verinnerlicht Opc-exprimierenden Neisseria meningitidis, um α-Actinin erforscht wurde mit HBMEC durch die Untersuchung der Kolokalisation von Bakterien und die Zytoskelettprotein in infizierten Zellen nach 3 und 8 h Inkubationszeit. Durch konfokale Mikroskopie konnte Kolokalisation von Neisseria meningitidis mit α-Actinin nachgewiesen werden. Bemerkenswert ist, obwohl Bakterien bei 3 h verinnerlicht wurden, gab es wenig Kolokalisation mit α-Actinin zu diesem Zeitpunkt. Bakterielle Assoziation mit dem Zytoskelett-Protein schien einen längeren Zeitraum von intrazellulären Aufenthalt als nach 8 h Infektion Zeitraum benötigen, hatte eine erhebliche Zahl von Bakterien α-Actinin offenbar in enger Verbindung. Alpha-actinin ist ein multifunktionelles Protein, und bakteriellen Interaktionen mit dem Zytoskelett-Element könnte erheblichen Einfluss auf die Zielzelle Funktion, die einen Gegenstand aktueller Untersuchungen ist zu haben.
Die Quantifizierung der Kolokalisation wie oben beschrieben, erfordert eine sorgfältige Probenvorbereitung. Besonderes Augenmerk sollte auf Probe Fixierung gegeben werden, Sperrfrist und Antikörper-Verdünnungen. Für das beste Signal-Rausch-Verhältnis sollte jeder primären und sekundären Antikörper in Vorversuchen titriert werden, um die optimale Konzentration zu bestimmen. In unserer Erfahrung, produzierte das Eindeckmedium Mowiol bessere Bilder.
Offenlegungen
Danksagungen
Die Untersuchungen wurden von der Wellcome Trust und Meningitis Großbritannien finanziert. HBMEC Zelllinie wurde von Dr. KS Kim zur Verfügung gestellt. Konfokale Bildgebung und Elektronenmikroskopie wurden in den Wolfson Bioimaging Facility, University of Bristol durchgeführt. Wir möchten auch an Herrn Alan Leard, Dr. Mark Jepson (University of Bristol), und Herr Alan Tilley (PerkinElmer) für ihre Hilfe und Ratschläge danken.
Materialien
1. Konfokale Laser Scanning Mikroskopie (CLSM):
Leica SP5 konfokalen Imaging-System: Dieses System, das durch eine Kombination von AOTF (akusto-optischen abstimmbaren Filter) und einer AOBS (akusto-optischen Strahlteiler), vereinfacht Anregung mit bestimmten Wellenlängen.
2-Software:
Leica konfokalen Software LCS, Leica Microsystems, Deutschland.
Volocity 5, Improvisation, PerkinElmer, USA.
Referenzen
- Virji, M., Makepeace, K., Moxon, E. R. Distinct mechanisms of interactions of Opc-expressing meningococci at apical and basolateral surfaces of human endothelial cells; the role of integrins in apical interactions. Molecular Microbiology. 14, 173-184 (1994).
- Virji, M., Makepeace, K., Peak, I. R., Ferguson, D. J., Jennings, M. P., Moxon, E. R. Opc- and pilus- dependent interactions of meningococci with human endothelial cells: molecular mechanisms and modulation by surface polysaccharides. Molecular Microbiology. 18, 741-754 (1995).
- Sa E Cunha, C., Griffiths, N. J., Murillo, I., Virji, M. Neisseria meningitidis Opc invasin binds to the cytoskeletal protein alpha-actinin. Cellular Microbiology. 11, 384-405 (2009).
- Virji, M., Kayhty, H., Ferguson, D. J., Alexandrescu, C., Alexandrescu, J. E., Heckels, E. R. The role of pili in the interactions of pathogenic Neisseria with cultured human endothelial cells. Molecular Microbiology. 5, 1831-1841 (1991).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of colocalization of objects in dual color confocal images. Journal of Microscopy. 6, 357-382 (1993).
- Zinchuk, V., Zinchuk, O., Okada, T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images: pushing pixels to explore biological phenomena. Acta Histochemica et Cytochemica. 40, 101-111 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten