Method Article
La visualización y cuantificación de interacciones intracelulares de Neisseria meningitidis Humanos y α-actinina de imagen confocal
En este artículo
Resumen
Neisseria meningitidis (Nm), una gram negativos humanos específicos de patógenos respiratorios, se puede unir a humanos α-actinina. Aquí se presenta un protocolo para la visualización de la colocalización de la bacteria intracelular de α-actinina después de la entrada de bacterias en las células endoteliales microvasculares cerebrales (HBMECs).
Resumen
La proteína Opc de Neisseria meningitidis (Nm, meningococo) es una proteína expresada en la superficie integral de membrana externa, que puede actuar como una adhesina y un invasina eficaz para las células epiteliales y endoteliales. Hemos identificado encuentra en la superficie endotelial integrinas como receptores principales de OPC, un proceso que requiere Opc para unirse primero a ligandos de integrinas como la vitronectina y a través de estos a las células expresan receptores 1. Este proceso conduce a la invasión bacteriana de las células endoteliales 2. Más recientemente, se observó una interacción de OPC con una proteína 100kDa en lisados de células enteras de células humanas 3. Inicialmente se observó esta interacción cuando las proteínas de la célula huésped separados por electroforesis y se transfirieron a nitrocelulosa se superpone con el OPC-expresando Nm. La interacción es directa y no implican moléculas intermedias. Por espectrometría de masas, hemos establecido la identidad de la proteína como α-actinina. Como no hay superficie expresada α-actinina se encontró en ninguna de las ocho líneas celulares examinadas y, en las interacciones OPC con las células endoteliales en la presencia de plomo en suero a la entrada de bacterias en las células diana, se analizó la posibilidad de que las dos proteínas que interactúan intracelularmente. Para ello, cultivan el cerebro humano las células endoteliales microvasculares (HBMECs) estaban infectados con el OPC-expresando Nm durante largos períodos y los lugares de bacterias internalizadas y α-actinina fueron examinadas por microscopía confocal. Hemos observado en función del tiempo de aumento de la colocalización Nm con la proteína del citoesqueleto, que fue considerable después de un periodo de ocho horas de la internalización de las bacterias. Además, el uso de software de imagen cuantitativa nos permitió obtener una medida relativa de la colocalización de Nm con α-actinina y otras proteínas del citoesqueleto. Aquí se presenta un protocolo para la visualización y cuantificación de la colocalización de la bacteria con las proteínas intracelulares después de la entrada de bacterias en las células endoteliales humanas, aunque el procedimiento es también aplicable a las células epiteliales humanas.
Protocolo
1. Inmunofluorescencia Protocolo
La siembra, la infección y inmuno-tinción
Los procedimientos siguientes requieren un nivel adecuado de seguridad y las instalaciones de cultivo de tejidos microbiológicos de laboratorio.
DIA 1
A. Preparación de las células diana para la infección
- HBMECs de semillas a 50% de confluencia (~ 1.5x10 4 células / cm 2) en cubreobjetos de vidrio (16 mm de diámetro) se coloca en una placa de 12 pocillos (3,8 cm 2 área de crecimiento / y).
Medio de cultivo: RPMI 1640 suplementado con 15% inactivado por calor (56 ° C, 30min) de SFB, 2 mM de glutamina, 1 mM piruvato sódico, 100 U / mL de penicilina / estreptomicina al 1% (v / v) MEM no aminoácidos esenciales ácidos solución y solución al 1% MEM vitaminas. - Cultura durante la noche (O / N) a 37 ° C, en un 5% de CO 2 incubadora.
B. cultivo bacteriano
- Crecimiento de la cepa de interés O / N (16-18 h) en el medio de la infusión por ejemplo, requiere de cerebro y corazón (BHI) placas de agar suplementado con sangre de caballo al 10% se calienta a 37 ° C en 5% de atmósfera de CO 2 4.
DIA 2
A. Preparación de bacterias (N. meningitidis) Suspensión
- El uso de un bucle de la cultura l 10, hacer una suspensión del cultivo bacteriano durante la noche en 2 ml PBSB (PBS con calcio y magnesio).
- Permiten a las grandes agregados bacterianos a resolver, de salir de la suspensión durante 5 min a temperatura ambiente (TA).
- Sin perturbar el sedimento, la transferencia de la parte superior de 1 ml de la suspensión (stock de inóculo) en un tubo estéril.
- Para estimar el número de bacterias en el inóculo de valores, añadir alícuotas (20-50 l) de los tubos que contienen los volúmenes de 1 ml de SDS al 1% en 0,1 M de NaOH y mezclar suavemente hasta disolver.
- Medir el contenido de ácido nucleico de la solución mediante la determinación de la absorbancia a 260 nm (A260). En nuestras manos, A260 de 1 corresponde a 5x10 8 unidades formadoras de colonias / ml (ufc / ml). Esto se puede verificar mediante la preparación de una serie de diluciones del inóculo de valores en PBSB, enchapado en placas de agar y el recuento de colonias después de O / N de incubación.
- Diluir una alícuota del inóculo de valores en el medio de infección [(M199 suplementado con 2% decomplemented (56 ° C, 30min) de suero humano normal (NHS)] para obtener la densidad requerida de bacterias en la infección de las células diana.
- En nuestro laboratorio, una relación de la infección de 200 a 300 bacterias por célula diana se utiliza habitualmente.
Celular B. Cultura infección
- Lave el cubreobjetos con las células diana cultivadas 3 veces con medio de Hank para eliminar cualquier rastro de los antibióticos.
- Infectar a las células recién preparada con suspensiones bacterianas (descrito anteriormente) durante 3 horas a 8 horas a 37 ° C, en el 5% de CO 2.
- Al final del periodo de infección, lávese las células tres veces con PBS y fijar en 500 l de 2% de paraformaldehído (PFA) durante 30-45 minutos a temperatura ambiente o S / N a 4 ° C.
- La fijación de paraformaldehído en la concentración y el tiempo se muestra más arriba se encontró que era adecuada para la preservación de la morfología bacteriana y celular.
- Después de lavar paraformaldehído, permeabilizar las células paraformaldehído-fijo mediante la incubación en el 0,1% Triton X-100 diluido en PBS durante 10 minutos.
- Lavar las muestras 3 veces con PBS.
- Proceder a la inmuno-tinción, o bien, dejar muestras de 500 l de BSA al 1% / PBST O / N a 4 ° C.
DÍA 3
Inmunotinción
Tinción de bacterias intracelulares y α-actinina se puede realizar de forma secuencial o simultánea con el uso apropiado de anticuerpos primarios y secundarios de la siguiente manera, todos los procedimientos pueden ser realizados en placas de 12 pocillos.
- Bloquear los cubreobjetos que contienen las células permeabilizadas con 500 l de 3% de BSA / PBST (PBS con 0,05% Triton X-100) durante 30-60 minutos a temperatura ambiente
- Después de lavar con PBS, la transferencia de cada cubreobjetos con un pozo seco en la nueva placa de 12 pocillos.
- Añadir los anticuerpos primarios contra las bacterias y α-actinina, de ochenta a 100 L de anticuerpo por cubreobjetos es suficiente si se añade con cuidado para cubrir la superficie del cubreobjetos. Incubar durante 1 hora a temperatura ambiente.
- Se utilizó un antisuero policlonal de conejo contra la Neisseria meningitidis (de laboratorio criados) y el anticuerpo monoclonal de ratón (MAB) en contra de α-actinina (Abcam) al mismo tiempo. En algunos experimentos, en lugar de anti α-actinina, mAbs contra la actina y vimentina fueron utilizados (Sigma).
- Al final de la incubación, añadir 200 l de PBS para el bien, levantar el cubreobjetos y colocarlo en un nuevo pozo que contiene 500 l de PBS.
- Después de 5 minutos, retire PBS con la pipeta y luego añadir PBS. Repita dos veces. Transferencia a un cubreobjetospozo seco nuevo.
- Añadir los anticuerpos adecuados secundario conjugado con fluorocromos diferentes diluido en BSA al 1% / PBST, se incuban a temperatura ambiente durante 1 hora en la oscuridad.
- Para la detección de bacterias, se utilizó anti-conejo conjugado con TRITC Ig y para la detección de la proteína α-actinina y otros citoesqueleto, se utilizó Ig anti-ratón conjugado con FITC o-(Sigma) o Alexa Fluor 488 - (Invitrogen).
- Al final de la incubación, lavar como en los pasos 4 y 5.
- Contador mancha con 0,6 mg / ml en PBS DAPI (mancha de ADN) por 5 min a temperatura ambiente en la oscuridad.
- Enjuagar con PBS.
- Monte cubreobjetos (células boca abajo) sobre portaobjetos con una gota de medio de montaje (e, g. Mowiol o Vectashield)
- Almacenar en la oscuridad a 4 ° C.
- Muestras están listas para la observación bajo el microscopio.
2. Láser confocal de microscopía de barrido (CLSM)
Para observar y capturar imágenes de bacterias intracelulares y elementos del citoesqueleto, se utilizaron muestras de immunolabelled y las imágenes capturadas con una cámara Leica SP5-AOBS microscopio láser confocal de barrido unido a una Leica DM i6000 microscopio de epifluorescencia invertida. Todas las imágenes se recopilaron mediante un 63x 1,4 NA objetivo de inmersión en el aceite y el proceso con el software de Leica.
CLSM procedimiento:
- Para comenzar el procedimiento CLSM, añadir una gota de aceite de inmersión con el objetivo y el lugar de la diapositiva muestra, cubreobjetos hacia abajo, en la platina del microscopio.
- Ajuste el microscopio para determinar un modo visual y encuentre el área de interés usando las piezas del ojo del microscopio.
- Uso del software de Leica, seleccione el modo de adquisición xyz.
- Seleccionar el formato de 512 x 512 (tamaño del fotograma). Para los estudios de colocalización, la resolución más alta, más precisa será la imagen, teniendo en cuenta el límite de resolución del microscopio. A continuación, seleccione el modo bidireccional X, lo que aumentará la velocidad de exploración y ayudar a reducir el foto-blanqueo.
- Configurar ajustes de escaneo secuencial. Haga clic en la "ss" función y elegir uno de los modos de escaneo. Usamos "entre líneas" de modo.
- Seleccione rayos láser de acuerdo con los fluorocromos conjugado con los anticuerpos secundarios: 405 nm para DAPI (azul), 488 nm para Alexa Fluor 488 (verde) y 561 nm para TRITC (rojo). Activar el tubo fotomultiplicador (PMT) 1, 2 y 3, respectivamente. Ajustar la configuración de la PMT para detectar la longitud de onda correcta emisión.
- Establecer la parte superior ("begin") e inferior ("end") de z-pilas o series. A continuación, establezca la necesaria "z-el tamaño de paso".
- Neisseria meningitidis es un diplococo (Figura 1G) y dado que cada coco tiene un diámetro aproximado de 0,5 micras, el tamaño z paso de 0,20 micras fue elegido para mejorar la probabilidad de modo que cada coco por lo menos dos veces. Es también en el tamaño de paso para una resolución óptima de 0,1 a 0,2 micras.
- Establecer los parámetros de análisis final, seleccionando un promedio de línea de 3 para mejorar la relación señal-ruido.
- Al hacer clic en "Inicio" imágenes de doble o triple del manchar-se obtienen mediante el análisis secuencial de diferentes longitudes de onda para eliminar la diafonía entre los cromóforos diferentes.
- Para tener una idea de la colocalización de dos fluorocromos, seleccione la opción "overlay" la función para fusionar los canales seleccionados en una sola imagen, por ejemplo, cuando ambos Alexa 488 (verde) y TRITC fluorocromos (rojo) colocalise, color amarillo aparece en la imagen superpuesta .
- Compilar z-pilas o series con la "máxima proyección" la función para la construcción de una imagen 2D necesarios para la visualización de colocalización posible. Un análisis más detallado de la colocalización puede obtener mediante el análisis de cada sección óptica.
- Después de adquirir el z-pilas o series, proceso de datos para obtener una imagen ortogonal para la visualización de la localización intracelular de diversos elementos (Figura 1).
3. Cuantificación de la colocalización
Los análisis estadísticos de las imágenes del microscopio confocal de barrido se llevan a cabo con el software Volocity (Improvisación, PerkinElmer). Este software proporciona una herramienta diseñada específicamente para el análisis de colocalización según lo descrito por Manders et al. (1993) 5. Colocalización en el contexto de la imagen digital de fluorescencia se puede describir como la detección de una señal en el mismo voxel (volumen píxeles) la ubicación de cada canal. Los dos canales se componen de imágenes de dos fluorocromos diferentes desde la zona de la misma muestra (guía Volocity usuario). Los análisis estadísticos se realizaron con el software Volocity (Improvisación, PerkinElmer) mediante análisis de colocalización cuantitativos se describen a continuación.
Análisis cuantitativo de colocalización
- Crear una biblioteca de imágenes CLSM el uso de software Volocity.
- Seleccione "enfoque ampliado" de la imagen en la barra superior. Esta herramienta de compilación z-pilas en una imagen 2D a analizar.
- Seleccione "colocalización" de la herramienta. Los dos canales a analizar debe tener la misma profundidad de color.
- Seleccionar el área que va a ser cuantificados. Establecer el umbral para eliminar cualquier fondo.
- Crear la salida de la colocalización seleccionando la opción "generar colocalización". Estadísticas de colocalización se generan para las regiones de interés previamente seleccionados.
- Seleccione Manders coeficientes de R (coeficiente de coincidencia) y Mi (coeficiente de colocalización).
- Coeficientes Manders no son sensibles a la intensidad de la coloración, ya que se normalizó en contra de la intensidad total de píxeles, por lo que pueden ser empleados cuando la tinción de un antígeno es más fuerte que el otro.
- Superponen R coeficiente de acuerdo a Manders 5,6 representa el verdadero grado de colocalización, es decir, el número de píxeles que colocalise en comparación con el número total de píxeles.
- Por otro lado, el coeficiente de colocalización, Mi, describe la contribución de la fluorescencia de la fracción más abundante (en este caso α-actinina, verde) a la fracción menos abundante (en este caso las bacterias, de color rojo), es decir, el número de píxeles de color rojo que se superponen con los píxeles verdes en comparación con el número total de píxeles de color rojo.
- Coeficientes Manders rango entre 1 y 0, siendo 1 la colocalización de alta, 0 ninguno de ellos está, pero que puede ser expresado como porcentaje de fácil interpretación.
- Estadísticas de exportación de los valores de un documento de Excel para la presentación de los datos.
4. Resultados representante
Localización intracelular de OPC expresa la Neisseria meningitidis y α-actinina
Imagen confocal de cerebro humano las células endoteliales microvasculares infectados con Nm de 3 y 8 horas como se describe anteriormente indicado colocalización de α-actinina y Nm que parecía ser menos frecuentes en los tres experimentos de infección h (no se muestra), en comparación con los cultivos infectados durante 8 horas ( Figura 1 AF). A colocalización demostrable de α-actinina con OPC que expresan los meningococos se observó cada vez en> 5 replicar los experimentos. El análisis estadístico de la colocalización con varias imágenes de confocal se llevó a cabo como se describió anteriormente. En general, en HBMEC infectadas con el OPC-expresando meningococos,> la superposición del 25% de la luz verde (α-actinina) y los píxeles de color rojo (Nm) se obtuvo (Figura 2B, superposición coeficiente R). En contraste con la α-actinina, experimentos en los que se llevó a cabo el etiquetado de las bacterias internalizadas y, o bien de actina y vimentina, colocalización ocasionalmente se observó con la actina, pero que con vimentina fue rara (Figure. 2B).
Los datos también fueron analizados utilizando el coeficiente de mi, que tiene en cuenta la abundancia relativa de cada fracción. Mi es una medida de la frecuencia de aparición de la señal más abundante (en este caso verde, α-actinina) cada vez que la señal menos abundante (en este caso de color rojo, las bacterias) se produce. Esta medida muestra un nivel notable de ocurrencia de α-actinina en las inmediaciones de interiorizado meningococos (Figura 2A y C).
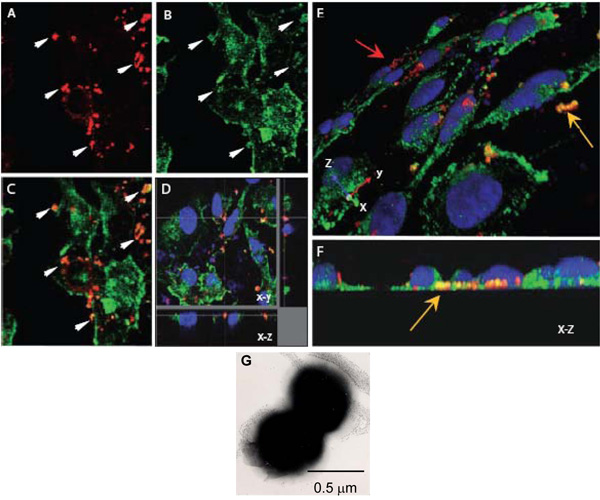
Figura 1. Láser confocal de microscopía de barrido para evaluar las interacciones intracelulares de N. meningitidis con α-actinina. AH. Confluente monocapas endoteliales cultivadas en cubreobjetos fueron infectadas con el OPC-expresa (AF) N. meningitidis. Después de 8 horas, las bacterias no adherentes se lavaron las células fijadas con paraformaldehído y permeabilizadas con Triton 0.1% X-100. Posteriormente, las bacterias y α-actinina se tiñeron como se describió anteriormente (α-actinina, verde, bacterias, rojo).
AC. Un campo que muestra imágenes de xy la ubicación de Nm (A) o α-actinina (B). La superposición de imágenes en (C) indica que varias regiones en las que el color amarillo-naranja parece sugerir colocalización. Las flechas en (A) y (B) muestran las regiones donde un alto grado de α-actinina acumulación parece haber ocurrido alrededor de las bacterias.
D. óptico disección de una colocalización monocapa infectada HBMEC indicando alrededor de las bacterias intracelulares ubicado en la base de una célula.
Una vez más, esta colocalización no es accidental debido a la proximidad de la α-actinina, como el general mancha de α-actinina en esta región es baja.
E y F. Las imágenes tridimensionales de las personas infectadas monocapas HBMEC procesados que el anterior. Una vista oblicua de la superficie apical (E) muestra las bacterias adheridas teñido de rojo (flecha roja), mientras que varias bacterias situada hacia la superficie basal de las células endoteliales (flecha amarilla) son claramente de color naranja / amarillo. Ubicación basal se puede ver más claramente en (F), que es un fin-de XZ sección transversal.
G. Una imagen de microscopio electrónico de tinción negativa de N. meningitidis que muestra sudiplococos predominantes. Cada coco es de aproximadamente 0,5 m de diámetro.
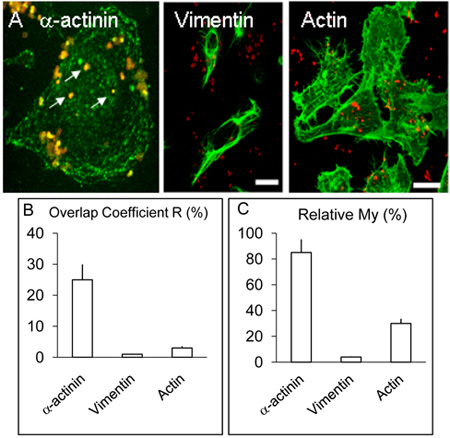
Figura 2. La localización y distribución de α-actinina, la actina y vimentina en las células HBMEC.
Monocapas infectadas de A. HBMEC fueron tratados como se describe en la leyenda anterior, pero además de la α-actinina, un cubreobjetos fueron utilizados para la detección de la actina y vimentina mediante procedimiento similar al de la α-actinina. Como el anterior, α-actinina concentra en torno a varias bacterias internalizadas (flechas blancas). Vimentina y actina no colocalise con las bacterias a niveles apreciables. Barra representa 20 micras.
B. y C. Los valores de los coeficientes R y mi fueron obtenidos de más de tres experimentos utilizando el software Volocity como se describió anteriormente.
Discusión
La posibilidad de unión de interiorizado OPC expresa la Neisseria meningitidis de α-actinina se exploró mediante HBMEC por el examen de la colocalización de la bacteria y la proteína del citoesqueleto de las células infectadas después de 3 y 8 período de incubación. Por microscopía confocal, la colocalización de Neisseria meningitidis con α-actinina se pudo demostrar. Cabe destacar que, aunque las bacterias se interiorizaron a las 3 h, se produjo poco colocalización con α-actinina en este punto del tiempo. Asociación de bacterias con la proteína del citoesqueleto parece requerir un largo período de residencia intracelular después de 8 h tiempo de infección, un número significativo de bacterias había α-actinina, aparentemente, en estrecha colaboración. Alfa-actinina es una proteína multifuncional, y las interacciones bacterianas con el elemento del citoesqueleto podría tener una influencia significativa en la función de las células diana, que es un tema de los estudios actuales.
Cuantificación de la colocalización como se describió anteriormente requiere una meticulosa preparación de la muestra. Se debe prestar especial atención a la fijación de la muestra, el bloqueo de las diluciones de época y de anticuerpos. Para obtener la mejor relación señal-ruido, cada anticuerpo primario y secundario deben ser valorados en experimentos preliminares para determinar las concentraciones óptimas. En nuestra experiencia, el medio de montaje Mowiol produce mejores imágenes.
Divulgaciones
Agradecimientos
Estos estudios fueron financiados por el Wellcome Trust del Reino Unido y la meningitis. HBMEC línea celular fue proporcionada por el Dr. KS Kim. Microscopía confocal y microscopía electrónica se realizaron en el Fondo para el Bioimagen Wolfson, de la Universidad de Bristol. También nos gustaría agradecer al Sr. Alan Leard, el Dr. Mark Jepson (Universidad de Bristol), y el Sr. Alan Tilley (PerkinElmer) por su ayuda y consejo.
Materiales
1. Láser confocal de microscopía de barrido (CLSM):
Leica SP5 confocal sistema de imagen: Este sistema, mediante el uso de una combinación de AOTF (acústico-ópticos filtro sintonizable) y AOBS un (acústico-óptico divisor de haz), simplifica la excitación con longitudes de onda específicas.
2-Software:
Confocal Leica software LCS, Leica Microsystems, Alemania.
Volocity 5, la improvisación, PerkinElmer, EE.UU..
Referencias
- Virji, M., Makepeace, K., Moxon, E. R. Distinct mechanisms of interactions of Opc-expressing meningococci at apical and basolateral surfaces of human endothelial cells; the role of integrins in apical interactions. Molecular Microbiology. 14, 173-184 (1994).
- Virji, M., Makepeace, K., Peak, I. R., Ferguson, D. J., Jennings, M. P., Moxon, E. R. Opc- and pilus- dependent interactions of meningococci with human endothelial cells: molecular mechanisms and modulation by surface polysaccharides. Molecular Microbiology. 18, 741-754 (1995).
- Sa E Cunha, C., Griffiths, N. J., Murillo, I., Virji, M. Neisseria meningitidis Opc invasin binds to the cytoskeletal protein alpha-actinin. Cellular Microbiology. 11, 384-405 (2009).
- Virji, M., Kayhty, H., Ferguson, D. J., Alexandrescu, C., Alexandrescu, J. E., Heckels, E. R. The role of pili in the interactions of pathogenic Neisseria with cultured human endothelial cells. Molecular Microbiology. 5, 1831-1841 (1991).
- Manders, E. M. M., Verbeek, F. J., Aten, J. A. Measurement of colocalization of objects in dual color confocal images. Journal of Microscopy. 6, 357-382 (1993).
- Zinchuk, V., Zinchuk, O., Okada, T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images: pushing pixels to explore biological phenomena. Acta Histochemica et Cytochemica. 40, 101-111 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados