A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التوكسوبلازما جدار الكيس الغوندية تشكيل المنشط تقوم البلاعم في نخاع العظام والمستمدة من الشروط المتباطئة
In This Article
Summary
المقوسة الغوندية يحول الى شكل كيس ردا على الضغوط البيئية ، والتي يمكن في نماذج تحاكي زراعة الأنسجة. هذا الفيديو يوضح التقنيات لدراسة تشكيل جدار الكيس عن طريق تنشيط نخاع العظام المستمدة الضامة أو تغيير درجة الحموضة المتوسطة النمو في الخلايا الليفية.
Abstract
المقوسة الغوندية هو طفيلي تلزم بين الخلايا التي يمكن أن تغزو أي خلية الأنوية من الحيوانات من ذوات الدم الحار. خلال العدوى ، T. كما تنشر الغوندية شكل سريع تكرار يسمى tachyzoite. Tachyzoites تحويلها الى شكل بطيء النمو المتباطئة متكيس يسمى بعملية الإشارات التي لا تتميز بشكل جيد. داخل الحيوانات ، تم العثور على أكياس المتباطئة في النظام العصبي المركزي والأنسجة العضلية وتمثل المرحلة المزمنة من المرض. يمكن تحويلها إلى bradyzoites تكون محاكاة في مجال زراعة الأنسجة عن طريق التجويع CO 2 ، وذلك باستخدام المتوسطة مع الحموضة عالية ، أو إضافة انترفيرون غاما (IFNγ). تتميز Bradyzoites عن وجود جدار الكيس ، والتي lectin Dolichos biflorus راصة (DBA) بربط. يستخدم DBA fluorescently المسمى لتصور جدار الكيس في الطفيليات التي تزرع في الخلايا الليفية الإنسان القلفة (HFFs) التي تعرضت لانخفاض CO 2 ، وارتفاع متوسط درجة الحموضة. وبالمثل ، والطفيليات المقيمين في نخاع العظام المستمدة من الفئران الضامة (BMMs) عرض الحائط كيسة كشفها بواسطة DBA بعد تنشيط BMMs مع IFNγ وlipopolysaccharide (LPS). وهذا البروتوكول لشرح كيفية إحداث تحويل T. الغوندية لbradyzoites باستخدام الرقم الهيدروجيني نمو عالية متوسطة منخفضة مع CO 2 وتفعيل BMMs. وسيتم تربيتها في الخلايا المضيفة coverslips ، tachyzoites المصابين هم من يمكنهم إما مع اضافة IFNγ وLPS (BMMs) أو تعرضها لدرجة الحموضة المتوسطة النمو العالية (HFFs) لمدة ثلاثة أيام. عند الانتهاء من العدوى ، وسوف تكون ثابتة الخلايا المضيفة ، permeabilized ، وحظرها. وسيتم استخدام الجدران كيسة تصور DBA رودامين مع المجهري مضان.
Protocol
1. إعداد الإنسان الليفية القلفة (HFF) المغلفة coverslips
- مكان معقم ساترة زجاجية مستديرة حول الجزء السفلي من الآبار لوحة نسيج الثقافة 24 أيضا.
- لحصاد HFFs من قارورة 2 150cm متموجة ، وشطف القارورة مرتين مع 1X PBS وإضافة 2.5 مل من 0.025 ٪ التربسين - EDTA. احتضان القارورة عند 37 درجة مئوية لمدة 5-10 دقائق.
- ويمكن الاستفادة من الجانب القارورة ضد كف يدك المساعدات في فصل الخلايا من القارورة. مرة واحدة الخلايا قد أفرج عنه من القارورة ، إضافة 150 مل من المتوسط HFF (Dulbecco في التعديل النسر متوسطة [DMEM] مع FBS 10 ٪ ، 2 مم L - الجلوتامين ، و 1 ٪ البنسلين الستربتوميسين) واستخدام وسيلة لغسل القارورة وجمع الخلايا.
- الاستغناء 1 مل من الخلايا لكل بئر مع coverslips.
- السماح لتصبح خلايا متكدسة عند 37 درجة مئوية ، 5 ٪ CO 2.
2. إعداد L929 المتوسطة مكيفة (CM) لتطوير BMC
- L929 هو مختل الصيغة الصبغية ليفية الفئران خط الخلية التي تفرز عامل تحفيز مستعمرة بلعم بعد فترات طويلة من confluency. هذا إفراز تمكن من L929 CM الخلايا لاستخدامها لتطوير خلايا فأر في نخاع العظم الضامة في الثقافة الخلية 1.
- مرة واحدة L929 الخلايا متموجة ، والسماح لهم لاحتضان أيام 7-9 اضافية حتى تظهر كروية وبدء رفع قبالة القارورة. جمع وطاف بيليه أية خلايا منفصلة في 425 x ج لمدة 10 دقائق. هذا هو طاف CM.
- واحد 150 سم 2 قارورة من الخلايا L929 غلة 30 مل من CM ، الذي يولد 150 مل من المتوسط BMC. وتتألف من FBS BMC المتوسطة 10 ٪ ، CM 20 ٪ ، 1 ٪ البنسلين الستربتوميسين ، و 1 ٪ في الجلوتامين L - DMEM.
3. العزلة من نخاع العظم والثقافة خلية من خلايا نخاع العظام
- التضحية C57BL 6 / 2 الماوس خنقا أكسيد الكربون وتعقيم السطح مع الايثانول 70 ٪.
- فضح البريتوني من خلال رفع جلد البطن بالقرب من المحطة وقطع مع مقص. تجنب ثقب التجويف البريتوني. خفض في الساق لفضح الساق والفخذ و. قطع الأنسجة العضلية من عظام الساق باستخدام المقص.
- لإزالة عظم الفخذ ، وقطع مرة واحدة اسفل الركبة ومرة واحدة بالقرب من مفصل الورك. مكان العظام في طبق بتري الجرثومية التي تحتوي الباردة 1X PBS. لا تستخدم زراعة الأنسجة المعالجة أطباق بتري لهذه الخطوات ، لأن خلايا نخاع العظم ستلتزم بشكل دائم. استخدام مشرط لكشط قبالة اضافية الأنسجة العضلية. قطع العظم فوق الركبة بقليل لفضح نخاع.
- كرر الخطوات من (ب) و (ج) لجمع نخاع العظم من عظم الفخذ الثاني.
- استخدام حقنة مليئة 10cc 1X PBS الباردة وإبرة قياس 25 لطرد لنخاع العظم في أنبوب مخروطي 50 مل. يجب أن تتم إزالة العظام تظهر مرة واحدة بيضاء نقية نخاع.
- تمرير الخليط PBS / نقي من خلال إبرة قياس 22 إلى تفتيت الحصى أي نخاع العظام.
- تدور الخليط في 425 x ج لمدة 10 دقائق ، وإزالة طاف.
- Resuspend الكرية في 8 مل من المتوسط BMC. إضافة 1 مل من التعليق الخلية و 9 مل المتوسطة BMC إلى 8 أطباق بتري الجرثومية.
- احتضان عند 37 درجة مئوية ، 5 ٪ CO 2.
- في يوم 5 ، وإضافة 10 مل BMC المتوسطة على كل صفيحة. قبل يوم 7 ، وسوف تكون خلايا كاملة النمو. قد يكون passaged خلايا نخاع العظم لمدة 1-2 أسابيع بعد النضج.
- لتقسيم خلايا نخاع العظم ، وإزالة المتوسطة وإضافة 5 مل من 1X PBS الباردة إلى كل طبق بتري. احتضان عند 4 درجة مئوية لمدة 30 دقائق ، حتى تبدأ الخلايا لرفع. خلايا نخاع العظم شطف قبالة مع لوحة ماصة نقل معقمة.
- تجمع خلايا نخاع العظم في أنبوب مخروطي 50 مل وبيليه في 425 x ج لمدة 10 دقائق.
- Resuspend وبيليه في 10 مل والمتوسطة BMC الاعتماد على عدادة الكريات. خلايا نخاع العظم في البذور 2x105 جيدا في صفيحة ال 24 جيدا مع الزجاج coverslips جولة في القاع. السماح للخلايا نخاع العظم قبل الانضمام بين عشية وضحاها مع اصابة T. يمكن reseeded الغوندية. خلايا نخاع العظام الزائدة على أطباق بتري لاستخدامها لاحقا.
4. اصابة الخلايا T. الغوندية
- إصابة 25 سم 2 قارورة من HFFs متموجة مع T. 6 2x10 الغوندية وتنمو حتى تبدأ الخلايا ليز (حوالي 2-3 أيام).
- استخدام مكشطة خلية لإزالة الخلايا المضيفة المصابة أحادي الطبقة من النسيج قارورة الثقافة ثم حرر الطفيليات من الخلايا المضيفة عن طريق تمرير المونولاير طردت من خلال إبرة عيار 27.
- عدادة الكريات تستخدم لتحديد عدد الطفيليات في المتوسط.
- إصابة 10 5 الطفيليات لكل بئر مع ساترة من monolayers HFF من البروتوكول 1 ، أو خلايا نخاع العظم من البروتوكول (3). السماح للغزو الطفيليات لمدة 3 ساعات في 37 درجة مئوية ، 5 ٪ CO 2.
5. بدء T. الغوندية المتباطئة التنمية من خلال الضغوط البيئية
- المتباطئة التنمية في HFFs مع زيادة درجة الحموضة والمتوسطة والتجويع CO 2
- تعد التنمية المتوسطة. التنمية المتوسطة يحتوي RPMأنا بدون بيكربونات 1640 ، 1 ٪ FBS ، 1 ٪ البنسلين الستربتوميسين ، و 42 HEPES ملم. الرقم الهيدروجيني إلى 8.0 تعقيم وتصفية.
- إزالة DMEM HFFs من المصابين ، وشطف مع 1X PBS ، وإضافة 1ml متوسطة التنمية.
- احتضان لمدة 3 أيام عند 37 درجة مئوية مع الهواء المحيط.
- تنشيط خلايا نخاع العظم
- إعداد المتوسطة لتفعيل خلايا نخاع العظم. التنشيط هو BMC المتوسطة المتوسطة تستكمل مع الإنترفيرون γ 100U/ml وLPS نانوغرام / 100 مل. LPS يصوتن في حمام الماء لمدة 2 دقيقة قبل استخدامها لتعطيل المجاميع.
- إزالة BMC المتوسطة من الآبار واستبدال مع 1 مل من المتوسط التنشيط.
- احتضان عند 37 درجة مئوية ، 5 ٪ CO 2 لمدة 3 أيام.
6. الكشف المناعي
- شطف المصابة الآبار ثلاث مرات مع 1X PBS.
- إصلاح أحادي الطبقة مع 200ul من الفورمالديهايد 3 ٪ لمدة 20 دقيقة.
- إزالة تثبيتي ، وشطف الآبار مع 1X PBS.
- إضافة 200μl من جليكاين M 0.1 إلى الآبار واسمحوا الجلوس لمدة 5 دقائق.
- جليكاين إزالة الآبار وشطف مع 1X PBS.
- إضافة 250 ميكرولتر من 3 ٪ BSA/0.2 ٪ TritonX - 100 في برنامج تلفزيوني ل1X permeabilize وعرقلة أحادي الطبقة لمدة 30 دقيقة.
- الحل إزالة الحجب وشطف الآبار مع 1X PBS.
- إضافة 50 ميكرولتر للتخفيف من 1:250 biflorus رودامين راصة Dolichos في 3 ٪ BSA/0.2 ٪ تريتون X - 100 في برنامج تلفزيوني 1X.
- تغطية صحن ومكان على منصة شاكر في درجة حرارة الغرفة لمدة 1 ساعة
- غسل coverslips 3 مرات مع 0.2 ٪ تريتون X - 100 في برنامج تلفزيوني 1X لمدة 5 دقائق على كل منصة شاكر.
- coverslips جبل باستخدام VectaShield المتوسطة المتصاعدة التي تحتوي على 4'6 - diamidino - 2 - phenylindole (دابي).
- ملطخة T. ويمكن تصور الغوندية باستخدام المجهر الفلورسنت مع مناسبة لتصفية رودامين في التكبير من 100X.
7. ممثل النتائج
الشكل 1 يوضح ممثل تلطيخ DBA ت. الغوندية BMMs في المنشط وHFFs تحت الضغط درجة الحموضة. كلا تلطيخ DBA تظهر حول الطفيليات التي تحتوي على فجوات ، مشيرا الى وجود مكونات جدار الكيس. صورة BMM تنشيط يبين تلطيخ DBA التي تنسجم مع السطح من فجوة. المقطع العرضي للT. الغوندية في درجة الحموضة وشدد HFFs يظهر الجدار كيسة مع عدم وجود الهياكل الداخلية الملون.
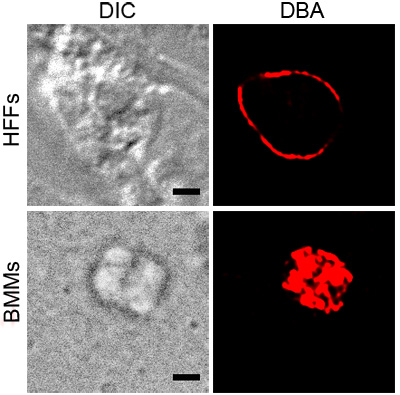
الشكل 1. ديسيبل تلون T. شدد وشدد الغوندية. الطفيليات بين الخلايا في ظل ظروف الإجهاد ، BMMs المنشط أو الحموضة HFFs ، كانت ملطخة DBA مترافق رودامين (الحمراء). الفرق المقابل تدخل (DIC) يبين الخطوط العريضة للكيسة وشريط أسود على نطاق يساوي 2 ميكرون.
تجارب على الحيوانات.
وقد أجريت تجارب على الحيوانات وفقا للمبادئ التوجيهية واللوائح التي وضعتها جامعة ويسكونسن ورعاية الحيوان اللجنة الاستخدام.
Discussion
في حين ليست آلية التنمية المتباطئة مفهومة تماما ، والتحليلات الجينية الجزيئية ت. وقد أدى الغوندية مرحلة التحويل في مجال زراعة الأنسجة إلى اكتشاف الجينات التي تشارك في تشكيل كيسة المتباطئة 2،3،4. التحليلات أدى أيضا إلى ملاحظة أن يتم التعبير عن بعض علام?...
Disclosures
Acknowledgements
Materials
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | GIBCO, by Life Technologies | 11960-051 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | heat inactivate |
| Rhodamine Dolichos biflorus agglutinin | Vector Laboratories | RL-1032 | |
| Formaldehyde (16%) | Polysciences, Inc. | 18814 | |
| Glycine | Fisher Scientific | BP381-5 | |
| HEPES | Fisher Scientific | BP310-1 | |
| IFNγ | PeproTech Inc | 315-05 | Store in single use aliquots |
| L-glutamine (200mM) | GIBCO, by Life Technologies | 25030 | |
| Lipopolysaccharide (LPS) | Sigma-Aldrich | L4391-1MG | Store in single use aliquots |
| Microscope Cover Glass | Fisher Scientific | 12-545-80 12CIR-1 | |
| Penicillin-Streptomycin | GIBCO, by Life Technologies | 15140 | |
| RPMI medium 1640 powder (with L-glutamine, without bicarbonate) | GIBCO, by Life Technologies | 31800-022 | |
| Triton-X-100 | Fisher Scientific | BP151-500 | |
| Trypsin-EDTA (0.25%) | GIBCO, by Life Technologies | 25200 | |
| VectaShield mounting media with DAPI | Vector Laboratories | H-1200 |
References
- Tomida, M., Yamamoto-Yamaguchi, Y., Hozumi, M. Purification of a factor inducing differentiation of mouse myeloid leukemic M1 cells from conditioned medium of mouse fibroblast L929 cells. J Biol Chem. 259 (17), 10978-10980 (1984).
- Matrajt, M., Donald, R. G., Singh, U., Roos, D. S. Identification and characterization of differentiation mutants in the protozoan parasite Toxoplasma gondii. Mol Microbiol. 44, 735-747 (2002).
- Singh, U., Brewer, J. L., Boothroyd, J. C. Genetic analysis of tachyzoite to bradyzoite differentiation mutants in Toxoplasma gondii reveals a hierarchy of gene induction. Mol Microbiol. 44, 721-733 (2002).
- J, P., Knoll, L. J. Isolation of Toxoplasma gondii development mutants identifies a potential proteophosphogylcan that enhances cyst wall formation. Molecular and Biochemical Parasitology. 169 (2), 120-123 (2010).
- Bohne, W., Heesemann, J., Gross, U. Induction of Bradyzoite-Specific Toxoplasma gondii Antigens in Gamma Interferon-Treated Mouse Macrophages. Infection and Immunity. 61 (3), 1141-1145 (1993).
- Ibrahim, H. M., Bannai, H., Xuan, X., Nishikawa, Y. Toxoplasma gondii Cyclophilin 18-Mediated Production of Nitric Oxide Induces Bradyzoite Conversion in a CCR5-Dependent Manner. Infection and Immunity. 77 (9), 3686-3695 (2009).
- Lyons, R. E., McLeod, R., Roberts, C. W. Toxoplasma gondii tachyzoite-bradyzoite interconversion. Trends in Parasitology. 18 (5), 198-201 (2002).
- Berghaus, L. J., Moore, J. N., Hurley, D. J., Vandenplas, M. L., Fortes, B. P., Wolfert, M. A., Boons, G. J. Innate immune responses of primary murine macrophage-lineage cells and RAW 264.7 cells to ligands of Toll-like receptors 2, 3, and 4. Comp Immunol Microbiol Infect Dis. , (2009).
- Mordue, D. G., Scott-Weathers, C. F., Tobin, C. M., Knoll, L. J. A patatin-like protein protects Toxoplasma gondii from degradation in activated macrophages. Mol Microbiol. 63 (2), 482-496 (2007).
- Bohne, W., Heesemann, J., Gross, U. Reduced replication of Toxoplasma gondii is necessary for induction of bradyzoite-specific antigens: a possible role for nitric oxide in triggering stage conversion. Infection and Immunity. 62 (5), 1761-1777 (1994).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved