É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Toxoplasma gondii Formação parede do cisto no Activated derivadas da medula óssea macrófagos e Condições Bradyzoite
Neste Artigo
Resumo
Toxoplasma gondii se converte em uma forma de cisto em resposta ao estresse ambiental, que pode ser imitada em modelos de cultura de tecidos. Este vídeo demonstra técnicas para examinar a formação de parede do cisto, ativando derivadas da medula óssea macrófagos ou alterar o pH de crescimento médio em células de fibroblastos.
Resumo
Toxoplasma gondii é um parasita intracelular obrigatório que pode invadir qualquer célula nucleada de animais de sangue quente. Durante a infecção, T. gondii dissemina como uma forma rápida replicação chamado tachyzoite. Taquizoítos converter em uma forma de crescimento lento encistados chamado bradyzoite por um processo de sinalização que não está bem caracterizada. Dentro de animais, cistos bradyzoite são encontradas no sistema nervoso central e tecido muscular e representam a fase crônica da infecção. Conversão para bradyzoites pode ser simulada em cultura de tecidos por inanição CO 2, utilizando meio com pH elevado, ou a adição de interferon gama (IFNγ). Bradyzoites são caracterizadas pela presença de uma parede do cisto, a que a lectina Dolichos biflorus aglutinina (DBA) liga. DBA fluorescente etiquetado é usado para visualizar a parede do cisto no parasitas cultivados em fibroblastos humanos prepúcio (HFFS) que tenham sido expostos a baixa emissão de CO 2 e pH médio alto. Da mesma forma, os parasitas que residem no óssea de camundongos derivadas da medula macrófagos (BMMs) exibir uma parede do cisto detectáveis por DBA após o BMMs são ativados com IFNγ e lipopolissacarídeo (LPS). Este protocolo irá demonstrar como induzir a conversão de T. gondii para bradyzoites usando um meio de crescimento elevado pH, com baixa de CO 2 e ativação de BMMs. Células do hospedeiro serão cultivadas em lamínulas, infectados com taquizoítos e quer ativado com adição de IFNγ e LPS (BMMs) ou expostos a um meio de alto pH de crescimento (HFFS) por três dias. Após a conclusão de infecções, células hospedeiras será corrigido, permeabilizadas, e bloqueado. Paredes do cisto será visualizado utilizando rodamina DBA com microscopia de fluorescência.
Protocolo
1. Preparação de fibroblastos humanos prepúcio (HFF) revestido lamínulas
- Coloque uma lamela de vidro estéril redonda sobre o fundo dos poços de uma placa de cultura de 24 poços de tecido.
- Para colher HFFS de um frasco de 150 centímetros confluentes 2, lavar o balão com duas 1X PBS e adicionar 2,5 ml de 0,025% de tripsina-EDTA. Incubar frasco a 37 ° C por 5-10 minutos.
- Tocando o lado do frasco contra a palma da sua mão pode ajudar em destacar as células do frasco. Uma vez que as células têm liberado do frasco, adicionar 150 ml de HFF médio (Modified Dulbecco Eagle Medium [DMEM] com 10% de SFB, 2 mM L-glutamina, e 1% de penicilina-estreptomicina) e use a médio e lavar o balão e recolher as células.
- Dispensar 1 ml de células por bem com as lamelas.
- Permitem que as células a se tornar confluentes, a 37 ° C, 5% CO 2.
2. Preparando L929 meio condicionado (MC) para desenvolvimento BMC
- L929 é uma linha de células aneuplóides murino fibrosarcoma que secreta colônia de macrófagos fator estimulador após longos períodos de confluência. Esta secreção permite que a CM da L929 células a serem utilizados para desenvolver células da medula óssea do rato em macrófagos em cultura de células 1.
- Uma vez L929 células são confluentes, deixe-incubar por mais 7-9 dias até que eles aparecem esférica e começar a decolagem do balão. Recolher o sobrenadante e pellet quaisquer células destacadas a 425 xg por 10 minutos. Este sobrenadante é o CM.
- Um frasco de 150 centímetros de duas células L929 rende 30 ml de CM, que gera 150 ml de meio de BMC. BMC médio é composto por 10% FBS, CM 20%, 1% de penicilina-estreptomicina, e 1% L-glutamina em DMEM.
3. Isolamento de medula óssea e de cultura de células de BMCs
- Sacrificar um rato C57BL / 6 por asfixia CO 2 e de superfície esterilizar com álcool 70%.
- Expor o peritônio, levantando a pele abdominal, perto da perna e corte com tesoura. Evitar a punção da cavidade peritoneal. Cortadas para a perna para expor a tíbia eo fêmur. Cortar o tecido muscular dos ossos da perna com uma tesoura.
- Para remover o fêmur, uma vez cortada abaixo do joelho e uma vez perto do quadril. Coloque os ossos em uma placa de Petri contendo bacteriológica frio 1X PBS. Não use cultura de tecidos tratados placas de Petri para essas etapas porque o BMCs vai aderir de forma permanente. Use um bisturi para raspar o tecido muscular extra. Cortar o osso logo acima do joelho para expor a medula.
- Repita os passos (b) e (c) para coletar a medula óssea do fêmur segundo.
- Use uma seringa de 10cc cheio de frio 1X PBS e uma agulha calibre 25 para desalojar a medula óssea em um tubo de 50 ml. O osso deve aparecer medula branco puro, uma vez é removido.
- Passe a mistura PBS / medula através de uma agulha de calibre 22 para quebrar qualquer agregados de medula óssea.
- Girar a mistura a 425 xg por 10 minutos, e remover o sobrenadante.
- Ressuspender o sedimento em 8 ml de meio de BMC. Adicionar 1 ml de suspensão de células e 9 ml de meio BMC a 8 pratos bacteriológica Petri.
- Incubar a 37 ° C, 5% CO 2.
- No dia 5, adicione 10 ml de meio BMC para cada prato. No 7 º dia, as células serão totalmente desenvolvidos. BMCs podem ser várias passagens por 1-2 semanas após a maturação.
- Para dividir BMCs, remova o meio e adicionar 5 ml de frio 1X PBS a cada placa de Petri. Incubar a 4 ° C por 30 minutos, até que as células começam a levantar. Lavar a BMCs off a placa com uma pipeta estéril.
- Piscina do BMCs em um tubo de 50 ml e pellet a 425 xg por 10 minutos.
- Ressuspender o sedimento em 10 ml de médio BMC e contar com um hemocitômetro. Semente 2x105 BMCs por bem em uma placa de 24 poços com lamínulas de vidro circulares na parte inferior. Deixe o BMCs aderir noite antes de infectar com o T. gondii. BMCs excesso pode ser reseeded em placas de Petri para uso posterior.
4. Infectar as células com T. gondii
- Infectar 25 cm 2 frasco de HFFS confluente com 2x10 6 T. gondii e crescer até que as células começam a lise (cerca de 2-3 dias).
- Use um raspador para remover células da monocamada de células infectadas anfitrião do frasco de cultura de tecidos em seguida, solte os parasitas de células do hospedeiro, passando a monocamada desalojado através de uma agulha calibre 27.
- Use um hemocitômetro para determinar o número de parasitas no meio.
- Infectar 10 5 por parasitas bem com lamela de HFF monocamadas do Protocolo 1, ou BMCs do Protocolo 3. Deixe os parasitas invadem durante 3 horas a 37 ° C, 5% CO 2.
5. Iniciar T. gondii desenvolvimento bradyzoite por estresses ambientais
- Bradyzoite desenvolvimento em HFFS com o aumento do pH médio e fome CO 2
- Prepare meio do desenvolvimento. Médio de desenvolvimento contém RPMEu, sem bicarbonato de 1640, 1% FBS, 1% de penicilina-estreptomicina e 42 mM HEPES. pH para 8,0 e filtro esterilizar.
- Remover DMEM de HFFS infectados, lavar com PBS 1X, e adicionar 1 ml de meio de desenvolvimento.
- Incubar por 3 dias a 37 ° C com o ar ambiente.
- Ativação de BMCs
- Prepare médio para ativar BMCs. Médio de ativação é BMC meio suplementado com IFN-γ 100U/ml e 100 ng / ml LPS. Sonicate LPS em banho-maria por 2 minutos antes de usar para interromper agregados.
- Remover BMC meio de poços e substituir com 1 ml de meio de ativação.
- Incubar a 37 ° C, 5% de CO 2 para 3 dias.
6. Detecção de imunofluorescência
- Enxágüe infectados poços três vezes com 1X PBS.
- Fixar a monocamada com 200ul de formaldeído a 3% por 20 minutos.
- Remover fixador e lavar os poços com PBS 1X.
- Adicionar 200μl de 0,1 M de glicina para poços e deixe descansar por 5 minutos.
- Remover glicina e enxaguar poços com PBS 1X.
- Adicionar 250 mL de 3% BSA/0.2% tritonX-100 em 1X PBS para permeabilizar e bloquear a monocamada por 30 minutos.
- Remoção da solução de bloqueio e lavar os poços com PBS 1X.
- Adicionar 50 ul de uma diluição de 1:250 de rodamina Dolichos biflorus aglutinina em 3% BSA/0.2% Triton X-100 em 1X PBS.
- Cobrir a placa e colocar na plataforma shaker à temperatura ambiente por uma hora
- Lavar as lamelas 3 vezes com 0,2% Triton X-100 em 1X PBS por 5 minutos cada em um agitador de plataforma.
- Lamínulas de montagem utilizando VectaShield meio de montagem contendo 4'6-diamidino-2-phenylindole (DAPI).
- T. manchada gondii pode ser visualizado através de um microscópio fluorescente com um filtro apropriado para rodamina com uma ampliação de 100x.
7. Resultados representativos
A Figura 1 mostra coloração representante da DBA T. gondii em BMMs ativado e HFFS sob estresse pH. Ambos mostram coloração DBA torno parasita contendo vacúolos, indicando a presença de componentes de parede do cisto. A imagem mostra BMM ativado coloração DBA que é consistente com a superfície do vacúolo. A seção transversal do T. gondii no pH salientou HFFS mostra a parede do cisto, sem estruturas internas manchado.
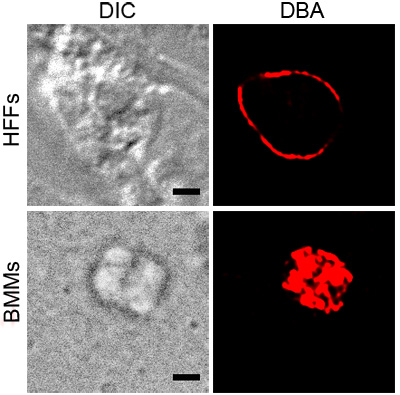
Figura 1. DBA coloração de T. salientou gondii. parasitas intracelulares sob condições de estresse, BMMs ativado ou pH salientou HFFS, foram coradas com conjugado DBA rodamina (vermelho). Contraste de interferência diferencial (DIC) mostra o esboço do cisto e da barra de escala preto é igual a 2 mM.
Experiências com animais
Experimentos em animais foram realizados de acordo com as diretrizes e regulamentos estabelecidos pela Universidade de Wisconsin Animal Care e do Comitê Use.
Discussão
Embora o mecanismo de desenvolvimento bradyzoite não é totalmente compreendido, molecular análises genéticas de T. gondii estágio de conversão em cultura de tecidos tem levado à descoberta de genes que estão envolvidos na formação de cistos bradyzoite 2,3,4. As análises também levaram à observação de que alguns marcadores bradyzoite são expressas em outras condições de estresse prolongado, incluindo o crescimento em macrófagos ativados 5,6. Os métodos acima descrevem co...
Divulgações
Agradecimentos
Materiais
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | GIBCO, by Life Technologies | 11960-051 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | heat inactivate |
| Rhodamine Dolichos biflorus agglutinin | Vector Laboratories | RL-1032 | |
| Formaldehyde (16%) | Polysciences, Inc. | 18814 | |
| Glycine | Fisher Scientific | BP381-5 | |
| HEPES | Fisher Scientific | BP310-1 | |
| IFNγ | PeproTech Inc | 315-05 | Store in single use aliquots |
| L-glutamine (200mM) | GIBCO, by Life Technologies | 25030 | |
| Lipopolysaccharide (LPS) | Sigma-Aldrich | L4391-1MG | Store in single use aliquots |
| Microscope Cover Glass | Fisher Scientific | 12-545-80 12CIR-1 | |
| Penicillin-Streptomycin | GIBCO, by Life Technologies | 15140 | |
| RPMI medium 1640 powder (with L-glutamine, without bicarbonate) | GIBCO, by Life Technologies | 31800-022 | |
| Triton-X-100 | Fisher Scientific | BP151-500 | |
| Trypsin-EDTA (0.25%) | GIBCO, by Life Technologies | 25200 | |
| VectaShield mounting media with DAPI | Vector Laboratories | H-1200 |
Referências
- Tomida, M., Yamamoto-Yamaguchi, Y., Hozumi, M. Purification of a factor inducing differentiation of mouse myeloid leukemic M1 cells from conditioned medium of mouse fibroblast L929 cells. J Biol Chem. 259 (17), 10978-10980 (1984).
- Matrajt, M., Donald, R. G., Singh, U., Roos, D. S. Identification and characterization of differentiation mutants in the protozoan parasite Toxoplasma gondii. Mol Microbiol. 44, 735-747 (2002).
- Singh, U., Brewer, J. L., Boothroyd, J. C. Genetic analysis of tachyzoite to bradyzoite differentiation mutants in Toxoplasma gondii reveals a hierarchy of gene induction. Mol Microbiol. 44, 721-733 (2002).
- J, P., Knoll, L. J. Isolation of Toxoplasma gondii development mutants identifies a potential proteophosphogylcan that enhances cyst wall formation. Molecular and Biochemical Parasitology. 169 (2), 120-123 (2010).
- Bohne, W., Heesemann, J., Gross, U. Induction of Bradyzoite-Specific Toxoplasma gondii Antigens in Gamma Interferon-Treated Mouse Macrophages. Infection and Immunity. 61 (3), 1141-1145 (1993).
- Ibrahim, H. M., Bannai, H., Xuan, X., Nishikawa, Y. Toxoplasma gondii Cyclophilin 18-Mediated Production of Nitric Oxide Induces Bradyzoite Conversion in a CCR5-Dependent Manner. Infection and Immunity. 77 (9), 3686-3695 (2009).
- Lyons, R. E., McLeod, R., Roberts, C. W. Toxoplasma gondii tachyzoite-bradyzoite interconversion. Trends in Parasitology. 18 (5), 198-201 (2002).
- Berghaus, L. J., Moore, J. N., Hurley, D. J., Vandenplas, M. L., Fortes, B. P., Wolfert, M. A., Boons, G. J. Innate immune responses of primary murine macrophage-lineage cells and RAW 264.7 cells to ligands of Toll-like receptors 2, 3, and 4. Comp Immunol Microbiol Infect Dis. , (2009).
- Mordue, D. G., Scott-Weathers, C. F., Tobin, C. M., Knoll, L. J. A patatin-like protein protects Toxoplasma gondii from degradation in activated macrophages. Mol Microbiol. 63 (2), 482-496 (2007).
- Bohne, W., Heesemann, J., Gross, U. Reduced replication of Toxoplasma gondii is necessary for induction of bradyzoite-specific antigens: a possible role for nitric oxide in triggering stage conversion. Infection and Immunity. 62 (5), 1761-1777 (1994).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados