Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Toxoplasma gondii Formation paroi du kyste dans la moelle osseuse Activé macrophages dérivés et Conditions Bradyzoite
Dans cet article
Résumé
Toxoplasma gondii se convertit en une forme un kyste, en réponse aux stress environnementaux, ce qui peut être imité dans les modèles de culture de tissus. Cette vidéo montre des techniques pour examiner la formation des parois du kyste en activant la moelle osseuse dérivées des macrophages ou des changements de pH moyen de croissance des cellules de fibroblastes.
Résumé
Toxoplasma gondii est un parasite intracellulaire obligatoire qui peut envahir toute cellule nucléée des animaux à sang chaud. Lors de l'infection, T. gondii diffuse comme une forme rapide répliquant appelé tachyzoïtes. Tachyzoïtes convertir en une forme à croissance lente enkystées appelé bradyzoite par un processus de signalisation qui ne sont pas bien caractérisés. Dans les animaux, les kystes bradyzoite sont trouvés dans le système nerveux central et les tissus musculaires et représentent la phase chronique de l'infection. Conversion à bradyzoïtes peut être simulé en culture de tissus par le CO 2 la famine, l'aide moyenne avec un pH élevé, ou l'ajout d'interféron gamma (IFN). Bradyzoïtes sont caractérisées par la présence d'un kyste, à laquelle la lectine de Dolichos biflorus agglutinine (DBA) lie. DBA marqué par fluorescence est utilisée pour visualiser la paroi du kyste chez des parasites cultivés dans des fibroblastes de prépuce humain (HFFS) qui ont été exposés à faibles émissions de CO 2 et moyennes pH élevé. De même, les parasites qui résident dans les os murins dérivés de la moelle macrophages (BMMs) affichent une paroi du kyste détectable par DBA après la BMMs sont activés avec IFN et de lipopolysaccharides (LPS). Ce protocole va montrer comment induire une conversion de T. gondii à l'aide d'un support bradyzoïtes pH élevé de croissance avec le CO 2 à faible et l'activation de BMMs. Les cellules hôtes seront cultivés sur des lamelles, infectés par tachyzoïtes et soit activé avec plus d'IFNy et LPS (BMMs) ou exposé à un milieu de croissance à pH élevé (HFFS) pendant trois jours. À la fin des infections, des cellules hôtes seront fixées, perméabilisées, et bloqués. Parois des kystes seront visualisés en utilisant la rhodamine DBA avec la microscopie à fluorescence.
Protocole
1. Préparation de fibroblastes de prépuce humain (HFF) enduit de lamelles
- Placer une lamelle de verre stérile ronde sur le fond des puits d'une plaque de 24 puits de culture de tissu.
- Pour récolter HFFS d'une confluence 150cm 2 flacon, rincer le ballon deux fois avec du PBS 1X et ajouter 2,5 ml de 0,025% de trypsine-EDTA. Incuber flacon à 37 ° C pendant 5-10 minutes.
- Exploiter le côté du ballon de contre la paume de votre main peut aider à détacher les cellules de la fiole. Une fois que les cellules ont libéré de la fiole, ajouter 150 ml de HFF moyennes (Dulbecco Modified Eagle Medium [DMEM] avec 10% de FBS, 2 mM de L-glutamine et 1% de pénicilline-streptomycine) et utiliser le moyen de se rincer la fiole et de recueillir les cellules.
- Distribuer 1 ml de cellules par puits avec les lamelles.
- Laisser les cellules deviennent confluentes à 37 ° C, 5% de CO 2.
2. Préparation L929 milieu conditionné (CM) pour le développement de BMC
- L929 est une ligne aneuploïdes murin fibrosarcome cellule qui sécrète colonies de macrophages facteur stimulant, après de longues périodes de confluence. Cette sécrétion permet à la CM de cellules L929 à être utilisé pour développer des cellules de la moelle osseuse de souris en macrophages dans une culture cellulaire.
- Une fois que des cellules L929 sont confluentes, laissez-les incuber pendant une 7-9 jours supplémentaires jusqu'à ce qu'ils apparaissent sphériques et commencer à lever hors du ballon. Recueillir surnageant et le culot des cellules détachées à 425 xg pendant 10 minutes. Ce surnageant est la CM.
- Un flacon de 150 cm 2 de cellules L929 rendements de 30 ml de CM, qui génère 150 ml de milieu de BMC. BMC milieu est composé de 10% de FBS, CM 20%, 1% de pénicilline-streptomycine et 1% de L-glutamine dans le DMEM.
3. L'isolement de la moelle osseuse et de culture cellulaire de BMC
- Sacrifice C57BL / 6 souris en CO 2 et la surface de l'asphyxie stériliser à 70% d'éthanol.
- Exposer le péritoine en soulevant la peau de l'abdomen près de la jambe et la coupe avec des ciseaux. Évitez de perforer le péritoine. Couper à la jambe pour exposer le tibia et le fémur. Coupez le tissu musculaire de l'os de la jambe à l'aide des ciseaux.
- Pour supprimer le fémur, couper une fois en dessous du genou et une fois près de la hanche. Placez les os dans un plat de Pétri contenant bactériologiques froide PBS 1X. Ne pas utiliser la culture de tissus traités boîtes de Pétri pour ces étapes parce que le BMC se conformer de façon permanente. Utiliser un scalpel pour gratter le tissu musculaire supplémentaire. Couper l'os juste au-dessus du genou pour exposer la moelle.
- Répétez les étapes (b) et (c) de recueillir la moelle osseuse du fémur secondes.
- Utiliser une seringue de 10cc rempli de PBS 1X froid et d'une aiguille de calibre 25 pour déloger la moelle osseuse dans un tube conique de 50 ml. L'os devrait apparaître pur moelle blanche fois est retiré.
- Passez le mélange PBS / la moelle par une aiguille de calibre 22 pour briser les agrégats de moelle osseuse.
- Spin le mélange à 425 xg pendant 10 minutes, et retirer le surnageant.
- Reprendre le culot dans 8 ml de milieu de BMC. Ajouter 1 ml de suspension cellulaire et 9 ml BMC moyenne à 8 bactériologiques boîtes de Pétri.
- Incuber à 37 ° C, 5% de CO 2.
- Au jour 5, ajouter 10 ml BMC moyenne à chaque assiette. Au jour 7, les cellules seront pleinement développées. BMC peuvent être repiquées pendant 1-2 semaines après la maturation.
- Pour diviser BMC, éliminer le milieu et ajouter 5 ml de PBS 1X froid à chaque boîte de Pétri. Incuber à 4 ° C pendant 30 minutes, jusqu'à ce que les cellules commencent à se soulever. Rincez le BMC de la plaque avec une pipette de transfert stérile.
- Piscine du BMC dans un tube conique de 50 ml et de granulés à 425 xg pendant 10 minutes.
- Reprendre le culot dans 10 ml de BMC moyen et compter sur un hématimètre. Graine 2x105 BMC par puits dans une plaque de 24 puits avec des lamelles de verre ronde sur le fond. Laissez les BMC adhèrent nuit avant d'infecter avec T. gondii. BMC en excès peuvent être ensemencés sur des boîtes de Pétri pour une utilisation ultérieure.
4. Infecter les cellules avec T. gondii
- Infect 25 cm 2 flacon de HFFS confluence avec 2x10 6 T. gondii et grandir jusqu'à ce que les cellules commencent à lyser (environ 2-3 jours).
- Utilisez un grattoir pour enlever la cellule de l'hôte infecté monocouche de cellules de la fiole de culture de tissus, puis relâchez les parasites de la cellule hôte par le passage de la monocouche délogé par une aiguille de calibre 27.
- Utilisez un hématimètre pour déterminer le nombre de parasites dans le milieu.
- Infect 10 5 parasites par bien avec lamelle de monocouches HFF de protocole 1, ou BMC du Protocole n ° 3. Laissez les parasites envahissent pendant 3 heures à 37 ° C, 5% de CO 2.
5. Initier T. gondii bradyzoite de développement par les contraintes environnementales
- Le développement de Bradyzoite HFFS avec une augmentation de pH du milieu et de CO 2 de famine
- Préparer le milieu du développement. Développement à moyen contient RPMJ'ai 1640 sans bicarbonate, 1% de FBS, 1% de pénicilline-streptomycine, et 42 mM d'HEPES. pH à 8,0 et stériliser par filtration.
- Retirer du DMEM HFFS infectés, rincer avec du PBS 1X, et ajoutez 1 ml de milieu de développement.
- Incuber pendant 3 jours à 37 ° C avec l'air ambiant.
- L'activation du BMC
- Préparer le milieu pour activer BMC. Moyennes activation est complétée par BMC moyennes d'IFN-γ 100U/ml et 100 ng / ml de LPS. Soniquer LPS dans un bain d'eau pendant 2 minutes avant de l'utiliser pour perturber les agrégats.
- Retirer BMC moyenne des puits et la remplacer par 1 ml de milieu d'activation.
- Incuber à 37 ° C, 5% de CO 2 pendant 3 jours.
6. Détection par immunofluorescence
- Rincez infectés puits trois fois avec du PBS 1X.
- Fixer le monocouche avec 200ul de formaldéhyde à 3% pendant 20 minutes.
- Retirer fixateur et rincer les puits avec du PBS 1X.
- Ajouter 200 ul de 0,1 M de glycine aux puits et laisser reposer pendant 5 minutes.
- Retirez la glycine et rincer les puits avec du PBS 1X.
- Ajouter 250 pi de 3% BSA/0.2% TritonX-100 dans du PBS 1X à perméabiliser et bloquer la monocouche pendant 30 minutes.
- Retirer la solution de blocage et rincer les puits avec du PBS 1X.
- Ajouter 50 ul d'une dilution 1:250 de la rhodamine Dolichos biflorus agglutinine de 3% BSA/0.2% de Triton X-100 dans du PBS 1X.
- Recouvrir la plaque et les placer sur la plate-forme agitateur à température ambiante pendant 1 heure
- Lavez les lamelles 3 fois avec 0,2% de Triton X-100 dans du PBS 1X pendant 5 minutes chacun sur un shaker plate-forme.
- Lamelles mont en utilisant le milieu de montage Vectashield contenant 4'6-diamidino-2-phénylindole (DAPI).
- Vitrail T. gondii peuvent être visualisées en utilisant un microscope à fluorescence avec un filtre approprié pour la rhodamine à un grossissement de 100x.
7. Les résultats représentatifs
La figure 1 montre coloration DBA représentant de T. gondii dans BMMs activé et HFFS sous stress pH. Les deux taches DBA montrer autour du parasite contenant des vacuoles, indiquant la présence de composants de la paroi du kyste. L'image montre BMM activé coloration DBA qui est conforme à la surface de la vacuole. La section transversale du T. gondii dans pH souligné HFFS montre la paroi du kyste sans structures internes tachés.
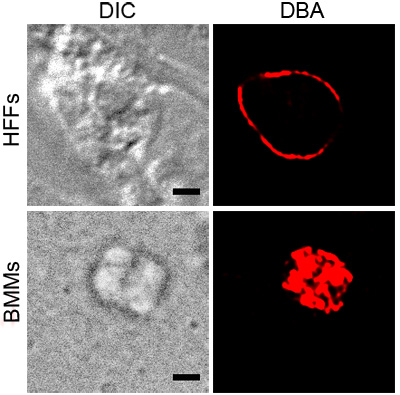
Figure 1. Coloration de la DBA a souligné T. gondii. parasites intracellulaires dans des conditions de stress, BMMs activé ou pH souligné HFFS, ont été colorés avec DBA conjugué rhodamine (rouge). Contraste d'interférence différentiel (DIC) montre le contour du kyste et la barre d'échelle est égal à 2 uM noire.
Expériences sur animaux
Expériences sur les animaux ont été effectuées en conformité avec les directives et règlements établis par l'Université du Wisconsin et de protection des animaux Comité utilisation.
Discussion
Bien que le mécanisme de développement bradyzoite n'est pas entièrement comprise, des analyses génétiques moléculaires de T. conversion de l'étape gondii dans la culture de tissus a conduit à la découverte des gènes qui sont impliqués dans la formation de kystes bradyzoite 2,3,4. Les analyses ont également conduit à l'observation que certains marqueurs bradyzoite sont exprimés dans d'autres conditions de stress prolongé, y compris la croissance dans les macroph...
Déclarations de divulgation
Remerciements
matériels
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | GIBCO, by Life Technologies | 11960-051 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | heat inactivate |
| Rhodamine Dolichos biflorus agglutinin | Vector Laboratories | RL-1032 | |
| Formaldehyde (16%) | Polysciences, Inc. | 18814 | |
| Glycine | Fisher Scientific | BP381-5 | |
| HEPES | Fisher Scientific | BP310-1 | |
| IFNγ | PeproTech Inc | 315-05 | Store in single use aliquots |
| L-glutamine (200mM) | GIBCO, by Life Technologies | 25030 | |
| Lipopolysaccharide (LPS) | Sigma-Aldrich | L4391-1MG | Store in single use aliquots |
| Microscope Cover Glass | Fisher Scientific | 12-545-80 12CIR-1 | |
| Penicillin-Streptomycin | GIBCO, by Life Technologies | 15140 | |
| RPMI medium 1640 powder (with L-glutamine, without bicarbonate) | GIBCO, by Life Technologies | 31800-022 | |
| Triton-X-100 | Fisher Scientific | BP151-500 | |
| Trypsin-EDTA (0.25%) | GIBCO, by Life Technologies | 25200 | |
| VectaShield mounting media with DAPI | Vector Laboratories | H-1200 |
Références
- Tomida, M., Yamamoto-Yamaguchi, Y., Hozumi, M. Purification of a factor inducing differentiation of mouse myeloid leukemic M1 cells from conditioned medium of mouse fibroblast L929 cells. J Biol Chem. 259 (17), 10978-10980 (1984).
- Matrajt, M., Donald, R. G., Singh, U., Roos, D. S. Identification and characterization of differentiation mutants in the protozoan parasite Toxoplasma gondii. Mol Microbiol. 44, 735-747 (2002).
- Singh, U., Brewer, J. L., Boothroyd, J. C. Genetic analysis of tachyzoite to bradyzoite differentiation mutants in Toxoplasma gondii reveals a hierarchy of gene induction. Mol Microbiol. 44, 721-733 (2002).
- J, P., Knoll, L. J. Isolation of Toxoplasma gondii development mutants identifies a potential proteophosphogylcan that enhances cyst wall formation. Molecular and Biochemical Parasitology. 169 (2), 120-123 (2010).
- Bohne, W., Heesemann, J., Gross, U. Induction of Bradyzoite-Specific Toxoplasma gondii Antigens in Gamma Interferon-Treated Mouse Macrophages. Infection and Immunity. 61 (3), 1141-1145 (1993).
- Ibrahim, H. M., Bannai, H., Xuan, X., Nishikawa, Y. Toxoplasma gondii Cyclophilin 18-Mediated Production of Nitric Oxide Induces Bradyzoite Conversion in a CCR5-Dependent Manner. Infection and Immunity. 77 (9), 3686-3695 (2009).
- Lyons, R. E., McLeod, R., Roberts, C. W. Toxoplasma gondii tachyzoite-bradyzoite interconversion. Trends in Parasitology. 18 (5), 198-201 (2002).
- Berghaus, L. J., Moore, J. N., Hurley, D. J., Vandenplas, M. L., Fortes, B. P., Wolfert, M. A., Boons, G. J. Innate immune responses of primary murine macrophage-lineage cells and RAW 264.7 cells to ligands of Toll-like receptors 2, 3, and 4. Comp Immunol Microbiol Infect Dis. , (2009).
- Mordue, D. G., Scott-Weathers, C. F., Tobin, C. M., Knoll, L. J. A patatin-like protein protects Toxoplasma gondii from degradation in activated macrophages. Mol Microbiol. 63 (2), 482-496 (2007).
- Bohne, W., Heesemann, J., Gross, U. Reduced replication of Toxoplasma gondii is necessary for induction of bradyzoite-specific antigens: a possible role for nitric oxide in triggering stage conversion. Infection and Immunity. 62 (5), 1761-1777 (1994).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon