È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Toxoplasma gondii parete formazione di cisti in attivo dal midollo osseo macrofagi e condizioni Bradyzoite
In questo articolo
Riepilogo
Toxoplasma gondii converte in una forma cisti in risposta a stress ambientali, che può essere imitato in modelli di colture di tessuti. Questo video mostra le tecniche per esaminare la formazione di cisti muro attivando midollo osseo macrofagi o modificare il pH medio di crescita in cellule di fibroblasti.
Abstract
Toxoplasma gondii è un parassita intracellulare obbligato che possono infettare ogni cellula nucleata di animali a sangue caldo. Durante l'infezione, T. gondii diffonde come una forma veloce replicando chiamato tachizoite. Tachizoiti convertire in una lenta crescita forma incistata chiamato bradyzoite da un processo di segnalazione che non è ben caratterizzato. All'interno di animali, cisti bradyzoite si trovano nel sistema nervoso centrale e del tessuto muscolare e rappresentano la fase cronica di infezione. Conversione in bradyzoites può essere simulato in coltura da CO 2 fame, utilizzando medio alta con un pH, o l'aggiunta di interferone gamma (IFNγ). Bradyzoites sono caratterizzate dalla presenza di un muro di cisti, a cui la lectina Dolichos biflorus agglutinina (DBA) si lega. DBA fluorescente viene utilizzato per visualizzare le cisti di parassiti muro cresciuto in fibroblasti umani prepuzio (HFFS) che sono stati esposti a basse emissioni di CO 2 e medio alto pH. Allo stesso modo, i parassiti che risiedono nel midollo osseo murino di derivazione macrofagi (BMMs) visualizzare una parete cisti rilevabile dal DBA dopo la BMMs sono attivate con IFNγ e lipopolisaccaride (LPS). Questo protocollo verrà illustrato come indurre la conversione di T. gondii a bradyzoites utilizzando un mezzo di crescita elevati pH con 2 CO bassa e l'attivazione di BMMs. Cellule ospiti saranno coltivati su vetrini, infettati con tachizoiti e sia attivato con aggiunta di IFNγ e LPS (BMMs) o esposti a una media di crescita elevato pH (HFFS) per tre giorni. Al termine delle infezioni, cellule ospiti sarà fissato, permeabilizzate, e bloccato. Pareti cisti verrà visualizzato usando DBA rodamina con microscopia a fluorescenza.
Protocollo
1. Preparazione dei fibroblasti prepuzio umano (HFF) rivestite coprioggetto
- Mettere un coprioggetti sterile di vetro rotonda sul fondo dei pozzetti di una 24-pozzetti di coltura tissutale.
- Per raccogliere HFFS da un confluente 150 centimetri 2 fiasco, lavare il pallone due volte con PBS 1X e aggiungere 2,5 ml di 0,025% tripsina-EDTA. Incubare Pallone a 37 ° C per 5-10 minuti.
- Toccando il lato del pallone contro il palmo della mano può aiutare a staccare le cellule dal pallone. Una volta che le cellule hanno liberato dal pallone, aggiungere 150 ml di HFF media (Dulbecco Modified Aquila Media [DMEM] con 10% FBS, 2 mM L-glutamina e 1% di penicillina-streptomicina) e utilizzare il mezzo per sciacquare il pallone e raccogliere le cellule.
- Dispensare 1 ml di cellule per bene con i coprioggetti.
- Consentono alle cellule di diventare confluenti a 37 ° C, 5% di CO 2.
2. Preparazione L929 mezzo condizionato (CM) per lo sviluppo BMC
- L929 è un fibrosarcoma murino linea di cellule aneuploidi che secerne il fattore stimolante colonie di macrofagi dopo lunghi periodi di confluenza. Questa secrezione permette al CM da L929 cellule da utilizzare per sviluppare il mouse cellule del midollo osseo in macrofagi in coltura cellulare 1.
- Una volta L929 cellule sono confluenti, lasciarli incubare per altri 7-9 giorni fino a che non appaiono sferici e iniziare a sollevare fuori il pallone. Raccogliere il supernatante e pellet eventuali cellule staccato a 425 xg per 10 minuti. Questo è il surnatante CM.
- Uno a 150 cm 2 fiasco di cellule L929 rendimenti 30 ml di CM, che genera 150 ml di medium BMC. BMC mezzo è composto da 10% FBS, 20% CM, 1% di penicillina-streptomicina e 1% di L-glutamina in DMEM.
3. Isolamento del midollo osseo e di colture cellulari di BMC
- Sacrificare uno C57BL / 6 del mouse asfissia da CO 2 e la superficie sterilizzare con il 70% di etanolo.
- Esporre il peritoneo sollevando la cute addominale vicino alla gamba e il taglio con le forbici. Evitare la puntura della cavità peritoneale. Ridurre alla gamba per esporre la tibia ed il femore. Tagliare il tessuto muscolare dalle ossa delle gambe con le forbici.
- Per rimuovere il femore, una volta tagliata sotto il ginocchio e una volta vicino al fianco. Mettere le ossa in un piatto batteriologico Petri contenenti freddo PBS 1X. Non utilizzare colture di tessuti trattati piastre di Petri per questi passi perché il BMC aderisce in modo permanente. Utilizzare un bisturi per raschiare il tessuto muscolare in più. Tagliare l'osso appena sopra il ginocchio per esporre il midollo.
- Ripetere i punti da (b) e (c) per raccogliere midollo osseo da femore secondo.
- Utilizzare una siringa 10cc riempito con PBS 1X freddo e da 25 gauge per rimuovere il midollo osseo in una provetta da 50 ml. L'osso deve apparire puro midollo bianco una volta è stato rimosso.
- Passare il composto PBS / midollo attraverso un ago 22 gauge per rompere ogni aggregati midollo osseo.
- Spin la miscela a 425 xg per 10 minuti, e rimuovere il surnatante.
- Risospendere il pellet in 8 ml di terreno BMC. Aggiungere 1 ml di sospensione cellulare e 9 ml di medie BMC a 8 piatti batteriologico Petri.
- Incubare a 37 ° C, 5% di CO 2.
- Il giorno 5, aggiungere 10 ml di media BMC per ogni piatto. Al 7 ° giorno, le cellule saranno pienamente sviluppati. BMC possono essere diversi passaggi per 1-2 settimane dopo la maturazione.
- Per dividere BMC, rimuovere il supporto e aggiungere 5 ml di PBS 1X freddo ad ogni piastra di Petri. Incubare a 4 ° C per 30 minuti, fino a quando le cellule cominciano a sollevare. Sciacquare la BMC via il piatto con una pipetta sterile per il trasferimento.
- Piscina del BMC in un tubo da 50 ml conica e pellet a 425 xg per 10 minuti.
- Risospendere il pellet in 10 ml di mezzo di BMC e contare su un emocitometro. Seme 2x105 BMC per bene in un 24-pozzetti con coprioggetto di vetro rotondo sul fondo. Lasciate che il BMC aderire durante la notte prima di infettare con T. gondii. BMC in eccesso può essere reseeded su piastre di Petri per un uso successivo.
4. Infettare le cellule con T. gondii
- Infettare 25 cm 2 fiasco di HFFS confluenti con 2x10 6 T. gondii e crescere fino a quando le cellule iniziano a lisare (circa 2-3 giorni).
- Utilizzare un raschietto per rimuovere le cellule infette monostrato cellula ospite dal pallone di coltura tissutale quindi rilasciare i parassiti dalle cellule ospiti passando il monostrato sloggiato con una 27-gauge.
- Utilizzare un emocitometro per determinare il numero di parassiti nel terreno.
- Infettare 10 5 parassiti per bene con coprioggetto di monostrati HFF dal protocollo n. 1, o BMC dal protocollo 3. Lasciate che i parassiti invadono per 3 ore a 37 ° C, 5% di CO 2.
5. Avvio T. gondii sviluppo bradyzoite da stress ambientali
- Sviluppo Bradyzoite in HFFS con aumento del pH medio e CO 2 fame
- Preparare di sviluppo a medio. Di sviluppo a medio contiene RPMI 1640 senza bicarbonato, 1% FBS, 1% di penicillina-streptomicina, e 42 HEPES mM. pH a 8,0 e filtrare sterilizzare.
- Rimuovere DMEM da HFFS infetti, sciacquare con PBS 1X, e aggiungere 1 ml di sviluppo a medio.
- Incubare per 3 giorni a 37 ° C con aria ambiente.
- Attivazione di BMC
- Preparare medio per attivare BMC. Medio di attivazione è di media BMC integrato con 100U/ml IFN-γ e 100 ng / ml LPS. Sonicare LPS in un bagno d'acqua per 2 minuti prima dell'uso per interrompere aggregati.
- Rimuovere BMC media da pozzi e sostituirlo con 1 ml di terreno di attivazione.
- Incubare a 37 ° C, 5% di CO 2 per 3 giorni.
6. Rilevamento immunofluorescenza
- Sciacquare infetti pozzi tre volte con PBS 1X.
- Fissare il monostrato con 200ul del 3% di formaldeide per 20 minuti.
- Rimuovere fissativo e risciacquare pozzetti con PBS 1X.
- Aggiungere 200μl di 0,1 M glicina a pozzi e lasciate riposare per 5 minuti.
- Rimuovere glicina e risciacquare pozzetti con PBS 1X.
- Aggiungere 250 microlitri del 3% BSA/0.2% TritonX-100 in PBS 1X per permeabilize e bloccare il monostrato per 30 minuti.
- Rimuovere soluzione di saturazione e risciacquare pozzetti con PBS 1X.
- Aggiungere 50 ml di una diluizione 1:250 di rodamina Dolichos biflorus agglutinina nel 3% BSA/0.2% Triton X-100 in PBS 1X.
- Piastra di copertura e posto su piattaforma agitatore a temperatura ambiente per 1 ora
- Lavare i coprioggetti 3 volte con 0,2% Triton X-100 in PBS 1X per 5 minuti ciascuno su un agitatore piattaforma.
- Coprioggetto montare utilizzando medium Vectashield montaggio contenente 4'6-diamidino-2-fenilindolo (DAPI).
- Macchiato T. gondii può essere visualizzato usando un microscopio a fluorescenza con un appropriato filtro per rodamina ad un ingrandimento di 100x.
7. Rappresentante risultati
La figura 1 mostra DBA colorazione rappresentante della T. gondii in BMMs attivato e HFFS sotto stress pH. Sia le macchie DBA spettacolo intorno parassita contenente vacuoli, che indica la presenza di componenti di parete cistica. L'immagine mostra BMM attivato colorazione DBA che è coerente con la superficie del vacuolo. La sezione di T. gondii del pH sottolineato HFFS mostra la parete cistica senza strutture interne macchiato.
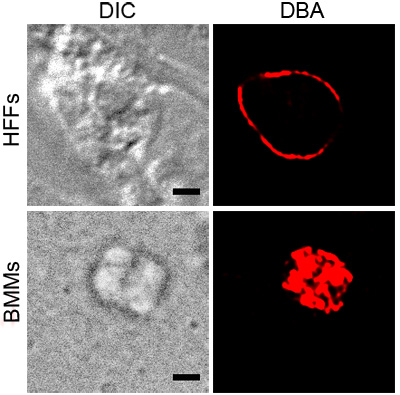
Figura 1. Colorazione di DBA sottolineato T. gondii. parassiti intracellulari in condizioni di stress, BMMs attivato o pH sottolineato HFFS, sono stati marcati con rodamina DBA coniugato (rosso). Contrasto interferenziale differenziale (DIC) mostra la sagoma della cisti e la barra di scala nera è uguale a 2 micron.
Esperimenti su animali
Gli esperimenti sugli animali sono stati eseguiti in conformità con le linee guida e dei regolamenti previsti dalla University of Wisconsin Cura degli animali e del Comitato Usa.
Discussione
Mentre il meccanismo di sviluppo bradyzoite non è pienamente compreso, analisi di genetica molecolare di T. stadio di conversione gondii in colture di tessuti ha portato alla scoperta di geni che sono coinvolti nella formazione di cisti bradyzoite 2,3,4. Le analisi inoltre ha portato alla constatazione che alcuni marcatori bradyzoite sono espressi in altre condizioni di stress prolungato, tra cui la crescita in macrofagi attivati 5,6. I metodi sopra descrivono come far cres...
Divulgazioni
Riconoscimenti
Materiali
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin | Sigma-Aldrich | A7906 | |
| Dulbecco’s Modified Eagle Medium (DMEM) | GIBCO, by Life Technologies | 11960-051 | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | heat inactivate |
| Rhodamine Dolichos biflorus agglutinin | Vector Laboratories | RL-1032 | |
| Formaldehyde (16%) | Polysciences, Inc. | 18814 | |
| Glycine | Fisher Scientific | BP381-5 | |
| HEPES | Fisher Scientific | BP310-1 | |
| IFNγ | PeproTech Inc | 315-05 | Store in single use aliquots |
| L-glutamine (200mM) | GIBCO, by Life Technologies | 25030 | |
| Lipopolysaccharide (LPS) | Sigma-Aldrich | L4391-1MG | Store in single use aliquots |
| Microscope Cover Glass | Fisher Scientific | 12-545-80 12CIR-1 | |
| Penicillin-Streptomycin | GIBCO, by Life Technologies | 15140 | |
| RPMI medium 1640 powder (with L-glutamine, without bicarbonate) | GIBCO, by Life Technologies | 31800-022 | |
| Triton-X-100 | Fisher Scientific | BP151-500 | |
| Trypsin-EDTA (0.25%) | GIBCO, by Life Technologies | 25200 | |
| VectaShield mounting media with DAPI | Vector Laboratories | H-1200 |
Riferimenti
- Tomida, M., Yamamoto-Yamaguchi, Y., Hozumi, M. Purification of a factor inducing differentiation of mouse myeloid leukemic M1 cells from conditioned medium of mouse fibroblast L929 cells. J Biol Chem. 259 (17), 10978-10980 (1984).
- Matrajt, M., Donald, R. G., Singh, U., Roos, D. S. Identification and characterization of differentiation mutants in the protozoan parasite Toxoplasma gondii. Mol Microbiol. 44, 735-747 (2002).
- Singh, U., Brewer, J. L., Boothroyd, J. C. Genetic analysis of tachyzoite to bradyzoite differentiation mutants in Toxoplasma gondii reveals a hierarchy of gene induction. Mol Microbiol. 44, 721-733 (2002).
- J, P., Knoll, L. J. Isolation of Toxoplasma gondii development mutants identifies a potential proteophosphogylcan that enhances cyst wall formation. Molecular and Biochemical Parasitology. 169 (2), 120-123 (2010).
- Bohne, W., Heesemann, J., Gross, U. Induction of Bradyzoite-Specific Toxoplasma gondii Antigens in Gamma Interferon-Treated Mouse Macrophages. Infection and Immunity. 61 (3), 1141-1145 (1993).
- Ibrahim, H. M., Bannai, H., Xuan, X., Nishikawa, Y. Toxoplasma gondii Cyclophilin 18-Mediated Production of Nitric Oxide Induces Bradyzoite Conversion in a CCR5-Dependent Manner. Infection and Immunity. 77 (9), 3686-3695 (2009).
- Lyons, R. E., McLeod, R., Roberts, C. W. Toxoplasma gondii tachyzoite-bradyzoite interconversion. Trends in Parasitology. 18 (5), 198-201 (2002).
- Berghaus, L. J., Moore, J. N., Hurley, D. J., Vandenplas, M. L., Fortes, B. P., Wolfert, M. A., Boons, G. J. Innate immune responses of primary murine macrophage-lineage cells and RAW 264.7 cells to ligands of Toll-like receptors 2, 3, and 4. Comp Immunol Microbiol Infect Dis. , (2009).
- Mordue, D. G., Scott-Weathers, C. F., Tobin, C. M., Knoll, L. J. A patatin-like protein protects Toxoplasma gondii from degradation in activated macrophages. Mol Microbiol. 63 (2), 482-496 (2007).
- Bohne, W., Heesemann, J., Gross, U. Reduced replication of Toxoplasma gondii is necessary for induction of bradyzoite-specific antigens: a possible role for nitric oxide in triggering stage conversion. Infection and Immunity. 62 (5), 1761-1777 (1994).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon