A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الشفوي إدارة روتنون باستخدام بالتزقيم وتحليل صورة الفا synuclein الادراج في الجهاز العصبي المعوي
In This Article
Summary
وقد ارتبط مرض باركنسون إلى التعرض للمبيدات الحشرية. هنا نعرض طريقة لتقديم المبيدات الحشرية باستخدام أنبوب إلى المعدة في التركيز المطلوب وطريقة لتحليل أثرها في تراكم synuclein ألفا في الجهاز العصبي المعوي.
Abstract
في مرضى باركنسون (PD) المرض ، وعلم الأمراض المرتبطة يتبع نمطا مميزة تشمل في جملة أمور على الجهاز العصبي المعوي (ENS) 1،2 ، والبصلة الشمية (OB) ، النواة الحركية الظهرية من 3 (DMV) المبهم ، والمتوسطي 4 نواة الحبل الشوكي ، والمادة السوداء ، وتوفير الأساس لانطلاق neuropathological من المرض 4،5. وENS وOB هم الأكثر تعرضا للهياكل العصبي ومنها أول من يتأثر. ومن المثير للاهتمام ، وقد ارتبط التعرض للمبيدات لPD 6-8. هنا نعرض بالتفصيل طريقتين المستخدمة في دراستنا السابقة 9. من أجل تحليل آثار روتينون تعمل محليا على ENS ، ونحن يديرها روتينون باستخدام أنبوب تغذية لمدة عام واحد الفئران C57/BL6 القديمة. روتينون هو المبيدات المستخدمة على نطاق واسع أن يكبح بقوة مجمع الميتوكوندريا أنا 10. فمن lipophylic للغاية ، واستوعبت ضعيفا في الجهاز الهضمي 11. وأظهرت نتائجنا ان الادارة من 5 ملغم / كغم من روتينون لم تمنع مجمع الميتوكوندريا أنا النشاط في العضلات أو الدماغ. وهكذا ، مما يشير إلى أن استخدام أسلوب الإدارة لدينا روتينون لم يعبر النظام كبدي بوابي وكان يتصرف فقط على ENS. هنا نعرض طريقة لإدارة مبيدات الآفات باستخدام بالتزقيم وبروتوكول تحليل الصور المستخدمة لتحليل آثار المبيدات في تراكم synuclein ألفا في ENS. الجزء الأول يوضح طريقة تسمح إدارة المبيدات داخل المعدة (روتينون) في تركيز دقيق المطلوب. الأسلوب الثاني يظهر تحليل الصور شبه التلقائي لتحليل بروتوكول ألفا synuclein تراكم في ENS باستخدام برمجيات تحليل الصور.
Protocol
1) الإدارة من داخل المعدة روتنون
- وزن الحيوان.
- حساب الحجم الكلي للروتينون / مركبة الحل المطلوب. في هذه الحالة 0.01 مل جرام من وزن الحيوان.
- تهمة حقنة 1 مل مع حجم المحسوبة سابقا من حل روتينون (0.625 ملغ / مل روتينون ، كربوكسي ميثيل سلولوز 4 ٪ و 1.25 ٪ كلوروفورم) أو حل السيارة (كربوكسي ميثيل سلولوز 4 ٪ و 1.25 ٪ كلوروفورم). في هذه الحالة كان مطابقا لجرعة روتينون 5 ملغم / كغم.
- التقاط الماوس ، وعقد ذيل الفأر مع يد واحدة ، وتمتد على جلد الرقبة بسحبه مع أصابع الأولين من جهة أخرى.
- مرة واحدة ثابتة الرأس بين أصابع اثنين العجاف ضد كف اليد وتحويلها رأسا على عقب. الإصلاح الذيل باستخدام الأصابع الرابع والخامس.
- حفظ الرأس نحو الظهر ، اضغط على الحنك لفتح فم الفأر. أعرض بلطف بالتزقيم في الفم. من المهم استخدام إبرة بالتزقيم وليس إبرة العادية. ببطء ، نقل بالتزقيم في اتجاه المعدة بعيدا بما فيه الكفاية. هذا سوف تجنب الحصول على المواد في الرئتين.
- إدارة حل روتينون أو مركبة بالضغط بلطف صمة. عند الانتهاء ، استخراج ببطء تسمين.
- مكان ظهر الحيوان في قفص آخر حتى تتم جميع الحيوانات من القفص.
إجراءات Immunostaining 2)
- بعد العلاج ، وتخدير الفئران باستخدام Ketamin 100 ملغم / كغم اوند Xylazin IP 10 ملغم / كغم وperfused intracardially لامتصاص العرق مع 4 ٪ في برنامج تلفزيوني.
- ثم يتم استخراج الشجاعة من قبل التشريح ، ووضعها في السكروز 15 ٪ بين عشية وضحاها. في اليوم التالي ، يتم نقل الأنسجة لالسكروز 30 ٪ وحضنت مرة أخرى بين عشية وضحاها في 4 درجات مئوية.
- ثم يتم وضع النسيج في تك النسيج وتخزينها في الفريزر -80 درجة مئوية حتى الاستخدام.
- باستخدام ناظم البرد ، يتم نقل 20 ميكرون الأمعاء المقاطع العرضية على الشرائح Superfrost.
- الحجب وimmunostaining الإجراءات باستخدام أضداد βIII - تويولين ومعاداة synuclein ألفا ، ثم يتم تنفيذها كما هو موضح سابقا 9.
3) تحليل صورة الفا synuclein إدراج
فمن المستحسن أن يجهل شخص خارجي المنشأ الصور 'ينفذ التحليل. لذا ، ينبغي تدوين البيانات. أجري تحليل الصور باستخدام برنامج فيجي.
- فتح ملف صورة مبائر. ثم ، وتقسيم القنوات بحيث يكون من الممكن العمل على كل قناة بشكل مستقل.
- إغلاق هذه القنوات التي لن يكون استخدام وحدد تحليل> ضبط مقياس وتعيين حجم بكسل إلى 1. تعيين المسافة المعروفة إلى 0.13 (وهذا يتوقف على الهدف والقرار المستخدمة) وانقر على الصعيد العالمي. سيتم الآن حجم الصورة ستكون معروضة في ميكرون.
- حدد قناة ألفا synuclein وحدد العقدة ، تأكد من أن اختيار يرفق العقدة في جميع الشرائح.
- اضغط> صورة مكررة لتكرار الصورة. مع العقدة المحددة ، ولن يكون صورة مكررة من حجم العقدة.
- الصحافة تحرير> خارج صافية. سيكون جزء من الصورة خارج المنطقة المحددة تصبح سوداء.
- تكرار الصورة مرة أخرى لتحديد الخطوات في وقت لاحق مدى الإجراء ذهب. لا ينبغي أن الصور التي تحتوي على إشارة إلى ارتفاع نسبة الضوضاء الخلفية لاستخدامها في تحليل الصور.
- اختر صورة> عتبة> ضبط ثم حدد MaxEntropy. ثم تنتقل عبر الشرائح في صورة اقتصاص ونسخة أصلية واحدة لضمان أن الإجراءات سارت على ما يرام. عتبة التدهور الحتمي تحديد مستوى كثافة إشارة على أساس الصورة والرسم البياني فقط تلك بكسل مع سيتم عرض كثافات أعلى من هذه العتبة في أكثر من صورة سوداء بيضاء.
- حدد عملية ، ثم انقر على السلس. هذه الخطوة تحول الحواف pixeled الصور في حواف ناعمة.
- حدد عملية ، ثم انقر على الثنائي ، وجعل اختيار الثنائي. سيتم عرض صورته كرجل أسود على صورة بيضاء.
- صورة مكررة لتنفيذ الخطوة التالية على الصورة تتكرر.
- انقر على تحليل> تحليل الجزيئات. ثم حدد عرض : الخطوط العريضة وانقر على تلخيص. يجب أن يكون بقية الأوراق في إعدادات الافتراضية. تسلم هذه الوظيفة العدد الإجمالي للبكسل مع إشارة وتلك التي يتم تجميعها معا. وذكرت والسطحية مجموعه بكسل مع الإشارة بالإضافة إلى عدد من مجموعات من بكسل وحجم متوسط.
- قارن وحدد أكبر شريحة أن يضبط بشكل جيد. وسيتم وضع علامة على شريحة.
- نسخ جدول البيانات مع سطح ألفا synuclein إجمالي عدد الادراج وحجم الجسيمات يعني. لصق البيانات في جداول اكسل أو المشروح في أماكن أخرى.
- عودة إلى فيجي والعثور على شريحة المحددة سابقا في قناة β - تويولين ، وتحديده.
- حدد منطقة العقدة وانقر على تحليل ثم حدد التدبير. وسوف يظهر جدول آخر يبينمجموع سطح العقدة.
- استخراج البيانات من الجدول إلى ورقة التفوق بالقرب من قياس ألفا synuclein أو نسخ عليه في أماكن أخرى.
- باستخدام إكسل ، تقسيم معلمات مختلفة تم الحصول عليها في قياس ألفا synuclein من عقدة للحصول على سطح إجمالي عدد السطحية وإدراج ألفا synuclein تطبيع حسب حجم العقدة.
نتائج الممثل 4)
عندما يتم تنفيذ بروتوكول إدارة بالتزقيم صحيح مضايقات للحيوان ضئيلة. العلاج باستخدام هذا التركيز من روتينون تمكن من التأثير المحلي روتينون على ENS دون مستويات روتينون في الدم وتثبيط أي مجمع العضلات أو الدماغ الميتوكوندريا أنا حتى بعد 1.5 شهر من العلاج (انظر الشكل 1) إذا أجري تحليل الصور بشكل صحيح وينبغي إجراء تحليل دقيق للنمط ألفا synuclein يكون ممكنا. انه يعطي بيانات موثوقة عن المبلغ الإجمالي للsynuclein ألفا (سطح الإجمالي) ، ألفا synuclein نمط في الخلية (عدد الادراج) وجود شوائب synuclein ألفا (حجم مضمن) (الشكل 2).
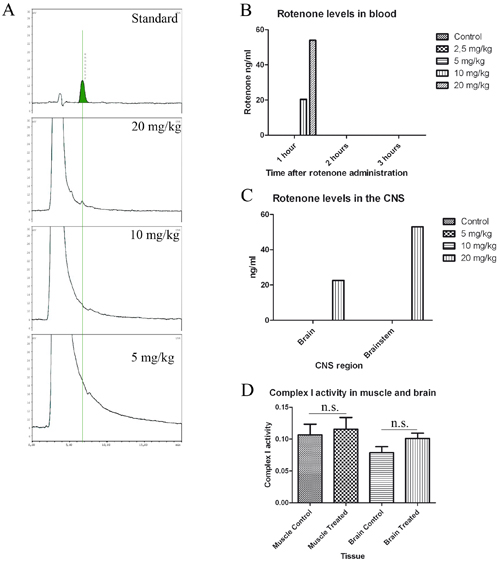
الشكل 1. علاج الخلل في المحرك روتينون الفئران دون الكشف عن روتينون في الدم أو الجهاز العصبي المركزي. قياسي ، (50 نانوغرام / مل) وchromatogram من عينات دماغ الفئران ملغم / كغم من 20 ، 10 و 5 المعالجة. B و C ، وتحديد مستويات روتينون في الدم (B) والجهاز العصبي المركزي (C). باء ، ومستويات الدم 1 و 2 و 3 ساعات بعد تلقي العلاج. وقسمت الفئران إلى ثلاث مجموعات (ن = 3) وتعامل مع 2.5 و 10 و 5 و 20 ملغم / كغم روتينون (ن = 3) ، تم استخراج 300 ميكرولتر من الدم 1 و 2 و 3 ساعات بعد تناوله روتينون والمجمعة معا من أجل HPLC تحليل جيم ، عولجت فئران لمدة أسبوع مرة واحدة في اليوم مع 5 (ن = 3) ، 10 (ن = 3) و 20 (ن = 1) ملغم / كغم انتزعت روتينون والمخ والدماغ 1 و 2 بعد ساعات مشاركة الإدارة والتطوير التي أعدت لهبلك. التحليل ، وأنا مجمع الميتوكوندريا النشاط في الدماغ والعضلات عينات من الفئران التي عولجت 1.5 شهر.

الشكل 2. روتينون تدار محليا يدفع ألفا synuclein الفسفرة ، وتراكم والتجميع مع دباق في العقد ENS (الحانات نطاق 20 ميكرون). A ، B ، C ، ومكافحة βIII - تويولين ألفا synuclein وتلوين دابي في العفج (B) والدقاق ( A ، C) المقاطع. السهم في باء ، 1.5 شهر يسببها العلاج منها زيادة ألفا synuclein نمط نقطي داخل الجهاز العصبي المعوي العقد بالمقارنة مع الضوابط 3 أشهر (A). السهم في C ، و 3 أشهر من تشكيل يسببها العلاج مشتملات أكبر ألفا synuclein (س> 6 ميكرون). D ، تلوين المناعي استخدام الألغام المضادة للsynuclein ألفا ، S ثيوفلافين ودابي. السهم في التطوير ، فقط لمدة 3 أشهر وأظهرت الفئران التي عولجت هذه التراكمات تجميع أكبر ألفا synuclein. E ، E '، E'' التحليل الكمي صورة الخطوات. E ، immunostained مثال الصورة المستخدمة في القياس الكمي مبديا العقدة ENS ضد synuclein ألفا تظهر مشتملات مختلفة. E '، مثال على صورة تم الحصول عليها بعد بروتوكول تحليل الصور. E'' ، التداخل بين بعض الادراج الأصلي (الأخضر) ، والحصول على تمثيل بعد تنفيذ البروتوكول (الخطوط الصفراء). FG ، القياس الكمي لهذه التجربة هو مبين في وقدم ميلان باستخدام التجزئة التلقائية وطرق thresholding الكون مقرا لها. واحد النجمة ، P <0.05 ، ومضاعفة النجمة ، P <0.01. F ، كل عمود يمثل مجموع ألفا synuclein سطح / سطح العقدة. G ، كل عمود يمثل مجموع عدد ألفا synuclein مشتملات / سطح العقدة. كل الرسوم البيانية تظهر يعني ± SEM
Discussion
وقد تم داخل المعدة الادارة تؤديها سابقا 12. ومع ذلك ، وفقا لمخطوطة Inden ، وكانت تدار روتينون المذابة في 0.5 ٪ كربوكسي ميثيل سلولوز ملح الصوديوم (نظم إدارة المحتوى) وحدها. روتينون هو مادة عالية liphophylic. لذا ، لا يمكن أن يتم حله في روتينون نظم إدارة المحتوى وحدها 0.5 ٪ ، وس?...
Disclosures
Acknowledgements
دعمت باري بيدرو دي لا مازا المؤسسة هذا العمل.
Materials
| Name | Company | Catalog Number | Comments |
| Rotenone | Sigma-Aldrich | R8875 | Germany |
| Chloroform | Carl Roth GmbH | 3313.1 | Germany |
| Carboxymethylcellulose | Sigma-Aldrich | C5678 | Germany |
| Gavage 1,2 mm x 60 mm | Unimed | Switzerland | |
| LSM 510 | Carl Zeiss, Inc. | ||
| FIJI | http://pacific.mpi-cbg.de |
References
- Braak, H., de Vos, R. A., Bohl, J., Del Tredici, K., K, . Gastric alpha-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology. Neurosci Lett. 396, 67-72 (2006).
- Wakabayashi, K., Takahashi, H., Ohama, E., Ikuta, F. Parkinson's disease: an immunohistochemical study of Lewy body-containing neurons in the enteric nervous system. Acta Neuropathol. 79, 581-583 (1990).
- Wakabayashi, K. Restricted occurrence of Lewy bodies in the dorsal vagal nucleus in a patient with late-onset parkinsonism. J Neurol Sci. 165, 188-191 (1999).
- Braak, H., Sastre, M., Bohl, J. R., de Vos, R. A., Del Tredici, K. Parkinson's disease: lesions in dorsal horn layer I, involvement of parasympathetic and sympathetic pre- and postganglionic neurons. Acta Neuropathol. 113, 421-429 (2007).
- Braak, H., Ghebremedhin, E., Rub, U., Bratzke, H., Del Tredici, K. Stages in the development of Parkinson's disease-related pathology. Cell Tissue Res. 318, 121-134 (2004).
- Gorell, J. M., Johnson, C. C., Rybicki, B. A., Peterson, E. L., Richardson, R. J. The risk of Parkinson's disease with exposure to pesticides, farming, well water, and rural living. Neurology. 50, 1346-1350 (1998).
- Semchuk, K. M., Love, E. J., Lee, R. G. Parkinson's disease and exposure to agricultural work and pesticide chemicals. Neurology. 42, 1328-1335 (1992).
- Butterfield, P. G., Valanis, B. G., Spencer, P. S., Lindeman, C. A., Nutt, J. G. Environmental antecedents of young-onset Parkinson's disease. Neurology. 43, 1150-1158 (1993).
- Pan-Montojo, F. Progression of Parkinson's disease pathology is reproduced by intragastric administration of rotenone in mice. PLoS One. 5, e8762-e8762 (2010).
- Sherer, T. B. Mechanism of toxicity in rotenone models of Parkinson's disease. J Neurosci. 23, 10756-10764 (2003).
- Bove, J., Prou, D., Perier, C., Przedborski, S. Toxin-induced models of Parkinson's disease. NeuroRx. 2, 484-494 (2005).
- Inden, M. Neurodegeneration of mouse nigrostriatal dopaminergic system induced by repeated oral administration of rotenone is prevented by 4-phenylbutyrate, a chemical chaperone. J Neurochem. 101, 1491-1504 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved