Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Administration orale de la roténone en utilisant un Gavage et analyse d'images d'alpha-synucléine inclusions dans le système nerveux entérique
Dans cet article
Résumé
La maladie de Parkinson a été lié à l'exposition aux pesticides. Ici, nous montrons une méthode pour fournir des pesticides à l'aide d'une sonde gastrique à la concentration désirée et une méthode pour analyser leur effet dans l'accumulation d'alpha-synucléine dans le système nerveux entérique.
Résumé
Dans la maladie de Parkinson (MP) des patients, la pathologie associée suit un modèle caractéristique impliquant notamment le système nerveux entérique (ENS) 1,2, le bulbe olfactif (OB), le noyau moteur dorsal du nerf vague (DMV) 3, le intermédiolatérale noyau de la moelle épinière et 4 de la substantia nigra, fournissant la base pour la stadification neuropathologiques de la maladie 4,5. L'ENS et l'OB sont les structures les plus exposées nerveux et les premières à être touchées. Fait intéressant, PD a été liée à 6-8 exposition aux pesticides. Ici, nous montrons en détail deux méthodes utilisées dans notre étude précédente 9. Afin d'analyser les effets de la roténone agit localement sur l'ENS, nous avons administré la roténone en utilisant un gavage à un an C57/BL6 souris. La roténone est un pesticide largement utilisé qui inhibe fortement complexe mitochondrial I 10. Il est fortement lipophile et mal absorbé dans le tractus gastro-intestinal 11. Nos résultats ont montré que l'administration de 5 mg / kg de roténone n'a pas inhibé l'activité complexe mitochondrial I dans le muscle ou le cerveau. Ainsi, ce qui suggère que la roténone en utilisant notre méthode d'administration n'a pas traversé le système hépatoportale et agissait uniquement sur l'ENS. Ici, nous montrons une méthode pour administrer les pesticides en utilisant un gavage et le protocole d'analyse d'images utilisés pour analyser les effets des pesticides dans l'alpha-synucléine accumulation dans l'ENS. La première partie montre une méthode qui permet l'administration intragastrique de pesticides (roténone) à une concentration désirée précis. La seconde méthode montre un protocole semi-automatique d'analyse d'images à analyser l'accumulation d'alpha-synucléine dans les ENS en utilisant un logiciel d'analyse d'image.
Protocole
1) Administration intragastrique de la roténone
- Peser l'animal.
- Calculer le volume total de la roténone / véhicule solution nécessaire. Dans ce cas 0,01 ml par gramme de poids de l'animal.
- Chargez une seringue de 1 mL avec le volume calculé précédemment d'une solution de roténone (0,625 mg / mL roténone, la carboxyméthylcellulose de 4% et 1,25% de chloroforme) ou la solution du véhicule (carboxyméthylcellulose 4% et 1,25% de chloroforme). Dans ce cas, elle correspond à une dose de 5 roténone mg / kg.
- Ramassez la souris et, tenant la queue de la souris avec une main, étirer la peau du cou en le tirant avec les deux premiers doigts de l'autre main.
- Une fois que la tête est fixée entre les deux doigts, il s'appuyer contre la paume de la main et le tourner à l'envers. Fixer la queue en utilisant les quatrième et cinquième doigts.
- Garder la tête vers l'arrière, appuyez sur le palais d'ouvrir la bouche de la souris. Introduire délicatement le gavage dans la bouche. Il est important d'utiliser une aiguille de gavage et non une aiguille régulière. Lentement, déplacez le gavage dans le sens de l'estomac assez loin. Cela permettra d'éviter matériels obtenir dans les poumons.
- Administrer la solution de roténone ou d'un véhicule en appuyant doucement sur l'embolie. Une fois terminé, lentement extraire le gavage.
- Placez le dos de l'animal dans une autre cage jusqu'à ce que tous les animaux d'une cage sont faites.
Procédures Immunocoloration 2)
- Après le traitement, les souris sont anesthésiées à l'aide Kétamine 100 mg / kg und Xylazin 10 mg / kg ip et intracardiaque perfusés avec du paraformaldéhyde 4% dans du PBS.
- Les tripes sont ensuite extraits par la dissection, et placés dans du saccharose 15% pendant la nuit. Le lendemain, le tissu est transféré à 30% de sucrose et incubé à nouveau la nuit à 4 ° C.
- Le tissu est ensuite placé dans Tissue-Tek et stockés dans un congélateur à -80 ° C jusqu'à utilisation.
- L'utilisation d'un cryostat, 20 microns intestin sections sont transférés à des diapositives Superfrost.
- Blocage et immunomarquage procédures utilisant des anticorps anti-βIII-tubuline et anti-alpha-synucléine sont ensuite effectuée comme décrit précédemment 9.
3) Image Analysis L'alpha-synucléine Inclusion
Il est recommandé qu'une personne externe ignore l'origine des images 'effectue l'analyse. Par conséquent, les données doivent être codifiées. L'analyse des images a été réalisée en utilisant le logiciel FIDJI.
- Ouvrez le fichier image confocale. Ensuite, diviser les canaux de sorte qu'il est possible de travailler sur chaque canal indépendamment.
- Fermer les canaux qui ne vont pas être utilisé et sélectionnez Analyser> Définir l'échelle et définir la taille des pixels pour 1. Réglez la distance connue à 0,13 (cela dépendra de l'objectif et la résolution utilisée) et cliquez sur mondiaux. La taille de l'image sera désormais indiqué dans microns.
- Sélectionnez l'alpha-synucléine canaux et sélectionnez ganglionnaires, assurez-vous que la sélection englobe le ganglion dans toutes les tranches.
- Image Press> Dupliquer pour dupliquer l'image. Avec le ganglion sélectionnés, seulement une image de la taille du ganglion sera dupliqué.
- Appuyez sur Modifier> Effacer extérieur. La partie de l'image en dehors de la région sélectionnée va devenir noire.
- Dupliquer l'image à nouveau pour déterminer dans les étapes ultérieures à quel point la procédure est allé. Les images qui ont un signal élevé au bruit ratio de fond ne devrait pas être utilisé pour l'analyse d'image.
- Sélectionnez Image> Réglages> Seuil puis sélectionnez MaxEntropy. Puis déplacez sur les tranches de l'image recadrée et celui d'origine afin de s'assurer que la procédure s'est bien déroulée. Le seuil entropique sélectionne un niveau de signal d'intensité basée sur l'histogramme d'image et que les pixels avec des intensités supérieures à ce seuil sera affichée dans un blanc sur l'image noire.
- Sélectionnez Processus, puis cliquez sur lisse. Cette étape transforme les bords pixeled des images en bords lisses.
- Sélectionnez processus, puis cliquez sur le binaire, et choisissez Créer un binaire. L'image sera affichée en tant que noir sur l'image blanche.
- Dupliquer l'image pour effectuer l'étape suivante sur l'image dupliquée.
- Cliquez sur Analyser> Analyse des particules. Ensuite, sélectionnez Afficher: Contours et cliquez sur Résumer. Le reste des paramètres doivent être feuillus en défaut. Cette fonction reconnaît le nombre total de pixels avec un signal et ceux qui sont regroupés. La surface totale des pixels avec un signal plus le nombre de groupes de pixels et la taille moyenne sont signalés.
- Comparez et choisissez le plus grand morceau qui ajuste bien. La tranche sera marqué.
- Copiez le tableau de données avec le nombre total d'alpha-synucléine surface, le nombre d'inclusions et la taille moyenne des particules. Collez les données dans un tableur Excel ou annotés ailleurs.
- Retour à Fidji et à trouver la tranche préalablement sélectionné dans le canal de β-tubuline, et le sélectionner.
- Sélectionnez la zone ganglionnaires et cliquez sur Analyser puis sélectionnez Mesure. Un autre tableau apparaît montrant lasurface totale du ganglion.
- Extraire les données de la table à la feuille Excel à proximité de la mesure alpha-synucléine ou le recopier ailleurs.
- Utilisation d'Excel, divisez les différents paramètres obtenus dans la mesure alpha-synucléine par la surface ganglionnaires pour obtenir le total d'alpha-synucléine certain nombre de surface et l'inclusion normalisée par la taille ganglionnaires.
Résultats Représentant 4)
Lorsque le protocole gavage est effectué correctement les inconvénients pour l'animal sont minimes. Traitement à l'aide de cette concentration de roténone permet un effet local de la roténone sur les ENS, sans niveaux roténone dans le sang et aucune inhibition du complexe de muscles ou le cerveau mitochondriale J'ai même après 1,5 mois de traitement (voir Figure 1). Si l'analyse d'images est effectuée correctement, une analyse rigoureuse de l'alpha-synucléine modèle devrait être possible. Il fournit des données fiables sur le montant total de l'alpha-synucléine (surface totale), l'alpha-synucléine motif dans la cellule (nombre d'inclusions) et la présence d'alpha-synucléine inclusions (taille inclusion) (figure 2).
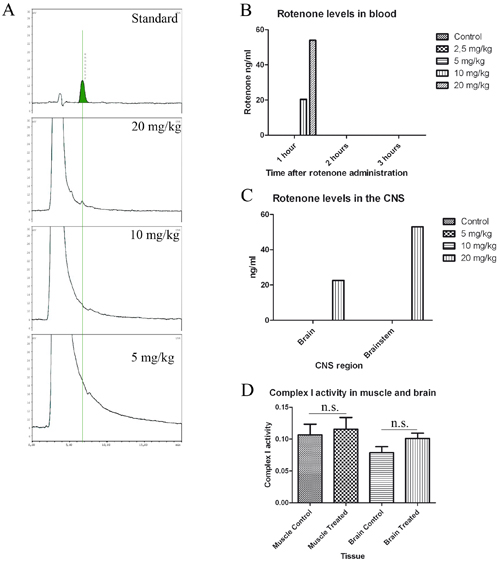
Figure 1. Dysfonction motrice de la roténone souris traitées sans détection de la roténone dans le sang ou le SNC. Une norme, (50 ng / ml) et chromatogramme des échantillons de cerveau de 20, 10 et 5 mg / kg chez les souris traitées. B et C, la quantification des niveaux roténone dans le sang (B) et du SNC (C). B, les taux sanguins 1 , 2 et 3 heures après le traitement. Les souris ont été divisées en trois groupes (n = 3) et traités avec 2,5, 5, 10 et 20 mg / kg de roténone (n = 3), 300 ul de sang a été extrait heures 1, 2 et 3 après l'administration de roténone et regroupées ensemble pour L'analyse par HPLC. C, les souris ont été traitées pendant une semaine une fois par jour avec 5 (n = 3), 10 (n = 3) et 20 (n = 1) mg / kg de roténone, le cerveau et le tronc cérébral ont été extraits 1 et 2 heures après dernière administration et préparés pour l'analyse HPLC. D, complexe mitochondrial I activité dans des échantillons de muscle et le cerveau de 1,5 mois chez les souris traitées.

Figure 2. Roténone administrés localement induit la phosphorylation d'alpha-synucléine, l'accumulation et l'agrégation avec gliose dans les ganglions de l'ENS. (Barres d'échelle 20 mm). A, B, C, anti-tubuline βIII, l'alpha-synucléine et la coloration DAPI dans le duodénum (B) et de l'iléon ( A, C) les articles. Flèche en B, 1,5 mois de traitement induit une augmentation de l'alpha-synucléine modèle ponctuée intérieur de ganglions système nerveux entérique, comparativement à 3 mois de contrôle (A). Flèche en C, la formation de 3 mois de traitement induit des grandes alpha-synucléine inclusions (ø> 6 m). D, immunofluorescence utilisant des anticorps anti-alpha-synucléine, Thioflavine S et DAPI. Flèche dans D, seulement trois mois chez les souris traitées ont montré l'agrégation de ces grandes accumulations d'alpha-synucléine. E, E ', E'', les étapes d'analyse d'images de quantification. E, par exemple de l'image utilisée dans la quantification montrant un ganglion ENS immunocolorés contre les alpha-synucléine montrant inclusions différentes. E ', par exemple d'image obtenue après le protocole d'analyse d'image. E'', le chevauchement entre certaines des inclusions d'origine (vert) et la représentation obtenue après l'exécution du protocole (lignes jaunes). FG, la quantification de l'expérience présentée dans le AC a été faite en utilisant une segmentation automatique et les méthodes de seuillage basée sur l'entropie. Single-astérisque, P <0,05, et double-astérisque, P <0,01. F, chaque colonne représente le total de l'alpha-synucléine surface / ganglionnaires surface. G, chaque colonne représente le nombre total d'alpha-synucléine inclusions / surface de ganglion. Tous les graphiques montrent moyenne ± SEM
Discussion
L'administration intragastrique a déjà été réalisé 12. Toutefois, selon le manuscrit de Inden, le roténone a été administré dissous dans le sel de carboxyméthylcellulose de sodium à 0,5% (CMSS) seul. La roténone est une substance de haute liphophylic. Par conséquent, la roténone ne peut pas être dissous dans CMSS 0,5% seul et va précipiter, si fait. L'utilisation de chloroforme crée une suspension roténone répartie uniformément en évitant la précipitation. Par ailleurs, en raiso...
Déclarations de divulgation
Remerciements
Le Pedro Barrie de la Maza Fondation a soutenu ce travail.
matériels
| Name | Company | Catalog Number | Comments |
| Rotenone | Sigma-Aldrich | R8875 | Germany |
| Chloroform | Carl Roth GmbH | 3313.1 | Germany |
| Carboxymethylcellulose | Sigma-Aldrich | C5678 | Germany |
| Gavage 1,2 mm x 60 mm | Unimed | Switzerland | |
| LSM 510 | Carl Zeiss, Inc. | ||
| FIJI | http://pacific.mpi-cbg.de |
Références
- Braak, H., de Vos, R. A., Bohl, J., Del Tredici, K., K, . Gastric alpha-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology. Neurosci Lett. 396, 67-72 (2006).
- Wakabayashi, K., Takahashi, H., Ohama, E., Ikuta, F. Parkinson's disease: an immunohistochemical study of Lewy body-containing neurons in the enteric nervous system. Acta Neuropathol. 79, 581-583 (1990).
- Wakabayashi, K. Restricted occurrence of Lewy bodies in the dorsal vagal nucleus in a patient with late-onset parkinsonism. J Neurol Sci. 165, 188-191 (1999).
- Braak, H., Sastre, M., Bohl, J. R., de Vos, R. A., Del Tredici, K. Parkinson's disease: lesions in dorsal horn layer I, involvement of parasympathetic and sympathetic pre- and postganglionic neurons. Acta Neuropathol. 113, 421-429 (2007).
- Braak, H., Ghebremedhin, E., Rub, U., Bratzke, H., Del Tredici, K. Stages in the development of Parkinson's disease-related pathology. Cell Tissue Res. 318, 121-134 (2004).
- Gorell, J. M., Johnson, C. C., Rybicki, B. A., Peterson, E. L., Richardson, R. J. The risk of Parkinson's disease with exposure to pesticides, farming, well water, and rural living. Neurology. 50, 1346-1350 (1998).
- Semchuk, K. M., Love, E. J., Lee, R. G. Parkinson's disease and exposure to agricultural work and pesticide chemicals. Neurology. 42, 1328-1335 (1992).
- Butterfield, P. G., Valanis, B. G., Spencer, P. S., Lindeman, C. A., Nutt, J. G. Environmental antecedents of young-onset Parkinson's disease. Neurology. 43, 1150-1158 (1993).
- Pan-Montojo, F. Progression of Parkinson's disease pathology is reproduced by intragastric administration of rotenone in mice. PLoS One. 5, e8762-e8762 (2010).
- Sherer, T. B. Mechanism of toxicity in rotenone models of Parkinson's disease. J Neurosci. 23, 10756-10764 (2003).
- Bove, J., Prou, D., Perier, C., Przedborski, S. Toxin-induced models of Parkinson's disease. NeuroRx. 2, 484-494 (2005).
- Inden, M. Neurodegeneration of mouse nigrostriatal dopaminergic system induced by repeated oral administration of rotenone is prevented by 4-phenylbutyrate, a chemical chaperone. J Neurochem. 101, 1491-1504 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon