A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
والفحص عن عضوي النمط شريحة الوقت الفاصل بين التصوير عالية الدقة للهجرة الخلايا العصبية في الدماغ بعد الولادة
In This Article
Summary
يصف هذا البروتوكول مقايسة شريحة عضوي النمط الأمثل للدماغ بعد الولادة وعالية الدقة الوقت الفاصل بين التصوير الهجرة neuroblast في تيار الهجرة منقاري.
Abstract
تكوين الخلايا العصبية في الدماغ بعد الولادة يعتمد على المحافظة على ثلاثة أحداث البيولوجي : انتشار الخلايا الاصلية ، والهجرة من neuroblasts ، فضلا عن التفاضل والتكامل من الخلايا العصبية الجديدة في الدوائر العصبية الموجودة. لتكوين الخلايا العصبية بعد الولادة في بصيلات الشم ، يتم فصل هذه الأحداث في غضون ثلاثة مجالات مميزة تشريحيا : يحدث الانتشار إلى حد كبير في المنطقة تحت البطانة العصبية (المنطقة الاقتصادية الخاصة) من البطينين الوحشي ، من خلال ترحيل neuroblasts اجتياز تيار المهاجرة منقاري (RMS) ، وخلايا عصبية جديدة وتميز الاندماج داخل بصيلات الشم (OB). المجالات الثلاثة بمثابة منصات مثالية لدراسة الآليات الخلوية والجزيئية والفيزيولوجية التي تنظم كل من الأحداث البيولوجية واضح. هذه الورقة تصف شريحة مقايسة عضوي النمط الأمثل لأنسجة المخ بعد الولادة ، والتي تحاكي ظروف خارج الخلية عن كثب في البيئة الحية لترحيل neuroblasts. نظهر أن لدينا تجربة يوفر للحركة الموحدة ، المنحى ، والإسراع في neuroblasts RMS. وهذا الاختبار تكون مناسبة للغاية لدراسة تنظيم خلية مستقلة وغير مستقلة للهجرة من خلال استخدام الخلايا العصبية عبر زرع النهج من الفئران لخلفيات وراثية مختلفة.
Protocol
أولا الإجراءات
يجب أن يتم تنفيذ الأساليب التالية تحت ظروف معقمة ، في التدفق الصفحي هود ، وذلك باستخدام أدوات معقمة.
إعداد أطباق أسفل الزجاج لشرائح عضوي النمط
- يجب أن يكون مستعدا الصحون في بيئة معقمة واستخدام أدوات معقمة.
- يتم وضع قطرة من 150μL شريحة المتوسطة (انظر صفات) في وسط الجزء السفلي من الزجاج طبق مع الحرص على تجنب فقاعات الهواء في المتوسط.
- مع حقنة واحدة مجهزة 23 إبرة المقياس ، بقع متعددة من الغراء (مطاط أسمنت -- إلمر ، والقط # E904) يتم وضعها على هامش الساحة المجاورة لساترة التعميم الذي يحتل مركز الطبق الثقافة ، في حين ترك جانب واحد unglued لتبادل السائل (الشكل 1). نوع من الغراء المذكورة ليست سامة للخلايا ، أو شرائح حسب ما هو مطبق في هذا البروتوكول. ويجب إيلاء عناية لتجنب وضع أي الغراء على زجاج زلة تغطية لأن هذا يمس وعرقلة التصوير من الشرائح في وقت لاحق. وضعت على رأس ساترة الزجاج ، وذلك باستخدام بقع الغراء لضمان الحصول عليها في مكان -- غشاء nucleopore (Whatman ، القط # 110614 قطرها 25mm ، حجم المسام 8.0μm). وينبغي أن يتم ذلك باستخدام ملقط الجزئي ، مع ضمان عدم فقاعات الهواء المحاصرين بين الزجاج وساترة غشاء.
- إضافة 1 مل من شريحة متوسطة على رأس الغشاء. توضع الأطباق في الحاضنة لمدة 30 دقيقة ثم على الجليد ، حتى جاهزة للاستخدام.
استخراج العقول في وقت مبكر بعد الولادة
ويتم الحصول على أفضل النتائج عند إعداد شرائح من الشباب الفئران بعد الولادة (P1 - P10).
- الجراء هي تخدير عضال (جرعة زائدة) من قبل isofluorane أو غيرها من أساليب المعتمدة. ويمكن رش مع رئيس الإيثانول 70 ٪ لزيادة العقم ، تليها قطع الرأس السريع باستخدام مقص حاد.
- واستقرت في رأسه لقط الفك السفلي مع ملقط الجزئي. ويستأصل الجلد طوليا من الرقبة إلى الخطم. يتم قطع الجمجمة الأمامية طوليا وابتداء من الساعة ماجنا صهريج ، وذلك بجعل 1 و 2 الإنسي الوحشي التخفيضات (واحد على كل جانب -- 2A الشكل). وينبغي الحرص على تقليل الاتصال مع الأنسجة القشرية الكامنة كما هي إزالة اللوحات الجمجمة بعيدا عن الدماغ.
- لتحسين الاستقرار في الأنسجة أثناء sectioning vibratome ، تتم إزالة جوانب معظم الاطراف من الدماغ عن طريق اثنين من التخفيضات السهمي. هو أيضا إزالة الجانب الذيلية من الدماغ عن طريق إجراء خفض في قاعدة منقاري من المخيخ (2B الشكل).
- يتم فصل نصفي الكرة الأرضية عن طريق خفض سلس على طول الشق خط الوسط ، ويتم بعناية نصفي حصد من الجمجمة وضعت ، سطح الإنسي لأسفل ، وذلك في قالب التضمين (الشكلان 2C - D).
Sectioning من الدماغ المضيفة
- وتغطي على الفور نصفي الكرة الأرضية في قالب دمج مع ذاب 3 ٪ نقطة انصهار منخفضة agarose هلام الحمض النووي من الدرجة (فيشر ، القط # BP1360 - 100) الذائب في إعداد الأنسجة العازلة التي تم الاحتفاظ ب 37 درجة مئوية (انظر صفات). بعد 2 دقيقة من الاستقرار على سطح أفقي مسطح لضمان تصلب حتى من agarose ، يتم وضع قوالب على الجليد لاستكمال الإعداد.
- حالما يتم تعيين هلام يحتوي على نصفي الكرة الأرضية ، يتم إزالته من العفن وقلصت ، وترك 2 - 3mm من هلام في جميع أنحاء أنسجة المخ.
- ثم يتم تحميل الجل جزءا لا يتجزأ من النسيج على القرص عينة من vibratome ، مع السطح الإنسي فوق ، والمضمون بمادة لاصقة cyanoacrylate (Krazy الغراء أو ما يعادلها). ويجب الحرص على تطبيق الحد الأدنى من المبالغ فقط من الغراء ، وكذلك الكثير من آثار سامة على الخلايا شرائح والمهاجرة. والكثير من الغراء على جانبي كتلة تعوق أيضا القطع ، مما تسبب في أضرار محتملة في الأنسجة.
- يتم تثبيت القرص في علبة مليئة vibratome عينة الجليد الباردة الأنسجة المتوسطة التحضير.
- الأنسجة غير مقطوع في سمك 150μm ، مع سرعة تعيين vibratome على طائفة بطيئة إلى متوسطة (سيعتمد على vibratome المستخدمة ، وبالتالي يجب أن تحدد بشكل مستقل من أجل تحقيق النتائج المثلى). في أيدينا ، وتواتر الاهتزاز هو الأمثل عندما وضعت في أقصى حد. قد يكون تجاهل شرائح القليلة الأولى.
- حالما RMS المحتوية على شرائح يتم الإفراج عن شفرة (RMS ومرئيا بالعين المجردة كما هيكل على شكل حرف U رمادية تمتد من المنطقة الاقتصادية الخاصة للOB) ، هي مثار بعناية للخروج من العفن هلام ، وحصد مسطح الرأس باستخدام ملعقة صغيرة. توضع شرائح على الغشاء nucleopore من الأطباق الزجاجية التي تحتوي على القاع شريحة المتوسطة (الشكل 3A - B). ونموذجي في وقت مبكر بعد الولادة مخ الفأر العائد حوالي 2-3 في نصف الكرة أقسام RMS عندما قطع في 150 ميكرون. فمن الأهمية بمكان أن يتم التعامل مع شرائح أبقت على الحد الأدنى لأنها هشة للغاية. ثم يتم نقل الأطباق مع شرائح للحاضنة.
المانحة الدماغsectioning وزرع RMS
- أدمغة المانحة (العقول معربا عن صحفيين في فلوري neuroblasts المهاجرة) هي في سمك مقطوع 250μm ويتم جمع الشرائح في الثلج الباردة الأنسجة العازلة التحضير.
- توضع شرائح فورا تحت المجهر مع القدرة على تشريح epifluorescence ، وmicrodissected بلطف RMS ، وذلك باستخدام ملقط الجزئي. يستخدم الملقط واحد لتحقيق الاستقرار في شريحة بينما يستخدم الآخر لإجراء تخفيضات صغيرة حول RMS حتى يتم تحريرها من شريحة. يتم قطع ثم رفعه إلى RMS explants الصغيرة (حوالي 200-500 ميكرون في القطر) قبل الزرع.
- تتم إزالة الجزء السفلي من الزجاج الأطباق التي تحتوي على شرائح المضيف المتمركزة على المرشحات nucleopore من الحاضنة ووضعها تحت مجهر تشريح. استخدام الضوء المرئي ، وحددت بوضوح RMS ويتم إجراء شق صغير في الجزء الأول من RMS.
- باستخدام pipettor مجهزة غيض 20 ميكرولتر ، يتم نقل احد المانحة RMS يزدرع إلى موقع قطعي في RMS المضيف. يتم الضغط برفق يزدرع في شق لاقامة اتصال بين الأنسجة 2. هذا الاتصال لضمان مستقرة ، يتم دفع explants قليلا في شريحة وبين الغشاء nucleopore.
- حالما يتم زرع جميع شرائح المضيف مع RMS ، يتم إرجاع الأطباق إلى حاضنة لمدة لا تقل عن 1 ساعة للسماح المقاطع لتستقر على الغشاء. وينبغي أن تبدأ Neuroblasts الهجرة من يزدرع في استضافة RMS بعد حوالي 1-2 ساعات.
الوقت الفاصل بين التصوير الهجرة العصبية
- يتم نقل أطباق الزجاج السفلي من الحاضنة إلى غرفة المحتضنة على المجهر (الشكل 3C). ولا يمكن تصوير neuroblasts الفلورسنت على فترات تتراوح من 0 إلى 10 دقيقة تبعا لنوع التحليل المطلوب. على سبيل المثال فإننا صورة ديناميكية هيكل الخلية خلال دورة المهاجرة neuroblasts الفردية عن طريق الإعداد لدينا في فترات أقل من أو يساوي 2.5 دقيقة. ومع ذلك ، يتم التقاط أفضل ديناميات السكان مثل الاتجاه والسرعة للهجرة على فترات تتراوح بين 5 إلى 10 دقائق. اختيار الأهداف متغير بدرجة كبيرة تبعا لنوع من المجهر. عن المجهر C1 نيكون مبائر ، نجد أن عدسة 20X الجافة (نيكون عموم فلور ، NA 0.75 ، 0.35mm WD) هو الأكثر ملاءمة لتحليلاتنا. للحصول على أفضل النتائج في هذا النظام مبائر ، يتم فتح ثقب صغير إلى متوسطة الحجم (60μm القطر). للسلوك المهاجرة الأنسب ، ويقتصر التصوير على الخلايا العميقة داخل سمك RMS ، لا يقل عن 20 ميكرون بعيدا من أي من الأسطح قطع من شريحة. وينبغي أن يكون الأمثل ليزر الطاقة بحيث يكون على الأقل ، إلا أن تفاصيل neuroblasts الفردية تبقى مرئية.
- ويمكن بمجرد الانتهاء من التصوير تكون ثابتة مع شرائح الجليد الباردة ، وأعدت حديثا بارافورمالدهيد 4 ٪ ، immunostained ، والتي شنت على شرائح أخرى للتصوير. لأننا لا معطف الأغشية لدينا مع أي ركائز ملتصقة مثل laminin ، وتعويم شرائح عادة بعيدا عن الغشاء مرة واحدة أنها مغمورة في مخازن تلطيخ. يتم تصوير الأجزاء مع الحفاظ على سمك ميكرومتر 150. فمن الممكن أيضا أن cryopreserve وتجميد شرائح واستخدام ناظم البرد الحصول على أرق أجزاء من شرائح الأصلي. ومع ذلك ، فإن هذا يؤدي إلى زيادة معدلات وقوع القطع في التلوين وكذلك تغيير وسلامة الأنسجة.
II. المواد / المعدات
إعداد أطباق أسفل الزجاج لشرائح عضوي النمط
- المحاقن الصغيرة (1 مل)
- 23 عيار الإبر
- Nucleopore المسار - إحفر الغشائية -- 25mm القطر ، 8.0μm حجم المسام -- Whatman ، القط # 110614
- أطباق زجاجية الثقافة أسفل -- 35mm طبق بتري ، 14mm Microwell ، ساترة رقم 1.5 -- MatTech ، القط # P35G - 1.5 - 14 - C
- المطاط أسمنت -- إلمر ، والقط # E904
- القاعدية النسر متوسط -- Gibco ، القط # 21010
- 1M Hepes (pH7.4)
- 1M D - غلوكوز
- 100mM CaCl 2
- 100mM MgSO 4
- 1M NaHCO 3
- DH 2 O
- L - 200MM الجلوتامين
- البنسلين الستربتوميسين
استخراج الدماغ وتضمينها
- مخدر (isofluorane ، الخ.)
- المايكرويف
- منخفض الانصهار Agarose -- فيشر ، القط # BP1360 - 100
- Krazy الغراء -- القط # KG585
- قشر - A - طريق تضمينها قوالب احدة (R - 40) -- مستطيلة 22mmx40mm ، 20mm عميق -- Polysciences ، القط # 18646C
sectioning الدماغ وزرع RMS
- Vibratome -- VT1000S ايكا وجميع مكونات التبعي لإعداد شريحة
- هانك 10X محلول الملح المتوازن -- Gibco ، القط # 14185
- Microdissecting ملقط # 5 -- Roboz ، القط # RS - 4976
- Microspatula -- فيشر ، القط # 21-401-15
- Stereomicroscope
الوقت الفاصل بين التصوير منشرائح عضوي النمط
- ترطيب حاضنة ، 5 ٪ CO 2
- مجهر مقلوب غرفة مجهزة الحاضنة وأهداف العمل لمسافات طويلة (NA قدره 0.6 أو أعلى)
III. وصفات
حل العازلة للتشريح الانسجة وإعداد شريحة (الأنسجة العازلة الإعداد)
| الأسهم الحل | حجم | Concetration النهائي |
| 10X HBSS | 50 مل | 1X |
| 1M Hepes (الرقم الهيدروجيني 7.4) | 1.25 مل | 2.5mM |
| 1M D - غلوكوز | 15 مل | 30mM |
| 1M CaCl 2 | 0.5 مل | 1MM |
| 1M MgSO 4 | 0.5 مل | 1MM |
| 1M NaHCO 3 | 2 مل | 4mM |
| DH 2 O | 430.75 مل |
تعقيم فلتر مع فلتر 0.2 ميكرومتر وتخزينها في 4 درجات مئوية.
مستنبت لشرائح عضوي النمط ، وزرع الأنسجة والتصوير (وسط شريحة)
| الأسهم الحل | حجم | التركيز النهائي |
| القاعدية متوسطة النسر | 35 مل | |
| إعداد الأنسجة العازلة | 12.9 مل | |
| 1M D - غلوكوز | 1.35 مل | 20mM |
| L - 200MM الجلوتامين | 0.25 مل | 1MM |
| البنسلين الستربتوميسين | 0.5 مل | 100units / مل البنسلين والستربتوميسين 0.1mg / مل |
تعقيم فلتر مع فلتر 0.2 ميكرومتر وتخزينها في 4 درجات مئوية.
إعداد منخفض ذوبان agarose هلام نقطة
غير المخفف منخفضة ذوبان نقطة agarose في إعداد الأنسجة العازلة في 0.3g / مل في أنبوب مخروطي 50 مل (انظر صفات). هو المايكرويف الأنبوب بزيادات ثانية 50-10 في الطاقة العالية. عدد من العلاوات تعتمد على الحجم الكلي ؛ لمدة 10 مل ، وثلاث زيادات (10-8-5 ثانية ، لكل منهما) وينبغي أن يكون كافيا. هو بعناية غطاء أنبوب التدفئة مفكوك بين العلاوات للافراج عن الضغط الجوي وتجنب انفجار أنبوب. ويجب اتخاذ الحذر ومحتوى أنبوب ستكون ساخنة جدا. بمجرد أن يتم حله بشكل كامل agarose ، هو الحفاظ على أنبوب في حمام الماء ° 37 مئوية لمدة 5 دقائق على الأقل للسماح للحرارة لتحقيق الاستقرار قبل الاستخدام. التعرض لفترة طويلة إلى درجة حرارة الغرفة سوف تتصلب الجل. على الرغم من هذا يجب تجنبه قدر الإمكان ، ويمكن إعادة تسخينها هلام صلابة وإعادة ذاب ، للاستخدام الفوري في غضون 24 ساعة من التحضير الأولي.
المناعية على شرائح عضوي النمط
بعد التصوير على المجهر مبائر ، قد تكون ثابتة شرائح يلة وضحاها في 4 درجة مئوية مع الفورمالدهايد 4 ٪ في برنامج تلفزيوني. ثم يتم حظر المقاطع بين عشية وضحاها في 4 درجة مئوية ، في مصل الماعز 10 ٪ مع تريتون X 1 ٪ (سيغما ، القط. # S26 - 36 - 23) في برنامج تلفزيوني تليها الحضانة بين عشية وضحاها مع الأجسام المضادة الأولية في 4 درجة مئوية. وتستخدم الأجسام المضادة الموسومة الماعز Fluorescently الثانوية للمرئيات (جميع 1:1000 المخفف ، 1 ساعة حضانة في درجة حرارة الغرفة). يتم غسلها جيدا شرائح المسمى 5-6 مرات مع الثلج الباردة PBS قبل تصاعد على الشرائح الزجاجية وcoverslipping.
رابعا. ممثل النتائج
وقد ثقافتنا شريحة عضوي النمط بروتوكول اختباره وتحسينه خلال السنوات القليلة الماضية أن تحقيق الاتساق في نمط الهجرة والتوجه. تحليل خلايا الهجرة من explants تم الحصول عليها من الفئران التي يسببها التعبير عن بروتين فلوري الأحمر ، TD - الطماطم ، تحت المروج Nestin (Nestin الدفتيريا الطماطم) ، ويكشف الهجرة الموجهة للغاية وسريعة neuroblasts + tdTomato في RMS المضيف ( الشكل 4A). عالية التكبير الوقت الفاصل بين التحليل يوضح القرار الممتاز لطول لneuroblast المهاجرة خلال جلسة التصوير لمدة 20 دقيقة (الشكل 4B).
مع الجهات المانحة شرائح طماطم + TD - تم إصلاح الخلايا وimmunostained عن المكونات الخلوية المختلفة داخل RMS. تم الكشف عن GFAP النجمية و+ CD31 + باستخدام الأوعية الدموية المناعية الفلورية (الشكل 5A). عالية التكبير تحليل شرائح الملون لهيكل الخلية والبروتينات أكتين تويولين تكشف عن التعبير غير موحدة من هذه المكونات من خلال خلية في خضم الهجرة (الشكل 5B).
الأجسام المضادة المستخدمة فيهذه الأمثلة : أرنب المضادة للRFP (Abcam ، 1:250) ، الأرنب مكافحة GFAP (داكو ، 1:1000) ، لمكافحة الفئران CD31 دينار بحريني (Pharmigen ، 1:100) ، والماوس المضادة للأكتين (سانتا كروز (1) : 500) ، الأرنب مكافحة تويولين (سيغما ، 1:1000) ، الماعز المضادة للماوس Cy3 (Chemicon ، 1:1000) ، الماعز المضادة للأرنب AlexaFluor 647 (Invitrogen ، 1:1000) والماعز لمكافحة الفئران AlexaFluor 488 (Invitrogen ، 1:1000) ، الماعز المضادة للأرنب AlexaFluor 488 (Invitrogen ، 1:1000).
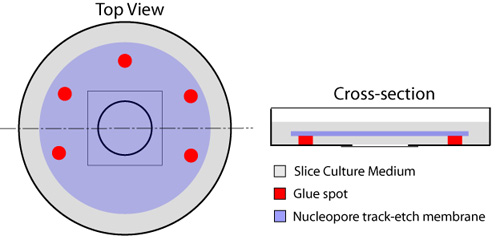
الشكل 1. إعداد أطباق الزجاج السفلي للشرائح عضوي النمط. توضع بقع متعددة من الغراء حول المكون من الزجاج السفلي من صحن دائري (أحمر) ، وترك جانب واحد مفتوح لتبادل المتوسط من تحت التصفية. يتم وضع قطرة 150μL من شريحة متوسطة في وسط ساترة الزجاج. ثم يتم تطبيق غشاء nucleopore (الأزرق) ، الجانب اللامع إلى الأسفل ، مع ضمان عدم فقاعات الهواء المحاصرين بين الزجاج وساترة غشاء. ينتشر واحد ملليلتر من شريحة متوسطة (الرمادي) على رأس الغشاء ، وحضنت الأطباق عند 37 درجة مئوية قبل الاستخدام.
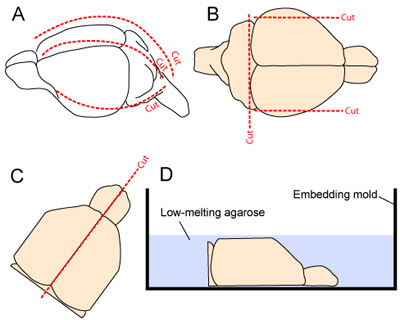
الشكل 2. استخراج الدماغ والتحضير لsectioning. (أ) تتعرض الجمجمة عن طريق عمل قطع في فروة الرأس من العنق إلى الخطم (الخط المتقطع على طول خط الوسط). ثم يتم قطع الجمجمة الأمامية طوليا وابتداء من الساعة ماجنا صهريج ، وذلك بجعل 1 و 2 الإنسي الوحشي التخفيضات (واحد على كل جانب ؛ 2A) ، (ب) والجوانب الاطراف معظم القشرة والجانب الذيلية للجهاز العصبي المركزي و مقطوعة لتحسين الاستقرار في الأنسجة أثناء sectioning vibratome (CD) ثم يتم فصل نصفي الكرة الأرضية وضعت أسفل الوجه الإنسي في قالب التضمين قبل تطبيق agarose هلام 3 ٪ الذائبة في إعداد الأنسجة العازلة.
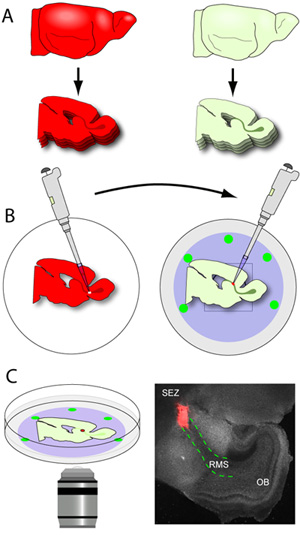
الشكل 3. sectioning الدماغ وعبر زرع. (A) والأنسجة المضيف هو مقطوع في سمك 150μm ، ويتم وضعه بعناية في المقاطع التي تحتوي على شقة RMS على الغشاء nucleopore من الأطباق الزجاجية القاع الباردة. (B) للمتبرعين العقول (العقول معربا عن صحفيين الفلورسنت في RMS) هي في مقطوع وتجمع سمك 250μm ، وشرائح من الجليد الباردة في الأنسجة العازلة التحضير. غير أن microdissected RMS المانحة ويقتطع explants الصغيرة. باستخدام pipettor مجهزة غيض 20 ميكرولتر ، يتم نقل الفردية explants RMS إلى موقع قطعي في RMS المضيف (C) بعد 1-2 ساعات من الحضانة ، يتم نقلها إلى مرحلة الأطباق المحتضنة على مبائر المجهر ويتم التقاط الهجرة استخدام الوقت الفاصل بين التصوير. صورة مجهرية لهو ممثل المنخفضة التكبير صورة شريحة نموذجية (الرمادي) إعداد 1 ساعة بعد الزرع (أحمر + يزدرع من tdTomato RMS على الفأرة المانحة ؛ أحمر منقط ومخطط خطوط RMS في شريحة المضيف).
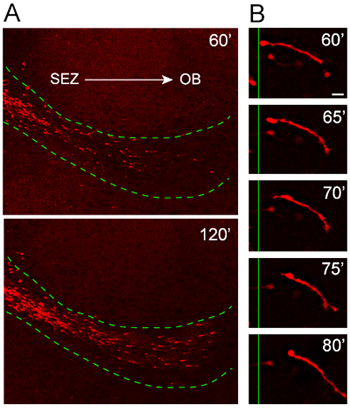
الشكل 4. هجرة neuroblasts من explants في RMS المضيف. (A) Nestin - tdTomato + neuroblasts (الحمراء) الهجرة من explants في RMS المضيف (الخط الأخضر المنقط) 1 ساعة بعد الزرع. tdTomato + الخلايا غزو RMS للمضيف شرائح عضوي النمط التحرك بطريقة موجهة نحو غاية وسريعة بعيدا عن المناطق الاقتصادية الخاصة ونحو OB (B) ويمكن ملاحظة دورة المهاجرة في لوحات مرور الزمن عالية الطاقة لneuroblast خلال ما يقرب من 20 مدة دقيقة واحدة. مقياس بار = 10 ميكرومتر.
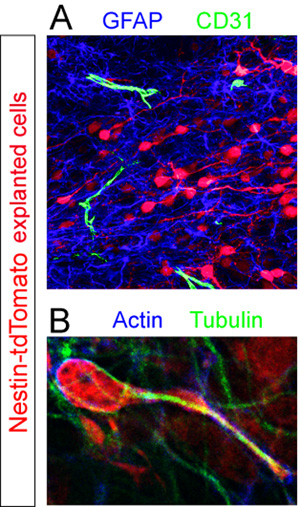
الشكل 5. تم إصلاح تقييم المناعى من شرائح عضوي النمط. neuroblasts Explanted (الحمراء) في خضم الهجرة 12 ساعة زرع آخر (أ) تلطيخ المناعى نيون للشريحة يكشف عن تجمع كثيف من الخلايا النجمية + GFAP (الأزرق) ومتناثرة CD31 + الأوعية الدموية (الخضراء) داخل RMS من شريحة المضيف (B) والهيكل الخلوي من tdTomato معزولة + هو كشف خلية المهاجرة (الحمراء) في RMS المضيف المشارك immunostaining باستخدام أجسام مضادة ضد أكتين (الأزرق) وتويولين (الخضراء).
Discussion
الهجرة العصبية في RMS هو عنصر أساسي من تكوين الخلايا العصبية بعد الولادة في بصيلات الشم 1. الهجرة من خلال RMS يحدث في الطائرة عرضية على سطح الدماغ. neuroblasts المهاجرة عرضية مميزة من الخلايا المهاجرة شعاعيا استنادا إلى موقع المصدر السلف الخاصة بهم ، فضلا عن مصير متباين?...
Disclosures
Acknowledgements
نشكر لرواية دان McWhorter البروتوكول في الفيديو. ويؤيد هذا العمل من قبل المعاهد الوطنية للصحة 5R01NS062182 غرانت ، وهي منحة مقدمة من الاتحاد الأمريكي لبحوث الشيخوخة ، والصناديق المؤسسية التي منحت لHTG.
References
- Ghashghaei, H. T., Lai, C., Anton, E. S. Neuronal migration in the adult brain: are we there yet. Nat. Rev. Neurosci. 8, 141-151 (2007).
- Valiente, M., Marin, O. Neuronal migration mechanisms in development and disease. Curr. Opin. Neurobiol. 20, 68-78 (2010).
- Rakic, P. Evolution of the neocortex: a perspective from developmental biology. Nat. Rev. Neurosci. 10, 724-735 (2009).
- Jaglin, X. H., Chelly, J. Tubulin-related cortical dysgeneses: microtubule dysfunction underlying neuronal migration defects. Trends Genet. 25, 555-566 (2009).
- Carro, M. S. The transcriptional network for mesenchymal transformation of brain tumours. Nature. 463, 318-325 (2010).
- Wu, W. Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature. 400, 331-336 (1999).
- Hu, H., Tomasiewicz, H., Magnuson, T., Rutishauser, U., U, . The role of polysialic acid in migration of olfactory bulb interneuron precursors in the subventricular zone. Neuron. 16, 735-743 (1996).
- Shapiro, E. M., Gonzalez-Perez, O., Garcia-Verdugo, M. a. n. u. e. l., Alvarez-Buylla, J., &, A., Koretsky, A. P. Magnetic resonance imaging of the migration of neuronal precursors generated in the adult rodent brain. Neuroimage. , (2006).
- Vreys, R. MRI visualization of endogenous neural progenitor cell migration along the RMS in the adult mouse brain: validation of various MPIO labeling strategies. Neuroimage. 49, 2094-2103 (2010).
- Davenne, M., Custody, C., Charneau, P., Lledo, P. M. In vivo imaging of migrating neurons in the mammalian forebrain. Chem. Senses. 30, 115-116 (2005).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal. J. Vis. Exp. , (2010).
- Shen, Q. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3, 289-300 (2008).
- Tavazoie, M. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3, 279-288 (2008).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural Stem Cells Confer Unique Pinwheel Architecture to the Ventricular Surface in Neurogenic Regions of the Adult Brain. Cell Stem Cell. 3, 265-278 (2008).
- Polleux, F. &. a. m. p. ;. a. m. p., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. , L9-L9 (2002).
- Murase, S. &. a. m. p. ;. a. m. p., Horwitz, A. F. Deleted in colorectal carcinoma and differentially expressed integrins mediate the directional migration of neural precursors in the rostral migratory stream. J. Neurosci. 22, 3568-3579 (2002).
- Suzuki, S. O. &. a. m. p. ;. a. m. p., Goldman, J. E. Multiple cell populations in the early postnatal subventricular zone take distinct migratory pathways: a dynamic study of glial and neuronal progenitor migration. J. Neurosci. 23, 4240-4250 (2003).
- Ghashghaei, H. T. The role of neuregulin-ErbB4 interactions on the proliferation and organization of cells in the subventricular zone. Proc. Natl. Acad. Sci. U. S. A. 103, 1930-1935 (2006).
- Khodosevich, K., Seeburg, P. H., Monyer, H. Major signaling pathways in migrating neuroblasts. Front Mol. Neurosci. 2, 7-7 (2009).
- Jacquet, B. V. Analysis of neuronal proliferation, migration and differentiation in the postnatal brain using equine infectious anemia virus-based lentiviral vectors. Gene Ther. 16, 1021-1033 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved