JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
출생 후의 두뇌에의 연결을 마이 그 레이션의 고해상도 시간 경과 이미징을위한 Organotypic 슬라이스 분석
요약
이 프로토콜은 주동이의 철새 스트림에서 출생 후의 두뇌와 neuroblast 마이 그 레이션의 고해상도 시간 저속 영상에 최적화된 organotypic 슬라이스 분석을 설명합니다.
초록
전구 세포, neuroblasts의 마이 그 레이션뿐만 아니라, 기존의 신경 회로에 분화하고 새로운 뉴런의 통합의 확산 : 출생 후의 두뇌에 Neurogenesis 세 생물 학적 사건의 유지에 따라 달라집니다. 후각 구근의 출생 후의 neurogenesis 들어,이 이벤트의 세 가지 해부학적인 몸의 구조 별개의 도메인 내에서 차별과 같습니다 확산은 크게 neuroblasts이 주동이의 철새 스트림 (RMS)를 통해 통과 마이 그 레이션, 측면 심실의 subependymal 구역 (SEZ)에 발생, 새로운 뉴런이 차별과 후각 구근 (OB) 내에 통합할 수 있습니다. 세 도메인은 독특한 생물 학적 사건의 각 조절, 세포 분자 및 생리 메커니즘을 연구하기 위해 이상적인 플랫폼 역할을합니다. 본 논문은 세포 조건이 밀접하게 neuroblasts 마이 그 레이션에 대한 생체내 환경에서을 모방하는 출생 후의 뇌 조직에 최적화된 organotypic 슬라이스 분석을 설명합니다. 우리는 우리의 분석은 RMS 이내 neuroblasts의 균일한 지향하고, 빠른 움직임을 위해 제공하는 것으로 나타났습니다. 이 분석은 다른 유전 배경에 생쥐에서 간 이식의 방법을 활용하여의 연결을 마이 그 레이션의 세포 자치가 아닌 자율 규제의 연구에 대해 매우 적합합니다.
프로토콜
I. 절차
다음 기술은 소독 도구를 사용하여 층류 후드에서 무균 조건 하에서 수행되어야합니다.
organotypic 조각 유리 바닥 요리 준비
- 요리는 무균 환경에서 준비 및 소독 도구를 사용해야합니다.
- 슬라이스 매체의 150μL 방울 (레시피 참조) 매체 공기 방울을 피하기 위해주의와 접시의 유리 바닥 부분의 중앙에 배치됩니다.
- unglued 한쪽을 떠나면서, 문화 요리의 중심을 차지하고 원형 coverslip에 인접한 사각형 가장자리에 배치 -이 23 게이지 바늘, 접착제의 여러 명소 (엘머의, 고양이 # E904 고무 시멘트)가 장착된 일회용 주사기 유체 교환 (그림 1). 접착제의 나열 형식은이 프로토콜에 적용 조각이나 세포에 독성되지 않습니다. 관리는이시 침해 나중에 조각의 이미지를 방해하므로 유리 커버 슬립에 대한 접착제를 배치하지 않도록 부여해야합니다. nucleopore 막가 (직경 25mm, 구멍 크기는 8.0μm - 왓먼, 고양이 # 110614) 대신에 그것을 확보하기 위해 접착제 명소를 사용하여 유리 coverslip 위에 위치합니다. 기포가 유리 coverslip와 멤브레인 사이에서 고민하지 않는 확보하면서 이것은, 마이크로 집게를 사용하여 완료해야합니다.
- 막 위에 한 ML 슬라이스 매체를 추가합니다. 요리는 사용할 때까지 30 분 후 얼음에 인큐베이터에 배치됩니다.
초기 출생 후의 두뇌의 추출
조각이 젊은 출생 후의 생쥐 (P1 - P10)에서 준비 때 가장 좋은 결과를 얻을 수있다.
- 펍스은 isofluorane 또는 기타 승인된 방법에 의해 (과용) 말기 anesthetized 있습니다. 머리는 날카로운 가위를 사용하여 빠른 잘린 다음, 불임을 높이기 위해 70 %의 에탄올로 뿌렸 수 있습니다.
- 머리는 마이크로 집게로 mandible를 클램핑하여 안정화됩니다. 피부는 목에 주둥이에 길이 방향 excised 수 있습니다. 두개골은 1 중간 2 측면 상처 (- 그림 2A 양쪽에 하나씩)함으로써, cisterna 마그나에서 시작하고 길이 방향 anteriorly 절단됩니다. 두개골 펄럭이 두뇌에서 멀리 제거와 같은 관리는 기본 대뇌 피질의 조직과의 접촉을 최소화하기 위해 이동해야합니다.
- vibratome의 sectioning 동안 조직의 안정성을 개선하기 위해, 뇌의 측면 - 대부분의 측면은 두 개의 화살을 삭감함으로써 제거됩니다. 두뇌의 꼬리 부분은 또한 소뇌의 주동이의 자료 (그림 2B)에 상처를 만들어 제거됩니다.
- 두 반구는 정중선 균열 (fissure)을 따라 부드럽게 상처를 만들기로 구분되며, 두 개의 반구는 조심스럽게 두개골 밖으로 훔쳐과 (Figs. 2C - D) 포함 금형에, 아래, 중간 표면에 배치됩니다.
호스트 뇌 Sectioning
- 포함 금형의 두 반구는 즉시 녹아 3% 낮은 용융 점의 DNA 수준의 아가로 오스 겔 (피셔, 고양이 # BP1360 - 100) 37 ° C (요리법 참조)에서 관리하고 있습니다 조직 준비 버퍼에 용해 덮여있다. 아가로 오스의 경화도를 보장하기 위해 평평한 수평 표면에 안정화 2 분 후에 금형은 설정을 완료하기 위해 얼음에 위치하고 있습니다.
- 반구를 포함하는 겔이 설정되면, 그것은 금형에서 제거되고 뇌 조직 주위에 젤의 2-3mm 떠나 손질.
- 젤 - 임베디드 조직은 다음에 중간 표면, vibratome의 표본 디스크에 탑재하고, cyanoacrylate 접착제 (Krazy 접착제 또는 동급)과 보안입니다. 케어는 접착제만을 최소한의 금액을 적용하기 위해 이동해야하며, 같은 너무 많은 조각과 마이 그 레이션하는 세포에 독성 영향을 미칠 것입니다. 블록의 측면에 너무 많은 접착제는 또한 조직에 잠재적인 손상을 초래, 절단을 방해합니다.
- 디스크가 얼음처럼 차가운 조직 준비 매체 가득 vibratome 표본 트레이에 설치됩니다.
- 조직 (사용 vibratome에 따라 달라집니다, 때문에 독립적으로 최적의 결과를 결정합니다) 느린 - 투 - 중간 범위에 설정된 vibratome 스피드와 150μm 두께 sectioned입니다. 최대 설정할 때 우리 손에서, 진동 주파수가 최적입니다. 처음 몇 조각을 폐기 수 있습니다.
- 마자 RMS는 함유 자른 것은 날개 (RMS는 SEZ에서 OB로 연장 회색 U 모양의 구조로 육안으로 볼 수 있습니다)에서 발표되며, 그들은 조심스럽게 겔 주형 밖으로 조롱하고, 훔쳐 아르 작은 플렛 헤드 주걱을 사용합니다. 조각은 슬라이스 매체 (그림 3A - B)이있는 유리 바닥 요리의 nucleopore 멤브레인에 표시됩니다. 150 μm의에서자를 때 전형적인 초기 출생 후의 마우스 뇌의 반구 당 약 2-3 RMS 섹션을 얻을 것입니다. 그들이 매우되기로 조각 처리하는 것은 최소한으로 유지됩니다 것이 중요합니다. 슬라이스와 함께 요리는 다음 인큐베이터로 전송됩니다.
공여 뇌sectioning 및 RMS 이식
- 기증자의 뇌는 (neuroblasts 마이 그 레이션에 형광 기자를 표현 두뇌) 250μm 두께 sectioned하고 조각은 얼음처럼 차가운 조직 준비 버퍼에 수집하고 있습니다.
- 조각은 즉시 epifluorescence 기능과 해부 현미경으로 배치하고 있으며, RMS는 부드럽게 마이크로 집게를 사용하여 microdissected입니다. 하나 포셉는 다른 그것은 슬라이스에서 해방 때까지 RMS 주위에 작은 상처를 만들기 위해 사용되는 동안 슬라이스를 안정화하는 데 사용됩니다. excised RMS는 다음 이식하기 전에 작은 explants (직경 약 200-500 μm의)로 절단됩니다.
- nucleopore 필터에 위치 호스트 조각을 포함하는 유리 바닥 요리는 인큐베이터에서 제거하고 해부 현미경으로 배치됩니다. 가시 광선을 사용하여 RMS 명확하게 식별하고 작은 절개는 RMS의 초기 세그먼트에서 이루어집니다.
- 20 μL 팁이 장착된 pipettor을 사용하여, 하나의 기증자 RMS explant는 호스트 RMS에 베인 사이트에 전송됩니다. explant은 부드럽게 2 조직 사이의 접촉을 확립하기 위해 절개로 밀려있다. 이 연락처가 안정되도록하려면, explants은 슬라이스와 nucleopore 막 사이에 약간 적용됩니다.
- RMS 모든 호스트 슬라이스가 이식되면, 요리는 부분이 막에 정착하는 수 있도록 최소 1 시간 동안 인큐베이터에 반환됩니다. Neuroblasts은 explant에서 호스트 약 1~2시간 후 RMS로 마이 그 레이션하기 시작한다.
의 연결을 마이 그 레이션 시간 저속 영상
- 유리 바닥 요리는 인큐베이터에서 현미경에 incubated 챔버 (그림 3C)으로 전송됩니다. 형광등 neuroblasts는 0에서 원하는 분석의 종류에 따라 10 분까지 간격으로 몇 군데하실 수 있습니다. 이하 또는 2.5 분 동등한 저희 간격을 설정하여 개별 neuroblasts의 철새주기 동안 예를 들어, 우리는 이미지 cytoskeletal 역학 있습니다. 그러나, 이러한 마이 그 레이션의 방향과 속도로 인구 역학은 더 나은 5에서 10 분 거리에 이르기까지 다양한 간격으로 캡처됩니다. 목표의 선택은 현미경의 브랜드에 따라 매우 변수입니다. 니콘 C1 공촛점 현미경을 위해, 우리는 20x 건조 렌즈 (니콘 판 플루어, NA 0.75, WD 0.35mm)의 분석에 가장 적합 것을 발견했습니다. 이 공촛점 시스템에서 최상의 결과를 얻으려면, 핀홀은 중간 크기 (직경 60μm)로 열립니다. 가장 적합한 철새 행동에, 영상은 최소한 20 μm의 떨어진 조각의 절단 표면 중 하나에서, RMS의 두께 내에서 깊은 세포에 국한됩니다. 레이저의 파워는 그것이 최소한되도록 최적화되어 있지만, 개별 neuroblasts의 세부 사항이 표시 유지되어야합니다.
- 이미징이 완료되면 조각은 얼음 감기로 고정하고, 갓 4 % paraformaldehyde를 준비 immunostained, 추가적인 영상을 위해 슬라이드에 장착할 수 있습니다. 우리가 같은 laminin과 같은 자기편 기판과 코팅의 세포막을하지 않기 때문에 그들은 얼룩 버퍼에 포장되어되면, 조각은 일반적으로 멤브레인 떨어져 떠. 그들의 150 μm의 두께를 유지하면서 부분이 몇 군데 있습니다. 그것은 cryopreserve 및 동결 조각하고 원래 조각의 얇은 부분을 얻기 위해 그라 이오 스탯을 사용하는 것도 가능합니다. 그러나, 이것은뿐만 아니라 조직의 무결성을 변경으로 얼룩에 유물의 발생률을 증가 발생합니다.
II. 재료 / 장비
organotypic 조각 유리 바닥 요리 준비
- 작은 주사기 (1 ML)
- 23 게이지 바늘
- Nucleopore 트랙 엣지 분리막 - 직경 25mm, 구멍 크기 8.0μm - 왓먼, 고양이 # 110614
- 유리 바닥 문화 요리 - 35mm 페트리 접시, 14mm Microwell 번, 1.5 coverglass - MatTech, 고양이 # P35G - 1.5-14 - C
- 고무 시멘트 - 엘머의, 고양이 # E904
- 기초 중간 이글 - Gibco, 고양이 # 21010
- 1M Hepes (pH7.4)
- 1M D - 글루코오스
- 100mM CaCl 2
- 100mM MgSO 4
- 1M NaHCO 3
- DH 2 O
- L - 글루타민 200mM
- 페니실린 - 스트렙토 마이신
브레인 추출 및 삽입
- 마취 (isofluorane 등)
- 전자 레인지
- 낮은 녹는 아가로 오스 - 피셔, 고양이 # BP1360 - 100
- Krazy 아교 - 고양이 # KG585
- 필 - A - 웨이 일회용 퍼가기 금형 (R - 40) - 22mmx40mm 직사각형, 20mm 깊이 - Polysciences, 고양이 # 18646C
뇌 sectioning 및 RMS 이식
- Vibratome - Leica VT1000S 및 슬라이스 준비의 모든 액세서리 부품
- 10X 행크의 밸런스드 소금 솔루션 - Gibco, 고양이 # 14185
- Microdissecting 포셉 # 5 - Roboz, 고양이 # RS - 4976
- Microspatula - 피셔, 고양이 # 21-401-15
- Stereomicroscope
의 시간 - 저속 영상organotypic 조각
- Humidified 보육 5 % CO 2
- 거꾸로 현미경 보육 챔버 및 장거리 작업의 목표 (0.6 이상의 NA)을 갖춘
III. 요리법
조직 해부와 슬라이스 준비 (조직 준비 버퍼)에 대한 버퍼 솔루션
| 증권 솔루션 | 음량 | 최종 Concetration |
| 10X HBSS | 50 ML | 1X |
| 1M Hepes (산도 7.4) | 1.25 ML | 2.5mM |
| 1M D - 포도당 | 15 ML | 30mM |
| 1M CaCl 2 | 0.5 ML | 1mM |
| 1M MgSO 4 | 0.5 ML | 1mM |
| 1M NaHCO 3 | 2 ML | 4mm짜리 |
| DH 2 O | 430.75 ML |
4 0.2 μm의 필터 및 저장 ° C.와 소독을 필터
organotypic 슬라이스, 조직 이식 및 이미징을위한 문화 매체 (슬라이스 매체)
| 증권 솔루션 | 음량 | 최종 농도 |
| 기초 중간 이글 | 35 ML | |
| 조직 준비 버퍼 | 12.9 ML | |
| 1M D - 포도당 | 1.35 ML | 20mM |
| L - 글루타민 200mM | 0.25 ML | 1mM |
| 페니실린 - 스트렙토 마이신 | 0.5 ML | 100units / ML 페니실린과 0.1mg / ML 스트렙토 마이신 |
4 0.2 μm의 필터 및 저장 ° C.와 소독을 필터
낮은 용융 점 아가로 오스 겔의 준비
낮은 용융 점 아가로 오스는 50 ML 원뿔 관에서 0.3g / ML (요리법 참조)에서 조직 준비 버퍼에 희석합니다. 튜브는 높은 전력 50~10초 단위 microwaved있다. 단위의 숫자는 전체 볼륨에 의존되며 10 ML에 대한 세 단위는 (10-8-5 초, 각) 충분해야합니다. 관 뚜껑은 신중하게 공기 압력을 해제하고 튜브의 폭발을 방지하기 위해 가열 증가 사이 unscrewed입니다. 튜브 내용이 매우 섹시하게되므로주의가 이동해야합니다. 아가로 오스가 완전히 해소되면 튜브는 온도가 사용하기 전에 안정 수 있도록 최소한 5 분 동안 37 ° C의 물을 욕조에 유지됩니다. 실온에 장시간 노출 강화가 젤 것입니다. 이것이 가능한 한 피해야한다하지만 초기 준비 24 시간 이내에 즉시 사용, 강화된 젤은 재가열 수 있으며 다시 녹아.
organotypic 조각에 Immunohistochemistry
공촛점 현미경에서 이미지에 따라, 조각은 PBS에 4 % 포름 알데히드와 4 ° C에서 밤새 고정 수 있습니다. 섹션은 다음 1퍼센트 트리톤 X와 10 % 염소 혈청에서 4 ° C에서 밤새 차단 (시그마, 고양이. # S26 - 36 - 23) PBS에 4 ° C.에서 일차 항체와 하룻밤 인큐베이션 다음 찬란 - 태그 염소 이차 항체는 시각화 (모든 희석 1:1000, 실온에서 1 시간 배양)에 사용됩니다. 라벨 조각은 철저하게 사전에 얼음 차가운 PBS는 유리 슬라이드에 장착하고 coverslipping로 5-6 번 씻어 있습니다.
IV. 대표 결과
우리 organotypic 슬라이스 문화 프로토콜은 철저하게 테스트 및 마이 그 레이션 패턴과 방향의 일관성을 위해 지난 몇 년 동안 최적화되었습니다. 붉은 형광 단백질, TD - 토마토의 표현이 Nestin 프로 모터 (Nestin - TD 토마토)에서 유도되는 생쥐에서 얻은 explants에서 emigrating 세포의 분석 (호스트 RMS에 tdTomato + neuroblasts의 높은 지향하고 빠른 마이 그 레이션을 공개 그림 4A). 높은 배율 시간이 경과 분석은 20 분 영상 세션 (그림 4B) 동안 마이 그 레이션 neuroblast의 전체 길이의 뛰어난 해상도를 보여줍니다.
기증자와 조각 TD - 토마토 + 세포 고정과 RMS 내에서 다른 세포 구성 요소에 대한 immunostained되었습니다. GFAP + astrocytes 및 CD31 + 혈관이 형광 immunohistochemistry (그림 5A)를 사용하여 공개되었습니다. cytoskeletal 단백질의 굴지 및 tubulin에 대한 스테인드 조각의 높은 배율 분석은 마이 그 레이션 중에 (그림 5B)에 휴대하여 이러한 구성 요소의 비 균일한 표현을 공개.
에 사용되는 항체이러한 예 : 토끼 방지 RFP (Abcam, 1:250), 토끼 안티 GFAP (Dako, 1:1000), 쥐 안티 CD31 (BD Pharmigen, 1:100), 마우스 방지 굴지 (산타 크루스, 1 : 500), 토끼 안티 tubulin (시그마, 1:1000), 염소 방지 마우스 Cy3 (Chemicon, 1:1000), 염소 안티 토끼 AlexaFluor 647 (Invitrogen, 1:1000), 염소 안티 쥐 AlexaFluor 488 (Invitrogen , 1:1000), 염소 방지 토끼 AlexaFluor 488 (Invitrogen, 1:1000).
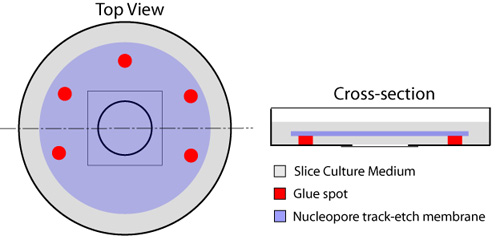
그림 1. organotypic 조각을위한 유리 바닥 요리의 준비가. 접착제의 여러 명소는 필터 아래에서 매체의 교환을위한 한쪽 열어두고, 요리의 원형 유리 바닥 구성 요소 (적색) 주위에 배치됩니다. 슬라이스 매체의 150μL 방울은 유리 coverslip의 중앙에 배치됩니다. 기포가가 유리 coverslip와 멤브레인 사이에서 고민하지 않는 확보하면서 nucleopore 막 (파란색)은 다음 반짝 쪽 아래, 적용됩니다. 슬라이스 매체 (회색) 중 하나 밀리리터가 막 위에 확산하고, 요리 °는 C 이전에 사용하는 37 incubated 수 있습니다.
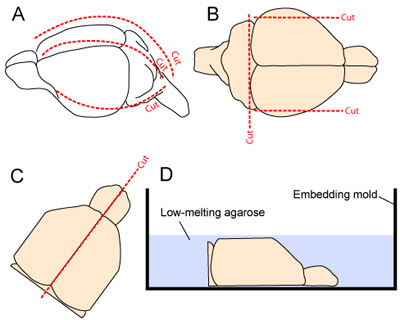
그림 2. sectioning에 대한 브레인 추출 및 준비. (A) 두개골은 목에 주둥이 (정중선을 따라 점선)로 두피를 절개하여 노출됩니다. 두개골은 다음 1 중간 2 측면 상처 (각 측면에 하나, 2A)함으로써, cisterna 마그나에서 시작 길이 방향과 anteriorly 절단됩니다. (B) 피질의 측면 - 대부분의 측면과 CNS의 꼬리 부분이 vibratome sectioning 동안 조직의 안정성을 향상시키기 위해 resected. (CD) 두 반구는 다음 구분하고 사전에 조직 준비 버퍼에 용해 3% 아가로 오스 겔의 응용 프로그램에 포함 금형의 중간 얼굴을 아래로 배치됩니다.
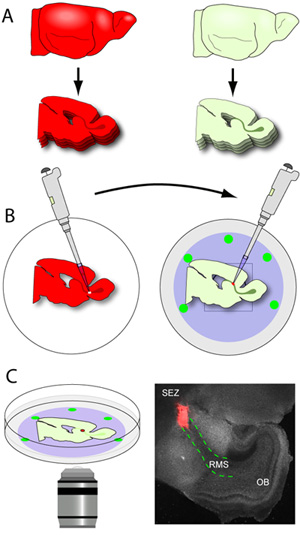
그림 3. 뇌 sectioning 상호 이식. (A) 호스트 조직 150μm 두께 sectioned이며, RMS -가 포함된 섹션은 신중하게 차가운 유리 바닥 요리의 nucleopore 막에 평면 위치가 결정됩니다. (B) 기증 두뇌 (RMS에 형광 기자를 표현 두뇌)에 sectioned 아르 250μm 두께, 그리고 조각은 얼음처럼 차가운 조직 준비 버퍼에 수집하고 있습니다. 기증자 RMS는 microdissected 작은 explants로 절단됩니다. 20 μL 팁이 장착된 pipettor를 사용하여 개별 RMS의 explants는 호스트 RMS에 베인 사이트에 전송됩니다. (C) 배양 1-2 시간 후, 요리 공촛점 현미경에 incubated 단계에 전송 및 마이 그 레이션이 캡처됩니다 시간이 경과 이미징을 사용합니다. 현미경 사진은 전형적인 슬라이스 (회색) 이식 (; 빨간색 점선 개요 호스트 슬라이스에서 RMS 기증자 마우스 tdTomato + RMS에서 빨간색 explant) 이후 1 시간 설정의 대표 낮은 배율 이미지입니다.
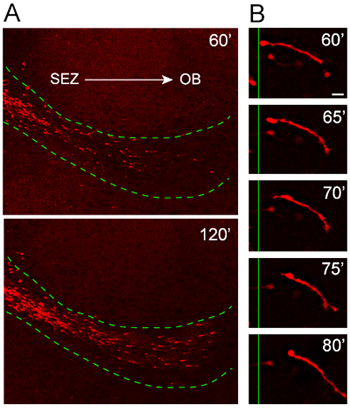
그림 4. 호스트 RMS로 explants에서 neuroblasts의 마이 그 레이션. (A) Nestin - tdTomato + neuroblasts (적색)은 호스트 RMS (점선 녹색 라인) 이식 후 1시간에 explants에서 마이 그 레이션. tdTomato + organotypic 조각이 떨어져 SEZ에서 높은 지향하고 빠른 방식과 OB쪽으로 이동 호스트의 RMS를 침해 세포. (B) 철새주기는 약 통해 neuroblast 높은 전력 시간 저속 이미지 관찰할 수 이십분 기간. 스케일 바 = 10 μm의.
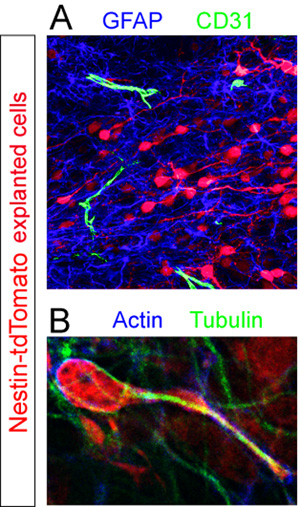
그림 5. organotypic 조각의 Immunohistochemical 평가. Explanted neuroblasts (적색)가 마이 그 레이션 속에서 해결되었습니다 12시간 게시 이식. (A) 단면의 형광 immunohistochemical 얼룩은 CD31 + 혈관 (녹색) GFAP + astrocytes의 고밀도 수영장 (파란색)를 공개하고 흩어져 호스트 슬라이스의 RMS. 내에서 (B) 절연 tdTomato의 cytoskeleton는 + 호스트 RMS에서 마이 그 레이션 세포 (적색)이 굴지 (파란색)과 tubulin (녹색)에 대한 항체를 사용하여 공동 immunostaining에 의해 드러났습니다.
토론
RMS에의 연결을 마이 그 레이션은 후각 구근 1 출생 후의 neurogenesis의 필수 구성 요소입니다. RMS를 통해 마이 그 레이션은 뇌의 표면에 접선 비행기에서 발생합니다. Tangentially 마이 그 레이션 neuroblasts은 반경들의 시조 소스의 위치뿐만 아니라 최종 제품의 연결 1, 2, 3 분기하는 운명에 따라 세포를 마이 그 레이션와는 있습니다. 출생 후의 RMS에 tangentially 마이 그 레이션하는 세포의 ?...
공개
감사의 말
우리는 비디오 프로토콜을 해설을위한 댄 맥월터 감사합니다. 이 작품은 NIH 그랜트 5R01NS062182, 노화 연구에 대한 미국 연방에서 부여하고 HTG에게 수여 기관 자금에 의해 지원됩니다.
참고문헌
- Ghashghaei, H. T., Lai, C., Anton, E. S. Neuronal migration in the adult brain: are we there yet. Nat. Rev. Neurosci. 8, 141-151 (2007).
- Valiente, M., Marin, O. Neuronal migration mechanisms in development and disease. Curr. Opin. Neurobiol. 20, 68-78 (2010).
- Rakic, P. Evolution of the neocortex: a perspective from developmental biology. Nat. Rev. Neurosci. 10, 724-735 (2009).
- Jaglin, X. H., Chelly, J. Tubulin-related cortical dysgeneses: microtubule dysfunction underlying neuronal migration defects. Trends Genet. 25, 555-566 (2009).
- Carro, M. S. The transcriptional network for mesenchymal transformation of brain tumours. Nature. 463, 318-325 (2010).
- Wu, W. Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature. 400, 331-336 (1999).
- Hu, H., Tomasiewicz, H., Magnuson, T., Rutishauser, U., U, . The role of polysialic acid in migration of olfactory bulb interneuron precursors in the subventricular zone. Neuron. 16, 735-743 (1996).
- Shapiro, E. M., Gonzalez-Perez, O., Garcia-Verdugo, M. a. n. u. e. l., Alvarez-Buylla, J., &, A., Koretsky, A. P. Magnetic resonance imaging of the migration of neuronal precursors generated in the adult rodent brain. Neuroimage. , (2006).
- Vreys, R. MRI visualization of endogenous neural progenitor cell migration along the RMS in the adult mouse brain: validation of various MPIO labeling strategies. Neuroimage. 49, 2094-2103 (2010).
- Davenne, M., Custody, C., Charneau, P., Lledo, P. M. In vivo imaging of migrating neurons in the mammalian forebrain. Chem. Senses. 30, 115-116 (2005).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal. J. Vis. Exp. , (2010).
- Shen, Q. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3, 289-300 (2008).
- Tavazoie, M. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3, 279-288 (2008).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural Stem Cells Confer Unique Pinwheel Architecture to the Ventricular Surface in Neurogenic Regions of the Adult Brain. Cell Stem Cell. 3, 265-278 (2008).
- Polleux, F. &. a. m. p. ;. a. m. p., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. , L9-L9 (2002).
- Murase, S. &. a. m. p. ;. a. m. p., Horwitz, A. F. Deleted in colorectal carcinoma and differentially expressed integrins mediate the directional migration of neural precursors in the rostral migratory stream. J. Neurosci. 22, 3568-3579 (2002).
- Suzuki, S. O. &. a. m. p. ;. a. m. p., Goldman, J. E. Multiple cell populations in the early postnatal subventricular zone take distinct migratory pathways: a dynamic study of glial and neuronal progenitor migration. J. Neurosci. 23, 4240-4250 (2003).
- Ghashghaei, H. T. The role of neuregulin-ErbB4 interactions on the proliferation and organization of cells in the subventricular zone. Proc. Natl. Acad. Sci. U. S. A. 103, 1930-1935 (2006).
- Khodosevich, K., Seeburg, P. H., Monyer, H. Major signaling pathways in migrating neuroblasts. Front Mol. Neurosci. 2, 7-7 (2009).
- Jacquet, B. V. Analysis of neuronal proliferation, migration and differentiation in the postnatal brain using equine infectious anemia virus-based lentiviral vectors. Gene Ther. 16, 1021-1033 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유