Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Органотипической Анализ фрагментов для высокого разрешения Time-Lapse Визуализация миграции нейронов в послеродовой мозга
В этой статье
Резюме
Этот протокол описывает органотипической анализа ломтик оптимизирован для послеродового мозга и высоким разрешением, замедленная съемка нейробластов миграции в ростральной миграционных потоков.
Аннотация
Нейрогенез в послеродовом мозга зависит от поддержания трех биологических мероприятий: распространение клеток-предшественников, миграцию нейробластов, а также дифференциации и интеграции новых нейронов в существующие нейронные цепи. Для послеродового нейрогенез в обонятельной луковицы, эти события были разделены в течение трех анатомически различных областях: распространение в значительной степени происходит в subependymal зоны (ОЭЗ) боковые желудочки, миграции нейробластов пройти через ростральной миграционных потоков (RMS), а также новые нейроны дифференцировать и интегрировать в обонятельные луковицы (OB). Трех областей служат идеальной платформой для изучения клеточном, молекулярном и физиологических механизмов, которые регулируют каждое из биологических событий отчетливо. Эта статья описывает органотипической анализа ломтик оптимизирован для послеродового ткани мозга, в котором внеклеточных условиях, максимально имитирующие в естественных условиях среды для миграции нейробластов. Мы показываем, что наш анализ обеспечивает равномерное, ориентированной, и быстрое движение нейробластов в RMS. Этот анализ будет весьма подходящим для исследования клеточных автономных и неавтономных регулирования миграции нейронов, используя кросс-трансплантации подходов от мышей на разных генетических фон.
протокол
I. Процедуры
Следующие методы должны выполняться в стерильных условиях, в ламинарном боксе, с использованием стерилизованных инструментов.
Подготовка блюд со стеклянным дном для органотипической ломтиками
- Блюда должны быть подготовлены в стерильных условиях и используя стерилизовать инструменты.
- 150 мкл каплю ломтик среды (см. рецепты) помещается в центр со стеклянным дном часть блюдо с осторожностью, чтобы избежать воздушных пузырей в среду.
- С одноразовый шприц оснащен 23 иглы, несколько пятен клея (резиновый клей -, кот Элмер # E904) размещены на площади полосы, прилегающей к круговой покровное, что находится в центре культуры блюдо, оставляя одну сторону слабины для обмена жидкости (рис. 1). Перечисленных типов клея не токсичен для ломтиками или клетки, которые применяются в этом протоколе. Забота должна быть предоставлена, чтобы избежать создания каких-либо клея на скольжение покровного стекла, так как это посягает и препятствовать визуализации ломтиками позже. Мембраны nucleopore (диаметр 25 мм, размер пор 8.0μm - ватмана, кошка # 110614) помещается в верхней части стекло покровное, с использованием клея, пятна, чтобы закрепить ее на месте. Это должно быть сделано с помощью микро-щипцы, обеспечивая при этом пузырьки воздуха, не находящуюся между покровным стеклом и мембраной.
- Добавьте 1 мл ломтик среды на верхней части мембраны. Посуду помещают в термостат на 30 минут, а затем на льду, пока не готово к использованию.
Добыча раннем постнатальном мозге
Лучшие результаты получаются, когда ломтики готовятся из молодых послеродовых мышей (Р1-Р10).
- Щенки неизлечимо анестезии (передозировка) по isofluorane или других одобренных методов. Голова может быть распылена на 70% этанола увеличить стерильности, с последующим быстрым обезглавливание острыми ножницами.
- Голова стабилизируется зажима челюсти с микро щипцами. Кожа вырезали продольно от шеи до морды. Череп разрезаются вдоль и вперед, начиная с цистерны Magna, сделав 1 медиальных и 2 боковыми разрезами (по одному на каждой стороне - Рисунок 2А). Следует проявлять осторожность, чтобы свести к минимуму контакты с основными корковой ткани черепной закрылки будут удалены от головного мозга.
- Для повышения устойчивости тканей при секционирования vibratome, бокового большинство аспектов мозга удаляют, сделав два сагиттальной сокращений. Хвостового аспект мозга также удаляется, делая разрез на ростральной базе мозжечка (рис. 2В).
- Два полушария разделены, делая гладкой разрезать вдоль средней линии трещину, и два полушария тщательно черпали из черепа и помещен, медиальной поверхности вниз, вложение формы (рис. 2C-D).
Секционирование принимающей мозга
- Двух полушарий в форме вложения сразу же покрыты растопленным 3% низкой температурой плавления ДНК-класса агарозном геле (Fisher, кошка # BP1360-100), растворенный в тканях подготовки буфер, который поддерживается на уровне 37 ° С (см. рецепты). Через 2 минуты стабилизации на плоской горизонтальной поверхности, чтобы обеспечить еще упрочнения агарозы, формы расположены на лед, чтобы завершить настройку.
- Как только гель, содержащий полушарий установлен, он будет удален из формы и обрезать, оставив 2-3мм геля вокруг мозговой ткани.
- Гель встраиваемый ткань затем монтируется на образец диска vibratome, с медиальной поверхности вверх, и закрепляется цианакрилатного клея (клей Krazy или эквивалент). Необходимо соблюдать осторожность применять только минимальное количество клея, так как слишком многое будет оказывать токсическое действие на кусочки и миграции клеток. Слишком много клея по бокам блока также может препятствовать резки, в результате чего потенциальный ущерб ткани.
- Диск устанавливается в лоток vibratome образец заполненной ледяной средой подготовки ткани.
- Ткань подразделяется на 150 мкм толщиной, с vibratome скорости установлен на медленное и среднего диапазона (будет зависеть от vibratome используются, и, следовательно, должны быть определены независимо для достижения оптимального результата). В наших руках, частота колебаний становится оптимальной во время установлена на максимум. Первые несколько ломтиков может быть отброшено.
- Как только RMS-содержащих ломтиками освобождаются от лезвия (RMS видна невооруженным глазом как серые U-образная структура простирается от ОЭЗ до OB), они тщательно дразнили из геля плесень, и черпали с помощью небольшого шпателя отвертка. Ломтики размещаются на nucleopore оболочки стеклянным дном блюд, содержащих часть среды (рис. 3А-В). Типичный ранний постнатальный мозг мыши получается примерно 2-3 RMS разделы в полушарии при разрезании на 150 мкм. Очень важно, чтобы обращение ломтиками сведено к минимуму, так как они очень хрупкие. Блюда с ломтиками, затем переведен в инкубаторе.
Доноры мозгасекционирования и RMS трансплантации
- Доноры мозга (мозг выражения флуоресцентные журналистам в миграции нейробластов) подразделяются на 250 мкм толщины и ломтиками собираются в ледяной буфера подготовки ткани.
- Ломтики немедленно помещены под микроскоп с рассекает epifluorescence возможностями, и RMS мягко микродиссекции, используя микро щипцами. Один щипцы для стабилизации срез, а другая используется, чтобы сделать небольшие разрезы вокруг RMS, пока не будет освобожден от среза. Вырезали RMS затем разрезается на мелкие эксплантов (около 200-500 мкм в диаметре) до трансплантации.
- Стекло-дно блюд, содержащих хост ломтиками расположен на nucleopore фильтры удаляют из инкубатора и помещен под рассекает микроскопом. Использование видимого света, RMS четко определены и небольшой надрез в начальном сегменте RMS.
- Использование пипетки оснащен 20 мкл наконечник, одного донора RMS эксплантов передается надрезанные сайта в принимающей RMS. Эксплантов мягко толкнул в разрез, чтобы наладить контакт между 2 тканях. Чтобы обеспечить этот контакт является стабильной, эксплантаты выталкиваются слегка между нарезать и мембранные nucleopore.
- После того как все хост ломтики с RMS пересаживают, блюда вернулся в инкубаторе в течение по крайней мере 1 час, чтобы разделы поселиться на мембране. Нейробластов должны начать мигрировать из эксплантов в принимающее RMS примерно через 1-2 часов.
Покадровый изображений миграцию нейронов
- Стеклянным дном блюд передаются из инкубатора в инкубировали камеры на микроскоп (рис. 3С). Флуоресцентные нейробластов может быть отображены с интервалом в диапазоне от 0 до 10 минут в зависимости от типа анализа лучшего. Например, мы цитоскелета изображение динамики в процессе миграционного цикла отдельных нейробластов, установив наши интервалы меньше или равна 2,5 минуты. Тем не менее, динамика популяций, таких как ориентация и скорость миграции лучше захватил с интервалом от 5 до 10 минут. Выбор целей сильно варьирует в зависимости от марки микроскоп. Для Nikon C1 конфокальной микроскопии, получаем, что 20-кратный объектив сухой (Nikon Пан Fluor, Н. А. 0.75, WD 0,35 мм) является наиболее подходящим для нашего анализа. Для достижения наилучших результатов по этому конфокальной системы, отверстие открывается для среднего размера (диаметром 60μm). Для наиболее подходящего миграционного поведения, работы с изображениями ограничивается клетки глубоко в толщину RMS, по крайней мере 20 мкм от одного из разреза поверхности среза. Мощность лазера должны быть оптимизированы так, чтобы она как минимум, но это детали отдельных нейробластов остаются видимыми.
- После завершения визуализации ломтиками может быть исправлено с ледяной холод, и свежеприготовленный 4% параформальдегида, immunostained, и установлены на салазках для дальнейшей обработки изображений. Так как мы не пальто наши мембраны с любого приверженца субстратов, таких как ламинин, ломтики обычно уплывают от мембраны, как только они погружаются в окрашивании буферов. Разделы изображаются при сохранении их толщину 150 мкм. Возможно также, чтобы cryopreserve и заморозить ломтиками и использования криостата для получения тонких разделов оригинальной ломтиками. Однако, это приведет к увеличению заболеваемости артефакты в окрашивании, а также изменить целостности тканей.
II. Материалы / оборудование
Подготовка блюд со стеклянным дном для органотипической ломтиками
- Малый шприцы (1 мл)
- 23-иглы
- Nucleopore Трек-Etch Мембрана - диаметр 25 мм, поры 8.0μm размера - Ватман, кошка # 110614
- Со стеклянным дном культуры блюда - 35 мм чашки Петри, 14мм Microwell, № 1,5 покровного стекла - Маттех, кошка # P35G-1.5-14-C
- Резиновые Цемент -, кошка Элмер # E904
- Базальные Средний Орел - Gibco, кошка # 21010
- 1M Hepes (pH7.4)
- 1M D-глюкозы
- 100mM CaCl 2
- 100mM MgSO 4
- 1M NaHCO 3
- дН 2 O
- 200 мМ L-глутамина
- Пенициллин-стрептомицин
Извлечение мозга и вложение
- Анестетики (isofluorane и т.д.)
- Микроволновая печь
- Низкий плавления агарозы - Фишер, кошка # BP1360-100
- Krazy клея - кошка # KG585
- Пил-A-Way Одноразовые Формы Вложение (R-40) - 22mmx40mm прямоугольная, 20 мм в глубину - Polysciences, кошка # 18646C
Срезов мозга и трансплантации RMS
- Vibratome - Leica VT1000S и все комплектующие детали для подготовки ломтик
- Сбалансированный Соль 10X Хэнка Solution - Gibco, кошка # 14185
- Microdissecting щипцов # 5 - Roboz, кошка # RS-4976
- Microspatula - Фишер, кошка # 21-401-15
- Стереомикроскоп
Покадровый изображенийорганотипической ломтиками
- Увлажненный инкубатор, 5% СО 2
- Перевернутый Микроскоп оснащен камерой инкубатор и междугородние рабочих целей (NA 0.6 или выше)
III. Рецепты
Буферный раствор для вскрытия ткани и нарезать подготовки (буфер ткани подготовки)
| Основной раствор | Объем | Заключительные Concetration |
| 10X HBSS | 50 мл | 1X |
| 1M Hepes (рН 7,4) | 1,25 мл | 2,5 мм |
| 1M D-глюкозы | 15 мл | 30 мм |
| 1М CaCl 2 | 0,5 мл | 1mM |
| 1M MgSO 4 | 0,5 мл | 1mM |
| 1M NaHCO 3 | 2 мл | 4мм |
| дН 2 O | 430,75 мл |
Фильтр стерилизуют при 0,2 мкм фильтр и хранить при 4 ° C.
Культура средой для органотипической ломтиками, тканей и обработки изображений (часть среды)
| Основной раствор | Объем | Конечная концентрация |
| Базальные Средний Eagle | 35 мл | |
| Буфер подготовки ткани | 12,9 мл | |
| 1M D-глюкозы | 1,35 мл | 20 мМ |
| 200 мМ L-глутамина | 0,25 мл | 1mM |
| Пенициллин-стрептомицин | 0,5 мл | 100units / мл пенициллина и 0,1 мг / мл стрептомицина |
Фильтр стерилизуют при 0,2 мкм фильтр и хранить при 4 ° C.
Подготовка низкой температурой плавления агарозном геле
Низкий температурой плавления агарозы разводят в ткани буфера подготовку на 0,3 г / мл в 50 мл коническую трубку (см. рецепты). Трубка микроволновой печи с шагом 5-10 секунд при высокой мощности. Количество шагом зависит от общего объема, по 10 мл, три шага (10-8-5 секунд каждый) должно быть достаточно. Трубки колпачок тщательно отвинтил между отопления шагом для освобождения давления воздуха и избежать взрыва трубы. Внимание должно быть принято как трубка содержание будет очень жарко. После агарозном полностью растворяется, трубки поддерживается в 37 ° С водяной бане в течение не менее 5 минут, чтобы дать стабилизации температуры перед использованием. Длительное воздействие комнатной температуры затвердевает гель. Хотя это должно избегать, насколько это возможно, закаленные гель можно разогревать и повторно расплавленного к немедленному использованию в течение 24 часов начальной подготовки.
Immunohistochemistry на органотипической ломтиками
После изображений по конфокальной микроскопии, ломтики может быть установлен в течение ночи при 4 ° С с 4% формальдегида в PBS. Разделы затем блокируют течение ночи при 4 ° С, в 10% сыворотки козьего с 1% Тритон Х (Sigma, кат. # S26-36-23) в PBS последующей инкубации в течение ночи с первичными антителами при 4 ° C. Флуоресцентно с метками козу вторичные антитела используются для визуализации (все разбавленный 1:1000, 1 час инкубации при комнатной температуре). Маркированный ломтики тщательно промывают 5-6 раз с ледяным PBS до монтажа на стеклах и coverslipping.
IV. Представитель Результаты
Наши органотипической протокол культуры ломтик была тщательно протестирована и оптимизирована за что последние несколько лет на предмет соответствия шаблону в миграции и ориентации. Анализ клеток эмиграции из эксплантов, полученных от мышей, в которых выражение красного флуоресцентного белка, АДС-помидор, индуцируется под промоутер нестин (нестин-Td помидор), показывает высокую направленность и быстрой миграции tdTomato + нейробластов в принимающее RMS ( Рисунок 4а). Высокая увеличение покадровой анализ показывает превосходное разрешение всей длине миграции нейробластов во время 20-минутной сессии визуализации (рис. 4В).
Ломтики с донорскими Td-помидор + клетки фиксировали и immunostained для различных клеточных компонентов в RMS. GFAP + астроциты и CD31 + судов крови были выявлены с помощью флуоресцентного иммуногистохимии (рис. 5А). Высокая увеличение анализ срезов окрашивали цитоскелета актина и тубулина белков выявить неоднородное выражение этих компонентов ячейки в разгар миграции (рис. 5B).
Антитела, используемые вэти примеры: кролик анти-RFP (Abcam, 1:250), кролика против GFAP (Dako, 1:1000), крысы анти-CD31 (BD Pharmigen, 1:100), мышь анти-актин (Санта-Крус, 1: 500), кролика против тубулина (Sigma, 1:1000), антимышиного Cy3 (Chemicon, 1:1000), козий анти-кролик AlexaFluor 647 (Invitrogen, 1:1000), козий анти-крыса AlexaFluor 488 (Invitrogen , 1:1000), козий анти-кролик AlexaFluor 488 (Invitrogen, 1:1000).
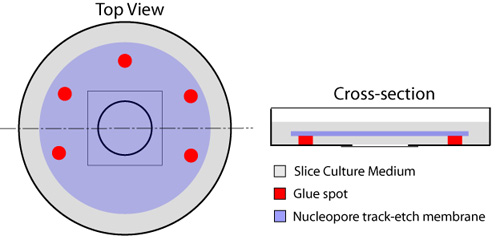
Рисунок 1. Подготовка стеклянным дном блюда для органотипической ломтиками. Множественные пятна клея расположены вокруг круглого стеклянным дном компонент блюда (красный), в результате чего одна сторона открыта для обмена среду из-под фильтра. 150 мкл каплю ломтик среда находится в центре стекло покровное. Мембраны nucleopore (синий) применяется затем, блестящей стороной вниз, обеспечивая при этом не быть пузырьков воздуха между покровным стеклом и мембраной. Один миллилитр ломтик среды (серый) распространяется в верхней части мембраны, и блюда инкубируют при 37 ° С до использования.
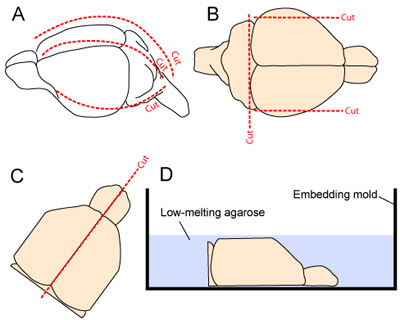
Рисунок 2. Извлечение мозга и подготовка к секционирования. (А) череп, предоставляемые надрезание кожу головы от шеи к морде (пунктирная линия вдоль средней линии). Череп затем разрезается вдоль и вперед, начиная с цистерны Magna, сделав 1 медиальных и 2 боковыми разрезами (по одному на каждой стороне, 2А). (B) бокового большинство аспектов коры и хвостового аспект ЦНС резекции для повышения стабильности ткани при vibratome секционирования. (CD) двух полушарий затем разделяют и помещен медиальной лицом вниз в форме вложения перед нанесением 3% агарозном геле, растворенный в тканях буфера подготовки.
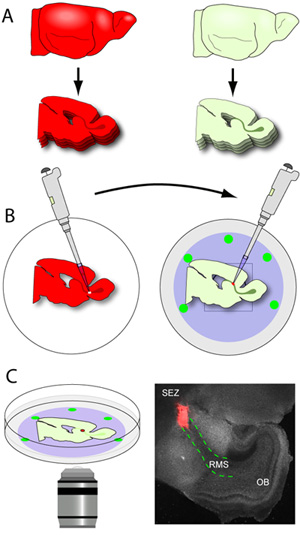
Рисунок 3. Срезов мозга и кросс-трансплантации. (А) тканей хозяина подразделяется на 150 мкм толщины, и RMS-содержащие разделы тщательно позиционируется квартира на nucleopore оболочки холодным стеклянным дном посуды. (Б) Донор мозги (мозги выражения флуоресцентные журналистам в RMS) подразделяются на 250 мкм толщина и ломтиками собираются в ледяной буфера подготовки ткани. Доноров RMS является микродиссекции и нарезать небольшими эксплантов. Использование пипетки оснащен 20 мкл наконечник, индивидуальный эксплантов RMS передаются надрезанные сайта в принимающей RMS. (С) Через 1-2 часа инкубации, блюда передаются инкубировали этап на конфокальной микроскопии и миграции захватывается использованием покадровой съемки. Микрофотография является представителем низким увеличением образ типичного ломтик (серый) создана 1 час после трансплантации (красный эксплантов из tdTomato + RMS из доноров мыши; красная пунктирная линия линий RMS в принимающей срез).
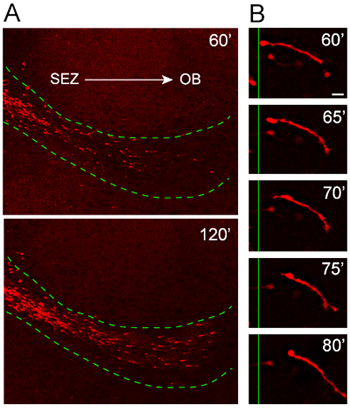
Рисунок 4. Миграция нейробластов из эксплантов в принимающее RMS. (А) нестин-tdTomato + нейробластов (красный) мигрируют из эксплантов в принимающее RMS (пунктирная зеленая линия) 1 час после трансплантации. tdTomato + клеток вторжения RMS принимающей органотипической ломтиками двигаться в высоко ориентированные и быстрым способом от ОЭЗ и в сторону Оби. (B) миграционный цикл можно наблюдать в мощных покадровой образы нейробластов в течение примерно 20-минутный период. Шкала бар = 10 мкм.
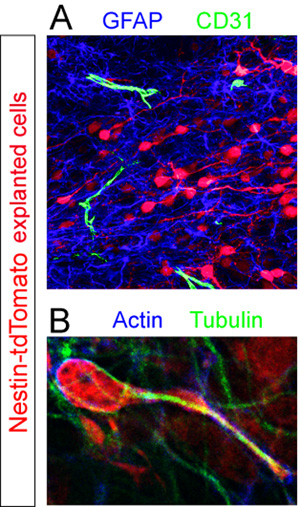
Рисунок 5. Иммуногистохимическое оценки органотипической ломтиками. Эксплантированных нейробластов (красный) были зафиксированы в разгар миграции 12 ч после трансплантации. () Флуоресцентные иммуногистохимического окрашивания срез показывает плотные пул GFAP + астроциты (синий) и рассеянного CD31 + кровеносных сосудов (зеленый) в RMS принимающей срез. (B) цитоскелета изолированных tdTomato + мигрирующие клетки (красный) в хост RMS раскрывается путем совместного иммуноокрашивания с использованием антител против актина (синий) и тубулина (зеленый).
Обсуждение
Миграцию нейронов в RMS является важным компонентом постнатального нейрогенез в обонятельной луковицы 1. Миграция через RMS происходит в плоскости, касательной к поверхности мозга. Касательной миграции нейробластов отличаются от радиально мигрирующих клеток по месту нахождения с...
Раскрытие информации
Благодарности
Мы благодарим Дэн Мак-Ухортер для повествующая протокол в видео. Эта работа проводится при поддержке гранта NIH 5R01NS062182, грант от Американской федерации по проблемам старения исследований и институциональных фондов присуждена HTG.
Ссылки
- Ghashghaei, H. T., Lai, C., Anton, E. S. Neuronal migration in the adult brain: are we there yet. Nat. Rev. Neurosci. 8, 141-151 (2007).
- Valiente, M., Marin, O. Neuronal migration mechanisms in development and disease. Curr. Opin. Neurobiol. 20, 68-78 (2010).
- Rakic, P. Evolution of the neocortex: a perspective from developmental biology. Nat. Rev. Neurosci. 10, 724-735 (2009).
- Jaglin, X. H., Chelly, J. Tubulin-related cortical dysgeneses: microtubule dysfunction underlying neuronal migration defects. Trends Genet. 25, 555-566 (2009).
- Carro, M. S. The transcriptional network for mesenchymal transformation of brain tumours. Nature. 463, 318-325 (2010).
- Wu, W. Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature. 400, 331-336 (1999).
- Hu, H., Tomasiewicz, H., Magnuson, T., Rutishauser, U., U, . The role of polysialic acid in migration of olfactory bulb interneuron precursors in the subventricular zone. Neuron. 16, 735-743 (1996).
- Shapiro, E. M., Gonzalez-Perez, O., Garcia-Verdugo, M. a. n. u. e. l., Alvarez-Buylla, J., &, A., Koretsky, A. P. Magnetic resonance imaging of the migration of neuronal precursors generated in the adult rodent brain. Neuroimage. , (2006).
- Vreys, R. MRI visualization of endogenous neural progenitor cell migration along the RMS in the adult mouse brain: validation of various MPIO labeling strategies. Neuroimage. 49, 2094-2103 (2010).
- Davenne, M., Custody, C., Charneau, P., Lledo, P. M. In vivo imaging of migrating neurons in the mammalian forebrain. Chem. Senses. 30, 115-116 (2005).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal. J. Vis. Exp. , (2010).
- Shen, Q. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3, 289-300 (2008).
- Tavazoie, M. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3, 279-288 (2008).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural Stem Cells Confer Unique Pinwheel Architecture to the Ventricular Surface in Neurogenic Regions of the Adult Brain. Cell Stem Cell. 3, 265-278 (2008).
- Polleux, F. &. a. m. p. ;. a. m. p., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. , L9-L9 (2002).
- Murase, S. &. a. m. p. ;. a. m. p., Horwitz, A. F. Deleted in colorectal carcinoma and differentially expressed integrins mediate the directional migration of neural precursors in the rostral migratory stream. J. Neurosci. 22, 3568-3579 (2002).
- Suzuki, S. O. &. a. m. p. ;. a. m. p., Goldman, J. E. Multiple cell populations in the early postnatal subventricular zone take distinct migratory pathways: a dynamic study of glial and neuronal progenitor migration. J. Neurosci. 23, 4240-4250 (2003).
- Ghashghaei, H. T. The role of neuregulin-ErbB4 interactions on the proliferation and organization of cells in the subventricular zone. Proc. Natl. Acad. Sci. U. S. A. 103, 1930-1935 (2006).
- Khodosevich, K., Seeburg, P. H., Monyer, H. Major signaling pathways in migrating neuroblasts. Front Mol. Neurosci. 2, 7-7 (2009).
- Jacquet, B. V. Analysis of neuronal proliferation, migration and differentiation in the postnatal brain using equine infectious anemia virus-based lentiviral vectors. Gene Ther. 16, 1021-1033 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены