Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Doğum Sonrası Beyin Nöronal Göç Yüksek Çözünürlüklü Zaman Aşımı Görüntüleme için bir Organotipik Dilim Testi
Özet
Bu protokol, postnatal beyin ve rostral göçmen akışı neuroblast göç yüksek çözünürlüklü zaman atlamalı görüntüleme için optimize edilmiş bir Organotipik dilim tahlil açıklamaktadır.
Özet
Progenitör hücrelerin, neuroblasts göç yanı sıra, mevcut nöral devrelerin farklılaşma ve yeni nöronlar entegrasyonu yayılması: doğum sonrası beyindeki nöron üç biyolojik olaylar bakım bağlıdır. Koku ampuller doğum sonrası nöron için, bu olayların üç anatomik olarak farklı alanlar içinde ayrı: proliferasyon neuroblasts rostral göçmen akışı (RMS) aracılığıyla hareket göç büyük ölçüde, lateral ventriküllerin subependimal bölgesi (SEZ) oluşur ve yeni nöronlar ayırt etmek ve koku ampuller (OB) içinde entegre. Bu üç etki alanı biyolojik olayların her belirgin düzenleyen, hücresel, moleküler ve fizyolojik mekanizmaların çalışması için ideal bir platform olarak hizmet vermektedir. Bu yazıda, ekstraselüler koşulları yakından neuroblasts göç in vivo ortamda taklit postnatal beyin dokusu için optimize edilmiş bir Organotipik dilim testi açıklar. Biz tahlil, üniforma, odaklı ve hızlı hareket için RMS içinde neuroblasts sağladığını göstermektedir. Bu testte, farklı genetik geçmişleri fareler çapraz nakli yaklaşımlar kullanılarak nöronal göçün hücre özerk ve özerk olmayan bir yönetmelik çalışması için son derece uygun olacaktır.
Protokol
I. Prosedürleri
Aşağıdaki teknikler, sterilize araçlarını kullanarak, bir laminer akış kaputu steril koşullar altında olmalıdır.
Organotipik dilimler için cam alt yemeklerin hazırlanması
- Yemekleri steril bir ortamda hazırlanan ve araçlarını kullanarak sterilize edilmelidir.
- 150μL dilim orta bir damla (yemek tarifleri) orta hava kabarcıklarını önlemek için dikkatli bir şekilde çanak cam alt kısmının merkezinde yer almaktadır.
- Neşesiz bir tarafı bırakarak, kültür çanak merkezi işgal yuvarlak lamel bitişik kare saçaklar yerleştirilir - 23 Gauge iğne, tutkal birden fazla lekeler (Elmer, kedi # E904 Kauçuk Çimento) ile donatılmış bir tek şırınga ile sıvı alışverişi için (Şekil 1). Listelenen tutkal olarak bu protokolü uygulanan dilimleri veya hücreleri için toksik değildir. Bakım değindiği ve daha sonra dilimleri görüntüleme engel olarak cam kapak slip üzerindeki her türlü tutkal yerleştirerek önlemek için verilmelidir. Nucleopore membran (çapı 25mm, gözenek boyutu 8.0μm Whatman kedi # 110.614), bir yere sabitlemek için yapıştırıcı noktalar kullanarak, cam lamel üstüne yerleştirilir. Cam lamel ve membran arasında sıkışmış hava kabarcıkları olmadığını sağlarken, bir mikro forseps kullanılarak yapılmalıdır.
- 1 ml dilim orta membran üstüne ekleyin. Yemekleri Kullanıma hazır olana kadar, 30 dakika sonra buz üzerinde bir kuluçka yerleştirilir.
Erken doğum sonrası beyinlerin çıkarımı
Dilimleri genç postnatal fareler (P1-P10) hazırlanan zaman en iyi sonuçları elde edilir.
- Pups ölümcül anestezi isofluorane veya onaylanmış diğer yöntemlerle (aşırı doz). Baş, sterilite artırmak için keskin bir makas kullanarak hızlı dekapitasyon% 70 etanol ile püskürtülür olabilir.
- Mikro forseps ile mandibula sıkma baş stabilize edilir. Deri, boyun burnu boyuna eksize edilir. Kafatası 1 medial ve 2 yan keser (Şekil 2A her iki tarafında bir) yaparak, sisterna magna başlayan boyuna ve anteriora kesilir. Kraniyal flep beyin uzak kaldırılır Bakım altta yatan kortikal doku ile temas en aza indirmek için alınmalıdır.
- Vibratome kesit sırasında doku istikrarı geliştirmek için iki sagital kesikler yaparak, beynin lateral en yönlerini kaldırılır. Beynin kaudal yönü de beyincik rostral tabanı (Şekil 2B) bir kesim yaparak kaldırılır.
- Iki yarısının orta hat fissür boyunca pürüzsüz bir kesim yaparak ayrılmış ve iki yarımküresinin kafatası dikkatle scooped ve gömme bir kalıp (Şekil 2C-D), aşağı, medial yüzeyi yerleştirilir.
Ev sahibi beyin, Kesit
- Gömme kalıp iki yarımküresinin hemen erimiş% 3, düşük erime noktası DNA dereceli agaroz jel (Fisher, kedi # BP1360-100) 37 ° C (yemek tarifleri) muhafaza doku hazırlanması tampon içinde çözünmüş kaplıdır. Agaroz bile sertleşme sağlamak için yatay düz bir yüzey üzerinde sabitleme 2 dakika sonra, kalıplar ayarını tamamlamak için buz üzerinde konumlandırılmış.
- Hemisferlerin içeren jel ayarlandıktan sonra, kalıptan çıkarılır ve beyin dokusu etrafında jel 2-3mm bırakarak kesilmiş.
- Sonra jel gömülü doku medial yüzeyi ile, vibratome numune disk monte ve siyanoakrilat yapıştırıcı (Krazy yapıştırıcı veya eşdeğeri) ile güvenli. Bakım sadece az miktarda tutkal uygulamak için gerekli önlemler alınmalıdır çok dilimleri ve göç hücreleri toksik etkileri olacaktır. Çok fazla tutkal blok tarafta da potansiyel doku zarar kesme engel olacaktır.
- Disk doku hazırlanması orta buz dolu vibratome örnek tepsiye yüklü.
- Doku (kullanılan vibratome bağlıdır, ve böylece en iyi sonuçlar için bağımsız olarak tespit edilmelidir), yavaş ve orta menzil vibratome hızda, 150μm kalınlığında kesitli konumundadır. Bizim ellerde, maksimum titreşim frekansı en uygunudur. İlk birkaç dilim atılabilir.
- En kısa sürede RMS içeren dilim bıçağı (RMS SEZ OB uzanan gri U-şeklinde bir yapı olarak çıplak gözle görülebilen) yayımlanan, onlar dikkatle jel kalıp alay ve topladım. küçük bir flathead spatula ile. Dilim dilim orta (Şekil 3A-B) içeren cam-alt yemekler nucleopore zarı üzerine yerleştirilir. 150 mikron kesildiğinde tipik bir erken postnatal fare beyin yarımkürede başına yaklaşık 2-3 RMS bölümleri verecektir. Bu, çok kırılgan olduğu gibi dilim işleme minimumda tutulması olduğunu kritik öneme sahiptir. Dilimleri ile yemekler daha sonra bir kuluçka aktarılır.
Donör beyinkesit ve RMS nakli
- Donör beyinleri (neuroblasts göç floresan gazetecilere ifade beyinsel) 250μm kalınlığı kesitli ve dilim buz doku hazırlanması tampon toplanır.
- Dilimler hemen Epifloresans yeteneği ile bir diseksiyon mikroskop altında yerleştirilir ve RMS yavaşça mikro forseps kullanarak, microdissected. Bir forseps, dilim, diğer dilim serbest bırakılana kadar RMS çevresinde küçük bir kesim yapmak için kullanılır ise stabilize etmek için kullanılır. Eksize RMS sonra nakli için önce küçük eksplantlar (çapı yaklaşık 200-500 mikron) bölünür.
- Cam alt yemekleri nucleopore filtrelerin üzerine yerleştirilmiş ana dilim içeren inkübatör kaldırılır ve diseksiyon mikroskop altında yerleştirilir. RMS, görünür ışık kullanarak, açıkça tanımlanmış ve RMS ilk segment küçük bir kesi yapılır.
- 20 mcL ucu ile donatılmış bir pipet kullanarak, tek bir donör RMS eksplant ana RMS kazıma sitesine aktarılır. Eksplant nazikçe 2 dokular arasında iletişim kurmak için kesi içine itilir. Bu iletişim kararlı olduğundan emin olmak için, eksplantlar dilim ve nucleopore zarı arasında biraz itti.
- RMS ile tüm ana dilim nakledilen sonra, bulaşıkları membran bölümlere yerleşmek için izin için en az 1 saat inkübatör iade edilir. Neuroblasts eksplant host yaklaşık 1-2 saat sonra RMS içine göç etmeye başlamalıdır.
Zaman atlamalı görüntüleme nöronal migrasyon
- Cam alt yemekleri inkübatör mikroskop inkübe odası (Şekil 3C) aktarılır. Floresan neuroblasts 0 İstenen analizin türüne bağlı olarak 10 dakika arasında değişen aralıklarla görüntülü olabilir. Örneğin bireysel neuroblasts göçmen döngüsü sırasında 2,5 dakika veya daha az eşit aralıklarla ayarlayarak görüntü sitoskeletal dinamikleri. Ancak, 5 ila 10 dakika arasında değişen aralıklarla göç yönü ve hızı gibi nüfus dinamikleri daha iyi yakalanır. Hedeflerinin seçim mikroskop marka bağlı olarak oldukça değişkendir. Nikon C1 konfokal mikroskop, 20x kuru lens (Nikon Pan Fluor, NA 0.75, WD 0.35mm) analizleri için en uygun olduğunu bulmak. Bu konfokal sistemi en iyi sonuçlar için, orta boy bir iğne deliği (60μm çap) açıldı. , Görüntüleme göç davranışı için en uygun en az 20 mm uzakta iki dilim kesilmiş yüzeyleri, RMS kalınlığı içinde derin hücrelerine sınırlıdır. Lazer gücü en az şekilde optimize edilmiş, ancak bireysel neuroblasts ayrıntıları görünür kalmasını olmalıdır.
- Dilimleri görüntüleme tamamlandıktan sonra buz ile sabit ve taze% 4 paraformaldehid hazırlanan, immunohistokimyasal ve daha fazla görüntüleme için kızaklar üzerinde monte edilmiş olabilir. Membranlar gibi laminin gibi herhangi bir yandaşı substratları ile kat bizim olmadığından boyama tamponlar dalmış kez dilimleri genellikle membran uzakta yüzer. , 150 mikron kalınlığında korurken Bölüm görüntülenmiş. Bu dilim cryopreserve ve dondurma ve orijinal dilim ince bölümleri elde etmek için bir Kriyostat kullanmak da mümkündür. Ancak, bu eserlerin yanı sıra doku bütünlüğünü değiştirecek boyama insidansı artış neden olur.
II. Malzeme / ekipman
Organotipik dilimler için cam alt yemeklerin hazırlanması
- Küçük şırınga ile (1 mL)
- 23-insülin iğnesi
- Parça-Etch Nucleopore Membran çapı 25mm, gözenek boyutu 8.0μm - whatman, kedi # 110.614
- Glass Bottom Kültür Yemekleri, 35mm petri, 14mm kuyu, No 1.5 coverglass - MatTech, kedi # P35G-1.5-14-C
- Kauçuk Çimento - Elmer, kedi # E904
- Bazal Orta Eagle - Gibco, kedi # 21010
- 1M HEPES (pH7.4)
- 1M D-glukoz
- 100 mM CaCl 2
- 100 mM MgSO 4
- 1M NaHCO 3
- dH 2 O
- 200mm L-glutamin
- Penisilin-streptomisin
Beyin çıkarma ve gömme
- Anestezik (isofluorane, vb.)
- Mikrodalga fırın
- Düşük Erime Agaroz - Fisher, kedi # BP1360-100
- Krazy tutkal - kedi # KG585
- Peel-A-Way Disposable gömülmesi Kalıplar (R-40) - 22mmx40mm dikdörtgen, 20mm derin - Polysciences, kedi # 18646C
Beyin kesit ve RMS transplantasyonu
- Vibratome - Leica VT1000S ve dilim hazırlanması için tüm aksesuar parçaları
- 10X Hank Dengeli Tuz Çözüm - Gibco, kedi # 14185
- Microdissecting forseps # 5 - Roboz, kedi # RS-4976
- Microspatula - Fisher, kedi # 21-401-15
- Stereomikroskopta
Time-lapse görüntülemeOrganotipik dilimleri
- Nemlendirilmiş İnkübatör,% 5 CO 2
- Ters Mikroskop inkübatör odası ve uzun mesafe çalışma hedefleri (0.6 veya daha yüksek NA) ile donatılmış
III. Yemek Tarifleri
Tampon çözelti doku diseksiyonu ve dilim hazırlama (doku hazırlama tampon)
| Stok çözelti | Hacim | Final konsantrasyon |
| 10X HBSS | 50 ml | 1X |
| 1M HEPES (pH 7.4) | 1.25 mL | 2.5mm |
| 1M D-Glikoz | 15 ml | 30mm |
| 1M CaCl 2 | 0,5 mL | 1mm |
| 1M MgSO 4 | 0,5 mL | 1mm |
| 1M NaHCO 3 | 2 mL | 4mm |
| dH 2 O | 430,75 ml |
4 at 0.2 mikron filtre ve mağaza ° C ile sterilize filtreleme
Organotipik dilimleri, doku nakli ve görüntüleme Kültür orta (dilim orta)
| Stok çözelti | Hacim | Final Konsantrasyon |
| Bazal Orta Kartal | 35 mL | |
| Doku hazırlanması tamponu | 12.9 ml | |
| 1M D-Glikoz | 1.35 mL | 20mm |
| 200mm L-glutamin | 0.25 ml | 1mm |
| Penisilin-streptomisin | 0,5 mL | 100units / ml penisilin ve 0.1 mg / ml streptomisin |
4 at 0.2 mikron filtre ve mağaza ° C ile sterilize filtreleme
Düşük erime noktası agaroz jel hazırlanması
Düşük erime noktası agaroz 50 ml konik tüpünde 0.3g / ml (yemek tarifleri) doku hazırlanması tampon ile seyreltilir. Tüp 5-10 saniye aralıklarla yüksek güç mikrodalga. Artışlarla sayısı toplam hacmine bağlıdır; 10 ml, üç artışlarla (10-8-5 saniye, her) yeterli olacaktır. Hava basıncı dikkatlice bırakın ve tüpün patlama önlemek için tüp kapağı ısıtma artışlarla arasındaki vida. Tüp içeriği çok sıcak olacak gibi Dikkat alınmalıdır. Agaroz tamamen eridikten sonra, tüp sıcaklığı kullanmadan önce stabilize etmek için izin vermek için en az 5 dakika 37 ° C su banyosunda tutulur. Oda sıcaklığında uzun süre maruz kalmak sertleşmesine jel. Bu mümkün olduğunca kaçınılmalıdır rağmen, ilk hazırlık 24 saat içinde hemen kullanıma için sertleştirilmiş jel ısıtılması olabilir ve yeniden erimiş.
Organotipik dilimleri üzerinde İmmünohistokimya
Konfokal mikroskop görüntüleme sonra, dilimler PBS içinde% 4 formaldehit ile 4 ° C'de gece boyunca sabit olabilir. Bölüm sonra% 1 Triton X% 10 keçi serumu gecede, 4 ° C'de engellenir (Sigma, Kedi # S26-36-23) PBS içinde 4 ° C'de primer antikorları ile gecelik inkübasyon Floresan etiketli keçi sekonder antikor görselleştirme için kullanılan (tüm seyreltilmiş 1:1000, oda sıcaklığında 1 saat inkübasyon). Etiketli dilimleri önce buz PBS cam slaytlar montaj ve coverslipping 5-6 kez iyice yıkanır.
IV. Temsilcisi Sonuçlar
Bizim Organotipik dilim kültür protokolü iyice test edilmiş ve bu son birkaç yıl içinde göç desen ve yönlendirme tutarlılık için optimize edilmiştir. Kırmızı floresan proteini, Td-domates, ifade Nestin organizatörü (Nestin-Td Domates) altında indüklenen olan hangi farelerden elde edilen eksplantlar göç hücrelerin analizi, (ev sahibi RMS içine tdTomato + neuroblasts yüksek odaklı ve hızlı göç ortaya koymaktadır Şekil 4A). Yüksek büyütmeli zaman atlamalı analizi (Şekil 4B) 20 dakika görüntüleme oturumu sırasında göç neuroblast tüm uzunluğu mükemmel çözünürlük göstermektedir.
Donör ile Dilimleri Td-domates + hücreler sabit ve RMS içinde farklı hücresel bileşenleri için immunohistokimyasal. GFAP + astrositler ve CD31 + kan damarlarının floresan immünohistokimya (Şekil 5A) kullanılarak ortaya çıkarılmıştır. Yüksek büyütmeli Hücre iskeleti proteinleri aktin ve tubulin lekeli dilim analizi göç ortasında bir hücre (Şekil 5B) tarafından bu bileşenlerin düzgün olmayan bir ifade ortaya koymaktadır.
Kullanılan Antikorlarbu örnekler: tavşan anti-Teklife Çağrı Dosyası (Abcam 1:250), tavşan anti-GFAP (Dako, 1:1000), sıçan, anti-CD31 (BD Pharmigen, 1:100), fare, anti-aktin (Santa Cruz, 1: 500), tavşan anti-tubulin (Sigma, 1:1000), keçi anti-fare Cy3 (Chemicon 1:1000), keçi anti-tavşan AlexaFluor 647 (Invitrogen, 1:1000), keçi anti-sıçan AlexaFluor 488 (Invitrogen 1:1000), keçi anti-tavşan AlexaFluor 488 (Invitrogen, 1:1000).
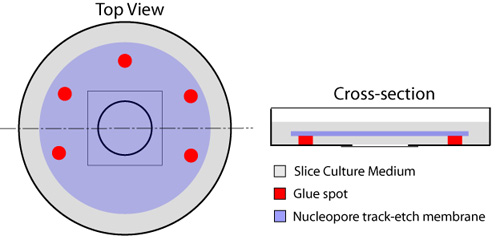
Şekil 1. Organotipik dilimleri için cam alt yemekler hazırlanması. Tutkal Çoklu noktalar, filtre altından orta değişimi için bir tarafı açık bırakarak, çanak dairesel cam alt bileşeni (kırmızı) etrafına yerleştirilir . Dilim orta 150μL açılan cam lamel merkezinde yer almaktadır. Nucleopore membran (mavi), sonra cam lamel ve membran arasında sıkışmış hava kabarcıkları olduğunu sağlarken, parlak tarafı aşağı, uygulanır. Bir mililitre dilim orta (gri) membran üstüne yayılır ve yemekleri ° C kullanımdan önce 37 inkübe edilir.
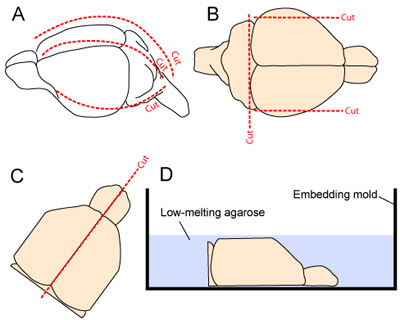
Şekil 2. Beyin çıkarma ve kesit için hazırlanması. (A) kafatası, boyun (orta hat boyunca noktalı çizgi) burnu kafa derisi incising maruz kalmaktadır . Kafatası 1 medial ve 2 yan keser (her iki tarafta; 2A) yaparak, sisterna magna başlayan boyuna ve anteriora kesilir (B) korteksin lateral en yönlerini ve MSS kaudal yönü vibratome kesit sırasında doku istikrarı geliştirmek için rezeke (CD) iki yarımküresinin daha sonra ayrılmış ve doku hazırlanması tampon içinde çözünmüş% 3 agaroz jel uygulaması öncesi bir iç içelik kalıp medial yüzü aşağı yerleştirilir .
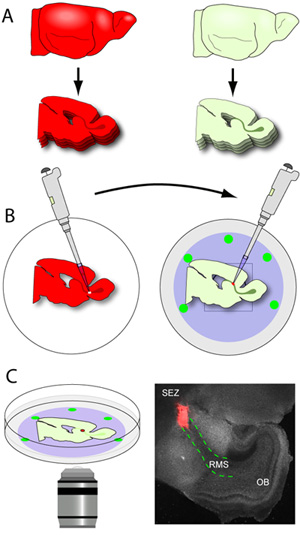
Şekil 3. Beyin kesit ve çapraz nakli. (A) konakçı doku 150μm kalınlığı kesitli, ve RMS içeren bölümleri dikkatli bir şekilde, soğuk cam alt yemekler nucleopore membran düz konumlandırılmış (B) Donör beyinleri (RMS floresan gazetecilere ifade beyinleri ) kesitli. 250μm kalınlığı, ve dilim buz doku hazırlanması tampon toplanır. Donör RMS microdissected ve küçük eksplantlar oyulmuş. 20 mcL ucu ile donatılmış bir pipet kullanarak, bireysel RMS eksplantlar ev sahibi RMS bir kazıma sitesine aktarılır (C) 1-2 saat inkübasyondan sonra, yemekleri konfokal mikroskop inkübe bir aşamaya aktarılır ve göç yakalanır zaman atlamalı kullanarak görüntüleme. Bir yüzey (gri) tipik bir dilim transplantasyonu (kırmızı noktalı çizgiler anahat ana dilim RMS tdTomato + RMS kırmızı bir bağış fare eksplant) 1 saat sonra bir temsilcisi düşük büyütmeli görüntü.
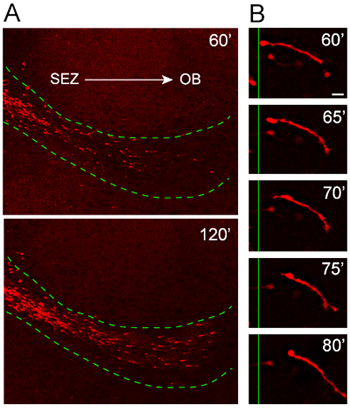
Şekil 4. Göç ev sahibi RMS içine eksplantlar gelen neuroblasts. (A) Nestin-tdTomato + neuroblasts (kırmızı), ev sahibi RMS (noktalı yeşil hat) naklinden sonra 1 saat içinde eksplantlar göç ederler . tdTomato + Organotipik dilim SEZ bir yüksek odaklı ve hızlı bir şekilde OB doğru hareket konak RMS işgalci hücreler. (B) göçmen döngüsü yaklaşık bir neuroblast yüksek güç zaman atlamalı görüntüleri gözlenen olabilir. 20 dakikalık süre. Ölçek çubuğu = 10 mm.
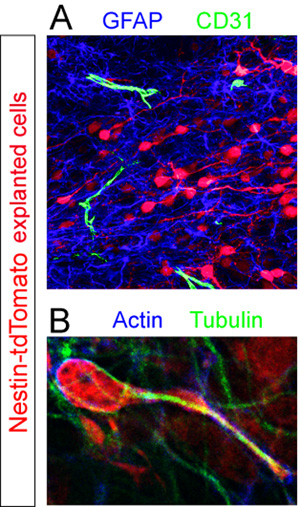
Şekil 5. Organotipik dilim immünohistokimyasal değerlendirme. Eksplante neuroblasts (kırmızı) göç ortasında sabit vardı 12 saat yazılan nakli. (A) dilim Floresan immünohistokimyasal boyama CD31 + kan damarlarının (yeşil) GFAP + astrositler bir yoğun havuzu (mavi) ortaya çıkarır ve dağınık (B), izole bir tdTomato hücre iskeletinin ana dilim RMS içinde + bir dizi RMS göç hücre (kırmızı) co-immün aktin (mavi) ve tubulin (yeşil) karşı antikorlar ortaya çıkar .
Tartışmalar
RMS Nöronal göç koku ampuller 1 postnatal nöron önemli bir bileşeni. Göç yoluyla RMS beynin yüzeyine teğet bir düzlem oluşur. Teğet göç neuroblasts radyal yanı sıra, son nöronal ürünler 1, 2, 3 ıraksak kaderi kendi progenitör kaynağının yerini dayalı hücreler göç farklıdır. Postnatal RMS teğet göç hücrelerinin oldukça saf bir nüfus bu anatomik olarak tanımlanabilir bölge teğet göç mekanizmaları çalışmak için optimum bir platform yapar. Nöronal göçü...
Açıklamalar
Teşekkürler
Dan McWhorter video protokol anlatan için teşekkür ederiz. Bu çalışma NIH Hibe 5R01NS062182 Yaşlanma Araştırma Amerikan Federasyonu hibe ve HTG verilen kurumsal fonlar tarafından desteklenmektedir.
Referanslar
- Ghashghaei, H. T., Lai, C., Anton, E. S. Neuronal migration in the adult brain: are we there yet. Nat. Rev. Neurosci. 8, 141-151 (2007).
- Valiente, M., Marin, O. Neuronal migration mechanisms in development and disease. Curr. Opin. Neurobiol. 20, 68-78 (2010).
- Rakic, P. Evolution of the neocortex: a perspective from developmental biology. Nat. Rev. Neurosci. 10, 724-735 (2009).
- Jaglin, X. H., Chelly, J. Tubulin-related cortical dysgeneses: microtubule dysfunction underlying neuronal migration defects. Trends Genet. 25, 555-566 (2009).
- Carro, M. S. The transcriptional network for mesenchymal transformation of brain tumours. Nature. 463, 318-325 (2010).
- Wu, W. Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature. 400, 331-336 (1999).
- Hu, H., Tomasiewicz, H., Magnuson, T., Rutishauser, U., U, . The role of polysialic acid in migration of olfactory bulb interneuron precursors in the subventricular zone. Neuron. 16, 735-743 (1996).
- Shapiro, E. M., Gonzalez-Perez, O., Garcia-Verdugo, M. a. n. u. e. l., Alvarez-Buylla, J., &, A., Koretsky, A. P. Magnetic resonance imaging of the migration of neuronal precursors generated in the adult rodent brain. Neuroimage. , (2006).
- Vreys, R. MRI visualization of endogenous neural progenitor cell migration along the RMS in the adult mouse brain: validation of various MPIO labeling strategies. Neuroimage. 49, 2094-2103 (2010).
- Davenne, M., Custody, C., Charneau, P., Lledo, P. M. In vivo imaging of migrating neurons in the mammalian forebrain. Chem. Senses. 30, 115-116 (2005).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal. J. Vis. Exp. , (2010).
- Shen, Q. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3, 289-300 (2008).
- Tavazoie, M. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3, 279-288 (2008).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural Stem Cells Confer Unique Pinwheel Architecture to the Ventricular Surface in Neurogenic Regions of the Adult Brain. Cell Stem Cell. 3, 265-278 (2008).
- Polleux, F. &. a. m. p. ;. a. m. p., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. , L9-L9 (2002).
- Murase, S. &. a. m. p. ;. a. m. p., Horwitz, A. F. Deleted in colorectal carcinoma and differentially expressed integrins mediate the directional migration of neural precursors in the rostral migratory stream. J. Neurosci. 22, 3568-3579 (2002).
- Suzuki, S. O. &. a. m. p. ;. a. m. p., Goldman, J. E. Multiple cell populations in the early postnatal subventricular zone take distinct migratory pathways: a dynamic study of glial and neuronal progenitor migration. J. Neurosci. 23, 4240-4250 (2003).
- Ghashghaei, H. T. The role of neuregulin-ErbB4 interactions on the proliferation and organization of cells in the subventricular zone. Proc. Natl. Acad. Sci. U. S. A. 103, 1930-1935 (2006).
- Khodosevich, K., Seeburg, P. H., Monyer, H. Major signaling pathways in migrating neuroblasts. Front Mol. Neurosci. 2, 7-7 (2009).
- Jacquet, B. V. Analysis of neuronal proliferation, migration and differentiation in the postnatal brain using equine infectious anemia virus-based lentiviral vectors. Gene Ther. 16, 1021-1033 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır