É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um Ensaio Slice organotípicas para High-Resolution Imaging Time Lapse de migração neuronal no cérebro pós-natal
Neste Artigo
Resumo
Este protocolo descreve um ensaio fatia organotípicas otimizado para o cérebro pós-natal e imagens de alta resolução de lapso de tempo de migração neuroblastos no fluxo migratório rostral.
Resumo
Neurogênese no cérebro pós-natal depende da manutenção de três eventos biológicos: a proliferação de células progenitoras, a migração dos neuroblastos, bem como diferenciação e integração de novos neurônios em circuitos neurais existentes. Para a neurogênese pós-natal no bulbo olfatório, esses eventos são segregados dentro de três domínios anatomicamente distintas: a proliferação em grande parte ocorre na zona subependimal (ZEE) dos ventrículos laterais, migrando neuroblastos atravessar o fluxo migratório rostral (RMS), e novos neurônios diferenciar e integração dentro do bulbo olfatório (OB). Os três domínios servem como plataformas ideais para estudar os mecanismos celulares, moleculares e fisiológicos que regulam cada um dos eventos biológicos distintamente. Este artigo descreve um ensaio fatia organotípicas otimizado para o tecido cerebral pós-natal, em que as condições extracelular imitam de perto as em ambiente vivo para a migração de neuroblastos. Nós mostramos que o nosso ensaio prevê movimento uniforme, orientado, e rápida de neuroblastos dentro da RMS. Este ensaio será muito adequado para o estudo da regulação celular autónomos e não-autônoma da migração neuronal utilizando cruz-transplante abordagens de ratos em diferentes backgrounds genéticos.
Protocolo
I. Procedimentos
As técnicas a seguir devem ser realizados em condições estéreis, em uma capela de fluxo laminar, utilizando ferramentas esterilizadas.
Preparação de pratos com fundo de vidro para fatias organotípicas
- Pratos devem ser preparados em ambiente estéril e usar ferramentas esterilizadas.
- A queda de 150μL de meio de fatia (veja receitas) é colocado no centro da peça com fundo de vidro do prato com cuidado para evitar bolhas de ar no meio.
- Com uma seringa descartável equipado com um 23 agulha, pontos múltiplos de cola (Borracha Cimento - cat Elmer, # E904) são colocados à margem quadrados adjacente à lamela circular que ocupa o centro da placa de cultura, deixando um lado descolado para a troca de fluidos (Figura 1). O tipo de cola listados não é tóxico para as fatias ou as células como aplicada neste protocolo. Cuidado deve ser dada para evitar a colocação de qualquer cola na lamínula de vidro, pois isso vai impingir e obstruir imagens das fatias mais tarde. Uma membrana nucleopore (diâmetro 25mm, tamanho dos poros 8.0μm - Whatman, cat # 110614) é colocado em cima da lamela de vidro, utilizando os pontos de cola para fixá-lo no lugar. Isto deve ser feito usando uma pinça micro, assegurando que as bolhas de ar não estão presos entre as lamelas de vidro e da membrana.
- Adicione 1 fatia média mL em cima da membrana. Os pratos são colocados em uma incubadora por 30 minutos e, em seguida, no gelo, até que esteja pronto para uso.
Extração de cérebros início pós-natal
Os melhores resultados são obtidos quando as fatias são preparados a partir de camundongos jovens pós-natal (P1-P10).
- Os filhotes são terminais anestesiados (overdose) de isofluorano ou outros métodos aprovados. A cabeça pode ser pulverizado com etanol 70% para aumentar a esterilidade, seguido por decapitação rápida usando uma tesoura afiada.
- A cabeça é estabilizados por fixação da mandíbula com uma pinça micro. A pele é excisados longitudinalmente desde o pescoço até o focinho. O crânio é cortado longitudinalmente e anteriormente começando na cisterna magna, fazendo um medial e dois cortes laterais (um de cada lado - Figura 2A). Cuidados devem ser tomados para minimizar o contato com o tecido cortical subjacente como os flaps cranial são removidos longe do cérebro.
- Para melhorar a estabilidade do tecido durante o corte vibratome, os aspectos mais lateral do cérebro são removidas por fazer dois cortes sagital. O aspecto caudal do cérebro também é removida, fazendo um corte na base rostral do cerebelo (Figura 2B).
- Os dois hemisférios são separados por fazer um corte liso ao longo da fissura mediana, e os dois hemisférios são cuidadosamente escavado para fora do crânio e colocado, face medial para baixo, em um molde de incorporação (Figs. 2C-D).
Seccionamento do cérebro anfitrião
- Os dois hemisférios nos moldes de incorporação são imediatamente cobertos com derretida 3% baixo ponto de fusão de DNA-grade agarose gel (Fisher, cat # BP1360-100) dissolvido em tampão de tecido de preparação, que é mantida a 37 ° C (veja receitas). Após 2 minutos de estabilização em uma superfície plana horizontal para garantir até mesmo o endurecimento das agarose, os moldes são posicionados no gelo para completar o ajuste.
- Uma vez que o gel contendo os hemisférios é definido, ele é removido do molde e cortado, deixando 2-3mm de gel em torno do tecido cerebral.
- O gel-embedded tecido é então montado no disco exemplar do vibratome, com a superfície medial up, e fixado com cola de cianoacrilato (cola Krazy ou equivalente). Cuidado deve ser tomado para aplicar apenas quantidades mínimas de cola, como muito se ter efeitos tóxicos em fatias e células migratórias. Cola muito nas laterais do bloco também vai impedir o corte, causando danos potenciais no tecido.
- O disco é instalado na bandeja do espécime vibratome cheio de gelada médio de preparação dos tecidos.
- O tecido é seccionada em 150μm de espessura, com a velocidade vibratome definida em um intervalo de baixa a média (vai depender do vibratome utilizado e, portanto, deve ser determinada de forma independente para melhores resultados). Em nossas mãos, a frequência de vibração é ideal quando ajustado no máximo. As fatias primeiras podem ser descartadas.
- Assim que o RMS contendo fatias são liberados a partir da lâmina (o RMS é visível a olho nu como uma estrutura cinza em forma de U que se estende do ZEE para o OB), eles são cuidadosamente brincou fora do molde gel, e scooped usando uma espátula flathead pequeno. As fatias são colocadas na membrana nucleopore dos pratos com fundo de vidro contendo meio de fatia (Figura 3A-B). Um cérebro de camundongo normal pós-natal precoce renderá cerca de 2-3 seções RMS por hemisfério quando cortado a 150 mM. É fundamental que o manuseio das fatias é mantida a um mínimo como eles são muito frágeis. Os pratos com as fatias são então transferidos para uma incubadora.
Cerebral do doadorsecção e RMS transplante
- Cérebros dos doadores (cérebros expressar repórteres fluorescentes na migração neuroblastos) são seccionados a 250μm de espessura e as fatias são coletadas em gelada tampão de preparação dos tecidos.
- Fatias são imediatamente colocadas sob um microscópio de dissecação com capacidade de epifluorescência, eo RMS é suavemente microdissecção, usando uma pinça micro. Um fórceps é usado para estabilizar a fatia, enquanto o outro é usado para fazer pequenos cortes ao redor do RMS até que seja liberada a partir da fatia. O RMS excisadas é então cortada em pequenos explantes (cerca de 200-500 m de diâmetro) antes do transplante.
- Com fundo de vidro pratos contendo fatias anfitrião posicionado sobre os filtros nucleopore são retirados da incubadora e colocado sob o microscópio de dissecação. Usando a luz visível, a RMS está claramente identificado e uma pequena incisão é feita no segmento inicial da RMS.
- Usando um pipetador equipado com uma gorjeta de 20 mL, um único doador RMS explante é transferido para o site incisão na RMS host. O explante é delicadamente empurrado para dentro da incisão para estabelecer contato entre os dois tecidos. Para garantir este contato é estável, os explantes são empurrados um pouco no meio da fatia ea membrana nucleopore.
- Uma vez que todas as fatias de acolhimento com o RMS são transplantadas, os pratos são devolvidos à incubadora por pelo menos uma hora para permitir que as seções para resolver sobre a membrana. Neuroblastos deve começar a migrar do explante no host RMS após cerca de 1-2 horas.
Lapso de tempo de imagem da migração neuronal
- Os pratos com fundo de vidro são transferidos da incubadora para a câmara de incubação no microscópio (Figura 3C). Neuroblastos fluorescentes podem ser visualizados em intervalos que variam de 0 a 10 minutos dependendo do tipo de análise desejada. Por exemplo imagem que a dinâmica do citoesqueleto durante o ciclo migratório de neuroblastos individuais definindo nossa intervalos em menor ou igual a 2,5 minutos. No entanto, a dinâmica populacional, tais como orientação e velocidade de migração são mais capturadas em intervalos que variam de 5 a 10 minutos. A escolha dos objectivos é altamente variável, dependendo da marca do microscópio. Para um microscópio confocal C1 Nikon, descobrimos que a lente 20x seca (Nikon Pan Fluor, NA 0,75, 0,35 milímetro WD) é mais adequado para nossas análises. Para melhores resultados neste sistema confocal, a pinhole é aberto para um tamanho médio (60μm de diâmetro). Para mais adequado comportamento migratório, a imagem está confinada às células profundamente dentro da espessura da RMS, pelo menos 20 mM longe de qualquer uma das superfícies de corte da fatia. Potência do laser deve ser otimizada de modo que é, no mínimo, mas que os detalhes de neuroblastos individuais permanecem visíveis.
- Uma vez que a imagem é completada fatias pode ser corrigido com frio, gelo e preparada de paraformaldeído 4%, imunocoradas, e montados em lâminas para imagens ainda mais. Uma vez que não coat nossas membranas com qualquer substratos aderentes tais como laminina, as fatias de flutuar normalmente a partir da membrana uma vez que estão imersos na buffers coloração. Seções são gravadas, mantendo a sua espessura mM 150. Também é possível criopreservar e congelar as fatias e usar um criostato para obtenção de cortes mais finos das fatias original. No entanto, isso irá resultar em aumento da incidência de artefatos na coloração, bem como alterar a integridade do tecido.
II. Materiais / equipamentos
Preparação de pratos com fundo de vidro para fatias organotípicas
- Seringas pequenas (1 mL)
- 23 gauge-agulhas
- Nucleopore Membrana Track-Etch - 25mm de diâmetro, tamanho dos poros 8.0μm - Whatman, cat # 110614
- Pratos de vidro de fundo Cultura - 35mm petri prato, 14mm Microwell, No. 1,5 lamela - MatTech, cat # P35G-1.5-14-C
- Borracha Cimento - cat Elmer, # E904
- Basal Medium Eagle - Gibco, cat # 21010
- Hepes 1M (pH7.4)
- 1M D-glucose
- CaCl 2 100mM
- MgSO 4 100mM
- 1M NaHCO 3
- dH 2 O
- 200mM L-glutamina
- Penicilina-estreptomicina
Extração de cérebro e incorporação de
- Anestésico (isofluorano, etc)
- Forno de microondas
- Low Melting Agarose - Fisher, cat # BP1360-100
- Krazy cola - cat # KG585
- Peel-A-Way descartáveis Moldes Embedding (R-40) - retangular 22mmx40mm, 20mm de profundidade - Polysciences, cat # 18646C
Seccionamento cérebro e RMS transplante
- Vibratome - Leica VT1000S e todos os componentes de acessórios para a preparação fatia
- Solução Hank 10X de salina balanceada - Gibco, cat # 14185
- Forceps Microdissecting # 5 - Roboz, cat # RS-4976
- Microspatula - Fisher, cat # 21-401-15
- Estereomicroscópio
Lapso de tempo de imagem defatias organotípicas
- Incubadora umidificado, 5% CO 2
- Microscópio invertido equipado com incubadora de câmara e de longa distância objetivos de trabalho (NA de 0,6 ou superior)
III. Receitas
Solução tampão para dissecção de tecidos e preparação fatia (buffer de preparação dos tecidos)
| Solução estoque | Volume | Concetration finais |
| HBSS 10X | 50 mL | 1X |
| Hepes 1M (pH 7,4) | 1,25 mL | 2,5 mm |
| 1M D-Glicose | 15 mL | 30mm |
| CaCl 2 1M | 0,5 mL | 1mM |
| 1M MgSO 4 | 0,5 mL | 1mM |
| 1M NaHCO 3 | 2 mL | 4mM |
| dH 2 O | 430,75 mL |
Filtro de esterilização com um filtro de 0,2 mm e armazenar a 4 ° C.
Meio de cultura para as fatias organotípicas, transplante de tecidos e de imagem (média fatia)
| Solução estoque | Volume | Concentração Final |
| Basal Medium Águia | 35 mL | |
| Buffer de preparação dos tecidos | 12,9 mL | |
| 1M D-Glicose | 1,35 mL | 20mM |
| 200mM L-glutamina | 0,25 mL | 1mM |
| Penicilina-estreptomicina | 0,5 mL | 100units / mL de penicilina e 0,1 mg / mL estreptomicina |
Filtro de esterilização com um filtro de 0,2 mm e armazenar a 4 ° C.
Preparação de baixo ponto de fusão ponto de gel de agarose
Baixo ponto de fusão agarose é diluído em tampão de preparação dos tecidos em 0,3 g / mL em um tubo cônico de 50 mL (veja receitas). O tubo é microwaved em incrementos de 5-10 segundos na potência alta. Número de incrementos depende do volume total; para 10 mL, três incrementos (10-8-5 segundos, cada) deve bastar. A tampa do tubo é cuidadosamente retirado entre os incrementos de aquecimento para liberar a pressão do ar e evitar a explosão do tubo. O cuidado deve ser tomado como o conteúdo do tubo estará muito quente. Uma vez que a agarose é completamente dissolvido, o tubo é mantida em banho-maria a 37 ° C durante pelo menos 5 minutos para permitir que a temperatura se estabilize antes de usar. Exposição prolongada a temperatura ambiente vai endurecer o gel. Embora isso deve ser evitado tanto quanto possível, gel endurecido podem ser reaquecidos e re-derretido para uso imediato no prazo de 24 horas de preparação inicial.
Imunohistoquímica em fatias organotípicas
Seguinte imagem no microscópio confocal, fatias pode ser fixado durante a noite a 4 ° C, com formaldeído 4% em PBS. Seções são então bloqueadas durante a noite a 4 ° C, em soro de cabra 10% com 1% Triton X (Sigma, Cat. # S26-36-23) em PBS seguido de incubação durante a noite com anticorpos primários, a 4 ° C. Anticorpos de cabra-fluorescente etiquetados secundárias são utilizadas para a visualização (todos 1:1000 diluída, 1 de incubação horas à temperatura ambiente). Fatias rotulados são muito bem lavados 5-6 vezes com PBS gelado antes da montagem em lâminas de vidro e lamínulas.
IV. Resultados representante
Nosso protocolo cultura organotípicas fatia foi exaustivamente testado e otimizado ao longo desse últimos anos para a consistência no padrão de migração e orientação. Análise de células de emigrar a partir de explantes obtidos de camundongos no qual a expressão da proteína fluorescente vermelha, Td-tomate, é induzido sob o promotor nestina (nestina-Td de tomate), revela a migração altamente orientado e rápida de tdTomato + neuroblastos no host RMS ( Figura 4A). De alta ampliação análise tempo-lapso ilustra excelente resolução de todo o comprimento de uma migração de neuroblastos durante uma sessão de imagem de 20 minutos (Figura 4B).
Fatias com doador Td-tomate + as células foram fixadas e histoquímica para diferentes componentes celulares dentro da RMS. GFAP + astrócitos e vasos sanguíneos CD31 + foram revelados usando imunohistoquímica fluorescente (Figura 5A). De alta ampliação análise de fatias coradas para os filamentos de actina e tubulina proteínas do citoesqueleto revelam não-uniforme expressão destes componentes por uma célula no meio da migração (Figura 5B).
Anticorpos utilizados emestes exemplos: coelho anti-RFP (Abcam, 1:250), de coelho anti-GFAP (Dako, 1:1000), rato anti-CD31 (BD Pharmigen, 1:100), mouse anti-actina (Santa Cruz, 1: 500), de coelho anti-tubulina (Sigma, 1:1000), cabra anti-camundongo Cy3 (Chemicon, 1:1000), de cabra anti-coelho AlexaFluor 647 (Invitrogen, 1:1000), de cabra anti-rato AlexaFluor 488 (Invitrogen , 1:1000), de cabra anti-coelho AlexaFluor 488 (Invitrogen, 1:1000).
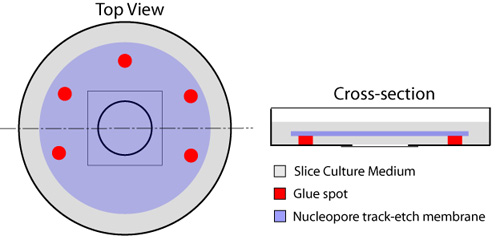
Figura 1. Preparação de pratos com fundo de vidro para fatias organotípicas. Spots Múltiplos de cola são colocados ao redor do componente com fundo de vidro circular do prato (vermelho), deixando um lado aberto para a troca do meio da parte de baixo do filtro. A queda de 150μL de meio de fatia é colocada no centro da lamela de vidro. Uma membrana nucleopore (azul) é então aplicada, com o lado brilhante para baixo, garantindo que nenhuma bolha de ar estão presos entre as lamelas de vidro e da membrana. Um mililitro de meio de fatia (cinza) é espalhado em cima da membrana, e os pratos são incubados a 37 ° C antes do uso.
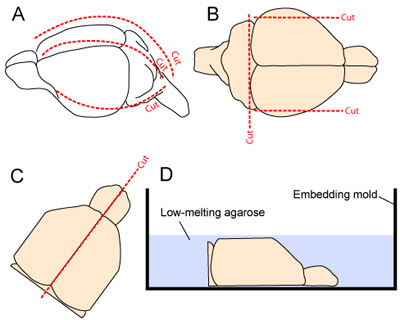
Figura 2. Extração de cérebro e preparação para a corte. (A) O crânio é exposta por incisão no couro cabeludo do pescoço até o focinho (linha pontilhada ao longo da linha média). O crânio é então cortado longitudinalmente e anteriormente começando na cisterna magna, fazendo um medial e dois cortes laterais (um de cada lado; 2A). (B) Os aspectos mais lateral do córtex e do aspecto caudal do SNC são ressecado para melhorar a estabilidade do tecido durante o corte vibratome. (CD) Os dois hemisférios são então separadas e colocadas face medial para baixo em um molde de incorporação antes da aplicação de 3% gel agarose dissolvida em tampão de preparação dos tecidos.
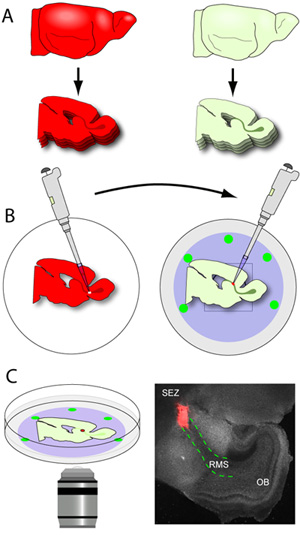
Figura 3. Seccionamento cérebro e cruz-transplante. (A) O tecido do hospedeiro é seccionada em 150μm de espessura, e as seções contendo RMS são cuidadosamente posicionados flat na membrana nucleopore de frio com fundo de vidro pratos. (B) cérebros de Doadores (cérebros expressar repórteres fluorescentes na RMS) são seccionados em 250μm de espessura e as fatias são coletadas em gelada tampão de preparação dos tecidos. O RMS doador é microdissecção e corte em pequenos explantes. Usando um pipetador equipado com uma gorjeta de 20 mL, explantes individuais RMS são transferidos para um local de incisão no hospedeiro RMS. (C) Depois de 1-2 horas de incubação, os pratos são transferidos para um estágio incubadas em um microscópio confocal e migração é capturado usando lapso de tempo de imagem. A fotomicrografia é uma imagem de ampliação de baixa representante de uma fatia típico (cinza) configurar uma hora após o transplante (vermelho explante de tdTomato + RMS de um camundongo doador; vermelho esboço linhas pontilhadas o RMS na fatia host).
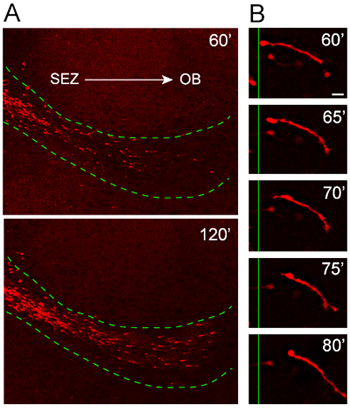
Figura 4. Migração de neuroblastos a partir de explantes na RMS host. (A) nestina-tdTomato + neuroblastos (vermelho) migrar de explantes para o host RMS (linha verde pontilhada) uma hora após o transplante. tdTomato + células invadindo o RMS do hospedeiro fatias organotípicas move de uma forma altamente orientado e rápida de distância do ZEE e para o OB. (B) O ciclo migratório pode ser observado na alta potência lapso de tempo imagens de um neuroblastos durante aproximadamente um período de 20 minutos. Barra de escala = 10 mM.
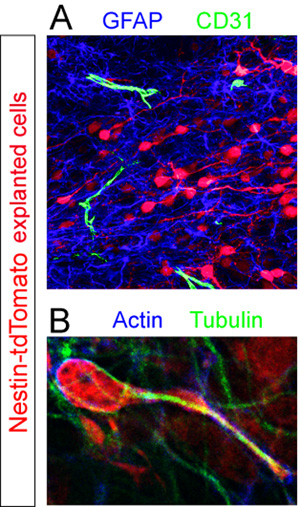
Figura 5. Avaliação imunohistoquímica de fatias organotípicas. Neuroblastos explantado (vermelho) foram fixados no meio da migração 12 horas pós-transplante. (A) coloração imuno-histoquímica fluorescente da fatia revela um conjunto denso de GFAP + astrócitos (azul) e espalhadas CD31 + vasos sanguíneos (verde) dentro do RMS da fatia de host. (B) O citoesqueleto de uma célula tdTomato isolado + migrando (vermelho) em um hospedeiro RMS é revelada por co-imunomarcação utilizando anticorpos contra actina (azul) e tubulina (verde).
Discussão
Migração neuronal na RMS é um componente essencial da neurogênese pós-natal no bulbo olfatório 1. Migração através do RMS ocorre em um plano tangente à superfície do cérebro. Neuroblastos tangencialmente migração são distintas das células migram radialmente com base na localização de sua fonte progenitor, bem como o destino divergentes de seus produtos finais neuronal 1, 2, 3. A população relativamente pura de células tangencialmente migrando na RMS pós-natal torna esta regiã...
Divulgações
Agradecimentos
Agradecemos a Dan McWhorter para narrar o protocolo no vídeo. Este trabalho é suportado pelo NIH Grant 5R01NS062182, uma doação da Federação Americana de Investigação em Envelhecimento e fundos institucionais concedido a HTG.
Referências
- Ghashghaei, H. T., Lai, C., Anton, E. S. Neuronal migration in the adult brain: are we there yet. Nat. Rev. Neurosci. 8, 141-151 (2007).
- Valiente, M., Marin, O. Neuronal migration mechanisms in development and disease. Curr. Opin. Neurobiol. 20, 68-78 (2010).
- Rakic, P. Evolution of the neocortex: a perspective from developmental biology. Nat. Rev. Neurosci. 10, 724-735 (2009).
- Jaglin, X. H., Chelly, J. Tubulin-related cortical dysgeneses: microtubule dysfunction underlying neuronal migration defects. Trends Genet. 25, 555-566 (2009).
- Carro, M. S. The transcriptional network for mesenchymal transformation of brain tumours. Nature. 463, 318-325 (2010).
- Wu, W. Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature. 400, 331-336 (1999).
- Hu, H., Tomasiewicz, H., Magnuson, T., Rutishauser, U., U, . The role of polysialic acid in migration of olfactory bulb interneuron precursors in the subventricular zone. Neuron. 16, 735-743 (1996).
- Shapiro, E. M., Gonzalez-Perez, O., Garcia-Verdugo, M. a. n. u. e. l., Alvarez-Buylla, J., &, A., Koretsky, A. P. Magnetic resonance imaging of the migration of neuronal precursors generated in the adult rodent brain. Neuroimage. , (2006).
- Vreys, R. MRI visualization of endogenous neural progenitor cell migration along the RMS in the adult mouse brain: validation of various MPIO labeling strategies. Neuroimage. 49, 2094-2103 (2010).
- Davenne, M., Custody, C., Charneau, P., Lledo, P. M. In vivo imaging of migrating neurons in the mammalian forebrain. Chem. Senses. 30, 115-116 (2005).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal. J. Vis. Exp. , (2010).
- Shen, Q. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3, 289-300 (2008).
- Tavazoie, M. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3, 279-288 (2008).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural Stem Cells Confer Unique Pinwheel Architecture to the Ventricular Surface in Neurogenic Regions of the Adult Brain. Cell Stem Cell. 3, 265-278 (2008).
- Polleux, F. &. a. m. p. ;. a. m. p., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. , L9-L9 (2002).
- Murase, S. &. a. m. p. ;. a. m. p., Horwitz, A. F. Deleted in colorectal carcinoma and differentially expressed integrins mediate the directional migration of neural precursors in the rostral migratory stream. J. Neurosci. 22, 3568-3579 (2002).
- Suzuki, S. O. &. a. m. p. ;. a. m. p., Goldman, J. E. Multiple cell populations in the early postnatal subventricular zone take distinct migratory pathways: a dynamic study of glial and neuronal progenitor migration. J. Neurosci. 23, 4240-4250 (2003).
- Ghashghaei, H. T. The role of neuregulin-ErbB4 interactions on the proliferation and organization of cells in the subventricular zone. Proc. Natl. Acad. Sci. U. S. A. 103, 1930-1935 (2006).
- Khodosevich, K., Seeburg, P. H., Monyer, H. Major signaling pathways in migrating neuroblasts. Front Mol. Neurosci. 2, 7-7 (2009).
- Jacquet, B. V. Analysis of neuronal proliferation, migration and differentiation in the postnatal brain using equine infectious anemia virus-based lentiviral vectors. Gene Ther. 16, 1021-1033 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados