A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
العزلة وثقافة الكبار الخلايا الجذعية الظهارية من الجلد البشري
In This Article
Summary
ووصف سريع ، طريقة سليمة قابلة للاستمرار في عزل الخلايا الجذعية البالغة الظهارية من الجلد البشري. الأسلوب يستخدم الهضم الأنزيمي مصفوفة الكولاجين الجلد ، تليها نتف من بصيلات الشعر وعزلة تعليق خلية واحدة أو شظايا الأنسجة للثقافة الخلية.
Abstract
والتوازن لجميع الأنسجة ذاتي يعتمد على تجديد الخلايا الجذعية للبالغين. والخلايا الجذعية غير المتمايزة الخضوع الانقسامات غير المتماثلة ، وأنها تولد الخلايا الوليدة التي تحتفظ النمط الظاهري الخلايا الجذعية والعبور تضخيم الخلايا (خلايا TA) التي تهاجر من جذع الخلية المتخصصة ، والخضوع الانتشار السريع والتفريق الميئوس من اعد اسكان الأنسجة.
تم التعرف على الخلايا الجذعية الظهارية في البشرة ، بصيلات الشعر ، والأمعاء والخلايا مع ارتفاع محتمل في المختبر والتكاثري وبطيئة الدراجات التسمية الاحتفاظ الخلايا في الجسم الحي 1-3. الكبار ، وأنسجة الخلايا الجذعية الخاصة هي المسؤولة عن تجديد الأنسجة التي يقيمون فيها أثناء دوران فيزيولوجية طبيعية ، وكذلك اثناء اوقات التوتر 4-5. علاوة على ذلك ، تعتبر عموما لتكون الخلايا الجذعية متعددة قوية ، تمتلك القدرة على أن تؤدي إلى أنواع خلايا متعددة داخل النسيج 6. على سبيل المثال ، يمكن للخلايا الجذعية القوارض جريب الشعرة توليد البشرة والغدد الدهنية وبصيلات الشعر 7-9. لقد أظهرنا أن الخلايا الجذعية من منطقة جريب شعرة الإنسان انتفاخ يحمل امكانيات متعددة 10.
أصبحت الخلايا الجذعية أداة قيمة في مجال البحوث الطبية الحيوية ، ونظرا لفائدتها في النظام باعتباره المختبر لدراسة البيولوجيا التطورية ، والتمايز ، وتكون الأورام لفائدتها العلاجية الممكنة. فمن المرجح أن الكبار الخلايا الجذعية الظهارية مفيدا في علاج أمراض مثل خلل التنسج الأدمة ، monilethrix ، متلازمة Netherton والمرض مينكيس ، وانحلال البشرة الفقاعي الوراثي alopecias 11-13. بالإضافة إلى ذلك ، فإن مشاكل الجلد الأخرى مثل حروق والجروح والقروح المزمنة الاستفادة من الخلايا الجذعية المتعلقة العلاجات 14،15. نظرا لإمكانية إعادة برمجة خلايا بالغة الى دولة ذات قوة تناسلية متعددة (خلايا الجذع) 16،17 ، قد الجذعية البالغة في متناول الجميع وتوسيع الخلايا في الجلد البشري توفر مصدرا قيما للخلايا لتحريض المصب والعلاج لمجموعة واسعة من الأمراض بما في ذلك مرض السكري ومرض باركنسون.
Protocol
1. استخراج الخلايا الجذعية الظهارية من الجلد البشري
- قبل البدء في إجراءات عزل الخلايا الجذعية الظهارية واحد يحتاج إلى تحضير سائل الإعلام المعنية والكواشف (انظر table1).
- ويتم جمع الطازجة الجلد الكبار فروة الرأس البشري من إجراءات عملية شد وجه لكمة أو خزعة ، ثم في احتضان FBS DMEM / 10 ٪ / Dispase (4 ملغ / مل) بين عشية وضحاها في 4 درجات مئوية. الحضانة لمدة 2-4 ساعة عند 37 درجة مئوية وهي فعالة أيضا. وينبغي أن تكون قطعة الجلد وأقصى عرض لها 1 سم للسماح للانزيم لاختراق.
- نقل الجلد إلى طبق بتري معقمة ، سحب قبالة كل الشعر من الجلد عن طريق استيعاب رمح الشعر بالقرب من سطح الجلد وسحب بقوة وسلاسة. حدد بصيلات تساقط الشعر في مرحلة التشكل استنادا تحت المجهر تشريح ، وقطع من انتفاخ المنطقة (الشكل 1A) بصيلات نقل في أنبوب 15 مل تعقيمها. ويمكن أيضا أن تستخدم بصيلات طور التنامي إذا ما خفضت العليا في 1 / 3 من جراب للحصول على بصيلات الشعر "انتفاخ" منطقة (1B الشكل).
- احتضان شظايا جريب معزولة في خليط من 0.05 ٪ التربسين - EDTA (GIBCO) وVersene (0.53 ملي EDTA 4NA ، GIBCO) (1:1) ل15-20 دقيقة في درجة حرارة الغرفة مع اهتزاز بشكل دوري ، إضافة 4 مل + 10 DMEM FBS ٪ لوقف رد الفعل ، وتدور باستمرار لمدة 5 دقائق عند 800 دورة في الدقيقة. بدلا من ذلك ، يمكن وضع قطعة من نسيج explants جريب في الثقافة دون هضم التربسين إلى خلايا بصيلات من ثقافة واحدة.
- تجاهل طاف بعناية (0،2-0،5 مل حفظ ~ لتجنب فقدان الخلايا) في مناجم كونكولا للنحاس ومل 1 (خلية كيراتينية المتوسطة) ، دون إعادة EGF تعليق.
2. الثقافة الابتدائية الخلايا الجذعية الظهارية
- قبل زرع الخلايا الجذعية الظهارية ، mitomycin C - تعامل ينبغي إعداد 3T3 - J2 الخلايا (الخلايا المغذية) على النحو التالي. يتم استزراع خلايا 3T3 - J2 في DMEM FBS مع 10 ٪ قبل بدء العلاج. إزالة وسائل الاعلام استنبات الخلايا ويغسل مرتين مع برنامج تلفزيوني ، وعلاج الخلايا مع C mitomycin 15μg / مل في DMEM دون المصل لمدة 2 ساعة على 37 درجة مئوية ، 5 ٪ CO 2. إزالة mitomycin C المحتوية DMEM ويغسل مرتين مع برنامج تلفزيوني ، أن الخلايا جاهزة للاستخدام. (C - Mitomycin المعالجة يمكن أيضا 3T3 - J2 الخلايا تكون معدة مسبقا وتخزينها على -80 درجة مئوية ذوبان والبذور الخلايا الأولية قبل يوم واحد زراعة الخلايا الجذعية الظهارية ، احتضان عند 37 درجة مئوية ، 5 ٪ CO 2. 150،000-200،000 ينصح 3T3 - J2 الخلايا لكل بئر من لوحة 6 - جيدا.
- البذور جراب الشعرة الخلايا الجذعية المعزولة من الخطوة 1.5 على mitomycin C - تعامل 3T3 - J2 الخلايا في مناجم كونكولا للنحاس بين عشية وضحاها دون EGF عند 37 درجة مئوية ، 5 ٪ CO 2 ، وتغيير لEGF التي تحتوي على مناجم كونكولا للنحاس في اليوم التالي. تزرع الخلايا عند 37 درجة مئوية في جو رطب تحتوي على 5 ٪ CO 2. ويتم تغذية الخلايا القرنية مع كل مناجم كونكولا للنحاس تحتوي EGF كل يوم (2) ونمت عن 14-20 يوما. فحص الخلايا كل يوم تحت المجهر. والخلايا الجذعية بصيلات الشعر شكل مستعمرات (الشكل 2A). سوف explants بصيلات الشعر شكل الامتداد بعد 10-14 يوما (الشكل 2B).
3. الخلايا الجذعية الظهارية مرور
- غسل الخلايا مع برنامج تلفزيوني واحد. إزالة الخلايا المغذية 3T3 - J2 من العلاج (قبل استعد لRT) Versene. احتضان الثقافة وزعته في Versene لمدة 5 دقائق ، ثم يهز بلطف ونضح خارج الخلايا المغذية.
- غسل الخلايا الجذعية بصيلات الشعر إما مع أو Versene PBS وقت واحد.
- إضافة استعد مسبقا (إلى 37 درجة مئوية ، الحرجة) التربسين - EDTA (2X) ، واحتضان عند 37 درجة مئوية لمدة 7 دقائق أو أكثر إذا لزم الأمر لبصيلات الشعر الخلايا الجذعية لفصل. لم يعد من 15 دقيقة هي الأفضل.
- إضافة مناجم كونكولا للنحاس ث / س EGF لوقف التربسين ، ماصة بلطف صعودا ونزولا لتفريق الخلايا ، وتدور في أسفل 200G ، 5 دقائق.
- اعادة تعليق الخلايا مع مناجم كونكولا للنحاس من دون إحصاء ، وإعادة لوحة EGF - C على معاملة mitomycin طبقة خلايا 3T3 - J2.
4. خلد الخلايا الجذعية الظهارية
الخلايا الأولية ، والخلايا الجذعية للبالغين حتى تصل إلى الشيخوخة بعد مرور أشهر في المسلسل والثقافة. تخليد الخلايا الجذعية الأساسي هو وسيلة فعالة لتخفيف هذه المشكلة.
- لوحة الأولية الخلايا الجذعية الظهارية (~ 350000 خلية / 6 وحة جيدا أيضا) في ممر 1 على طبقة المغذية (3T3 - J2) والثقافة لمدة 2 ايام.
- ثقافة PA317 LXSN خط الخلية 16E6E7 بعد يوم واحد زرع الخلايا الجذعية الأولية الظهارية مع DMEM تحتوي على 10 ٪ FBS. (هذا الخط ينتج LXSN16E6E7 الارتجاعي amphotropic التي بترميز HPV16 E6 E7 وفتح إطارات القراءة ، والتي يمكن استخدامها لنقل العدوى ستابلي وخلد العديد من أنواع الخلايا).
- علاج PA317 LXSN خط الخلية 16E6E7 مع C mitomycin لمدة 2 ساعة (البروتوكول نفسه مع خلايا 3T3 - J2). إضافة mitomycin C تعامل PA317 LXSN 16E6E7 خط الخلية إلى الخلايا الجذعية الظهارية الابتدائي ، وشارك في الثقافة لمدة 6 أيام في مناجم كونكولا للنحاس مع EGF. تجديد مناجم كونكولا للنحاس جديدة مع وسائل الاعلام كل يوم 2 EGF.
- إزالة 3T3 - J2 وPA317 LXSN 16E6E7 زنزانة مع Versene. إضافة mitomycin - C تعامل الخلايا NHP 3T3 - J2 (النيوميسين ، هيغروميسين ، بوروميسين مقاومة ، ~ 200000 خلايا لكل بئر) إلى الخلايا الجذعية الظهارية. ويتم اختيار الخلايا تحت 0.2 ملغ / مل من G418 (Gibco) لإضافةitional 6 أيام. تجديد الطازجة التي تحتوي على مناجم كونكولا للنحاس G418 EGF مع وسائل الاعلام كل يوم 2.
وسيتم قيد الحياة خلدت الخلايا الجذعية الخلايا الجذعية الظهارية. وينبغي وضع جيد من التعليم الابتدائي الخلايا الجذعية الظهارية التي لا تشارك في تربيتها مع PA317 الخلية 16E6E7 LXSN كعنصر تحكم لاختيار G418 ، يجب قتل جميع الخلايا في هذه البئر التي G418 بعد 6 أيام من التحديد.
5. ممثل النتائج
مرور وقت مبكر من خلايا الجلد الجذعية الظهارية وخلدت الخلايا الجذعية الظهارية شكل مستعمرات ضيقة تتكون من الخلايا القرنية الصغيرة (الشكل 2A) محاطة الخلايا المغذية. إذا كان المثقف في وسائل الاعلام الحرة في المصل مع ملاحق محددة ، من دون طبقة وحدة التغذية ، فإن الخلايا الجذعية لا تفريق وشكل مستعمرات ضيقة (كما أنها تنمو الخلايا واحد ومجموعات صغيرة). خلدت الخلايا الجذعية الظهارية الحفاظ على النمط الظاهري مستقرة لمدة 12 شهرا> للمرور مستمرة ، ولكن تميل إلى شكل أكثر إحكاما من مستعمرات الخلايا الأولية. وهم لا يشكلون المستعمرات مرسى مستقلة في المقايسات آغار ميسرة ، مشيرا إلى أن هذه الخلايا خلد لا تملك خصائص الخلايا السرطانية. في المرحلتين الابتدائية وخلدت الخلايا الجذعية الظهارية الشعر تعبير عن الخلايا الجذعية علامة جريب cytokeratin 15 (الشكل 3A) ، وقادرة على التمايز إلى البشرة بصيلات الشعر ، والأنساب الزهمية (الشكل 3B - D).
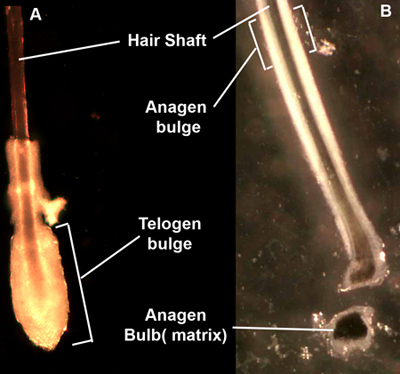
التقطه الشكل 1. الشعر. بعد نتف من dispase معاملة الجلد وبصيلات الشعر تظهر إما نادي الشعر تساقط الشعر (A) مع كرة من الخلايا المحيطة الجزء السفلي من الشعر ، أو الشعر طور التنامي (B) مع الأكمام من ظهارة المحيطة طول الشعر. انتفاخ في منطقة الطور الانتهائي أشكال منطقة متميزة المورفولوجي لتشريح الدقيقة ، في حين أن انتفاخ طور التنامي أقل مميزة. لمبة طور التنامي يحتوي الكيراتينية مصفوفة ، تمثل العبور تضخيم الخلايا التي يمكن أيضا أن تكون معزولة والمثقفين.
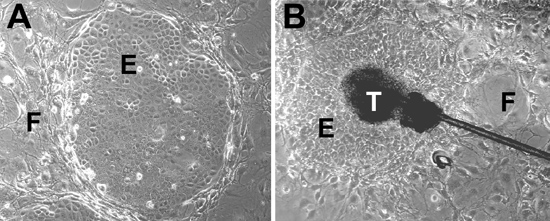
الشكل 2. خلايا الجذعية الثقافات. (أ) الخلايا الجذعية الظهارية من الجلد شكل مستعمرات الظهارية ضيقة (تسميهم E) عند تربيتها في مناجم كونكولا للنحاس مع طبقة من الخلايا المغذية (تسميهم F). (ب) explants بصيلات الشعر تؤدي إلى الامتداد الظهارية. ويرد في المنطقة انتفاخ تساقط الشعر (الذين تسميهم تي) إلى صحن وتحيط الخلية الظهارية مستعمرة مع الخلايا المغذية.
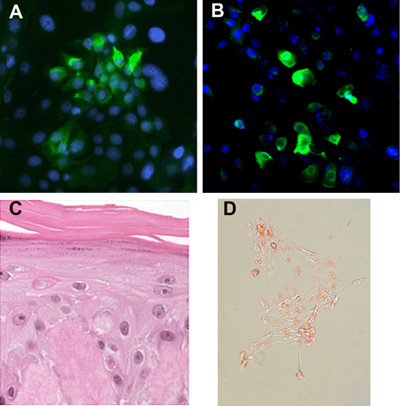
الشكل 3. تمايز الخلايا الجذعية. (أ) الحفاظ على مستعمرات الخلايا الجذعية من علامات التعبير الظهارية مثل cytokeratin 15. (ب) يمكن أن تكون متمايزة خلايا الجلد الجذعية الظهارية على طول الشعر المسام النسب على النحو الذي يحدده K6Hf التعبير. يمكن (C) تكون هذه الخلايا المستزرعة في دي epidermalized الأدمة أو المصفوفات الأخرى في واجهة الهواء السائل ، وسوف تشكل طبقات مع طبقة البشرة متقرن ، الطبقة الحبيبية والطبقة الشائكة. يمكن (D) تكون الخلايا الجذعية المستحثة على طول نسب الزهمية مع الكريات الحمراء النفط إيجابية.
Discussion
الخلية استخراج والثقافة الأساليب المذكورة هي سهلة وقابلة للتكرار من المستغرب. لقد ولدت لنا الثقافات طلائي الخلايا الجذعية من عشرات من الأفراد عبر طائفة واسعة العمرية ، بما في ذلك المرضى الذين يعانون من عيوب البشرة ورثت 18. فمن الأفضل أن تبدأ العملية في يوم الحص?...
Disclosures
Acknowledgements
ويتم تمويل هذا العمل من قبل المعاهد الوطنية للصحة / NCI منح R01CA - 118916
Materials
خلية كيراتينية سائل الإعلام (مناجم كونكولا للنحاس)
[DMEM ولحم الخنزير ليالي F12 (GIBCO ، 3:1) ، الأدينين (سيغما ، 180 ملم) ، و 10 ٪ الجنين مصل الأبقار (GIBCO) والكوليرا توكسين (ICN ، 0.1 نانومتر) ، البنسلين / الستربتوميسين (GIBCO ، 100 U / مل و 100 ملغم / لتر ، على التوالي) ، هيدروكورتيزون (سيغما ، 0.4 ملغ / مل ، و 1.1 ملم) ، T/T3 (ترانسفيرين ، GIBCO ، 5 ميكروغرام / مل ، 649 نانومتر ؛ وtriiodo - L ثيرونين ، سيغما ، 2 نانومتر) والأنسولين (سيغما ، 5 ملغ / مل و 862 نانومتر) ، وEGF (سيغما ، 10 نانوغرام / مل و 1.6 نانومتر) ، ودرجة الحموضة 7.2]
References
- Jones, P. H., Watt, F. M. Separation of human epidermal stem cells from transit amplifying cells on the basis of differences in integrin function and expression. Cell. 73, 713-724 (1993).
- Lyle, S., Christofidou-Solomidou, M., Liu, Y., Elder, D. E., Albelda, S., Cotsarelis, G. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J. Cell. Sci. 111, 3179-3188 (1998).
- Bac, S. P., Reneha, A. G., Potte, C. S. Stem cells: the intestinal stem cell as a paradigm. Carcinogenesis. 21, 469-476 (2000).
- Slac, J. M. Stem cells in epithelial tissues. Science. 287, 1431-1433 (2000).
- It, M., Li, Y., Yan, Z., Nguye, J., Lian, F., Morri, R. J., Cotsarelis, G. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-134 (2005).
- Spradlin, A., Drummond-Barbos, D., Kai, T. Stem cells find their niche. Nature. 414, 98-104 (2001).
- Taylo, G., Lehre, M. S., Jense, P. J., Su, T. T., Lavke, R. M. Involvement of follicular stem cells in forming not only the follicle but also the epidermis. Cell. 102, 451-461 (2000).
- Oshim, H., Rocha, A., Kedzi, C., Kobayash, K., Barrandon, Y. Morphogenesis and renewal of hair follicles from adult multipotent stem cells. Cell. 104, 233-245 (2001).
- Morri, R. J., Li, Y., Marle, L., Yan, Z., Trempu, C., L, S., Li, J. S., Sawick, J. A. Cotsarelis G Capturing and profiling adult hair follicle stem cells. Nat. Biotechnol. 22, 411-417 (2004).
- Ro, C., Roch, M., Gu, Z., Photopoulo, C., Ta, Q., Lyle, S. Multi-potentiality of a new immortalized epithelial stem cell line derived from human hair follicles. In vitro Cell. & Dev. Biol. 44, 236-244 (2008).
- Ohyama, M., Vogel, J. C. G. e. n. e. delivery to the hair follicle. J Investig Dermatol Symp Proc. 8, 204-206 (2003).
- Sugiyama-Nakagiri, Y., Akiyama, M., Shimizu, H. Hair follicle stem cell-targeted gene transfer and reconstitution system. Gene Ther. 13, 732-737 (2006).
- Stenn, K. S., Cotsarelis, G. Bioengineering the hair follicle: fringe benefits of stem cell technology. Curr Opin Biotechnol. 16, 493-497 (2005).
- Hoeller, D. An improved and rapid method to construct skin equivalents from human hair follicles and fibroblasts. Exp Dermatol 10. , 264-271 (2001).
- Navsaria, H. A., Ojeh, N. O., Moiemen, N., Griffiths, M. A., Frame, J. D. Reepithelialization of a full-thickness burn from stem cells of hair follicles micrografted into a tissue-engineered dermal template (Integra). Plast Reconstr Surg. 113, 978-981 (2004).
- Werni, M., Meissne, A., Forema, R., Brambrin, T., K, M., Hochedlinge, K., Bernstei, B. E., Jaenisch, R. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448, 318-324 (2007).
- Par, I. H., Zha, R., Wes, J. A., Yabuuch, A., Hu, H., Inc, T. A., Lero, P. H., Lensc, M. W., Dale, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Kazantsev, A., Goltso, A., Zinchenk, R., Grigorenk, A. P., Abrukov, A. V., Moliak, Y. K., Kirillo, A. G., Gu, Z., Lyl, S., Ginte, E. K., Rogae, E. I. Human hair growth deficiency is linked to a genetic defect in the phospholipase gene LIPH. Science. 314, 982-985 (2006).
- Tola, J., Ishida-Yamamot, A., Riddl, M., McElmurr, R. T., Osbor, M., Xi, L., Lun, T., Slatter, C., Uitt, J., Christian, A. M., Wagne, J. E., Blaza, B. R. Amelioration of epidermolysis bullosa by transfer of wild-type bone marrow cells. Blood. 113, 1167-1174 (2009).
- Wagne, J. E., Ishida-Yamamot, A., McGrat, J. A., Hordinsk, M., Keen, D. R., Riddl, M. J., Osbor, M. J., Lun, T., Dola, M., Blaza, B. R., Tolar, J. Bone marrow transplantation for recessive dystrophic epidermolysis bullosa. N Engl J Med. 363, 629-639 (2010).
- Muraue, E. M., Gach, Y., Grat, I. K., Klausegge, A., Mus, W., Grube, C., Meneguzz, G., Hintne, H., Baue, J. W. Functional Correction of Type VII Collagen Expression in Dystrophic Epidermolysis Bullosa. J Invest Dermatol. , (2010).
- Y, H., Kuma, S. M., Kossenko, A. V., Show, L., X, X. Stem cells with neural crest characteristics derived from the bulge region of cultured human hair follicles. J Invest Dermatol. 130, 1227-1236 (2010).
- Nishimur, E. K., Grante, S. R., Fishe, D. E. Mechanisms of hair graying: incomplete melanocyte stem cell maintenance in the niche. Science. 307, 720-724 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved