Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento y cultivo de células madre adultas epiteliales de la piel humana
En este artículo
Resumen
Una forma rápida y robusta de aislar células viables de adultos epiteliales madre de la piel humana se describe. El método utiliza la digestión enzimática de la matriz de colágeno la piel, seguido por el punteo de los folículos pilosos y el aislamiento de las suspensiones de células individuales o fragmentos de tejido para el cultivo celular.
Resumen
La homeostasis de los tejidos de auto-renovación depende de las células madre adultas. Como células madre indiferenciadas sufren divisiones asimétricas, que generan las células hijas que mantienen el fenotipo de células madre y la amplificación de tránsito de las células (células TA), que migran desde el nicho de células madre, se someten a la rápida proliferación y diferenciación terminal para repoblar el tejido.
Las células epiteliales madre han sido identificados en la epidermis, folículos pilosos, y en el intestino como las células con un alto potencial de proliferación in vitro y como lento en bicicleta etiqueta de retención de las células in vivo 1-3. Adulto, el tejido de células madre específicas son responsables de la regeneración de los tejidos en los que residen durante el recambio fisiológico normal, así como en momentos de estrés 4-5. Por otra parte, las células madre son generalmente considerados como multi-potentes, que poseen la capacidad de dar lugar a múltiples tipos de células dentro del tejido 6. Por ejemplo, los roedores células madre del folículo del pelo puede generar epidermis, glándulas sebáceas y los folículos pilosos 7-9. Hemos demostrado que las células madre de la región de bulto del pelo humano folículo exhibición multi-potencialidad 10.
Las células madre se han convertido en una herramienta valiosa en la investigación biomédica, debido a su utilidad como un sistema in vitro para el estudio de la biología del desarrollo, la diferenciación, la tumorogénesis y por su posible utilidad terapéutica. Es probable que las células madre adultas del epitelio será útil en el tratamiento de enfermedades como la displasia ectodérmica, monilethrix, el síndrome de Netherton, la enfermedad de Menkes, la epidermólisis bullosa hereditaria y alopecias 11-13. Además, otros problemas de piel como quemaduras, heridas crónicas y úlceras se beneficiarán de las terapias con células madre 14,15. Dado el potencial para la reprogramación de células adultas en un estado pluripotente (células iPS) 16,17, las células adultas de fácil acceso y ampliable madre en la piel humana puede proporcionar una valiosa fuente de células para la inducción y la terapia posterior para una amplia gama de enfermedades, incluyendo la diabetes y la enfermedad de Parkinson.
Protocolo
1. Extracto de las células epiteliales madre de piel humana
- Antes de iniciar el procedimiento de aislamiento de las células epiteliales del tallo que se necesita para preparar los medios respectivos y los reactivos (ver tabla 1).
- Piel fresca humano adulto cuero cabelludo de los procedimientos de cirugía estética o biopsia por punción se recoge, a continuación, se incuban en FBS DMEM / 10% / Dispasa (4 mg / mL) durante la noche a 4 ° C. Incubación de 2-4 horas a 37 ° C también es efectiva. Trozos de piel debe tener un ancho máximo de 1 cm para permitir la enzima de penetrar.
- Transferencia de la piel en una placa de Petri esterilizadas, saque cada pelo de la piel, sujetando el tallo del pelo cerca de la superficie de la piel y tirando con firmeza y sin problemas. Seleccione los folículos en la fase de telogen en función de su morfología bajo un microscopio de disección, corte de la región bulto (Figura 1) la transferencia de los folículos en un tubo de 15 ml esterilizados. Folículos anágena también se puede utilizar si se corta en 1 / 3 superior del folículo para obtener folículo piloso "bulto" región (fig. 1B).
- Incubar los fragmentos aislados del folículo en una mezcla de 0,05% de tripsina-EDTA (GIBCO) y Versene (0,53 mM EDTA 4NA, GIBCO) (1:1) durante 15-20 minutos a temperatura ambiente con agitación periódica, añadir 4 ml de DMEM + 10 % de SFB para detener la reacción, la desaceleración durante 5 minutos a 800 rpm. Por otra parte, el folículo explantes fragmento de tejido se pueden colocar en la cultura sin la tripsina digerir para cultivar células de los folículos individuales.
- Desechar el sobrenadante con cuidado (~ 0.2-0.5 mL ahorrar para evitar la pérdida de las células) y vuelva a suspender en 1 ml de KCM (medio de queratinocitos), sin FEAG.
2. La cultura primaria de las células madre epiteliales
- Antes de que el cultivo de células madre epiteliales, la mitomicina C tratados con células 3T3-J2 (células alimentadoras) se deben preparar de la siguiente manera. 3T3-J2 células se cultivaron en DMEM con FBS al 10% antes del tratamiento. Retire el medio de cultivo de células y lavar dos veces con PBS, el tratamiento de células con 15μg / ml de mitomicina C en DMEM sin suero durante 2 horas a 37 ° C, 5% de CO 2. Retire la mitomicina C que contienen DMEM y lavar dos veces con PBS, las células están listas para usar. (Mitomicina C tratados con células 3T3-J2 también se puede preparar previamente y almacenadas a -80 ° C. Descongelar y semillas de las células de un día antes de cultivo de células madre epiteliales primarias, se incuba a 37 ° C, 5% de CO 2. 150.000-200.000 3T3-J2 células por pocillo de la placa de 6 pocillos se recomienda.
- Semilla del folículo del pelo aislado células madre a partir del paso de 1,5 sobre la mitomicina C tratados con células 3T3-J2 en KCM sin noche a la mañana a 37 del FEAG ° C, 5% de CO 2, cambió a EGF contienen KCM al día siguiente. Las células se cultivan a 37 ° C en una atmósfera húmeda con 5% de CO 2. Todos los queratinocitos son alimentados con KCM contiene FEAG cada 2 días y se cultivan durante 14-20 días. Compruebe celular todos los días bajo el microscopio. Células madre del folículo del pelo se forman colonias (Figura 2A). Explantes del folículo del pelo se forman crecimientos después de 10-14 días (Figura 2B).
3. Las células madre epiteliales paso
- Lavar las células con PBS una vez. Quitar 3T3-J2 células alimentadoras por Versene (pre-calentado a RT) de tratamiento. Incubar la cultura servida en Versene durante 5 minutos, luego agite suavemente y aspirar de células alimentadoras.
- Lave el cabello de las células madre del folículo, ya sea con o Versene tiempo PBS uno.
- Añadir precalentado (a 37 ° C, crítico) de tripsina-EDTA (2 veces) y se incuba a 37 ° C durante 7 minutos o más si es necesario para que la célula madre de los folículos del pelo se puede desprender. No más de 15 minutos es lo mejor.
- Añadir KCM w / o FEAG para detener la tripsina, suavemente la pipeta hacia arriba y abajo para dispersar las células, la desaceleración en 200 g, 5 minutos.
- Vuelva a suspender las células con KCM sin EGF, Conde y re-placa de mitomicina C tratados con 3T3-J2 capa de células.
4. Inmortalizar las células epiteliales madre
Las células primarias, células madre adultas, incluso, llegar a la senectud, después del paso de serie y el mes en la cultura. Inmortalización de las células madre primaria es una forma efectiva para aliviar este problema.
- Plato principal las células madre epiteliales (~ 350,000 células / pocillo de 6 pocillos) en el paso 1 en la capa de alimentación (3T3-J2) y la cultura durante 2 días.
- Cultura PA317 LXSN 16E6E7 línea celular un día después de la siembra de las células epiteliales primarias madre con DMEM con 10% de SFB. (Esta línea produce los LXSN16E6E7 anfotrópico retrovirus que codifica para el VPH 16 E6 y E7 marcos de lectura abierta, y que puede ser usado para infectar de forma estable e inmortalizar muchos tipos de células).
- Tratar PA317 LXSN 16E6E7 línea celular con mitomicina C durante 2 horas (el mismo protocolo con 3T3-J2 células). Añadir mitomicina C tratados PA317 LXSN 16E6E7 línea celular de las células madre epiteliales primarias, co-cultivo durante 6 días en KCM con EGF. Renovar KCM fresco con EGF los medios de comunicación cada 2 días.
- Quitar 3T3-J2 y PA317 LXSN 16E6E7 celda con Versene. Añadir mitomicina-C tratados 3T3-J2 células NHP (neomicina, higromicina, puromicina resistentes, ~ 200.000 células por pocillo) a las células madre epiteliales. Las células se seleccionan menos de 0,2 mg / ml de G418 (Gibco) para añadiritional 6 días. Renovar fresco KCM contiene G418 con EGF los medios de comunicación cada 2 días.
Sobrevivir a las células madre epiteliales se inmortalizó células madre. Un pozo de primaria de las células madre epiteliales que no son co-cultivadas con PA317 LXSN 16E6E7 celular se debe establecer como un control para la selección G418, todas las células de este bien debe ser asesinado por G418 después de 6 días de la selección.
5. Resultados representante
Pronta aprobación de las células madre de la piel epiteliales e inmortalizado células madre epiteliales forman colonias apretado que consiste en queratinocitos pequeñas (Figura 2A), rodeada de células alimentadoras. Si se cultivan en medio libre de suero con los suplementos definido, sin una capa de alimentación, las células madre se dispersan y forman colonias no ajustados (que crecen como células individuales y pequeños grupos). Inmortalizado células madre epiteliales mantienen un fenotipo estable durante> 12 meses de paso continuo, pero tienden a formar colonias más estrictas que las células primarias. No forman colonias de anclaje independiente en los ensayos de agar blando, lo que indica que estas células inmortalizadas no poseen las características de las células cancerosas. Primaria y inmortalizado células epiteliales expresan madre del folículo piloso marcador de célula madre citoqueratina 15 (Figura 3), y son capaces de diferenciarse en la epidermis del folículo del pelo, y los linajes sebáceas (Figura 3B-D).
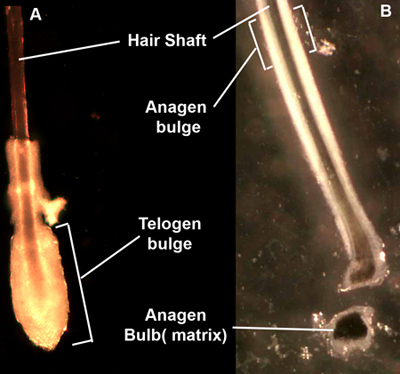
Figura 1. Desplumados pelos. Después de arrancar desde dispasa tratados con la piel, folículos pilosos aparecer como telogen pelos club (A) con una bola de células que rodean la parte inferior del pelo, o pelos anágena (B) con una manga de epitelio que rodea la longitud del pelo. La región del bulbo telogen forma una región distinta a la morfología micro-disección, mientras que el bulto anágena es menos clara. El bulbo anágena contiene queratinocitos de la matriz, lo que representa el tránsito de amplificación de las células que también pueden ser aisladas y cultivadas.
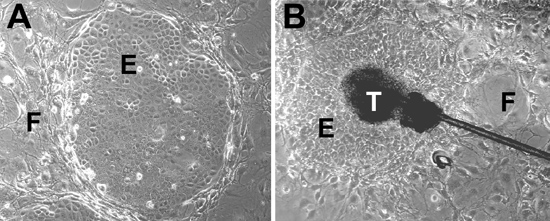
Figura 2. Células madre culturas. (A) Las células epiteliales se derivan de la piel forma apretada colonias epiteliales (designado por E) cuando se cultivan en KCM con una capa de alimentación de las células (designado por F). (B) explantes del folículo piloso dar lugar a crecimientos epiteliales. La región del bulbo telogen (designado por T) está conectado a la fuente y rodeada de colonias de células epiteliales con células alimentadoras.
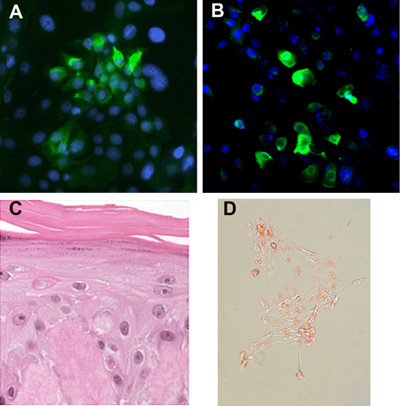
Figura 3. Diferenciación de las células madre. (A) Las células madre colonias mantener la expresión de marcadores epiteliales, como citoqueratina 15. (B) Las células cutáneas epiteliales madre pueden ser diferenciadas a lo largo del linaje folículo del pelo según lo determinado por la expresión K6Hf. (C) Las células pueden ser cultivadas en de-epidermalized dermis u otras matrices en la interfase aire-líquido y se forma una epidermis estratificada con capa córnea, la capa granular y la capa espinosa. (D) Las células madre pueden ser inducidas a lo largo del linaje sebáceas con aceite positiva glóbulos rojos.
Discusión
Los métodos de extracción de células y la cultura se describen son sorprendentemente fácil y reproducible. Hemos generado cultivos de células madre epiteliales de docenas de personas a través de un amplio rango de edades, incluidos los pacientes con defectos de la piel hereditaria 18. Lo mejor es comenzar el proceso en el día de la cosecha de tejidos, sin embargo, las células se mantienen viables en los medios de comunicación en hielo durante varios días, lo que facilita el envío de noche si es nec...
Divulgaciones
Agradecimientos
Este trabajo está financiado por el NIH / NCI subvención R01CA-118916
Materiales
Los medios de comunicación de queratinocitos (KCM)
[DMEM y Ham s F12 (GIBCO, 3:1), la adenina (Sigma, de 180 mm), el 10% de suero fetal bovino (GIBCO), la toxina del cólera (ICN, 0,1 nM), a la penicilina / estreptomicina (GIBCO, 100 U / ml y 100 mg / ml, respectivamente), hidrocortisona (Sigma, 0,4 mg / ml, 1,1 mM), T/T3 (transferrina, GIBCO, 5 mg / ml, 649 nM, y triyodo-l tironina, Sigma, 2 nM) , la insulina (Sigma, 5 mg / ml, 862 nm), y EGF (Sigma, 10 ng / ml, 1,6 nM), pH 7.2]
Referencias
- Jones, P. H., Watt, F. M. Separation of human epidermal stem cells from transit amplifying cells on the basis of differences in integrin function and expression. Cell. 73, 713-724 (1993).
- Lyle, S., Christofidou-Solomidou, M., Liu, Y., Elder, D. E., Albelda, S., Cotsarelis, G. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J. Cell. Sci. 111, 3179-3188 (1998).
- Bac, S. P., Reneha, A. G., Potte, C. S. Stem cells: the intestinal stem cell as a paradigm. Carcinogenesis. 21, 469-476 (2000).
- Slac, J. M. Stem cells in epithelial tissues. Science. 287, 1431-1433 (2000).
- It, M., Li, Y., Yan, Z., Nguye, J., Lian, F., Morri, R. J., Cotsarelis, G. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-134 (2005).
- Spradlin, A., Drummond-Barbos, D., Kai, T. Stem cells find their niche. Nature. 414, 98-104 (2001).
- Taylo, G., Lehre, M. S., Jense, P. J., Su, T. T., Lavke, R. M. Involvement of follicular stem cells in forming not only the follicle but also the epidermis. Cell. 102, 451-461 (2000).
- Oshim, H., Rocha, A., Kedzi, C., Kobayash, K., Barrandon, Y. Morphogenesis and renewal of hair follicles from adult multipotent stem cells. Cell. 104, 233-245 (2001).
- Morri, R. J., Li, Y., Marle, L., Yan, Z., Trempu, C., L, S., Li, J. S., Sawick, J. A. Cotsarelis G Capturing and profiling adult hair follicle stem cells. Nat. Biotechnol. 22, 411-417 (2004).
- Ro, C., Roch, M., Gu, Z., Photopoulo, C., Ta, Q., Lyle, S. Multi-potentiality of a new immortalized epithelial stem cell line derived from human hair follicles. In vitro Cell. & Dev. Biol. 44, 236-244 (2008).
- Ohyama, M., Vogel, J. C. G. e. n. e. delivery to the hair follicle. J Investig Dermatol Symp Proc. 8, 204-206 (2003).
- Sugiyama-Nakagiri, Y., Akiyama, M., Shimizu, H. Hair follicle stem cell-targeted gene transfer and reconstitution system. Gene Ther. 13, 732-737 (2006).
- Stenn, K. S., Cotsarelis, G. Bioengineering the hair follicle: fringe benefits of stem cell technology. Curr Opin Biotechnol. 16, 493-497 (2005).
- Hoeller, D. An improved and rapid method to construct skin equivalents from human hair follicles and fibroblasts. Exp Dermatol 10. , 264-271 (2001).
- Navsaria, H. A., Ojeh, N. O., Moiemen, N., Griffiths, M. A., Frame, J. D. Reepithelialization of a full-thickness burn from stem cells of hair follicles micrografted into a tissue-engineered dermal template (Integra). Plast Reconstr Surg. 113, 978-981 (2004).
- Werni, M., Meissne, A., Forema, R., Brambrin, T., K, M., Hochedlinge, K., Bernstei, B. E., Jaenisch, R. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448, 318-324 (2007).
- Par, I. H., Zha, R., Wes, J. A., Yabuuch, A., Hu, H., Inc, T. A., Lero, P. H., Lensc, M. W., Dale, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Kazantsev, A., Goltso, A., Zinchenk, R., Grigorenk, A. P., Abrukov, A. V., Moliak, Y. K., Kirillo, A. G., Gu, Z., Lyl, S., Ginte, E. K., Rogae, E. I. Human hair growth deficiency is linked to a genetic defect in the phospholipase gene LIPH. Science. 314, 982-985 (2006).
- Tola, J., Ishida-Yamamot, A., Riddl, M., McElmurr, R. T., Osbor, M., Xi, L., Lun, T., Slatter, C., Uitt, J., Christian, A. M., Wagne, J. E., Blaza, B. R. Amelioration of epidermolysis bullosa by transfer of wild-type bone marrow cells. Blood. 113, 1167-1174 (2009).
- Wagne, J. E., Ishida-Yamamot, A., McGrat, J. A., Hordinsk, M., Keen, D. R., Riddl, M. J., Osbor, M. J., Lun, T., Dola, M., Blaza, B. R., Tolar, J. Bone marrow transplantation for recessive dystrophic epidermolysis bullosa. N Engl J Med. 363, 629-639 (2010).
- Muraue, E. M., Gach, Y., Grat, I. K., Klausegge, A., Mus, W., Grube, C., Meneguzz, G., Hintne, H., Baue, J. W. Functional Correction of Type VII Collagen Expression in Dystrophic Epidermolysis Bullosa. J Invest Dermatol. , (2010).
- Y, H., Kuma, S. M., Kossenko, A. V., Show, L., X, X. Stem cells with neural crest characteristics derived from the bulge region of cultured human hair follicles. J Invest Dermatol. 130, 1227-1236 (2010).
- Nishimur, E. K., Grante, S. R., Fishe, D. E. Mechanisms of hair graying: incomplete melanocyte stem cell maintenance in the niche. Science. 307, 720-724 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados