JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
사람의 피부에서 성인 상피 줄기 세포의 분리 및 문화
요약
인간의 피부에서 가능한 성인 상피 줄기 세포를 분리의 신속하고 강력한 방법이 설명되어 있습니다. 방법은 모낭과 세포 배양에 대한 단세포 suspensions 또는 조직의 파편의 격리에 따버릴 다음 피부 콜라겐 매트릭스의 효소 소화를 활용합니다.
초록
모든 자기 갱신 조직의 항상성은 성인 줄기 세포에 따라 좌우됩니다. undifferentiated 줄기 세포는 비대칭 분열을 받다, 그들은 줄기 세포 표현형, 그리고 줄기 세포 틈새에서 마이 그 레이션 급속한 확산을 받다하고 말기 조직을 repopulate하기 위해 차별화 교통 - 확장 세포를 (TA 세포) 유지 딸 세포를 생성합니다.
상피 줄기 세포는 체외 proliferative 가능성이 높은과 같은 느린 - 자전거 생체내 1-3에서 세포를 레이블 - 유지와 세포로 표피, 머리 뿌리하고, 소장에서 발견되었습니다. 성인, 조직 고유의 줄기 세포들이 정상적인 physiologic 매출 동안뿐만 아니라 스트레스의 4-5 시간 동안 거주하고있는 조직의 재생에 대한 책임이 있습니다. 또한, 줄기 세포는 일반적으로 조직 내에서 여러 셀에 6 타입 야기할 수있는 능력을 보유하고 다중 강력한 것으로 간주됩니다. 예를 들어, 쥐 머리 뿌리의 줄기 세포는 표피, 피지선 땀샘과 모낭 7-9를 생성할 수 있습니다. 우리는 인간의 머리 뿌리의 팽창 지역에서 줄기 세포가 여러 가능성 10 전시 것으로 나타났습니다.
줄기 세포가 발달 생물학, 분화, tumorigenesis과 가능한 치료 유틸리티에 대한 공부를 위해 체외 시스템에 해당하는 유틸리티로 인해 생명 의학 연구에 가치있는 도구가되었습니다. 그것은 성인 상피 줄기 세포는 같은 ectodermal dysplasias, monilethrix, 네더턴 증후군, Menkes 질환, 유전 epidermolysis bullosa 및 alopecias 11-13으로 질병의 치료에 유용하게 사용될 가능성이 높습니다. 또한, 같은 화상 상처, 만성 상처와 궤양 등의 피부 문제 요법 14,15 관련 줄기 세포에서 도움이 될 것입니다. pluripotent 상태 (IPS 세포) 16,17로 성인 세포의 프로그래밍에 대한 잠재력을 감안할 때, 인간의 피부에 쉽게 접근 및 확장 성인 줄기 세포를 포함한 질환의 광범위한 유도 및 다운 스트림 치료를위한 세포의 중요한 원천을 제공할 수 있습니다 당뇨병과 파킨슨병.
프로토콜
1. 사람의 피부에서 상피 줄기 세포를 추출
- 상피 줄기 세포를 분리의 절차를 시작하기 전에 하나는 각 medias 및 시약을 (table1 참조) 준비해야합니다.
- facelift 절차 또는 펀치 생검에서 신선한 성인 인간의 두피가 수집된 후, 4 DMEM / 10 % FBS / 숙박 Dispase (4 MG / ML) ° C.에 품어 37 2-4 시간을위한 인큐베이션 ° C도 효과적입니다. 피부 조각에 침투하는 효소 수 있도록 1cm의 최대 너비가되어야합니다.
- 멸균 페트리 접시에 피부를 전송, 피부 표면 근처의 머리 샤프트 쥐고 단단히하고 부드럽게 당겨 피부의 각 머리를 당겨. 해부 현미경으로 자신의 형태에 따라 telogen 단계에서 모공을 선택하고, 전송 모공은 15 ML 멸균 튜브에 (그림 1A) 팽창 영역을 잘라. 뿌리의 1 / 3 상단에 상처가 머리 뿌리 '팽창'영역 (그림 1B)을 구하는 경우 Anagen의 모공도 사용할 수 있습니다.
- 주기적으로 잡고 실온에서 15-20 분 0.05 % 트립신 - EDTA (에틸렌 다이아 민 테트라 초산) (GIBCO)와 Versene (0.53 MM EDTA (에틸렌 다이아 민 테트라 초산) 4Na, GIBCO) (1:1)의 혼합물에 고립 뿌리 조각을 품어 추가 4 ML DMEM + 10 % FBS는 반응을 중지 800 rpm으로 5 분 스핀 다운합니다. 또는, 소낭 조직 조각의 explants은 단일 모공의 문화를 세포에 트립신 소화하지 않고 문화에 배치하실 수 있습니다.
- 신중하게 뜨는 폐기 (세포가 손실되는 것을 방지하기 위해 ~ 0.2-0.5 ML을 저장)와 EGF없이 한 ML KCM (keratinocyte 중간)에 다시 일시 중지합니다.
2. 문화 차 상피 줄기 세포
- culturing 전에 상피 줄기 세포는 3T3 - J2 세포 (피더 세포) 아래와 같이 준비되어야 C - 처리 mitomycin. 3T3 - J2 전지는 치료 전에 10% FBS과 DMEM의 양식입니다. culturing 미디어를 제거하고 PBS로 두 번 세포를 씻어, 37에서 2 시간에 대한 혈청없이 DMEM에 15μg / ML mitomycin C ° C, 5 % CO 2와 세포를 치료. mitomycin C 함유 DMEM를 제거하고 PBS로 두 번 세척, 전지는 사용할 수 있습니다. (Mitomycin은 C - 처리 3T3 - J2 전지는 -80에서 이전에 준비하고 저장할 수 있습니다 ° C.의 해동과 씨앗은 세포 culturing 기본 상피 줄기 세포 하루 전에, 37 품어 ° C, 5 % CO 2. 150,000-200,000 6 - 잘 접시의 잘 당 3T3 - J2 전지 권장합니다.
- mitomycin의 단계 1.5에서 시드 고립 머리 뿌리의 줄기 세포는 37에서 하루 EGF없이 KCM의 3T3 - J2 세포를 C - 대우 다음날 EGF 함유 KCM 변경 ° C 5 % CO 2. 전지는 37 ° 재배되는 CO 2 5 %를 포함한 습한 분위기에서 C. 모든 keratinocytes는 모든 이일 KCM 포함 EGF와 함께 공급하고 14~20일를위한 성장하고 있습니다. 현미경 매일 세포를 확인합니다. 헤어 뿌리의 줄기 세포는 식민지 (그림 2A)을 형성합니다. 헤어 뿌리의 explants은 10-14일 (그림 2B) 이후 outgrowths를 형성합니다.
3. 통로 상피 줄기 세포
- 한 번 PBS로 세포를 씻으십시오. Versene (RT 사전 예열) 처리하여 3T3 - J2 피더 세포를 제거합니다. 부화 문화 5 분 Versene에 걸려 다음 부드럽게 흔들 피더 세포를 대기음.
- Versene 또는 PBS 한 번에 하나와 머리 뿌리의 줄기 세포를 씻으십시오.
- 사전 예열 추가 (37 ° C, 중요) 트립신 - EDTA (에틸렌 다이아 민 테트라 초산) (2X) 37에서 품어 ° 7분 이상 분리에 머리 뿌리의 줄기 세포에 필요한 경우를 위해 C. 더 이상보다 15 분 가장 적합합니다.
- , 트립신을 중지 KCM W / O EGF를 추가 부드럽게, 200g에 스핀 다운, 세포를 해산하기 위해 5 분 위아래로 피펫합니다.
- mitomycin C - 3T3 - J2 처리 세포 계층에 EGF, 카운트하고 다시 플레이트없이 KCM과 함께 다시 정지 세포.
4. 상피 줄기 세포를 불멸하게하다
차 전지, 심지어는 성인 줄기 세포는 문화에 시리얼 통과하고 개월 만에 노화에 도달. 기본 줄기 세포의 불멸화이 문제를 완화하는 효과적인 방법입니다.
- 플레이트 2 일 기본 상피 줄기 피더 계층에 통로 1 셀 (~ 350,000 셀 / 물론 6 자 접시) (3T3 - J2)과 문화를.
- DMEM 10 % FBS를 포함하는으로 기본 상피 줄기 세포을 심는 후 문화 PA317 LXSN 16E6E7 세포주 하루. (이 라인은 HPV16 E6와 E7 오픈 읽기 프레임을 인코딩 amphotropic 레트로 바이러스의 LXSN16E6E7을 생산하고있는이 안정적으로 감염 많은 세포 유형을 불멸하게하다하는 데 사용할 수 있습니다.)
- 2 시간 mitomycin C (3T3 - J2 전지와 동일한 프로토콜)와 PA317 LXSN 16E6E7 세포 라인을 취급. mitomycin C는 EGF와 KCM 6 일 동안 기본 상피 줄기 세포로 PA317 LXSN 16E6E7 세포주, 공동 문화를 처리 추가합니다. 모든 이일 EGF 미디어 신선한 KCM을 갱신.
- 3T3 - J2를 제거하고 Versene와 PA317 LXSN 16E6E7 세포. 추가 mitomycin - C 처리 3T3 - J2 NHP 세포 (네오 마이신, hygromycin, puromycin 내성을 잘 당 ~ 200,000 개 셀) 상피 줄기 세포 수 있습니다. 전지는 추가에 대한 G418 (Gibco)의 0.2 MG / ML 아래에 선택됩니다itional 육일. EGF 미디어 매 2 일 신선한 G418 포함 KCM을 갱신.
살아 상피 줄기 세포는 줄기 세포를 영원히 것입니다. PA317 LXSN 16E6E7 셀과 함께 공동 교양되지 않은 기본 상피 줄기 세포의 잘이 G418의 선택을위한 컨트롤로 설정해야이 잘의 모든 세포가 선택 6 일 후에 G418에 의해 사망한다.
5. 대표 결과
피부 상피 줄기 세포와 영원히 상피 줄기 세포의 조기 통과가 피더 세포에 둘러싸인 작은 keratinocytes (그림 2A)로 구성된 꽉 식민지를 형성하고 있습니다. 피더 레이어없이 정의된 보조제와 함께 혈청 무료 미디어 교양 경우, 줄기 세포가 꽉 식민지를 (그들은 단일 세포와 작은 클러스터로 성장) 분산과 양식을하지 않습니다. 불후의 상피 줄기 세포가 지속적으로 통과> 12 개월 동안 안정적인 표현형를 유지하지만, 주요 전지보다 성능이 더 좋은걸 식민지를 형성하는 경향이. 그들은이 불후의 세포가 암 세포의 특성을 가지고하지 않는 것이 의미 소프트 한천 assays에서 앵커리지 독립 식민지를 형성하지 않습니다. 기본 및 상피 줄기 세포를 영원히 둘 다 머리 뿌리의 줄기 세포 마커에게 cytokeratin 15 (그림 3A)를 표현하고, 표피, 헤어 대과 및 피지선 lineages (그림 3B - D)으로 구별 할 수 있습니다.
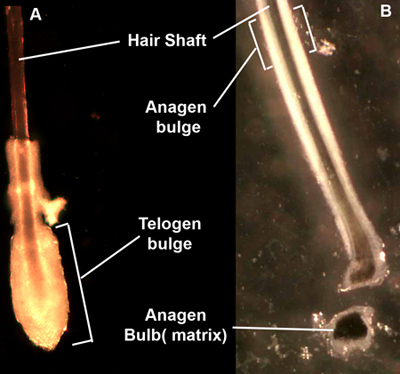
그림 1. 머리카락을 끌고. dispase - 치료 피부에서 따버릴 후, 모낭은 (B) 머리카락의 길이를 둘러싼 상피의 소매와 머리카락의 바닥을 둘러싼 세포의 공을 telogen 클럽 머리카락 (A), 또는 anagen의 머리카락 중으로 나타납니다. anagen의 팽창이 덜 뚜렷한 반면 telogen의 볼록한 지방은 마이크로 해부하다하는 독특한 morphologic 지역을 형성하고 있습니다. anagen 전구는 격리 및 교양 수있는 대중 교통 - 확장 전지를 나타내는 매트릭스 keratinocytes을 포함하고 있습니다.
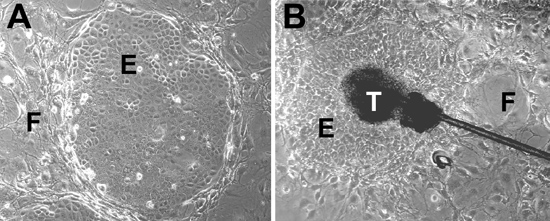
그림 2. 줄기 세포 문화. (A) 전지 (F 지정)의 피더 레이어와 KCM의 교양 피부 양식 꽉 상피 식민지 (E 지정)에서 상피 줄기 세포. (B) 헤어 뿌리의 explants는 상피 outgrowths을 일으키다. telogen의 팽창 지역은 (T 지정) 접시에 붙어 피더 세포와 함께 상피 세포 콜로니로 둘러싸여 있습니다.
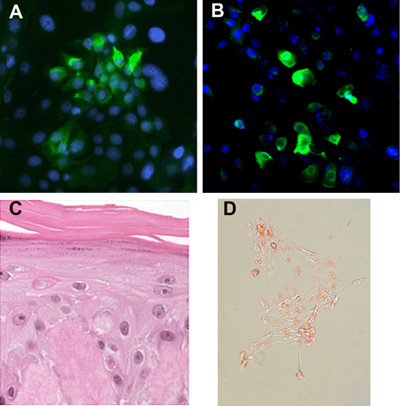
그림 3. 전지 차별 줄기. (A) 줄기 세포의 식민지는 cytokeratin 15 상피 마커의 표현을 유지합니다. (B) 피부 상피 줄기 세포는 같은 K6Hf 표현식에 의해 결정 머리 뿌리의 가계 따라 차별화된 수 있습니다. (C) 세포는 공기 - 액체 인터페이스에서 드 epidermalized 진피 또는 다른 매트릭스에 교양 수 있으며 cornified 계층, 세분화된 레이어와 spinous 레이어와 층상 표피를 형성합니다. (D) 줄기 세포는 오일 레드 긍정 globules과 피지선 혈통을 따라 유도하실 수 있습니다.
토론
설명 세포 추출과 문화 방법은 놀라울 정도로 손쉬운하고 재현할 수 있습니다. 우리는 상속 피부 결함 18 환자를 포함하여 넓은 연령 범위에 걸쳐 개인의 수십에서 상피 줄기 세포 문화를 생성합니다. 조직 수확 당일에 과정을 시작하는 것이 좋습니다이지만 전지는 필요한 경우 야간 선적을 촉진시켜, 며칠 동안 얼음 미디어 가능한 상태로 유지됩니다. 폐기 facelift의 피부가 단세포 suspensio...
공개
감사의 말
이 작품은 NIH / NCI 부여 R01CA - 118916에 의해 투자입니다
자료
Keratinocyte 미디어 (KCM)
[DMEM과 햄의 F12 (GIBCO, 3시 1분), 아데닌 (시그마, 180 ㎜) 10 % 태아 소 혈청 (GIBCO), 콜레라 독소 (ICN 0.1 NM), 페니실린 / 스트렙토 마이신 (GIBCO, 100 U / ML 각각 100 MG / ML), 하이드로코티손 (시그마, 0.4 MG / ML, 1.1 ㎜), T/T3 (트랜스페린, GIBCO, 5 μg / ML, 649 NM 및 triiodo - L - thyronine, 시그마, 2 NM) , 인슐린 (시그마, 5 MG / ML, 862 NM), 그리고 EGF (시그마, 10 NG / ML, 1.6 NM), 산도 7.2]
참고문헌
- Jones, P. H., Watt, F. M. Separation of human epidermal stem cells from transit amplifying cells on the basis of differences in integrin function and expression. Cell. 73, 713-724 (1993).
- Lyle, S., Christofidou-Solomidou, M., Liu, Y., Elder, D. E., Albelda, S., Cotsarelis, G. The C8/144B monoclonal antibody recognizes cytokeratin 15 and defines the location of human hair follicle stem cells. J. Cell. Sci. 111, 3179-3188 (1998).
- Bac, S. P., Reneha, A. G., Potte, C. S. Stem cells: the intestinal stem cell as a paradigm. Carcinogenesis. 21, 469-476 (2000).
- Slac, J. M. Stem cells in epithelial tissues. Science. 287, 1431-1433 (2000).
- It, M., Li, Y., Yan, Z., Nguye, J., Lian, F., Morri, R. J., Cotsarelis, G. Stem cells in the hair follicle bulge contribute to wound repair but not to homeostasis of the epidermis. Nat Med. 11, 1351-134 (2005).
- Spradlin, A., Drummond-Barbos, D., Kai, T. Stem cells find their niche. Nature. 414, 98-104 (2001).
- Taylo, G., Lehre, M. S., Jense, P. J., Su, T. T., Lavke, R. M. Involvement of follicular stem cells in forming not only the follicle but also the epidermis. Cell. 102, 451-461 (2000).
- Oshim, H., Rocha, A., Kedzi, C., Kobayash, K., Barrandon, Y. Morphogenesis and renewal of hair follicles from adult multipotent stem cells. Cell. 104, 233-245 (2001).
- Morri, R. J., Li, Y., Marle, L., Yan, Z., Trempu, C., L, S., Li, J. S., Sawick, J. A. Cotsarelis G Capturing and profiling adult hair follicle stem cells. Nat. Biotechnol. 22, 411-417 (2004).
- Ro, C., Roch, M., Gu, Z., Photopoulo, C., Ta, Q., Lyle, S. Multi-potentiality of a new immortalized epithelial stem cell line derived from human hair follicles. In vitro Cell. & Dev. Biol. 44, 236-244 (2008).
- Ohyama, M., Vogel, J. C. G. e. n. e. delivery to the hair follicle. J Investig Dermatol Symp Proc. 8, 204-206 (2003).
- Sugiyama-Nakagiri, Y., Akiyama, M., Shimizu, H. Hair follicle stem cell-targeted gene transfer and reconstitution system. Gene Ther. 13, 732-737 (2006).
- Stenn, K. S., Cotsarelis, G. Bioengineering the hair follicle: fringe benefits of stem cell technology. Curr Opin Biotechnol. 16, 493-497 (2005).
- Hoeller, D. An improved and rapid method to construct skin equivalents from human hair follicles and fibroblasts. Exp Dermatol 10. , 264-271 (2001).
- Navsaria, H. A., Ojeh, N. O., Moiemen, N., Griffiths, M. A., Frame, J. D. Reepithelialization of a full-thickness burn from stem cells of hair follicles micrografted into a tissue-engineered dermal template (Integra). Plast Reconstr Surg. 113, 978-981 (2004).
- Werni, M., Meissne, A., Forema, R., Brambrin, T., K, M., Hochedlinge, K., Bernstei, B. E., Jaenisch, R. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448, 318-324 (2007).
- Par, I. H., Zha, R., Wes, J. A., Yabuuch, A., Hu, H., Inc, T. A., Lero, P. H., Lensc, M. W., Dale, G. Q. Reprogramming of human somatic cells to pluripotency with defined factors. Nature. 451, 141-146 (2008).
- Kazantsev, A., Goltso, A., Zinchenk, R., Grigorenk, A. P., Abrukov, A. V., Moliak, Y. K., Kirillo, A. G., Gu, Z., Lyl, S., Ginte, E. K., Rogae, E. I. Human hair growth deficiency is linked to a genetic defect in the phospholipase gene LIPH. Science. 314, 982-985 (2006).
- Tola, J., Ishida-Yamamot, A., Riddl, M., McElmurr, R. T., Osbor, M., Xi, L., Lun, T., Slatter, C., Uitt, J., Christian, A. M., Wagne, J. E., Blaza, B. R. Amelioration of epidermolysis bullosa by transfer of wild-type bone marrow cells. Blood. 113, 1167-1174 (2009).
- Wagne, J. E., Ishida-Yamamot, A., McGrat, J. A., Hordinsk, M., Keen, D. R., Riddl, M. J., Osbor, M. J., Lun, T., Dola, M., Blaza, B. R., Tolar, J. Bone marrow transplantation for recessive dystrophic epidermolysis bullosa. N Engl J Med. 363, 629-639 (2010).
- Muraue, E. M., Gach, Y., Grat, I. K., Klausegge, A., Mus, W., Grube, C., Meneguzz, G., Hintne, H., Baue, J. W. Functional Correction of Type VII Collagen Expression in Dystrophic Epidermolysis Bullosa. J Invest Dermatol. , (2010).
- Y, H., Kuma, S. M., Kossenko, A. V., Show, L., X, X. Stem cells with neural crest characteristics derived from the bulge region of cultured human hair follicles. J Invest Dermatol. 130, 1227-1236 (2010).
- Nishimur, E. K., Grante, S. R., Fishe, D. E. Mechanisms of hair graying: incomplete melanocyte stem cell maintenance in the niche. Science. 307, 720-724 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유