A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
المسلكة الفأرية العدوى : نموذج من الحصانة من النوع 2 والتهاب في القناة الهضمية
In This Article
Summary
المسلكة الفأرية العدوى المعوية هو نموذج الحصانة TH2 حيث توليد فئران مقاومة للاستجابة وقائية TH2 والفئران عرضة توليد المرضية TH1 الاستجابة.
Abstract
المسلكة الفأرية هو الممرض من الفئران الطبيعية والبيولوجية ومستضديا مشابهة نوعا من المسلكة التي تصيب البشر والحيوانات 1. تعطى البيض بالتزقيم المعدية عن طريق الفم ، يفقس في الأمعاء الصغيرة البعيدة ، غزو الخلايا الظهارية في الأمعاء (IECS) التي تبطن الخبايا من الأعور والقولون والداني على نضوج الديدان الإفراج البيض في البيئة 1. هذا النموذج هو أداة قوية لدراسة العوامل التي تحكم CD4 + T تنشيط الخلايا المساعد (ث) ، وكذلك تغييرات في ظهارة الأمعاء. وتتميز الاستجابة المناعية التي تحدث في سلالات مقاومة الفطرية ، مثل C57BL / 6 و BALB / ج ، من خلال الاستقطاب السيتوكينات TH2 (IL - 4 ، IL - 5 و IL - 13) وطرد الديدان بينما TH1 المرتبطة السيتوكينات (IL -12 ، IL - 18 ، IFN - γ) تعزيز الالتهابات المزمنة في عكر عرضة وراثيا / الفئران J 2-6. السيتوكينات TH2 تعزيز التغيرات الفسيولوجية في المكروية المعوية بما في ذلك سرعة دوران IECS ، القدح تمايز الخلايا ، والتوظيف ، والتغيرات في نفاذية الظهارية وسلس تقلص العضلات ، والتي تورطت في طرد الدودة 7-15. نحن هنا بالتفصيل بروتوكولا لنشر المسلكة الفأرية البيض والتي يمكن استخدامها في التجارب اللاحقة. ونحن نقدم أيضا عينة تجريبية الحصاد مع اقتراحات لمرحلة ما بعد الإصابة التحليل. عموما ، سوف توفر للباحثين هذا البروتوكول مع الأدوات الأساسية لتنفيذ ماوس الفأرية المسلكة نموذج العدوى التي يمكن استخدامها لمعالجة المسائل المتعلقة الميل ث في الجهاز الهضمي فضلا عن وظائف المناعة في IECS المستجيب.
Protocol
1. نشر المسلكة البيض الفأرية
- لتوليد دفعات جديدة من بيض الفأرية المسلكة ، 20-30 تصيب الفئران العوز المناعي (مثل NOD.Cg - Prkdc SCID Il2rg tm1Wjl / SzJ (NSG) أو 129S6/SvEvTac-Rag2 tm1Fwa (RAG2 -- / --)) أو الفئران المعرضة وراثيا ( على سبيل المثال. عكر / J) التي هي 6-8 أسابيع من العمر مع ما يقرب من 300 بيضة المسلكة الفأرية بالتزقيم عن طريق الفم.
- بعد 32-35 يوما التضحية الفئران خنقا 2 CO.
- كشف الجانب البطني للفأرة والرطب في البطن مع الايثانول 70 ٪.
- ملقط به فهم جلد البطن وإحداث شق صغير باستخدام المقص. قطع الجلد لكشف محتويات البطن.
- تحديد الأعور والداني الأمعاء كبيرة ، وإزالتها.
- ضع الأعور والأمعاء الغليظة الداني في طبق بتري 10 سم تحتوي على التعديل Dulbecco النسر متوسطة (DMEM) مع 500 U / البنسلين مل و 500 ميكروغرام / مل الستربتوميسين (P / S). قطع الأعور فتح لكشف التجويف والديدان و. باستخدام الملقط الأعور مكان في كوب من الفوسفات مخزنة المالحة (PBS) ويهز بلطف لإزالة البراز.
- عودة إلى طبق بتري الأعور واستخدام الملقط منحني سلس (RS - 5047 Roboz) برفق من الديدان ووضعها في بئر من لوحة تحتوي على 5 6 جيدا مليليتر من DMEM + P / S.
- كرر هذه العملية لجميع الفئران.
- وضع 6 لوحة جيدا في وعاء تثبرور بمنشفة مبللة ورقة للحفاظ على الرطوبة واحتضان عند 37 درجة مئوية لمدة 4 ساعات.
- بعد 4 ساعات إزالة الديدان باستخدام الملقط المنحنية على نحو سلس وتقسيمها إلى 2 آبار جديدة من لوحة تحتوي على 6 جيدا DMEM 5mL + P / S. حصاد محتويات البئر والمكان الأصلي في أنبوب 15 مل الصقر. تدور أنبوب في 3000 دورة في الدقيقة ، وإزالة وطاف الاحتياطي كما مستضد ساعة 4 (يمكن أن تستخدم لغسيل الكلى restimulation الخلية بعد برنامج تلفزيوني ، حيث غلة البروتين النموذجية هي 20 ملغ في 10-20 الفئران) والتي تحتوي على البيض resuspend بيليه في مياه الحنفية تعقيمها.
- وضع لوحة 6 جيدا مرة أخرى عند 37 درجة مئوية خلال الليل. إزالة والتخلص من الديدان. حصاد محتويات الآبار في أنبوب الصقر وتدور بسرعة 3000 دورة في الدقيقة لمدة 5 دقائق. إزالة طاف والاحتياطي كما مستضد بين عشية وضحاها (يمكن استخدامها في حج المسلكة محددة ELISAs isotype الضد بعد الغسيل الكلوي في برنامج تلفزيوني ، حيث غلة البروتين النموذجية هي 20 ملغ في 10-20 الفئران) والتي تحتوي على البيض resuspend بيليه في مياه الحنفية تعقيمها.
- الجمع بين 4 ساعات والبيض بين عشية وضحاها وتصفية البيض من خلال مصفاة 70μm لإزالة أي بقايا الديدان ثم نقل إلى القارورة 75 2 سم. إبقاء القارورة في مكان مظلم المشمولة في احباط لمدة 6 أسابيع في درجة حرارة الغرفة (RT).
- غسل البيض في ماء الصنبور وتعقيمها resuspend على 50 بيضة قابلة للحياة في 50 ميكرولتر. للقيام بذلك ، الطرد المركزي البيض في 3000 دورة في الدقيقة لمدة 5 دقائق وresuspend 50ml ~ في مياه الحنفية العقيمة. إزالة 50 ميكرولتر البيض وتوضع على شريحة زجاجية. استخدام التكبير 40X حساب عدد البيض المحتوي قابلة للحياة في 50 ميكرولتر. تمييع البيض 50 بيضة لإعطاء قابلة للحياة في 50 ميكرولتر. لوحات من البيض مجدية الرجاء راجع الدراسة التي أجراها كوبر ومانسفيلد 16.
2. عدوى حادة من فئران التجارب مع المسلكة الفأرية البيض (200 بيضة / الماوس)
- resuspend البيض جيدا حجم وإزالة ما يكفي لعلاج عدد من الفئران X 2 (مثل الفئران لمدة 10 ميكرولتر تأخذ 200 × 10 × 2 = الفئران 4 مليليتر من البيض) ووضعها في أنبوب 14 مل غطاء مبكرة.
- اقلب المفاجئة مل 14 أنبوب الغطاء لالمزيج. طرح 200 ميكرولتر من البيض في حقنة 1 مل على إبرة حجم التغذية المناسبة (بالنسبة للفئران وزنها 25 غراما استخدمنا قياس 18 1 1 / 2 "الإبر) في ناحية القفا واستخدام الماوس من جهة أخرى إدارة البيض بواسطة التغذية عن طريق الفم .
- الانتظار 21 يوما.
3. الحصاد التجريبي
- في يوم 21 التضحية الفئران باستخدام ثاني أكسيد الكربون 2.
- جمع الدم من ثقب في القلب من قبل الفئران ، في حقنة غير heparinized ، وتخزينها في 4 درجات مئوية. في اليوم التالي عزل المصل وتجميد عند -20 درجة مئوية. ويمكن استخدام المصل للكشف عن المسلكة محددة من قبل الجماعات الحكومية الدولية وإيج إليسا.
- كشف الجانب البطني للفأرة والرطب في البطن مع الايثانول 70 ٪.
- ملقط به فهم جلد البطن وإحداث شق صغير باستخدام المقص. قطع الجلد والأغشية الكامنة لكشف محتويات البطن.
- التعرف على الأمعاء الدقيقة ، الأعور والقولون. الاستيلاء على الأعور مع ملقط والانسحاب من تجويف البطن. مع زوج آخر من الأمعاء الدقيقة ملقط دفع إلى اليمين تعريض الغدد الليمفاوية المساريقي (mLNs). إزالة mLNs الحرص على عدم قطع في الأمعاء والمكان في 15 مل تحتوي على الصقر 2 ملل من وسائل الإعلام. يمكن إذا أن المطلوب معالجة هذه وrestimulated في المختبر (4x10 6 / مل في 1 مل في 24 لوحات جيدة مع αCD3/CD28 ميكروغرام / 1 مل أو مع حج 50μg/ml المسلكة 4H) لمدة 72 ساعة للتحليل بواسطة ELISA وخلوى و جوانيانخفاض الخلوي.
- تخلص من الأعور والقولون.
- باستخدام الملقط ، طرد من القولون البرازية الكريات القاصي ومكان في أنبوب Axygen 2 مل. التجميد في -20 درجة مئوية. ويمكن تحليلها بواسطة الكريات البرازية طخة الغربية للتعبير عن resistin مثل β جزيء (RELM - β).
- إزالة غيض من الأعور (~ 0،5 سم). لإزالة البراز عقد الأعور غيض مع ملقط والاحمرار مع برنامج تلفزيوني باستخدام حقنة 3 مل و 22 قياس إبرة في طبق بتري. في مكان جديد بارافورمالدهيد 4 ٪ في 5 مل غطاء أنبوب فالكون مبكرة. المحل في 4 درجات مئوية. يمكن لهذه أن تكون جزءا لا يتجزأ من البرافين ، مقطوع والتي شنت على الشرائح للتحليل النسيجي.
- إزالة جزء من القولون الداني (~ 1 سم) عن الحمض النووي الريبي. وضعت العينة في أنبوب Axygen 2 مل مع 500 RNAlater ميكرولتر. المحل في 4 درجات مئوية. ويمكن تحليل هذه العينات للتعبير مرنا بواسطة qPCR.
- ضع بقية الأعور في طبق بتري وصفت والتجميد في -20 درجة مئوية.
4. تعداد الديدان الفأرية المسلكة في الأعور
- إزالة الأعور من الثلاجة وضعها في طبق بتري تحتوي على ~ الماء 5 مل.
- باستخدام مقص ، قص الأعور فتح لكشف التجويف.
- عقد الأعور مع ملقط ويهز بقوة الأعور لإزالة غالبية البراز.
- نقل الأعور إلى آخر طبق بتري تحتوي على المياه واستخدام الملقط منحني سلس كشط بلطف قبالة IECS النسيج الأساسي.
- الأعور نقل إلى طبق بتري جديدة تحتوي على الماء وكشط بقوة الأنسجة المتبقية مع ملقط ، تمزيق النسيج الى قطع صغيرة.
- استخدام مجهر تشريح لحساب كل من الديدان في كل 3 من أطباق بتري. كما تجد دودة إزالته من طبق لضمان الدودة نفسها لا يحسب مرتين. في حالة تلف الديدان (كسر أي في النصف) العد تنتهي إلا رقيقة أو سميكة للحصول على عدد دقيقة.
5. ممثل النتائج
العدوى الفأرية المسلكة النموذج يسمح للباحثين لتحديد عبء طفيلي والاستجابات المناعية الجهازية ، وكذلك لدراسة تشريحيا للاستجابة التهابية داخل الأعور القاصي. عندما يتعرض لمعة من الأعور المقطوع ، ويمكن تعداد الديدان المسلكة باستخدام مجهر تشريح (الشكل 1A - B). معلمات من الحصانة لتشمل أيضا المسلكة isotype التحول إلى الضد IgG1 (المقترنة TH2 من نوع الحصانة) في الحيوانات مقاومة ، وIgG2a (المقترنة TH1 من نوع الحصانة) في الحيوانات الحساسة (الشكل 1C). ويرتبط التعبير عن القدح خلية محددة resistin البروتين مثل جزيء β (RELM - β) مع إزالة المسلكة واكتشافها عن طريق تحليل لطخة غربية (الشكل 2). يمكن أن تكون ملطخة الجزء الأعلى من الأعور مع حمض دورية شيف (PAS) لتقييم الاستجابات الخلية القدح ومدى التهاب في الامعاء في الاستجابة للعدوى (الشكل 3).
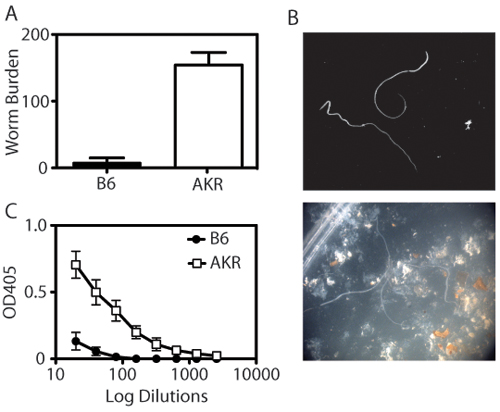
الشكل 1. الكمي من الحصانة لالفأرية المسلكة. (أ) مقاومة (B6) طرد الفئران التي الفأرية المسلكة 21 يوما بعد العدوى. على النقيض من ذلك ، فإنهم يصابون بالالتهاب المزمن عرضة (عكر / J) الفئران مع المسلكة ، مما أدى إلى إنشاء الطفيلي. كل شريط يمثل يعني ± SEM من الحيوانات 4-8 في المجموعة. (ب) تحسب الديدان باستخدام مجهر تشريح. اللوحة العلوية يظهر الديدان في عزلة ، لوحة أسفل يظهر الديدان في حضور IECS والبراز. (C) ويتم تحديد المسلكة محددة عيارات IgG2a ELISA بواسطة المصل المخفف (1:2 التخفيف ، ابتداء من الساعة 1:20 وتنتهي في التخفيف 1:2560) على لوحات مغطاة مستضد المسلكة مطرح (O / N حج ، 5 ميكروغرام / مل). عرضة عكر / J الفئران لديهم مستويات أعلى بشكل ملحوظ من المسلكة محددة IgG2a المصل من الفئران المقاومة B6.

الشكل 2. ويرتبط تطهير الفأرية المسلكة مع التعبير عن القدح خلية محددة بروتين RELM β - 7. ويمكن الكشف عن RELM - β انتاج الكريات من البراز من المسلكة المصابة مقاومة (B6) ، ولكن ليس عرضة (عكر / J) الفئران عن طريق تحليل لطخة غربية. حارة كل من ممثل لحيوان واحد ، (N) = السذاجة ، (TM) = 21 يوما المسلكة الفئران المصابة.
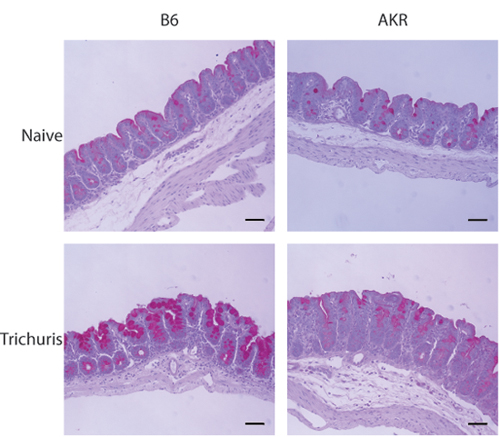
الشكل 3. الفحص النسيجي للعدوى الأعور المسلكة التالية القاصي. المقاطع 5-7 ميكرومتر من الأعور القاصي ملطخة PAS. كأس تضخم الخلايا وإنتاج المخاط واضحة في مقاومة (B6) ولكن ليس عرضة (عكر / J) الفئران بعد العدوى المسلكة.
Discussion
تفاصيل هذا البروتوكول معيار جرعة عالية العدوى الحادة الفأرية المسلكة التي يمكن تعديلها على النحو المطلوب من قبل المحقق. على سبيل المثال ، يمكن التضحية وأنسجة الفئران التي تحصد في أيام مختلفة. يمكن أن تقرر أن الفئران قد أنشأت بنجاح كامل عبء دودة يمكن التضحية أنه?...
Disclosures
Acknowledgements
وأيد هذا العمل من قبل المعاهد الكندية لأبحاث الصحة (MSH - 95368 ، 89773 وMOP - MOP - 106623 لتشيكوسلوفاكيا) ، والمؤسسة الكندية للإبداع. SCM هو المستفيد من جمعية CIHR / الكندي للزمالة أمراض الجهاز الهضمي ما بعد الدكتوراه. CZ هو محقق CIHR جديد.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات |
|---|---|---|---|
| إبر تغذية الحيوان (18 × 1 ½ ") | بوبر | 7912 | |
| منحني سلس الملقط | Roboz | RS - 5047 | |
| DMEM | Gibco | 11965 | |
| NOD.Cg - Prkdc SCID Il2r gtm1Wjl / SzJ (NSG) | جاكسون مختبرات | 005557 | هذه هي الفئران التي استخدمناها ، ومع ذلك ، ينبغي لأي الفئران العوز المناعي أو سلالة معرضة العمل. |
| RNAlater | Qiagen | 76104 | |
| 2 مل أنابيب | Axygen | MCT - 200 - C | |
| 15 مل أنابيب | صقر | 352096 | |
| 6 لوحات جيدة | صقر | 353046 | |
| بارافورمالدهيد | الإلكترون المجهر العلوم | 15710 | |
| α - RELMβ الأضداد | PeproTech المؤتمر الوطني العراقي | 0694270Rb |
References
- Cliffe, L. J., Grencis, R. K. The Trichuris muris system: a paradigm of resistance and susceptibility to intestinal nematode infection. Adv. Parasitol. 57, 255-307 (2004).
- Else, K. J., Finkelman, F. D., Maliszewski, C. R., Grencis, R. K. Cytokine-mediated regulation of chronic intestinal helminth infection. J. Exp. Med. 179, 347-351 (1994).
- Bancroft, A. J., Grencis, R. K. Th1 and Th2 cells and immunity to intestinal helminths. Chem. Immunol. 71, 192-208 (1998).
- Bancroft, A. J., McKenzie, A. N., Grencis, R. K. A critical role for IL-13 in resistance to intestinal nematode infection. J. Immunol. 160, 3453-3461 (1998).
- Helmby, H., Takeda, K., Akira, S., Grencis, R. K. Interleukin (IL)-18 promotes the development of chronic gastrointestinal helminth infection by downregulating IL-13. J. Exp. Med. 194, 355-364 (2001).
- Owyang, A. M. Interleukin 25 regulates type 2 cytokine-dependent immunity and limits chronic inflammation in the gastrointestinal tract. J. Exp. Med. 203, 843-849 (2006).
- Artis, D. RELMβ/FIZZ2 is a goblet cell-specific immune-effector molecule in the gastrointestinal tract. Proc. Natl. Acad. Sci. U. S. A. 101, 13596-13600 (2004).
- Datta, R. Identification of novel genes in intestinal tissue that are regulated after infection with an intestinal nematode parasite. Infect. Immun. 73, 4025-4033 (2005).
- Cliffe, L. J. Accelerated intestinal epithelial cell turnover: a new mechanism of parasite expulsion. Science. 308, 1463-1465 (2005).
- Artis, D. New weapons in the war on worms: identification of putative mechanisms of immune-mediated expulsion of gastrointestinal nematodes. Int. J. Parasitol. 36, 723-733 (2006).
- Finkelman, F. D. Cytokine regulation of host defense against parasitic gastrointestinal nematodes: lessons from studies with rodent models. Annu. Rev. Immunol. 15, 505-533 (1997).
- Grencis, R. K. Enteric helminth infection: immunopathology and resistance during intestinal nematode infection. Chem. Immunol. 66, 41-61 (1997).
- Khan, W. I. Modulation of intestinal muscle contraction by interleukin-9 (IL-9) or IL-9 neutralization: correlation with worm expulsion in murine nematode infections. Infect. Immun. 71, 2430-2438 (2003).
- Khan, W. I., Blennerhasset, P., Ma, C., Matthaei, K. I., Collins, S. M. Stat6 dependent goblet cell hyperplasia during intestinal nematode infection. Parasite Immunol. 23, 39-42 (2001).
- Akiho, H., Blennerhassett, P., Deng, Y., Collins, S. M. Role of IL-4, IL-13, and STAT6 in inflammation-induced hypercontractility of murine smooth muscle cells. Am. J. Physiol. Gastrointest. Liver Physiol. 282, 226-2232 (2002).
- Kopper, J. J., Mansfield, L. S. Development of improved methods for delivery of Trichuris muris to the laboratory mouse. Parasitol. Res. 107, 1103-1113 (2010).
- Bancroft, A. J., Else, K. J., Grencis, R. K. Low-level infection with Trichuris muris significantly affects the polarization of the CD4 response. Eur. J. Immunol. 24, 3113-3118 (1994).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved