Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Trichuris muris Enfeksiyon: Gut Tip 2 Bağışıklık ve İnflamasyon Bir Model
Bu Makalede
Özet
Trichuris muris enfeksiyon dayanıklı farelerde koruyucu bir Th2 yanıtı oluşturmak ve duyarlı fareler patolojik bir Th1 yanıtı Th2 dokunulmazlık bağırsak modelidir.
Özet
Trichuris muris farelerin doğal bir patojen ve enfekte insanlar ve hayvancılık 1 Trichuris türleri biyolojik ve antijenik olarak benzer . Enfektif yumurta ağızdan sonda ile distal ince bağırsakta ambar tarafından verilen, çizgi çekum ve proksimal kolon ve olgunlaşma üzerine kript solucanlar ortamı içine 1 yumurta serbest intestinal epitel hücrelerinde (IECS) işgal. Bu model faktörleri incelemek için güçlü bir araç olduğunu kontrol CD4 + T helper (Th) hücre aktivasyonu yanı sıra bağırsak epitel değişiklikleri. C57BL / 6 ve BALB / c gibi dayanıklı kendilenmiş suşları, ortaya çıkan immün yanıt, polarize Th2 sitokinlerin (IL-4, IL-5 ve IL-13) ve ilişkili Th1 sitokinlerin iken (IL solucanlar sürülmesi ile karakterizedir -12, IL-18, IFN-γ) kronik enfeksiyonlar, genetik olarak yatkın AKR / J fareler 2-6 teşvik . Th2 sitokinleri hızlı IECS ciro, goblet hücre farklılaşması, işe alma ve epitelyal permeabilite ve düz kas kasılması, solucan sınırdışı 7-15 suçlanmıştır hangi değişiklikler dahil olmak üzere bağırsak mikroçevresinin fizyolojik değişiklikler teşvik eder. Burada detay Trichuris muris yumurta sonraki deneylerde kullanılan propaganda için bir protokol. Ayrıca enfeksiyon sonrası analizi için önerileri ile örnek bir deneysel hasat sağlar. Genel olarak, bu protokol, gastrointestinal sistem gibi IECS immün efektör fonksiyonları Th eğilimine ilişkin soruları yanıtlamak için kullanılabilecek bir Trichuris muris fare enfeksiyon modeli gerçekleştirmek için temel araçları araştırmacılar sağlayacaktır .
Protokol
1. Trichuris muris yumurta Çoğaltım
- (Ya da genetik olarak yatkın fareler Trichuris muris yumurta yeni toplu üretmek için, 20-30 bağışık yetmezliği olan farelere enfekte () örneğin NOD.Cg-Prkdc SCID Il2rg tm1Wjl / SzJ (NSG) veya 129S6/SvEvTac-Rag2 tm1Fwa (RAG2 - /) örn. ağızdan sonda ile yaklaşık 300 Trichuris muris yumurta ile 6-8 hafta eski AKR / J).
- CO 2 boğulma 32-35 gün sonra fareler kurban.
- Fare ventral tarafında ortaya çıkarmak ve% 70 etanol ile karın ıslak.
- Forseps kullanarak karın cilt kavramak ve makas kullanarak küçük bir kesi yapmak. Karın içeriğini ortaya çıkarmak için cildi kesin.
- Çekum ve proksimal kalın bağırsak belirleyin ve bunları kaldırın.
- Dulbecco'nun Modifiye Eagle Orta (DMEM) 500 U / ml penisilin ve 500 mg / ml streptomisin (P / S) içeren bir 10 cm petri çekum ve proksimal kalın bağırsak yerleştirin. Lümen ve solucanlar ortaya çıkarmak için açık çekum kesin. Fosfat beher forseps yer çekum tamponlu salin (PBS) ve dışkı çıkarmak için hafifçe sallayın.
- Petri çekum dönün ve hafifçe solucanlar çekin ve 6 plaka DMEM + P / S 5 ml içeren bir iyi bir yer onları yumuşak kavisli bir forseps (Roboz RS-5047)
- Tüm fareler için bu işlemi tekrarlayın.
- 37 nem ve inkübe korumak için nemli bir kağıt havlu ° C, 4 saat için bir Tupperware kap içinde 6 plaka koyun.
- 4 saat yumuşak kavisli bir forseps kullanarak solucanları kaldırmak ve 5ml DMEM içeren 6 plaka 2 yeni kuyu bölebilirsiniz sonra + P / S 15 ml şahin tüp orijinal yeri iyi ve içeriğini Hasat. 4 saat antijen (tipik protein verimi 20 fareler başına 10-20 mg PBS diyaliz, sonra hücre restimulation için kullanılabilir) ve tekrar süspansiyon olarak 3000 rpm ve kaldır ve yedek süpernatant tüp Spin yumurta içeren pelet otoklavlanmış musluk suyu.
- 6 plaka ° C gecede 37 geri koyun. Çıkarın ve solucanlar atmayın. Bir şahin tüp ve 3000 rpm'de 5 dakika boyunca spin kuyuların içeriğini Hasat. Süpernatant ve rezerv gecede antijen (PBS diyaliz, tipik bir protein verimi 20 fareler başına 10-20 mg sonra Trichuris Ag spesifik antikor izotip ELISA'larla için kullanılabilir) ve tekrar süspansiyon yumurta içeren otoklavlanmış musluk suyu pelet olarak çıkarın.
- 4 saat ve gece boyunca yumurta birleştirin ve 75 cm 2 balona transfer daha sonra herhangi bir artık solucanları kaldırmak için 70μm süzgeç vasıtasıyla yumurta filtre . Şişesi, 6 hafta boyunca oda sıcaklığında (RT) folyo ile kaplanmış karanlık bir yerde tutun.
- Otoklavlanmış musluk suyu yumurta yıkayın ve 50 ul 50 yaşayabilir yumurtaların tekrar süspansiyon. Bunu yapmak için, 3000 rpm'de 5 dakika ~ 50ml steril musluk suyu ve tekrar süspansiyon yumurta santrifüj. Bir bardak slayt 50 ul yumurta ve yer çıkarın. 40x büyütme kullanarak 50 ul yaşayabilir embriyolu yumurta sayısını. 50 ul 50 yaşayabilir yumurtaların vermek için yumurta sulandırınız. Kopper ve Mansfield 16 tarafından yapılan çalışmada yaşayabilir yumurtaların görüntüler için bakın lütfen.
2. Trichuris muris yumurta (200 yumurta / fare) ile deneysel fareler Akut enfeksiyon
- Iyice tekrar süspansiyon yumurta ve farelerin sayısı tedavisi için yeterli hacmi kaldırmak X 2 (örneğin 10 fareler için 200 ul x alabilir 10 fareler x 2 = 4 yumurta ml) ve 14 ml ek bileşenini kap tüp koyun.
- Karıştırmak için 14 ml ek bileşenini kap tüp ters çevirin. 1 ml şırınga uygun bir boyut besleme iğne (18 gauge 1 1 / 2 "iğneler kullanılır 25 gram ağırlığında fare) içine yumurta 200 ul getirin. Fare ve diğer elinizi kullanarak bir el ense ağızdan sonda ile yumurta yönetmek .
- 21 gün bekleyin.
3. Deneysel hasat
- Gün 21 CO 2 kullanarak fareleri kurban.
- Kalp ponksiyon farelerden alınan kan toplayın, heparinize olmayan şırınga ve 4 mağaza ° C Ertesi gün, -20 ° C'de, serum ve donma izole Serum Trichuris özel IgGs ve IgE tespiti için ELISA yöntemi ile kullanılabilir.
- Fare ventral tarafında ortaya çıkarmak ve% 70 etanol ile karın ıslak.
- Forseps kullanarak karın cilt kavramak ve makas kullanarak küçük bir kesi yapmak. Deri ve karın içeriğini ortaya çıkarmak için temel membran kesin.
- Küçük bağırsak, çekum ve kolon tanımlayın. Forseps ile çekum alın ve karın boşluğundan dışarı doğru çekin. Forseps başka bir çift ile, mezenterik lenf düğümleri (mLNs) teşhir hakkı üzerinde ince bağırsak itin. Medya içeren 2 ml, 15 ml Falcon bağırsak ve yerine kesmek için dikkatli olmak mLNs çıkarın. İsterseniz bu ELISA ve hücre içi f sitokin analizi için 72 saat işlem ve in vitro (1 ml, 1 mcg / ml αCD3/CD28 veya 50μg/ml 4h Trichuris Ag 24 kuyucuğu 4x10 6 / ml) restimulated olabilirdüşük sitometri.
- Çekum ve kolon kesin.
- Forseps kullanarak, 2 ml Axygen tüp distal kolon ve yerden fekal pelet dışarı itmek. Freeze az -20 ° C. Fekal pelet molekülü-β (AHLAK-β) resistin gibi ifade western blot ile analiz edilebilir.
- Çekum (~ 0.5 cm) ucu çıkarın. Dışkı forseps ile çekum ucu tutun kaldırın ve PBS bir petri 3 ml şırınga ve 22-gauge iğne ile yıkayın. Bir 5 ml Falcon ek kap tüp içinde taze% 4 paraformaldehid yerleştirin. 4 ° C saklayınız Bu parafine gömülü kesitli ve histolojik analiz için kızaklar üzerinde monte edilebilir.
- RNA (~ 1 cm) proksimal kolonda bir parça kaldırın. 500 ul RNAlater 2 ml Axygen tüpe örnek koyun. 4 ° C saklayınız Bu örnekleri qPCR mRNA için analiz edilebilir.
- Etiketli petri ve dondurucuda -20 ° C'de çekum geri kalanı yerleştirin.
4. Çekum Trichuris muris solucanlar sayımı
- Çekum ~ 5 ml su içeren bir petri dondurucu ve yerden çıkarın.
- Makas kullanarak, lümen maruz çekum kesilerek açılır.
- Forseps ile çekum tutun ve şiddetle dışkı çoğunluğu kaldırmak için çekum sallamak.
- Su içeren ve yavaşça IECS altta yatan doku kazıyın yumuşak kavisli bir forseps kullanarak başka bir petri çekum aktarın.
- Su içeren yeni bir petri çekum aktarın ve şiddetle, küçük parçalar halinde doku müthiş, kalan doku forseps ile kazımak.
- Tüm petri kutularının 3 solucanlar saymak için bir diseksiyon mikroskobu kullanın. Eğer bir solucan aynı solucan sağlamak için çanak çıkarın bulmak gibi iki kez sayılmaz. Solucanlar hasarlı ise (yani yarı yarıya kırık) doğru bir sayım almak için sadece kalın ya da ince uçları saymak.
5. Temsilcisi Sonuçlar
Trichuris muris enfeksiyon modeli araştırmacılar parazit yükünü ve sistemik immün yanıtların yanı sıra, histolojik olarak incelemek için distal çekum içinde inflamatuvar yanıtı ölçmek için sağlar. Hasat çekum lümen maruz kaldığında, Trichuris solucanlar bir diseksiyon mikroskobu (Şekil 1A-B) ile numaralandırılan. Trichuris için bağışıklık parametreleri de antikor dayanıklı hayvanlar IgG1 için geçiş izotip (Th2 tip bağışıklık ile ilgili) ve duyarlı hayvanlarda IgG2a (Th1-tipi bağışıklık ile ilişkili) (Şekil 1C) içerir. Goblet hücre-spesifik protein resistin gibi molekülü-β (AHLAK-β) İfade Trichuris klerensi ile ilişkilidir ve Western blot analizi (Şekil 2) tarafından algılanamaz. Çekum distal kısmı goblet hücre yanıtları ve enfeksiyona yanıt olarak intestinal inflamasyon ölçüde (Şekil 3) değerlendirmek için periyodik asit-Schiff (PAS) ile boyandı.
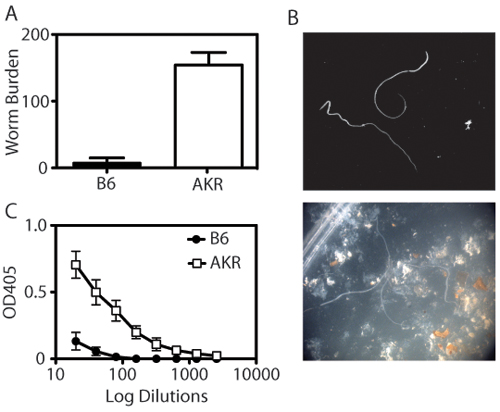
Şekil 1. Trichuris muris bağışıklık Kantitasyonu. (A) Dayanıklı (B6) fareler gün 21 sonrası enfeksiyon Trichuris muris sınırdışı. Buna karşılık, duyarlı (AKR / J) farelerde kronik parazit kurulması, Trichuris ile enfekte olma. Her çubuk, ortalama ± SEM grup başına 4-8 hayvanlar temsil eder. (B) Worms diseksiyon mikroskobu kullanılarak sayılır. Üst panel, izolasyon solucanlar gösterir, alt panel IECS ve dışkı varlığı solucanlar gösterir. (C) Trichuris özel IgG2a titreleri boşaltım Trichuris antijen (O / N Ag, 5 mg / ile kaplı plakalar üzerinde seyreltilmiş serum ELISA (1:2 seyreltme 1:20 seyreltme başlayan ve biten 1:2560) tarafından belirlenir ml). Duyarlı AKR / J farelerin dayanıklı B6 farelere göre daha Trichuris-spesifik serum IgG2a özellikle yüksek seviyeleri var.

Şekil 2. Trichuris muris Gümrükleme goblet hücre-spesifik protein AHLAK-β 7 ifade ile ilişkilidir. AHLAK-β üretim Trichuris enfekte dayanıklı (B6) fekal pelet saptandı, ancak western blot analizi ile fareler (AKR / J) duyarlı değildir. Her şerit, (N) = Naive (Tm) = 21 gün Trichuris bulaşmış farelerin tek bir hayvan temsilcisidir.
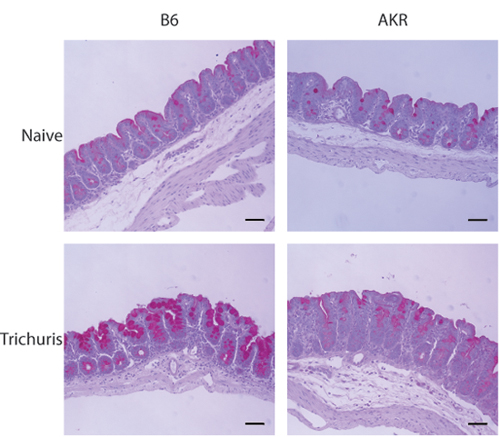
Şekil 3. Distal çekum aşağıdaki Trichuris enfeksiyon histolojik incelenmesi. Distal çekum 5-7 mikron bölümlerini PAS ile boyandı. Goblet hücre hiperplazisi ve mukus üretimi dayanıklı (B6) belirgindir, ancak Trichuris enfeksiyon fareler (AKR / J) duyarlı değildir .
Tartışmalar
Bu protokol, araştırmacı tarafından gerekli olarak modifiye edilebilir bir standart yüksek doz akut Trichuris muris enfeksiyon. Örneğin, fare kurban edilebilir ve dokuların farklı günlerde hasat. Farelerin tam solucan yükü başarıyla kurduk belirlemek için hangi noktada tüm fareler yaklaşık 200 solucanlar bir yük taşımak, 14. günde kurban edilebilir. Fareler de 32 gün için tespit edilen solucan olgunluğa erişmiş olacak ve ömrünün süresi için ev sahibi ile kalacaktı enfekte olabil...
Açıklamalar
Teşekkürler
Bu çalışma, Kanada Sağlık Araştırma Enstitüsü (MSH-95.368, MOP-89.773 ve MOP-106.623 - CZ) ve Kanada Yenilik Vakfı tarafından desteklenmiştir. SCM, Gastroenteroloji doktora sonrası burs CIHR / Kanada Derneği alıcı. CZ CIHR Yeni Araştırmacı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifin Adı | Şirket | Katalog numarası | Yorumlar |
|---|---|---|---|
| Hayvan Besleme İğneler (18 x 1 ½ ") | Çıtçıt | 7912 | |
| Pürüzsüz eğimli Forseps | Roboz | RS-5047 | |
| DMEM | Gibco | 11965 | |
| NOD.Cg Prkdc SCID Il2r gtm1Wjl / SzJ (NSG) | Jackson Laboratuvarları | 005557 | Bunlar kullanılan fareler, ancak, herhangi bir bağışık yetmezliği olan farelere veya zorlanma duyarlı çalışması gerektiğini. |
| RNAlater | Qiagen | 76104 | |
| 2 ml tüpler | Axygen | MCT-200-C | |
| 15 ml tüpler | Şahin | 352096 | |
| 6 kuyucuğu | Şahin | 353046 | |
| Paraformaldehit | Elektron Mikroskopi Bilimi | 15710 | |
| α-RELMβ antikor | PeproTech Inc. | 0694270Rb |
Referanslar
- Cliffe, L. J., Grencis, R. K. The Trichuris muris system: a paradigm of resistance and susceptibility to intestinal nematode infection. Adv. Parasitol. 57, 255-307 (2004).
- Else, K. J., Finkelman, F. D., Maliszewski, C. R., Grencis, R. K. Cytokine-mediated regulation of chronic intestinal helminth infection. J. Exp. Med. 179, 347-351 (1994).
- Bancroft, A. J., Grencis, R. K. Th1 and Th2 cells and immunity to intestinal helminths. Chem. Immunol. 71, 192-208 (1998).
- Bancroft, A. J., McKenzie, A. N., Grencis, R. K. A critical role for IL-13 in resistance to intestinal nematode infection. J. Immunol. 160, 3453-3461 (1998).
- Helmby, H., Takeda, K., Akira, S., Grencis, R. K. Interleukin (IL)-18 promotes the development of chronic gastrointestinal helminth infection by downregulating IL-13. J. Exp. Med. 194, 355-364 (2001).
- Owyang, A. M. Interleukin 25 regulates type 2 cytokine-dependent immunity and limits chronic inflammation in the gastrointestinal tract. J. Exp. Med. 203, 843-849 (2006).
- Artis, D. RELMβ/FIZZ2 is a goblet cell-specific immune-effector molecule in the gastrointestinal tract. Proc. Natl. Acad. Sci. U. S. A. 101, 13596-13600 (2004).
- Datta, R. Identification of novel genes in intestinal tissue that are regulated after infection with an intestinal nematode parasite. Infect. Immun. 73, 4025-4033 (2005).
- Cliffe, L. J. Accelerated intestinal epithelial cell turnover: a new mechanism of parasite expulsion. Science. 308, 1463-1465 (2005).
- Artis, D. New weapons in the war on worms: identification of putative mechanisms of immune-mediated expulsion of gastrointestinal nematodes. Int. J. Parasitol. 36, 723-733 (2006).
- Finkelman, F. D. Cytokine regulation of host defense against parasitic gastrointestinal nematodes: lessons from studies with rodent models. Annu. Rev. Immunol. 15, 505-533 (1997).
- Grencis, R. K. Enteric helminth infection: immunopathology and resistance during intestinal nematode infection. Chem. Immunol. 66, 41-61 (1997).
- Khan, W. I. Modulation of intestinal muscle contraction by interleukin-9 (IL-9) or IL-9 neutralization: correlation with worm expulsion in murine nematode infections. Infect. Immun. 71, 2430-2438 (2003).
- Khan, W. I., Blennerhasset, P., Ma, C., Matthaei, K. I., Collins, S. M. Stat6 dependent goblet cell hyperplasia during intestinal nematode infection. Parasite Immunol. 23, 39-42 (2001).
- Akiho, H., Blennerhassett, P., Deng, Y., Collins, S. M. Role of IL-4, IL-13, and STAT6 in inflammation-induced hypercontractility of murine smooth muscle cells. Am. J. Physiol. Gastrointest. Liver Physiol. 282, 226-2232 (2002).
- Kopper, J. J., Mansfield, L. S. Development of improved methods for delivery of Trichuris muris to the laboratory mouse. Parasitol. Res. 107, 1103-1113 (2010).
- Bancroft, A. J., Else, K. J., Grencis, R. K. Low-level infection with Trichuris muris significantly affects the polarization of the CD4 response. Eur. J. Immunol. 24, 3113-3118 (1994).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır