Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Trichuris muris infección: un modelo de tipo 2 inmunidad y la inflamación en el intestino
En este artículo
Resumen
Trichuris muris infección intestinal es un modelo de la inmunidad Th2 en ratones resistentes al generar una respuesta Th2 protección y ratones susceptibles de generar una respuesta Th1 patológicos.
Resumen
Trichuris muris es un patógeno natural de los ratones y es biológicamente y antigénicamente similares a las especies de Trichuris que infectan a los seres humanos y animales 1. Los huevos infectantes se dan mediante una sonda nasogástrica, eclosionan en el intestino delgado distal, invaden las células epiteliales intestinales (IEC) que la línea de las criptas del ciego y el colon proximal y en la maduración de los huevos de los gusanos liberación en el medio ambiente 1. Este modelo es una herramienta poderosa para examinar los factores que las células CD4 + de control T helper (Th) activación de las células, así como cambios en el epitelio intestinal. La respuesta inmune que se produce en las cepas endogámicas, como C57BL / 6 y BALB / c, se caracteriza por las citocinas Th2 polarizadas (IL-4, IL-5 e IL-13) y la expulsión de los gusanos, mientras que Th1 asociada a las citocinas (IL -12, IL-18, IFN-γ) promover las infecciones crónicas en AKR genéticamente susceptibles / J ratones 2-6. Citocinas Th2 promover cambios fisiológicos en el microambiente intestinal incluyendo la rápida rotación de la IEC, la diferenciación de las células caliciformes, la contratación y cambios en la permeabilidad del epitelio y la contracción del músculo liso, que se han implicado en la expulsión del gusano 7.15. Aquí detallamos un protocolo para la propagación de los huevos de Trichuris muris que puede ser utilizado en experimentos posteriores. También proporcionamos una pesca experimental de la muestra con sugerencias para el análisis post-infección. En términos generales, este protocolo se proporcionará a los investigadores con las herramientas básicas para realizar una Trichuris muris ratón modelo de infección que puede ser utilizado para tratar las cuestiones relacionadas con proclividad Th en el tracto gastrointestinal, así como funciones efectoras inmunes de la IEC.
Protocolo
1. Propagación de los huevos de Trichuris muris
- Para generar nuevos lotes de huevos de Trichuris muris, 20-30 infectar ratones inmunodeficientes (por ejemplo, NOD.Cg-Prkdc scid Il2rg tm1Wjl / SzJ (NSG) o 129S6/SvEvTac-Rag2 tm1Fwa (RAG2 - / -)) o ratones genéticamente susceptibles ( por ejemplo. AKR / J), que es de 6-8 semanas de edad con aproximadamente 300 huevos de Trichuris muris mediante una sonda nasogástrica.
- Después de 32-35 días el sacrificio de los ratones por asfixia de CO 2.
- Exponer el lado ventral del ratón y húmedo en el abdomen con un 70% de etanol.
- Pinzas de agarre utilizando la piel del abdomen y hacer una pequeña incisión con unas tijeras. Cortar la piel para exponer el contenido abdominal.
- Identificar el ciego y el intestino grueso proximal, y eliminarlos.
- Coloque el ciego y el intestino grueso proximal en una placa de Petri de 10 cm que contiene Dulbecco modificado por Eagle (DMEM) con 500 U / ml de penicilina y 500 mg / ml de estreptomicina (P / S). Cortar el ciego abierta para exponer la luz y los gusanos. Utilizando unas pinzas ciego colocarlos en un vaso de tampón fosfato salino (PBS) y agite suavemente para eliminar las heces.
- Volver al ciego placa de Petri y el uso de pinzas curvas suaves (Roboz RS-5047) tire suavemente de gusanos y colocarlos en un pozo de una placa de 6 pocillos que contienen 5 ml de DMEM + P / S.
- Repita este proceso para todos los ratones.
- Colocar 6 pocillos en un recipiente Tupperware con una toalla de papel húmeda para mantener la humedad y se incuba a 37 ° C durante 4 horas.
- Después de 4 horas eliminar los gusanos utilizando pinzas curvas suaves y los dividieron en dos nuevos pozos de la placa de 6 pocillos que contienen 5 ml de DMEM + P / S. Cosecha el contenido del pozo original y colocarla en un tubo Falcon de 15 ml. Girar el tubo a 3000 rpm y eliminar el sobrenadante de reserva como el antígeno de 4 horas (se puede utilizar para re-estimulación de células después de la PBS de diálisis, donde los rendimientos son típicas de proteínas 10-20 mg por cada 20 ratones) y resuspender que contengan huevo sedimento en el agua del grifo en autoclave.
- Coloque la placa de 6 y de nuevo a 37 ° C durante la noche. Remoción y eliminación de los gusanos. Cosecha de los contenidos de los pozos en un tubo Falcon y giran a 3000 rpm durante 5 min. Aspirar el sobrenadante y la reserva como antígeno durante la noche (se puede utilizar para Trichuris Ag. ELISA específico isotipo de anticuerpos después de la PBS de diálisis, donde los rendimientos son típicas de proteínas 10-20 mg por cada 20 ratones) y que contiene huevo volver a suspender el pellet en el agua del grifo en autoclave.
- Combine 4 horas y los huevos durante la noche y el filtro de los huevos a través del tamiz 70μm para eliminar los gusanos de sobra a continuación, transferir a un matraz de 75 cm 2. Mantenga matraz en un sitio oscuro cubierto de lámina por 6 semanas a temperatura ambiente, (RT).
- Lavar los huevos en el agua del grifo en autoclave y volver a suspender a 50 huevos viables en 50 microlitros. Para ello, los huevos centrífuga a 3000 rpm durante 5 min y se resuspenden en 50 ml de agua de la llave ~ estéril. Retire 50 huevos l y el lugar en un portaobjetos de vidrio. Usando el aumento de 40x contar el número de huevos embrionados viables en el l 50. Diluir los huevos para dar 50 huevos viables en 50 microlitros. Para las imágenes de huevos viables por favor vea el estudio de Kopper y Mansfield 16.
2. La infección aguda de los ratones experimentales con Trichuris muris huevos (200 huevos / ratón)
- Huevos bien volver a suspender y eliminar un volumen suficiente para tratar el número de ratones X 2 (por ejemplo, de 10 ratones tener 200 x l 10 ratones x 2 = 4 ml de huevos) y colocarlos en un tubo de tapa de 14 ml fácil.
- Invierta el tubo de 14 ml snap tapa para mezclar. Lleva hasta 200 l de huevos en jeringa de 1 ml en una aguja de tamaño de la alimentación adecuada (para los ratones un peso de 25 gramos que utiliza calibre 18 1 1 / 2 "agujas). En pescuezo por un lado, el ratón y con la otra mano administrar los huevos mediante una sonda nasogástrica .
- Esperar 21 días.
3. De pesca experimental
- El día 21 el sacrificio de los ratones con CO 2.
- Recoger la sangre de los ratones mediante punción cardíaca, en una jeringa no heparinizada, y se almacenan a 4 ° C. Al día siguiente aislar el suero y congelar a -20 ° C. Suero puede ser utilizado para la detección de IgG específica Trichuris e IgE por ELISA.
- Exponer el lado ventral del ratón y húmedo en el abdomen con un 70% de etanol.
- Pinzas de agarre utilizando la piel del abdomen y hacer una pequeña incisión con unas tijeras. Cortar la piel y la membrana subyacente para exponer el contenido abdominal.
- Identificar el intestino delgado, el ciego y el colon. Coge el ciego con unas pinzas y extraer de la cavidad abdominal. Con otro par de pinzas de empujar el intestino delgado hacia la derecha exponer los nódulos linfáticos mesentéricos (mLNs). Retire la mLNs teniendo cuidado de no cortar los intestinos y el lugar en un falcon de 15 ml que contiene 2 ml de los medios de comunicación. Si lo desea estos pueden ser procesados y volvieron a estimular in vitro (4x10 6 / ml en 1 ml en placas de 24 pocillos con 1 mg / ml αCD3/CD28 o con 50μg/ml 4h Trichuris Ag) durante 72 horas para el análisis de citoquinas por ELISA y f intracelularcitometría de baja.
- Cortar el ciego y el colon.
- Con unas pinzas, expulsar partículas fecales de colon distal y el lugar en un tubo de 2 ml Axygen. Congelar a -20 ° C. Bolitas fecales pueden ser analizados por Western blot para la expresión de la resistina, como la molécula de β (β-RELM).
- Retire la punta del ciego (~ 0,5 cm). Para eliminar las heces mantener la punta del ciego con unas pinzas y enjuague con PBS utilizando una jeringa de 3 ml y aguja de calibre 22 en una placa de Petri. Lugar en paraformaldehído al 4% fresco en un tubo de 5 ml tapa Falcon fácil. Almacenar a 4 ° C. Estos pueden ser incluidos en parafina, se cortaron y montaron en portaobjetos para su análisis histológico.
- Extraer un pedazo de colon proximal (aproximadamente 1 cm) para el ARN. Ponga la muestra en 2 ml tubo Axygen con 500 l RNAlater. Almacenar a 4 ° C. Estas muestras pueden ser analizadas para la expresión del ARNm de qPCR.
- Coloque el resto del ciego en una placa de Petri etiquetados y se congelan a -20 ° C.
4. La enumeración de los gusanos Trichuris muris en el ciego
- Quitar el ciego del congelador y colóquela en un plato de Petri que contiene ~ 5 ml de agua.
- El uso de tijeras, corte ciego para exponer la luz.
- Mantenga el ciego con unas pinzas y agite vigorosamente el ciego para eliminar la mayoría de las heces.
- Transferencia a otro ciego placa de Petri que contiene el agua y el uso de pinzas curvas suaves raspe suavemente la IEC el tejido subyacente.
- Transferencia de ciego a una nueva placa de Petri que contiene agua y raspar el tejido restante vigorosamente con fórceps, extracción del tejido en trozos pequeños.
- Utilizar un microscopio de disección para contar todos los gusanos en los 3 de los platos de Petri. Como encontrar un gusano de sacarlo de la placa para asegurarse de que el gusano lo mismo no se cuenta dos veces. Si los gusanos son dañados (es decir, roto por la mitad) sólo cuentan los extremos gruesos o finos para obtener una cifra exacta.
5. Resultados representante
El modelo de Trichuris muris infección permite a los investigadores para cuantificar la carga parasitaria y la respuesta inmune sistémica, así como para examinar histológicamente la respuesta inflamatoria en el intestino ciego distal. Cuando la luz del ciego cosechado se expone, gusanos Trichuris se pueden enumerar usando un microscopio de disección (Figura 1-B). Parámetros de inmunidad a Trichuris también incluyen isotipo de anticuerpos IgG1 cambiar a (asociado con la inmunidad de tipo Th2) en los animales resistentes, y IgG2a (asociados con la inmunidad de tipo Th1) en animales susceptibles (fig. 1C). Expresión de la copa de células específicas de la proteína resistin-como la molécula de β (β-RELM) se asocia con un aclaramiento de Trichuris y es detectable por análisis de Western blot (Figura 2). La porción distal del intestino ciego se puede teñir con ácido periódico de Schiff (PAS) para evaluar las respuestas de las células caliciformes y el grado de inflamación intestinal en respuesta a la infección (Figura 3).
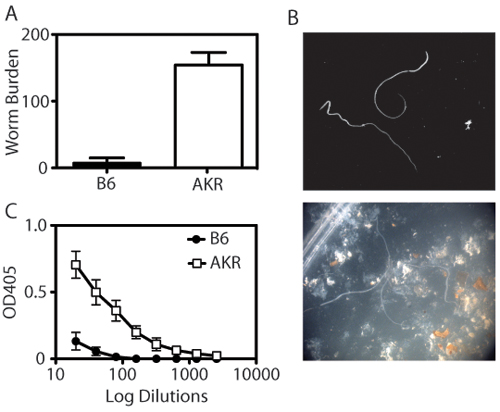
Figura 1. La cuantificación de la inmunidad de Trichuris muris. (A) Resistente (B6) expulsar a los ratones Trichuris muris a los 21 días post-infección. Por el contrario, susceptibles (AKR / J) de ratones con infección crónica por Trichuris, lo que resulta en el establecimiento de los parásitos. Cada barra representa la media ± SEM de 4-8 animales por grupo. (B) Los gusanos se cuentan utilizando un microscopio de disección. El panel superior muestra los gusanos en el aislamiento, el panel inferior muestra los gusanos en la presencia de la IEC y las heces. (C) Trichuris específicos de los títulos de IgG2a se determinó por ELISA de suero diluido (1:2 dilución, a partir de las 1:20 de dilución y terminando a las 1:2560) en placas recubiertas con antígeno excretor Trichuris (O / N Ag, 5 mg / ml). Susceptibles AKR / J ratones tienen niveles notablemente más altos de Trichuris IgG2a específicos en suero de ratones B6 resistente.

Figura 2. Liquidación de Trichuris muris se asocia con la expresión de la copa de células específicas de la proteína β-RELM 7. RELM-β de producción pueden ser detectados a partir de partículas fecales de Trichuris infectadas resistentes (B6), pero no susceptibles (AKR / J) en ratones mediante el análisis de Western blot. Cada carril es representante de un solo animal, (N) = ingenuo, (Tm) = 21 días Trichuris ratones infectados.
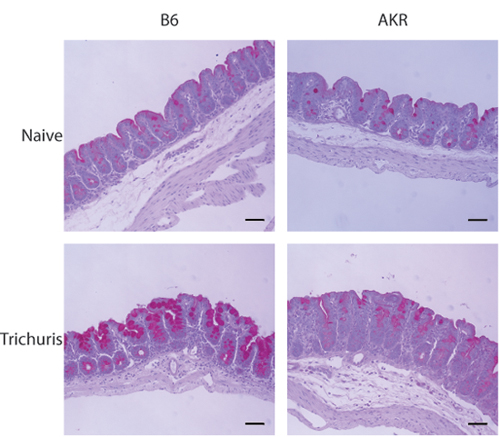
Figura 3. El examen histológico de la infección por Trichuris ciego siguientes distal. Secciones 7.5 micras de la parte distal ciego teñidos con PAS. Hiperplasia de células caliciformes y la producción de moco son evidentes en resistencia (B6), pero no susceptibles (AKR / J) ratones después de la infección por Trichuris.
Discusión
Este protocolo detalla un estándar de alta dosis aguda de la infección por Trichuris muris que pueden ser modificados según sea necesario por el investigador. Por ejemplo, los ratones pueden ser sacrificados y tejidos recolectados en días diferentes. Para determinar que los ratones han establecido con éxito la carga del gusano completo que puede ser sacrificado en el día 14, momento en el que todos los ratones que llevan una carga de aproximadamente 200 gusanos. Los ratones también pueden ser infectados ...
Divulgaciones
Agradecimientos
Este trabajo fue financiado por los Institutos Canadienses de Investigación en Salud (MSH-95368, 89773 y MOP-MOP-106623 a la República Checa) y la Fundación Canadiense para la Innovación. SCM es el destinatario de una Asociación de CIHR / canadiense de la comunión Gastroenterología postdoctoral. CZ es un investigador de Nueva CIHR.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| Agujas de alimentación animal (18 x 1 ½ ") | Corchete | 7912 | |
| Suave pinzas curvas | Roboz | RS-5047 | |
| DMEM | Gibco | 11965 | |
| NOD.Cg-Prkdc scid IL2R gtm1Wjl / SzJ (NSG) | Jackson Laboratories | 005557 | Estos son los ratones que hemos utilizado, sin embargo, cualquier ratones inmunodeficientes o cepa susceptible debería funcionar. |
| RNAlater | Qiagen | 76104 | |
| Tubos de 2 ml | Axygen | MCT-200-C | |
| Tubos de 15 ml | Halcón | 352096 | |
| 6 placas | Halcón | 353046 | |
| Paraformaldehído | Microscopía electrónica de la Ciencia | 15710 | |
| α-RELMβ anticuerpos | PeproTech Inc | 0694270Rb |
Referencias
- Cliffe, L. J., Grencis, R. K. The Trichuris muris system: a paradigm of resistance and susceptibility to intestinal nematode infection. Adv. Parasitol. 57, 255-307 (2004).
- Else, K. J., Finkelman, F. D., Maliszewski, C. R., Grencis, R. K. Cytokine-mediated regulation of chronic intestinal helminth infection. J. Exp. Med. 179, 347-351 (1994).
- Bancroft, A. J., Grencis, R. K. Th1 and Th2 cells and immunity to intestinal helminths. Chem. Immunol. 71, 192-208 (1998).
- Bancroft, A. J., McKenzie, A. N., Grencis, R. K. A critical role for IL-13 in resistance to intestinal nematode infection. J. Immunol. 160, 3453-3461 (1998).
- Helmby, H., Takeda, K., Akira, S., Grencis, R. K. Interleukin (IL)-18 promotes the development of chronic gastrointestinal helminth infection by downregulating IL-13. J. Exp. Med. 194, 355-364 (2001).
- Owyang, A. M. Interleukin 25 regulates type 2 cytokine-dependent immunity and limits chronic inflammation in the gastrointestinal tract. J. Exp. Med. 203, 843-849 (2006).
- Artis, D. RELMβ/FIZZ2 is a goblet cell-specific immune-effector molecule in the gastrointestinal tract. Proc. Natl. Acad. Sci. U. S. A. 101, 13596-13600 (2004).
- Datta, R. Identification of novel genes in intestinal tissue that are regulated after infection with an intestinal nematode parasite. Infect. Immun. 73, 4025-4033 (2005).
- Cliffe, L. J. Accelerated intestinal epithelial cell turnover: a new mechanism of parasite expulsion. Science. 308, 1463-1465 (2005).
- Artis, D. New weapons in the war on worms: identification of putative mechanisms of immune-mediated expulsion of gastrointestinal nematodes. Int. J. Parasitol. 36, 723-733 (2006).
- Finkelman, F. D. Cytokine regulation of host defense against parasitic gastrointestinal nematodes: lessons from studies with rodent models. Annu. Rev. Immunol. 15, 505-533 (1997).
- Grencis, R. K. Enteric helminth infection: immunopathology and resistance during intestinal nematode infection. Chem. Immunol. 66, 41-61 (1997).
- Khan, W. I. Modulation of intestinal muscle contraction by interleukin-9 (IL-9) or IL-9 neutralization: correlation with worm expulsion in murine nematode infections. Infect. Immun. 71, 2430-2438 (2003).
- Khan, W. I., Blennerhasset, P., Ma, C., Matthaei, K. I., Collins, S. M. Stat6 dependent goblet cell hyperplasia during intestinal nematode infection. Parasite Immunol. 23, 39-42 (2001).
- Akiho, H., Blennerhassett, P., Deng, Y., Collins, S. M. Role of IL-4, IL-13, and STAT6 in inflammation-induced hypercontractility of murine smooth muscle cells. Am. J. Physiol. Gastrointest. Liver Physiol. 282, 226-2232 (2002).
- Kopper, J. J., Mansfield, L. S. Development of improved methods for delivery of Trichuris muris to the laboratory mouse. Parasitol. Res. 107, 1103-1113 (2010).
- Bancroft, A. J., Else, K. J., Grencis, R. K. Low-level infection with Trichuris muris significantly affects the polarization of the CD4 response. Eur. J. Immunol. 24, 3113-3118 (1994).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados