A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
يعيش بين محاور التصوير الجذر الظهرية بعد بضع الجذور
In This Article
Summary
و في الجسم الحي التصوير بروتوكول لرصد المحاور العصبية الحسية الأولية التالية سحق الجذرية الظهرية. إجراءات استخدام واسع الحقل المجهري مضان وthy1 - YFP الفئران المعدلة وراثيا ، والسماح التصوير المتكرر للتجديد لأكثر من 4 سم محور عصبي في الجهاز العصبي المحيطي والتفاعلات محوار مع واجهة للجهاز العصبي المركزي.
Abstract
والمحاور الرئيسية الحسية أصيب إصابات العمود الفقري تفشل الجذرية على التجدد في النخاع الشوكي ، مما يؤدي إلى الألم المزمن وفقدان الحواس دائم. يتم منع تجديد الظهرية المحاوير (DR) الجذر في النخاع الشوكي في منطقة الجذر دخول الظهرية (DREZ) ، والتفاعل بين الجهاز العصبي المركزي والجهاز العصبي المحيطي. فهمنا من الأحداث الجزيئية والخلوية التي تمنع التجديد في DREZ غير مكتملة ، في جزء منه لأنه قد تم استنتاجها التغيرات المعقدة المرتبطة الاصابة العصبية من يحلل بعد الوفاة. يتم دراسة أفضل العمليات الخلوية الحيوية ، مثل تجديد المحور ، مع التقنيات التي التقاط الأحداث في الوقت الحقيقي مع ملاحظات متعددة من كل حيوان حي. وقد زاد من قدرتنا على رصد الخلايا العصبية في الجسم الحي بسبب متسلسل بشكل كبير على الابتكارات الثورية في علم البصريات والمعدلة وراثيا الماوس. عدة أسطر من الفئران المعدلة وراثيا thy1 - GFP ، الذي وصفت وراثيا مجموعات فرعية من الخلايا العصبية في الألوان الفلورية متميزة ، تسمح تصوير الخلايا العصبية الفردية في الجسم الحي 1. وقد استخدمت هذه الفئران على نطاق واسع في الجسم الحي لتصوير الدماغ والعضلات 2-4 5-7 ، وقدمت أفكارا جديدة في آليات الفسيولوجية التي لا يمكن أن يكون حل تحليلات ثابتة. دراسات التصوير من الخلايا العصبية في النخاع الشوكي الذين يعيشون في الآونة الأخيرة فقط بدأ. يختمن وزملاؤه أثبتت جدواها first عن طريق تتبع المصابين عمود الظهري (DC) مع المحاور واسعة المجال المجهري 8،9. الفوتون متعددة في مجال التصوير المجراة من محاور العاصمة وضعه بعمق ، الدبقية الصغيرة والأوعية الدموية كما تم إنجاز 10. على مدى السنوات القليلة الماضية ، ونحن كان لها السبق في تطبيق المجراة في مجال التصوير لرصد تجديد المحاوير DR باستخدام واسع المجال المجهري وH - خط thy1 YFP الفئران. وقد أدت هذه الدراسات لنا فرضية جديدة حول لماذا يمنعون من المحاور DR تجديد داخل الحبل الشوكي 11.
في خط H - YFP من thy1 الفئران ، متوضعة بشكل سطحي متميزة YFP + المحاور ، الذي يسمح برصد محاور عدة في وقت واحد. تعلمنا أن يتم تصوير أفضل محاور DR صوله DREZ في الفقرات القطنية من العمود الفقري في عنق الرحم. في هذا التقرير عدة استراتيجيات وصفنا بأننا وجدنا من المفيد أن أؤكد التصوير ناجحة على المدى الطويل والمتكرر لتجديد المحاوير DR. وتشمل هذه الأساليب التي تقضي على التنبيب المتكررة وانقطاع التنفس ، وتقليل التوتر المصاحب لعملية جراحية وتشكيل ندبة ، والحصول على صور ثابتة بدرجة وضوح عالية دون الضيائية.
Protocol
1. مجهر إعداد والتحضير والتصوير
- لدينا مجموعة التصوير وتتألف المجموعة من stereomicroscope MZ16 ايكا الفلورسنت مع مصراع الكاميرا بسرعة ويبرد CCD التي تسيطر عليها البرمجيات Metamorph.
- إعداد لوحة التحكم التدفئة حراريا وضبط الانتاج الى 32.5 درجة مئوية للحفاظ على درجة حرارة جسم الحيوان أثناء وبعد الجراحة.
- رينغر الدافئة محلول معقم أو اصطناعية السائل النخاعي (ACSF) إلى 32.5 درجة مئوية في وقت مبكر للري من الحبل الشوكي أثناء الجراحة.
- تخدير الحيوانات مع حقن داخل الصفاق من زيلازين (8 ملغ / كلغ) والكيتامين (120 ملغ / كلغ) كوكتيل.
- حلق أعلى الظهر مع كليبرز الحيوانات الصغيرة وانتشارها قطرة واحدة صغيرة من محلول لإزالة الشعر فوق منطقة حلق مع مسحات القطن ذات الرؤوس. بعد دقائق ، وإزالة المستحضر تطبيقها باستخدام الايثانول 70 ٪ الإسفنج شاش مبللة.
2. استئصال الصفيحه والتعرض الجراحية الجذرية الظهرية L5
- وضع الحيوانات على حامية (32.5 درجة مئوية) وسادة وتطهير الجلد مع مسحات الايثانول 70 ٪ غارقة.
- تحت إضاءة ساطعة على حقل stereomicroscope ، تنفيذ شق خط الوسط (2 -- لسم 3) في جلد ظهره. إذا كان ذلك ضروريا ، واستخدام القطن مسحات يميل لوقف النزيف.
- تعكس عضلات العمود الفقري لفضح الفقرات القطنية الكامنة.
- فضح شرائح L3 - S1 الشوكي عن طريق الحق من جانب ونصفي الثقب باستخدام rongeurs الصغيرة. يتم إنشاء الثقب الجزئي تعريض 4-6 شرائح من الحبل الشوكي القطنية والعجزية بواسطة إزالة الجزء الأيمن من فقرات الظهرية L5 على مستوى قمة الحرقفي في الورك (موقع DRG L5) rostrally إلى فقرات L2 (2 الفقرات الذيلية للضلع الماضي). يروي تجويف بمحلول معقم رينغر الدافئة.
- موقف الحيوان على وسادة الدعم (تدحرجت الشاش والقطن) إلى تسطيح العمود الفقري. تراجع استخدام السنانير لتوسيع منطقة مكشوفة.
- عند هذه النقطة (حوالي 30 دقيقة بعد حقن المخدر IP الأول ، ينبغي حقن ملحق (0.5X) تحت الجلد وذلك للحفاظ على الحيوانات تخدير كامل. التخدير بدلا من الغاز ، (2-4 ٪ isoflurane في الأكسجين 0.5L/min ) يمكن استخدامها لتخدير المتكررة أثناء جلسات التصوير وقتا أطول من 1 ساعة.
3. بضع الجذور / سحق الظهرية جذر
- التبديل إلى الإثارة مضان لتصور YFP المسمى (+) المحاور.
- استخدام غيض من إبرة (26ga.) الفرعية Q ، إجراء شق صغير في الجافية المغطي الجذر L5 الظهرية (DR). يروي مرارا مع حل رينغر ونظيفة بلطف مع مسحات القطن ذات الرؤوس.
- تحديد موقع لابد من سحقهم وإدراج جانب واحد من ملقط غرامة (دومون # 5) subdurally.
- إغلاق ملقط بلطف ولكن بحزم ، وعقد جزء من الجذر الإنسي L5 لمدة 10 ثوان ، ثم حرر بلطف ملقط.
- يغسل مرارا مع حل الفسيولوجية ونظيفة بلطف مع مسحات القطن ذات الرؤوس.
4. الحصول على الصور والاجراءات بعد العملية
- الحصول على صور متعددة من المنطقة كلها بما في ذلك تعرض موقع وسحق DREZ قبل وبعد سحق الحق في كل من التكبير المنخفضة والعالية.
- يتم الحصول على الصور لقطات إما واحد أو في تيارات متعددة من 10 إلى 20 لقطة المكتسبة في غضون 30 -- لزمن التعرض 40 مللي. ويتم اختيار ثم التركيز في الصور ، ويتم إنشاء المونتاج نظرة عامة في وقت لاحق باستخدام برنامج فوتوشوب.
- للحد من تشكيل ندبة ، وتطبيق بإحكام قطعة من الغشاء الرقيق مصفوفة الاصطناعية (Biobrane) ، تليها الجافية الاصطناعي ، وعلى رأس الحبل الشوكي المكشوفة. يجب التأكد من قطع القطع لتناسب بالضبط في إطار يتعرض الحبل الشوكي بحيث تكون ملتصقة إلى الحبل الشوكي.
- إغلاق الجهاز العضلي مع الغرز 5-0 معقمة وإغلاق شق خط الوسط مع مقاطع الجرح.
- حقن محلول رينغر (0.3 إلى 0.5 مل ، تحت الجلد) ، وإدارة البوبرينورفين وتسكين بعد العملية الجراحية (0.05 ملغ / كلغ) تحت الجلد كل 12 ساعة لمدة 2 ايام.
- ابقاء الحيوانات على لوحة التدفئة (34 درجة -35 درجة مئوية) حتى استردادها.
5. التصوير المتكرر
- تخدير الحيوانات وإزالة مقاطع الجرح والغرز.
- إزالة الجافية الاصطناعي ورقيقة الغشاء مصفوفة بقع الاصطناعية والاحتفاظ بها في أنبوب يحتوي على محلول معقم رينغر لإعادة استخدامها في وقت لاحق.
- إزالة بلطف أي النسيج الضام المتراكمة ندبة مع طرف عازمة إبرة الفرعية س ملقط والغرامة. يروي كثير من الأحيان مع حل رينغر الدافئة.
- إعادة فضح مجال المنطوق ، بما في ذلك موقع وسحق DREZ ، نقل YFP + المحاوير المصورة في الدورات السابقة ، وكرر الإجراءات المذكورة في القسم 4.
6. ممثل النتائج :
وقد لاحظنا أنه ، في حين أنهم لم تتجدد بعد إصابة transection ، وتقريبا جميع المحاور + YFP نمت من خلال موقعاصابة بواقع 3 أيام بعد سحق (الشكل 1) 11. عادة ، في اليوم التالي بعد سحق لاحظنا يموتون الظهير تنكس المحاوير جدعة الداني والتفتيت / تنكس من نفس المحاور البعيدة للسحق ، الذي أكد أنه قد تم المحاوير التالفة بشكل مناسب (على سبيل المثال ، الشكل 1 ؛ يوم 3 و 5) . وتطبق معايير إضافية للتمييز بين عدة محاور بشكل لا لبس فيه من تجديد المحاور التي كانت بمنأى أو قد تعافى من الاصابة. وشملت هذه ما يلي : (1) محاور تجديد تظهر توسعا في الجزء غير الفلورسنت من YFP + محور عصبي في موقع سحق بسبب تنكس الدانية والقاصية (على النقيض من تضييق الفجوة غير المسماة بسبب السيتوبلازم الفلورسنت إعادة تعبئتها على موقع سحق إذا نجا من الاصابة المحاور) ، (2) تجديد محاور هي أرق بكثير ، وأقل الفلورسنت الزاهية ، وأكثر من متموجة من المحاور التي نجت من الضرر ؛ (3) neurites تجديد هي أرق وأكثر الفلورسنت بشكل خافت من شظايا التحول الفلورسنت من خلال المحاور التي قدموه ، (4) على النقيض من الباقين على قيد الحياة أو يدخر المحاور ، المحاور تجديد تتوقف عند DREZ ؛ و (5) على العكس من الباقين على قيد الحياة أو يدخر المحاور ، المحاور تجديد العقد لا يحمل رانفييه. الشكل 1 يظهر أربعة محاور + YFP سطحية مباشرة بعد سحق (A1 ؛ السهام الملونة). بعد ثلاثة أيام من سحق جميع المحاور four تمديد neurite واحد الذي ينمو من خلال موقع سحق (A2). بعد خمسة أيام من سحق ، neurites تبقى مستقرة وليس هناك أي نمو إضافي من هذه المحاور أو غيرها الداني (A3).
وتجديد neurites التي عبرت من خلال موقع سحق ممدود شظايا الفلورسنت أكثر سمكا وأكثر إشراقا بكثير من محور عصبي تحولها (أي أنابيب غمد الليف العصبي) ، وتصل في أقرب وقت DREZ 4 أيام بعد سحق (حوالي 3mm / 2 يوما) 11. وكشف التصوير المتكرر لهذه المحاور ونصائح لهم كل يومين أو ثلاثة أسابيع لاثنين من أكثر (الشكل 2) أنها لا تنمو إلى الأمام أو التراجع ، ولكنها بقيت جامدة. وكان التغيير الوحيد الملحوظ تورم في مهاوي ونصائح من بعض المحاور. تبرهن هذه الملاحظات السريعة من المستغرب بالتالي الشلل والأمراض المزمنة من المحاور في تجديد DREZ.
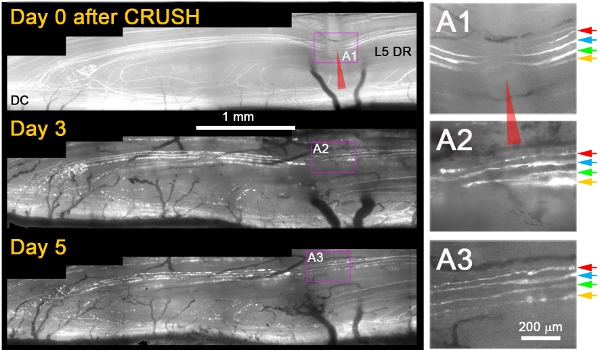
الشكل 1 : التصوير المتكرر للL5 المحاوير DR + YFP في موقع سحق الجذرية الظهرية على مدى 5 أيام. وسحق جزء من الجذر الإنسي L5 (رأس السهم الأحمر) ، والتقط في أيام 0 ، 3 ، 5 وبعد سحق. ويضاعف مجال سحق الحق في لوحات (A1 - A3).

وصل التصوير المتكرر من المحاور وصلت إلى أكثر من 20 DREZ يوما بعد يوم سحق الجذر L5 4 ، وثلاثة محاور (الأسهم الملونة) في DREZ : الشكل 2. نصائح من هذه المحاور لا تزال في الموقع نفسه ، ولها مظهر مماثل في دورات لاحقة على التصوير 7 أيام ، 9 ، 13 ، 15 ، و 20. واستخدمت مواقف تلميح محوار النسبي لنصائح الآخرين ومعالم محوار (النجمة) لتحديد حركية محور عصبي بين دورات التصوير.
Access restricted. Please log in or start a trial to view this content.
Discussion
التصوير DR التجدد مباشرة في الفئران الحية تحديا من نوع خاص لأنه يتطلب استئصال الصفيحه كبيرة الظهرية لرصد النمو محوار على مساحة واسعة تليها إجراءات متعددة الغازية الجراحية والتخدير في جلسات التصوير لاحقة. وساعدت عدة استراتيجيات للتغلب على هذه التحديات. الأولى ، والت?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نشكر الدكتور ألان تسلر للتعليق عليها ومساعدة التحرير. وأيد هذا العمل من قبل المعاهد الوطنية للصحة NS062320.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات |
|---|---|---|---|
| H - خط thy1 YFP (2-4 أشهر من العمر ، أي من الجنسين) | مختبر جاكسون (بار هاربور ، ME) | 003782 | |
| زيلازين (حقن AnaSed ، محلول معقم) | مختبرات لويد ، (شيناندواه ، LA) | 4811 | 8 ملغ / كغ |
| الكيتامين (حقن هيدروكلوريد الكيتامين ، USP) | هوسبيرا ، وشركة (ليك فورست ، IL) | 2051 | 120 ملغ / كغ |
| البوبرينورفين (Buprenex حقن) (0.05 ملغ / كلغ) | ريكيت بينكيزر الصيدلة (رمزها في ريتشموند ، فيرجينيا) | 7571 | |
| الحيوانات الصغيرة كليبرز الشعر | اوستر الفنية ، (McMinnville ، TN) | 76059-030 | |
| إزالة الشعر محلول | الكنيسة وشركاه دوايت (برينستون ، نيوجيرسي) | ناير النفط مع اطفال | |
| الشاش الإسفنج | فيشر العلمية ، (بيتسبرغ ، السلطة الفلسطينية) | 22-362-173 | |
| مسحات القطن ذات الرؤوس | فيشر العلمية ، (بيتسبرغ ، السلطة الفلسطينية) | 14-960 ، 3Q | |
| 1 مل المحاقن | بيكتون ، ديكسون وشركة فرانكلين البحيرات ، ونيو جيرسي) | 309602 | |
| تحت الجلد (الفرعية س) الإبر ، 26ga. | بيكتون ، وشركة ديكسون (فرانكلين البحيرات ، ونيو جيرسي) | 305115 | |
| مقص وملقط الربيع | أدوات العلوم الدقيقة ، (فوستر سيتي ، كاليفورنيا) | ||
| 2.5 ملم rongeurs المنحني | أدوات العلوم الدقيقة ، (فوستر سيتي ، كاليفورنيا) | 16221-14 | |
| USP حقن Lactated رينغر | باء براون الطبية ، وشركة (ايرفين ، كاليفورنيا) | ببر - L7502 | |
| محلول ملحي معقم | APP الصيدلة ، (شومبرغ ، IL) | 918610 | |
| الغشاء الرقيق مصفوفة الاصطناعية (Biobrane) | Bertek الصيدلة ، (مورغانتاون ، WV) | 62794-096-251 | |
| الاصطناعي الجافية | جور يستبعد دورا MVP البديل ، WL غور وشركاه ، و(فلاغستاف ، من الألف إلى الياء) | 1MVP40 | |
| خيوط الحرير 5-0 | Ethicon ، وشركة (سوميرفيل ، ونيو جيرسي) | K - 580 | |
| مقاطع الجرح | الكمال -- الترجمة Ets Bruneau (Burnea ، فرنسا) | A75 | |
| فلوري stereomicroscope | لايكا مايكروسيستمز ، (يتزلا ، ألمانيا) | MZ16 | |
| كاميرا CCD | هاماماتسو ، (بريدجووتر ، ونيو جيرسي) | ORCA - Rx2 | |
| درجة الحرارة المراقب المالي | العالم الدقة الثمينة (ساراسوتا ، فلوريدا) | 1000 ATC | |
| Metamorph البرمجيات | الأجهزة الجزيئية (سانيفيل كاليفورنيا) | ||
| فوتوشوب | أدوبي سيستمز ، سان خوسيه ، كاليفورنيا |
References
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Lichtman, J. W., Sanes, J. R. Watching the neuromuscular junction. J Neurocytol. 32, 767-775 (2003).
- Bishop, D. L., Misgeld, T., Walsh, M. K., Gan, W. B., Lichtman, J. W. Axon branch removal at developing synapses by axosome shedding. Neuron. 44, 651-661 (2004).
- Balice-Gordon, R. J., Lichtman, J. W. in vivo visualization of the growth of pre- and postsynaptic elements of neuromuscular junctions in the mouse. J Neurosci. 10, 894-908 (1990).
- Trachtenberg, J. T. Long-term in vivo imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420, 788-794 (2002).
- Pan, F., Gan, W. B. Two-photon imaging of dendritic spine development in the mouse cortex. Dev Neurobiol. 68, 771-778 (2008).
- Grutzendler, J., Gan, W. B. Two-photon imaging of synaptic plasticity and pathology in the living mouse brain. NeuroRx. 3, 489-496 (2006).
- Kerschensteiner, M., Schwab, M. E., Lichtman, J. W., Misgeld, T. in vivo imaging of axonal degeneration and regeneration in the injured spinal cord. Nat Med. 11, 572-577 (2005).
- Misgeld, T., Nikic, I., Kerschensteiner, M. in vivo imaging of single axons in the mouse spinal cord. Nat Protoc. 2, 263-268 (2007).
- Davalos, D. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169, 1-7 (2008).
- Maio, D. D. i in vivo imaging of dorsal root regeneration: Rapid immobilization and presynaptic differentiation at the CNS/PNS border. Journal of Neuroscience. 31, 4569-4582 (2011).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved