É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagens ao vivo de axônios da raiz dorsal após rizotomia
Neste Artigo
Resumo
Um In vivo Imagem de protocolo para monitor principal axônios sensitivos seguintes esmagar raiz dorsal é descrito. Utilizar os procedimentos de campo amplo de microscopia de fluorescência e thy1-YFP camundongos transgênicos, e permitir que imagens repetidas de regeneração de axônios mais de 4 cm no PNS e interações com a interface do axônio do SNC.
Resumo
Os axônios sensoriais primárias feridos por lesões de raízes nervosas não conseguem regenerar na medula espinhal, levando à dor crônica e perda sensorial permanente. Regeneração da raiz dorsal (DR) em axônios da medula espinhal é impedido na raiz dorsal entrada de zona (DREZ), a interface entre o CNS e PNS. Nossa compreensão dos eventos moleculares e celulares que impedem a regeneração em DREZ está incompleto, em parte porque as mudanças complexas associadas a lesão do nervo ter sido deduzida a partir de análises pós-morte. Dinâmicos processos celulares, tais como a regeneração de axônios, são melhor estudadas com técnicas que capturam eventos em tempo real com múltiplas observações de cada animal vivo. Nossa capacidade de acompanhar os neurônios em série in vivo aumentou dramaticamente devido a inovações revolucionárias em óptica e transgênicos mouse. Várias linhas de camundongos transgênicos thy1-GFP, na qual subconjuntos de neurônios são geneticamente distintos rotulados em cores fluorescentes, permitem que os neurônios individuais a ser trabalhada in vivo 1. Esses camundongos têm sido amplamente utilizadas para in vivo de imagens de músculo 2-4 e 5-7 cérebro, e forneceram introspecções novas nos mecanismos fisiológicos que análises estáticas não poderia ter resolvido. Estudos de imagem de neurônios da medula espinhal em viver só recentemente começaram. Lichtman e seus colegas demonstraram a sua viabilidade através do rastreamento feridos coluna dorsal (DC) com axônios de grande campo de microscopia de 8,9. Multi-fotão in vivo de imagens de axônios profundamente posicionado DC, microglia e os vasos sanguíneos também tem sido realizados 10. Ao longo dos últimos anos, somos pioneiros na aplicação de imagem in vivo para monitorar a regeneração de axônios DR usando gama microscopia de campo e linha de H thy1-YFP camundongos. Esses estudos nos levaram a uma nova hipótese sobre por que os axônios DR são impedidos de regeneração dentro da medula espinhal 11.
H em linha de thy1-YFP ratos, distinto axônios YFP + são superficialmente posicionado, o que permite que vários axônios ser monitorados simultaneamente. Aprendemos que os axônios DR chegar a DREZ são melhores visualizados na lombar do que na medula espinhal cervical. No presente relatório, nós descrevemos várias estratégias que temos encontrado útil para garantir a imagem de longo prazo e repetiu sucesso dos axônios em regeneração DR. Estes incluem métodos que eliminam intubação repetidas e interrupção respiratória, minimizar a cirurgia associada à tensão e formação de cicatrizes, e adquirir imagens estáveis em alta resolução sem fototoxicidade.
Protocolo
1. Microscópio de configurar e preparação de imagens
- Nossa imagem criada é constituída de um estereomicroscópio Leica MZ16 fluorescente com um disparo mais rápida e uma câmera CCD refrigerado controlado por software Metamorph.
- Prepare uma almofada de aquecimento controlada por termostato e ajustar a saída de 32,5 ° C para manter a temperatura corporal do animal durante e após a cirurgia.
- Solução de Ringer estéril morna ou líquido cefalorraquidiano artificial (ACSF) a 32,5 ° C com antecedência para a irrigação da medula espinhal durante a cirurgia.
- Anestesiar o animal com uma injeção intraperitoneal de xilazina (8 mg / kg) e ketamina (120 mg / kg) cocktail.
- Raspar a parte superior das costas com cortadores de pequenos animais e espalhe uma pequena gota de depilação loção sobre a área depilada com cotonetes. Minutos depois, remova a loção aplicada usando 70% de etanol esponjas gaze embebida.
2. Laminectomia e exposição cirúrgica da raiz dorsal L5
- Colocar o animal em uma aquecida (32,5 ° C) pad e desinfectar a pele com compressas embebidas etanol 70%.
- Sob iluminação de campo claro no estereomicroscópio, realizar uma incisão mediana (2 - 3 cm) na pele das costas. Se necessário, use cotonetes para parar o sangramento.
- Refletem a musculatura da coluna vertebral para expor as vértebras lombares subjacente.
- Expor os segmentos L3-S1 da coluna do lado direito por hemi-laminectomia usando fórceps de pequeno porte. A laminectomia parcial expondo 4-6 segmentos da medula lombar e sacral da coluna vertebral é criado por eliminar a parte direita dorsal das vértebras L5 ao nível da crista ilíaca do quadril (localização da DRG L5) rostralmente para as vértebras L2 (2 vértebras caudais para a última costela). Perfundir a cavidade com solução de Ringer estéril morna do.
- A posição do animal em uma almofada de apoio (gaze de algodão laminado) para achatar a coluna vertebral. Use ganchos retração para ampliar a área exposta.
- Neste ponto (aproximadamente 30 minutos após a primeira injeção ip de anestésico, um suplemento (0,5 X) deve ser administrado por via subcutânea, a fim de manter o animal anestesiado totalmente. Alternativamente anestesia gás, (2-4% isoflurano em oxigênio 0.5L/min ) pode ser usado para anestesiados repetida durante as sessões de imagem mais de 1 hora.
3. Rizotomia / esmagar raiz dorsal
- Mudar para a excitação de fluorescência para visualizar YFP rotulados (+) axônios.
- Usando a ponta de uma Sub-Q agulha (26ga.), realizar uma pequena incisão na dura-máter que recobre a raiz dorsal L5 (DR). Perfundir repetidamente com solução de Ringer e limpa suavemente com cotonetes.
- Identificar o local a ser esmagada e inserir um dos lados de uma pinça fina (Dumont # 5) subdurally.
- Fechar a pinça delicadamente mas com firmeza, segurando a parte medial da raiz L5 por 10 segundos, e depois gentilmente liberamos o fórceps.
- Lavar várias vezes com solução fisiológica e limpa suavemente com cotonetes.
4. Aquisição de imagem e pós-op procedimentos
- Obter várias imagens de toda a área exposta, incluindo o local do esmagamento ea DREZ antes e logo após o esmagamento em ambos ampliação baixa e alta.
- Imagens são adquiridas tanto como snapshots único ou como múltiplos fluxos de 10 a 20 quadros adquiridos dentro de 30 - para 40 ms de tempo de exposição. Em foco imagens são então selecionados, e uma montagem panorâmica é criada posteriormente utilizando Photoshop.
- Para minimizar a formação de cicatriz, bem aplicar um pedaço de membrana de matriz fina sintética (Biobrane), seguida pela dura artificial, no alto da medula espinal exposta. Certifique-se de peças cortadas para caber exatamente na janela medula espinal exposta de modo que sejam aderentes à medula espinhal.
- Feche a musculatura com estéril 5-0 e fechar a incisão mediana com clipes ferida.
- Injetar solução de Ringer (0,3 a 0,5 ml por via subcutânea), e administrar a buprenorfina como analgesia pós-operatória (0,05 mg / kg) por via subcutânea a cada 12 h durante 2 dias.
- Manter o animal em uma almofada de aquecimento (34 ° -35 ° C) até que se recuperou.
5. Imagem repetida
- Anestesiar o animal e remover os clipes de feridas e suturas.
- Remover dura artificial e finas manchas membrana sintética matriz e mantê-los em um tubo estéril contendo solução de Ringer para reutilização posterior.
- Remova com cuidado o tecido cicatricial acumulado conjuntivo com a ponta de uma agulha dobrada Sub-Q e uma pinça fina. Perfundir freqüentemente com solução de Ringer quente é.
- Re-expor o campo operatório, incluindo local do esmagamento e DREZ, relocar YFP + axônios fotografada em sessões anteriores, e repetir os procedimentos descritos na seção 4.
6. Resultados representativos:
Temos observado que, enquanto eles não regenerar após uma lesão transecção, quase todos os axônios + YFP cresceu através do site daferimento por 3 dias após esmagar (Figura 1) 11. Tipicamente, no dia seguinte após esmagar, observou-se a morrer-back degeneração de axônios do coto proximal e fragmentação / degeneração dos axônios distais à mesma paixão, que confirmaram que tinham sido devidamente axônios danificados (por exemplo, a Figura 1; Dia 3 e 5) . Vários critérios adicionais são aplicadas de forma inequívoca distinguir axônios em regeneração de axônios que foram poupados ou tinha recuperado da lesão. Estes incluíram o seguinte: (1) axônios em regeneração mostram uma expansão da porção não-fluorescente do YFP + axônio no local do esmagamento devido à degeneração proximal e distal (em contraste com a redução da diferença unlabeled devido ao citoplasma fluorescentes recarga do local do esmagamento axônios se sobreviveu ao ferimento), (2) axônios em regeneração muito mais fino, menos brilhante fluorescente, e mais ondulado do que os axônios que sobreviveram à lesão; (3) neurites regeneração são mais finas e mais fracamente fluorescentes que os fragmentos de axônios em degeneração fluorescente através da qual eles estenderam; (4) em contraste com a sobrevivência ou poupado axônios, os axônios em regeneração parar no DREZ e (5) em contraste com a sobrevivência ou poupado axônios, os axônios em regeneração não apresentam nódulos de Ranvier. A Figura 1 mostra quatro axônios YFP superficial + imediatamente após esmagar (A1; setas coloridas). Três dias após o esmagamento, todos os quatro axônios estender uma neurite única que cresce através do site paixão (A2). Cinco dias após esmagar, neurites permanecer estável e não há um crescimento adicional de estes ou outros axônios proximal (A3).
O neurites regeneração que atravessou o site esmagar alongada através muito mais espessa e mais brilhante fluorescente fragmentos de um axônio em degeneração (ou seja, tubos endoneuro), e chegar ao DREZ tão cedo quanto 4 dias após o esmagamento (cerca de 3 milímetros / 2 dias) 11. Imagem repetida destes axônios e suas pontas a cada dois ou três dias por mais duas semanas (Figura 2) revelou que eles não crescer ou retrair a frente, mas permaneceu imóvel. A única mudança visível foi o inchaço das pontas e eixos de alguns axônios. Estas observações mostram pois imobilização surpreendentemente rápida e crônica da axônios em regeneração na DREZ.
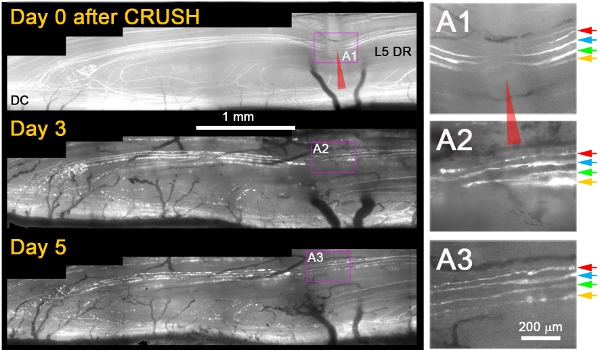
Figura 1: imagem repetida de L5 DR YFP + axônios no local do esmagamento da raiz dorsal durante 5 dias. A porção medial da raiz L5 foi esmagado (vermelho ponta de seta) e fotografada nos dias 0, 3 e 5 após o esmagamento. A área de esmagamento é ampliada nos painéis à direita (A1-A3).

Figura 2:. Imagem repetida de axônios chegou ao DREZ mais de 20 dias após o esmagamento da raiz L5 Dia 4, três axônios (setas coloridas) chegou ao DREZ. As pontas desses axônios permanecem no mesmo local e têm uma aparência semelhante nas sessões subseqüentes imagem nos dias 7, 9, 13, 15 e 20. Posições de uma dica em relação ao axônio axônio outras dicas e marcos (asteriscos) foram usados para determinar a motilidade axônio entre as sessões de imagem.
Access restricted. Please log in or start a trial to view this content.
Discussão
DR regeneração imagem diretamente em ratos vivos é particularmente desafiador, porque exige uma laminectomia dorsal substancial para monitorar o crescimento do axônio em uma ampla área seguido por vários procedimentos cirúrgicos invasivos e anestésico em sessões de imagem subseqüentes. Várias estratégias ajudaram a superar esses desafios. De imagem, primeiro sucesso requerida a redução da mortalidade mouse (aproximadamente 25%), minimizando a duração da anestesia e sangramento, e pelo cuidado pós-operat...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos ao Dr. Alan Tessler para comentários e ajudar a editorial. Este trabalho foi financiado pelo NIH NS062320.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
|---|---|---|---|
| H linha thy1-YFP (2-4 meses de idade, ambos os sexos) | Jackson Laboratory (Bar Harbor, ME) | 003782 | |
| Xilazina (injeção AnaSed, solução estéril) | Lloyd Laboratories, (Shenandoah, LA) | 4811 | 8 mg / kg |
| Ketamina (injeção de cloridrato de ketamina, USP) | Hospira, Inc. (Lake Forest, IL) | 2051 | 120 mg / kg |
| Buprenorfina (Buprenex injetável) (0,05 mg / kg) | Reckitt Benckiser Pharmaceuticals Inc. (Richmond, VA) | 7571 | |
| Cortar cabelo de pequenos animais | Oster Professional, (McMinnville, TN) | 76059-030 | |
| Loção depilação | Church & Dwight Co. (Princeton, NJ) | NAIR com Baby Oil | |
| Esponjas de gaze | Fisher Scientific, (Pittsburgh, PA) | 22-362-173 | |
| Cotonetes | Fisher Scientific, (Pittsburgh, PA) | 14-960-3T | |
| Seringas de 1 mL | Becton, Dickson and Company Franklin Lakes, NJ) | 309602 | |
| Subcutânea (Sub-Q) agulhas, 26ga. | Becton, Dickson and Company (Franklin Lakes, NJ) | 305115 | |
| Tesouras e pinças de primavera | Multa Ferramentas Science, (Foster City, CA) | ||
| De 2,5 mm fórceps curvos | Multa Ferramentas Science, (Foster City, CA) | 16221-14 | |
| Injeção de Ringer com lactato USP | B. Braun Medical Inc., (Irvine, CA) | BBR-L7502 | |
| Solução salina estéril | APP Pharmaceuticals, (Schaumburg, IL) | 918610 | |
| Membrana fina matriz sintética (Biobrane) | Bertek Pharmaceuticals, (Morgantown, WV) | 62794-096-251 | |
| Artificial dura | Gore Impedir MVP Substituto Dura, WL Gore and Associates, (Flagstaff, AZ) | 1MVP40 | |
| 5-0 de seda | Ethicon, Inc. (Somerville, NJ) | K-580 | |
| Grampos de sutura | Perfeito - Ets Bruneau, (Burnea, França) | A75 | |
| Estereomicroscópio fluorescentes | Leica Microsystems, (Wetzlar, Alemanha) | MZ16 | |
| CCD da câmera | Hamamatsu, (Bridgewater, NJ) | ORCA-Rx2 | |
| Controlador de temperatura | Mundial Precision Instruments (Sarasota, FL) | ATC 1000 | |
| Metamorph software | Os dispositivos moleculares, (Sunnyvale, CA) | ||
| Photoshop | Adobe Systems, San Jose, CA |
Referências
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Lichtman, J. W., Sanes, J. R. Watching the neuromuscular junction. J Neurocytol. 32, 767-775 (2003).
- Bishop, D. L., Misgeld, T., Walsh, M. K., Gan, W. B., Lichtman, J. W. Axon branch removal at developing synapses by axosome shedding. Neuron. 44, 651-661 (2004).
- Balice-Gordon, R. J., Lichtman, J. W. in vivo visualization of the growth of pre- and postsynaptic elements of neuromuscular junctions in the mouse. J Neurosci. 10, 894-908 (1990).
- Trachtenberg, J. T. Long-term in vivo imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420, 788-794 (2002).
- Pan, F., Gan, W. B. Two-photon imaging of dendritic spine development in the mouse cortex. Dev Neurobiol. 68, 771-778 (2008).
- Grutzendler, J., Gan, W. B. Two-photon imaging of synaptic plasticity and pathology in the living mouse brain. NeuroRx. 3, 489-496 (2006).
- Kerschensteiner, M., Schwab, M. E., Lichtman, J. W., Misgeld, T. in vivo imaging of axonal degeneration and regeneration in the injured spinal cord. Nat Med. 11, 572-577 (2005).
- Misgeld, T., Nikic, I., Kerschensteiner, M. in vivo imaging of single axons in the mouse spinal cord. Nat Protoc. 2, 263-268 (2007).
- Davalos, D. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169, 1-7 (2008).
- Maio, D. D. i in vivo imaging of dorsal root regeneration: Rapid immobilization and presynaptic differentiation at the CNS/PNS border. Journal of Neuroscience. 31, 4569-4582 (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados