Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Live-Imaging von Spinalganglien Axone nach Rhizotomie
In diesem Artikel
Zusammenfassung
Ein In vivo Bildgebungsprotokoll zu primären sensorischen Axone folgenden Spinalganglien crush-Monitor beschrieben. Die Verfahren nutzen wide-field Fluoreszenzmikroskopie und THY1-YFP transgenen Mäusen, und erlauben wiederholte Bildgebung Axonregeneration über 4 cm im PNS und Axon Wechselwirkungen mit der Oberfläche des ZNS.
Zusammenfassung
Die primären sensorischen Axone durch spinale Verletzungen verletzt ausfallen, um in das Rückenmark zu regenerieren, was zu chronischen Schmerzen und dauerhaften Verlust der Empfindung. Regeneration der Spinalganglien (DR) Axone in das Rückenmark an der Spinalganglien Eingangszone (Drez), die Schnittstelle zwischen dem ZNS und PNS verhindert. Unser Verständnis der molekularen und zellulären Vorgänge Regeneration bei Drez zu verhindern, ist unvollständig, zum Teil, weil komplexe Änderungen mit Nervenverletzung verbunden von postmortalen Analysen abgeleitet worden sind. Dynamische zelluläre Prozesse, wie Axonregeneration, werden am besten mit Techniken, die Echtzeit-Ereignisse mit mehreren Beobachtungen von jedem lebenden Tier einzufangen untersucht. Unsere Fähigkeit, Neuronen seriell in vivo-Monitor hat dramatisch zugenommen aufgrund revolutionäre Innovationen in der Optik-und Maus-Transgenen. Mehrere Linien der THY1-GFP transgenen Mäusen, bei denen Teilmengen von Neuronen genetisch in unterschiedlichen fluoreszierenden Farben markiert, ermöglichen individuelle Neuronen in vivo 1 abgebildet werden. Diese Mäuse wurden umfassend in-vivo-Bildgebung von Muskel 2-4 und 5-7 Gehirn verwendet, und sofern neue Einblicke in physiologische Mechanismen, die statischen Analysen nicht gelöst haben könnte. Imaging-Studien von Neuronen im Rückenmark leben erst seit kurzem. Lichtman und seine Kollegen demonstrierten ihre Realisierbarkeit durch die Verfolgung verletzt dorsalen Spalte (DC) Axone mit Weitfeldmikroskopie 8,9. Multi-Photonen-in-vivo-Bildgebung von tief positioniert DC Axone hat Mikroglia und Blutgefäße, auch schon 10 erreicht. In den letzten Jahren haben wir bei der Anwendung in-vivo-Bildgebung, um die Regeneration von Axonen DR mit Weitwinkel-Mikroskopie und H-Linie von THY1-YFP Mäusen Monitor Pionierarbeit. Diese Studien haben wir eine neuartige Hypothese darüber, warum DR Axone sind aus nachwachsenden innerhalb des Rückenmarks 11 verhindert geführt.
In H-Linie von THY1-YFP Mäusen unterscheiden YFP + Axone oberflächlich positioniert, die ermöglicht, dass mehrere Axone gleichzeitig überwacht werden. Wir haben gelernt, dass DR Axone Ankunft am Drez besser in Lendenwirbelsäule als im zervikalen Rückenmarks abgebildet. In dem vorliegenden Bericht beschreiben wir verschiedene Strategien, die wir als nützlich erwiesen, um langfristig erfolgreich und wiederholte Bildgebung zu regenerieren DR Axone zu gewährleisten haben. Dazu gehören Methoden, die wiederholt Intubation und Atemwege Unterbrechung zu beseitigen, zu minimieren Chirurgie-assoziierten Stress und Narbenbildung, und erwerben stabile Bilder mit hoher Auflösung ohne Phototoxizität.
Protokoll
1. Mikroskop aufgebaut und Imaging-Vorbereitung
- Unsere bildgebenden Einrichtung besteht aus einem Leica MZ16 fluoreszierenden Stereomikroskop mit einer schnellen Verschlusszeit und eine gekühlte CCD-Kamera von Metamorph-Software gesteuert.
- Bereiten Sie einen thermostatisch geregelten Heizkissen und passen Ausgang bis 32,5 ° C zu halten das Tier seine Körpertemperatur während und nach der Operation.
- Warm sterile Ringer-Lösung oder künstliche Liquor (ACSF) bis 32,5 ° C im Voraus für die Bewässerung des Rückenmarks während der Operation.
- Anesthetize das Tier mit einer intraperitonealen Injektion von Xylazin (8 mg / kg) und Ketamin (120 mg / kg) Cocktail.
- Shave den oberen Rücken mit kleinen Tierschermaschinen und verbreiten einen kleinen Tropfen der Haarentfernung Lotion über die rasierte Fläche mit Wattestäbchen Abstriche. Minuten später, entfernen Sie die Anwendung Lotion mit 70% igem Ethanol getränkten Gaze Schwämme.
2. Laminektomie und chirurgische Freilegung der L5 Spinalganglien
- Legen Sie das Tier auf einem beheizten (32,5 ° C) pad und desinfizieren die Haut mit 70% Ethanol getränkten Wattestäbchen.
- Unter Hellfeldbeleuchtung auf dem Stereomikroskop, führen Sie einen Medianschnitt (2 - bis 3-cm) in der Haut des Rückens. Falls erforderlich, verwenden Wattestäbchen Abstriche, um die Blutung zu stoppen.
- Spiegeln die Muskulatur der Wirbelsäule auf die zugrunde liegende Lendenwirbel aussetzen.
- Setzen Sie die L3-S1 Wirbelsäulensegmente durch rechtsseitige Hemi-Laminektomie mit kleinen Rongeure. Eine partielle Laminektomie auszusetzen 4-6 Segmenten der Lenden-und sakralen Rückenmark wird durch Entfernen der rechten dorsalen Teil des L5 Wirbel auf der Ebene der dem Beckenkamm des Hüftgelenkes (Standort der L5 DRG) rostral der L2 Wirbel (2 erstellt Wirbel kaudal der letzten Rippe). Perfundieren den Hohlraum mit warmen sterile Ringer-Lösung.
- Position des Tieres auf einem Stützkissen (gerollt Baumwollgaze), um die Wirbelsäule zu glätten. Verwenden Sie Einfahren Haken auf den Bereich zu erweitern.
- Zu diesem Zeitpunkt (ca. 30 Minuten nach dem ersten ip Injektion von Anästhetika, eine Ergänzung (0.5X) subkutan injiziert werden, um zu halten das Tier vollständig betäubt. Alternativ-, Gas-Anästhesie (2-4% Isofluran in 0.5L/min Sauerstoff ) kann bei wiederholter Betäubung während der Bildgebung, die länger als 1 Stunde genutzt werden.
3. Rhizotomie / Spinalganglien crush
- Wechseln Sie zu Fluoreszenzanregung zu visualisieren YFP markierten (+) Axone.
- Mit der Spitze eines Sub-Q (26ga.) Nadel, führen Sie einen kleinen Einschnitt in die Dura über der L5 Spinalganglien (DR). Perfundieren wiederholt mit Ringer-Lösung und reinigen Sie vorsichtig mit Wattestäbchen Abstriche.
- Identifizieren Sie die Website zu zerschlagen werden und legen Sie eine Seite einer feinen Pinzette (Dumont Nr. 5) subdural.
- Schließen Sie die Zange vorsichtig, aber fest und hält den medialen Teil des L5-Wurzel für 10 Sekunden, und dann sanft Release der Zange.
- Wash wiederholt mit physiologischer Kochsalzlösung und sauber vorsichtig mit Wattestäbchen Abstriche.
4. Bildaufnahme und post-op Verfahren
- Erhalten Sie mehrere Bilder der gesamten exponierten Bereich einschließlich der Andrang vor Ort und die Drez vor und direkt nach der Andrang bei niedrigen und hohen Vergrößerungen.
- Die Bilder werden entweder als einzelne Schnappschüsse oder als mehrere Streams von 10 bis 20 Frames innerhalb von 30 Unternehmen erworben - bis 40-ms Belichtungszeit. In-Fokus-Bilder werden dann ausgewählt und einen Überblick montage entsteht später mit Photoshop.
- Zur Minimierung der Narbenbildung, dicht gelten ein Stück dünnen synthetischen Matrix-Membran (Biobrane), gefolgt von künstlichen dura gefolgt, auf der exponierten Rückenmark. Achten Sie darauf, Stücke geschnitten passgenau in die freigelegte Rückenmark Fenster, so dass sie Anhänger des Rückenmarks sind.
- Schließen Sie die Muskulatur mit sterilem Nahtmaterial 5-0 und in der Nähe der Mittellinie Schnitt mit Wundklammern.
- Inject Ringer-Lösung (0,3-bis 0,5-ml subkutan), und zu verwalten, Buprenorphin als postoperative Analgesie (0,05 mg / kg) subkutan alle 12 h für 2 Tage.
- Halten Sie das Tier auf einem Heizkissen (34 ° -35 ° C) bis erholt.
5. Wiederholte Bildgebung
- Anesthetize das Tier, und entfernen Sie die Wunde Clips und Nähte.
- Entfernen künstliche Dura und dünne synthetische Matrix Membranflecken und halten sie in einem sterilen Röhrchen mit Ringer-Lösung für die spätere Wiederverwendung.
- Entfernen Sie vorsichtig die kumulierte Bindegewebe Narbe mit der gebogenen Spitze eines Sub-Q Nadel und feinen Pinzette. Perfundieren häufig mit warmen Ringer-Lösung.
- Re-Setzen der operative Bereich, einschließlich crush Website und Drez, verlagern YFP + Axone in früheren Sitzungen abgebildet, und wiederholen Sie die in Abschnitt 4 beschrieben.
6. Repräsentative Ergebnisse:
Wir haben beobachtet, dass, während sie nicht nach einer Durchtrennung Verletzungen regenerieren sich, fast alle YFP + Axone über die Website von wuchsenVerletzungen von 3 Tagen nach crush (Abbildung 1) 11. In der Regel am nächsten Tag nach crush, beobachteten wir sterben-zurück-Degeneration proximalen Stumpf Axonen und Fragmentierung / Degeneration der Axone gleichen distal der zerquetschen, was bedeutet, dass Axone war entsprechend beschädigt bestätigt (z. B. Abbildung 1; Tag 3 und 5) . Mehrere zusätzliche Kriterien angewendet werden, um eindeutig zu unterscheiden regenerierenden Axone von Axonen, die verschont wurden oder hatte von der Verletzung erholt. Dazu gehörten die folgenden: (1) regenerierenden Axone zeigen eine Erweiterung der nicht-fluoreszierenden Teil des YFP + Axon das Gedränge vor Ort durch proximale und distale Degeneration (im Gegensatz zu einer Verengung der unmarkierten Lücke durch fluoreszierende Zytoplasma Nachfüllen der Andrang vor Ort Wenn Axone überlebte die Verletzung), (2) regenerierenden Axonen sind viel dünner, weniger hell fluoreszierendes und mehr welligen als Axone, dass die Verletzung überlebt, (3) Regeneration Neuriten sind dünner und schwach fluoreszierenden als die degenerierenden fluoreszierenden Fragmente der Axone durch die sie verlängert, (4) im Gegensatz zu überleben oder Axonen verschont, regenerierenden Axonen an der Drez stoppen, und (5) im Gegensatz zu überleben oder Axonen verschont, regenerierenden Axonen zeigen keine Knoten Ranvier. Abbildung 1 zeigt vier oberflächlichen YFP + Axone unmittelbar nach crush (A1; farbige Pfeile). Drei Tage nach dem Gedränge, erweitern alle vier Axone einem Neuriten, dass durch das Gedränge vor Ort (A2) wächst. Fünf Tage nach crush, bleiben Neuriten stabil und es gibt keine zusätzlichen Wachstum von diesen oder anderen proximalen Axone (A3).
Die Regeneration von Neuriten, dass das Gedränge vor Ort durch viel dicker und heller fluoreszierende Fragmente eines degenerierenden Axon (dh endoneuralen Rohre) längliche gekreuzt, und kommen zu dem Drez bereits 4 Tage nach der Andrang (ca. 3mm / 2 Tage) 11. Wiederholte Bildgebung dieser Axone und ihre Spitzen alle zwei oder drei Tage für zwei weitere Wochen (Abbildung 2) ergab, dass sie nicht nach vorne wachsen oder zurückzunehmen, blieb aber unbeweglich. Die einzige merkliche Veränderung wurde von den Spitzen und Wellen von einigen Axonen Schwellung. Diese Beobachtungen zeigen somit überraschend schnell und chronische Immobilisation der regenerierenden Axone bei der Drez.
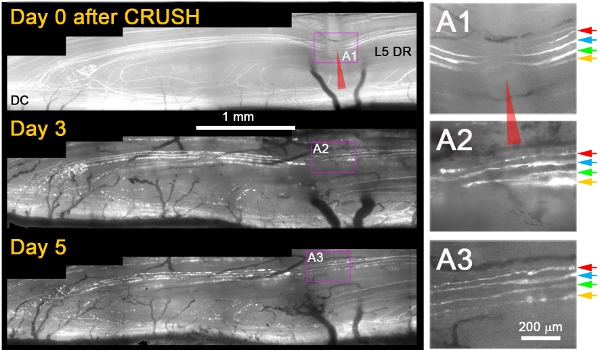
Abbildung 1: Wiederholte Bildgebung von L5 DR YFP + Axone an der Stelle der Spinalganglien crush über 5 Tage. Der mediale Teil der L5-Wurzel war am Boden zerstört (rot Pfeilspitze) und abgebildet an den Tagen 0, 3 und 5 nach dem Gedränge. Der Bereich der Andrang ist in der rechten Panels (A1-A3) vergrößert.

Abbildung 2:. Wiederholte Bildgebung von Axonen kam zu dem Drez über 20 Tage nach L5-Wurzel crush Tag 4, drei Axone (farbige Pfeile) kam zu dem Drez. Die Spitzen dieser Axone bleiben in der gleichen Lage und haben ein ähnliches Aussehen in aufeinander folgenden Sitzungen an den Tagen 7, 9, 13, 15 und 20. Die Positionen der ein Axon Spitze im Vergleich zu anderen Axon Tipps und Sehenswürdigkeiten (Sternchen) wurden verwendet, um Axon Motilität zwischen Imaging-Sessions zu bestimmen.
Diskussion
Imaging DR Regeneration direkt in lebenden Mäusen ist eine besondere Herausforderung, weil es eine erhebliche dorsale Laminektomie benötigt, um Axon-Wachstum über einen weiten Bereich von mehreren invasive chirurgische und Anästhesieverfahren in aufeinander folgenden Sitzungen folgten überwachen. Mehrere Strategien dazu beigetragen, diese Herausforderungen zu meistern. Erste erfolgreiche Bildgebung erforderlich Reduzierung Maus Mortalität (ca. 25%) durch die Minimierung der Dauer der Narkose und Blutungen, und dur...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken Herrn Dr. Alan Tessler für Kommentare und Leitartikel zu helfen. Diese Arbeit wurde vom NIH NS062320 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| H-Linie THY1-YFP (2-4 Monate alt, beiderlei Geschlechts) | Jackson Laboratory (Bar Harbor, ME) | 003782 | |
| Xylazin (AnaSed Injektion, sterile Lösung) | Lloyd Laboratories, (Shenandoah, LA) | 4811 | 8 mg / kg |
| Ketamin (Ketamin-Hydrochlorid Injektion, USP) | Hospira, Inc. (Lake Forest, IL) | 2051 | 120 mg / kg |
| Buprenorphin (Buprenex injizierbare) (0,05 mg / kg) | Reckitt Benckiser Pharmaceuticals Inc. (Richmond, VA) | 7571 | |
| Kleintier-Haarschneidemaschinen | Oster Professional, (McMinnville, TN) | 76059-030 | |
| Haarentfernung Lotion | Church & Dwight Co. (Princeton, NJ) | NAIR mit Baby-Öl | |
| Gazetupfer | Fisher Scientific, (Pittsburgh, PA) | 22-362-173 | |
| Wattestäbchen Abstriche | Fisher Scientific, (Pittsburgh, PA) | 14 bis 960-3Q | |
| 1 ml-Spritzen | Becton, Dickson and Company Franklin Lakes, NJ) | 309602 | |
| Subkutane (Sub-Q) Nadeln, 26ga. | Becton, Dickinson und Company (Franklin Lakes, NJ) | 305115 | |
| Frühling Schere und Pinzette | Feine Science Tools, (Foster City, CA) | ||
| 2,5-mm gebogene Rongeure | Feine Science Tools, (Foster City, CA) | 16221-14 | |
| Ringer-Laktat-Injection USP | B. Braun Medical Inc., (Irvine, CA) | BBR-L7502 | |
| Sterile Kochsalzlösung | APP Pharmaceuticals, (Schaumburg, IL) | 918610 | |
| Thin synthetischen Matrix-Membran (Biobrane) | Bertek Pharmaceuticals, (Morgantown, WV) | 62794-096-251 | |
| Künstliche dura | Gore Rückweisungen MVP Dura Substitute, WL Gore and Associates, (Flagstaff, AZ) | 1MVP40 | |
| 5-0 Seidenfäden | Ethicon, Inc. (Somerville, NJ) | K-580 | |
| Wound-Clips | Perfect - Ets Bruneau, (Burnea, Frankreich) | A75 | |
| Fluorescent Stereomikroskop | Leica Microsystems (Wetzlar, Deutschland) | MZ16 | |
| CCD-Kamera | Hamamatsu (Bridgewater, NJ) | ORCA-Rx2 | |
| Temperaturregler | World Precision Instruments (Sarasota, FL) | ATC 1000 | |
| Metamorph-Software | Molecular Devices (Sunnyvale, CA) | ||
| Photoshop | Adobe Systems, San Jose, CA |
Referenzen
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Lichtman, J. W., Sanes, J. R. Watching the neuromuscular junction. J Neurocytol. 32, 767-775 (2003).
- Bishop, D. L., Misgeld, T., Walsh, M. K., Gan, W. B., Lichtman, J. W. Axon branch removal at developing synapses by axosome shedding. Neuron. 44, 651-661 (2004).
- Balice-Gordon, R. J., Lichtman, J. W. in vivo visualization of the growth of pre- and postsynaptic elements of neuromuscular junctions in the mouse. J Neurosci. 10, 894-908 (1990).
- Trachtenberg, J. T. Long-term in vivo imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420, 788-794 (2002).
- Pan, F., Gan, W. B. Two-photon imaging of dendritic spine development in the mouse cortex. Dev Neurobiol. 68, 771-778 (2008).
- Grutzendler, J., Gan, W. B. Two-photon imaging of synaptic plasticity and pathology in the living mouse brain. NeuroRx. 3, 489-496 (2006).
- Kerschensteiner, M., Schwab, M. E., Lichtman, J. W., Misgeld, T. in vivo imaging of axonal degeneration and regeneration in the injured spinal cord. Nat Med. 11, 572-577 (2005).
- Misgeld, T., Nikic, I., Kerschensteiner, M. in vivo imaging of single axons in the mouse spinal cord. Nat Protoc. 2, 263-268 (2007).
- Davalos, D. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169, 1-7 (2008).
- Maio, D. D. i. in vivo imaging of dorsal root regeneration: Rapid immobilization and presynaptic differentiation at the CNS/PNS border. Journal of Neuroscience. 31, 4569-4582 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten