Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Живая съемка Спинной Аксоны Корневая после ризотомия
В этой статье
Резюме
В естественных условиях Изображение протокол для мониторинга первичных сенсорных аксонов следующие спинной раздавить корень описано. Процедуры использования широкого поля флуоресцентной микроскопии и thy1-YFP трансгенных мышей, и разрешить повторяющиеся изображения регенерации аксонов более 4 см в ПНС и аксонов взаимодействия с интерфейсом ЦНС.
Аннотация
The primary sensory axons injured by spinal root injuries fail to regenerate into the spinal cord, leading to chronic pain and permanent sensory loss. Regeneration of dorsal root (DR) axons into spinal cord is prevented at the dorsal root entry zone (DREZ), the interface between the CNS and PNS. Our understanding of the molecular and cellular events that prevent regeneration at DREZ is incomplete, in part because complex changes associated with nerve injury have been deduced from postmortem analyses. Dynamic cellular processes, such as axon regeneration, are best studied with techniques that capture real-time events with multiple observations of each living animal. Our ability to monitor neurons serially in vivo has increased dramatically owing to revolutionary innovations in optics and mouse transgenics. Several lines of thy1-GFP transgenic mice, in which subsets of neurons are genetically labeled in distinct fluorescent colors, permit individual neurons to be imaged in vivo1. These mice have been used extensively for in vivo imaging of muscle2-4 and brain5-7, and have provided novel insights into physiological mechanisms that static analyses could not have resolved. Imaging studies of neurons in living spinal cord have only recently begun. Lichtman and his colleagues first demonstrated their feasibility by tracking injured dorsal column (DC) axons with wide-field microscopy8,9. Multi-photon in vivo imaging of deeply positioned DC axons, microglia and blood vessels has also been accomplished10. Over the last few years, we have pioneered in applying in vivo imaging to monitor regeneration of DR axons using wide-field microscopy and H line of thy1-YFP mice. These studies have led us to a novel hypothesis about why DR axons are prevented from regenerating within the spinal cord11.
In H line of thy1-YFP mice, distinct YFP+ axons are superficially positioned, which allows several axons to be monitored simultaneously. We have learned that DR axons arriving at DREZ are better imaged in lumbar than in cervical spinal cord. In the present report we describe several strategies that we have found useful to assure successful long-term and repeated imaging of regenerating DR axons. These include methods that eliminate repeated intubation and respiratory interruption, minimize surgery-associated stress and scar formation, and acquire stable images at high resolution without phototoxicity.
протокол
1. Микроскоп настройки и подготовки изображений
- Наши изображения созданы состоит из Leica MZ16 флуоресцентного стереомикроскопа с быстрым затвором и охлаждением ПЗС-камера управляется программой Метаморф.
- Подготовка термостатом грелку и настроить выход до 32,5 ° С для поддержания температуры тела животного во время и после операции.
- Теплый стерильной раствор Рингера или искусственных спинномозговой жидкости (ACSF) до 32,5 ° C заранее для орошения спинного мозга во время операции.
- Обезболить животное с внутрибрюшинного введения ксилазина (8 мг / кг) и кетамина (120 мг / кг) коктейль.
- Бритье верхней части спины с небольшими кусачками животных и распространение одной маленькой капле лосьон для волос удаление над бритой области с хлопком тампоны. Через несколько минут, снимите применяется лосьон с использованием 70% этилового спирта пропитанные губки марлю.
2. Ламинэктомия и хирургическое воздействие на задний корешок L5
- Место животное на нагревают (32,5 ° С), блокнот и дезинфекции кожи с 70% этанола, пропитанные тампоны.
- Под яркого освещения поля на стереомикроскопа, выполните средней линии разрез (2 - и 3-см) в коже спины. При необходимости можно использовать хлопковые тампоны, чтобы остановить кровотечение.
- Отражение спинной мускулатуры раскрыть основные поясничных позвонков.
- Expose L3-S1 сегментов спинного от правосторонней геми-ламинэктомии с использованием малых rongeurs. Частичное ламинэктомии подвергая 4-6 сегментов поясничного и крестцового спинного мозга создается путем удаления право спинной части L5 позвонков на уровне гребня подвздошной кости тазобедренного сустава (расположение L5 DRG) рострально для L2 позвонков (2 позвонков хвостового до последнего ребра). Заливать полость раствором теплой стерильной Рингера.
- Позиция животное на поддержку подушке (прокат хлопковой марле), чтобы сгладить позвоночника. Используйте опровержение крючки расширить область отображения.
- В этот момент (примерно 30 минут после первой инъекции ф анестезии, дополнения (0,5) следует вводить подкожно, чтобы держать животное полностью под наркозом. Кроме того, газ анестезией (2-4% изофлуран в кислороде 0.5L/min ) может быть использован для повторного обезболивания во время съемки сессии более чем на 1 час.
3. Ризотомия / Спинной раздавить корень
- Переключение в режим возбуждения флуоресценции для визуализации YFP помечены (+) аксонов.
- Использование кончик Sub-Q (26ga.) иглы, выполнить небольшой разрез в твердой мозговой оболочки вышележащих задний корешок L5 (DR). Неоднократно заливать раствором Рингера и чистой осторожно ватой тампоны.
- Определить места, где будет раздавлен и вставить одну сторону штраф пинцет (Дюмон # 5) subdurally.
- Закрыть пинцетом осторожно, но твердо, держа медиальной части L5 болеть за 10 секунд, а затем аккуратно освободить щипцами.
- Вымойте неоднократно с физиологическим раствором и чистой осторожно ватой тампоны.
4. Приобретение изображений и послеоперационных процедур
- Получить несколько изображений всего пострадавшего района в том числе сайт сокрушить и DREZ до и сразу после раздавить при низких и высоких увеличениях.
- Изображения приобретаются либо в качестве одного снимки или несколько потоков от 10 до 20 фреймов в пределах 30 - 40-мс время экспозиции. В фокусе изображения потом выбрали, и обзор монтаж создан позже с помощью Photoshop.
- Чтобы свести к минимуму образование рубцов, плотно применять кусок тонкой синтетической мембраны матрицы (Biobrane), а затем искусственные оболочки, в верхней части подвергаются спинного мозга. Будьте уверены, чтобы разрезать фрагменты, чтобы соответствовать именно в подвергается спинного окна кабель так, что они являются приверженцами спинного мозга.
- Закрыть мускулатуры стерильным 5-0 швов и близких средней линии разрез раны клипов.
- Inject раствор Рингера (0,3 до 0,5 мл подкожно) и администрирования Бупренорфин как послеоперационного обезболивания (0,05 мг / кг) подкожно каждые 12 ч в течение 2 дней.
- Держите животное на грелку (34 ° -35 ° C), пока не восстановлены.
5. Повторные изображений
- Анестезию животного и удалить клипы раны и швы.
- Удалить искусственные оболочки и тонкие синтетические мембраны патчи матрицы и держать их в стерильную пробирку с раствором Рингера для дальнейшего использования.
- Осторожно удалите все накопленные шрам соединительной ткани с загнутым кончиком из Sub-Q и тонкой иглой щипцами. Заливать часто с раствором теплой Рингера.
- Повторно выставить операционного поля, в том числе сайт сокрушить и DREZ, переместите YFP + аксонов отображаемого на предыдущих сессиях, и повторите процедуры, описанные в разделе 4.
6. Представитель результаты:
Мы заметили, что, в то время как они не восстанавливаются после перерезки травмы, почти все аксоны YFP + вырос через сайттравмы на 3 дня после раздавить (рис. 1) 11. Как правило, на следующий день после разрушать, мы наблюдали умирают обратной дегенерации аксонов проксимальной культи и фрагментации / дегенерации аксонов же дистальнее измельчить, который подтвердил, что аксоны были надлежащим поврежден (например, на рисунке 1, 3-й день и 5) . Несколько дополнительных критериев, которые применяются к однозначно отличать регенерирующие аксоны из аксонов, которые были спасены или еще не оправилась от травмы. К ним относятся следующие: (1) регенерирующие аксоны показать расширение не-люминесцентные часть YFP + аксон на сокрушить сайт из-за проксимальных и дистальных дегенерации (в отличие от сужения немеченого разрыв в связи с люминесцентными цитоплазме заправки раздавить сайта если аксоны пережили травмы), (2) регенерирующие аксоны намного тоньше, менее яркие флуоресцентные, и больше, чем волнистые аксонов, которые пережили травму, (3) регенерирующим нейритов тоньше и более тускло, чем флуоресцентные вырождается флуоресцентные фрагменты аксонов, через которые они расширили; (4) в отличие от выживания или пощадил аксонов, регенерирующие аксоны останавливаться на DREZ; и (5) в отличие от выживания или пощадил аксонов, регенерирующие аксоны не проявляют перехватами Ранвье. На рисунке 1 показаны четыре поверхностных YFP + аксоны сразу после раздавить (A1; цветные стрелки). Через три дня после измельчить, все четыре аксонов расширить одного аксонов, которая растет через раздавить сайта (А2). Через пять дней после измельчить, невриты остаются стабильными, и нет дополнительного роста от этих или других проксимальных аксонов (A3).
Регенерирующим нейритов, которые пересекли раздавить сайт удлиненные через гораздо толще и ярче флуоресцентного фрагменты вырождается аксонов (т.е. endoneurial трубки), и прибыть в DREZ уже через 4 дня после раздавить (около 3 мм / 2 дня) 11. Повторная съемка этих аксонов и их советы каждые два-три дня в течение еще двух недель (рис. 2) показали, что они не росли вперед или отказаться, но оставался неподвижным. Единственное заметное изменение отек советы и валов некоторых аксонов. Эти наблюдения таким образом продемонстрировать удивительно быстро и хронической иммобилизации регенерирующие аксоны на DREZ.
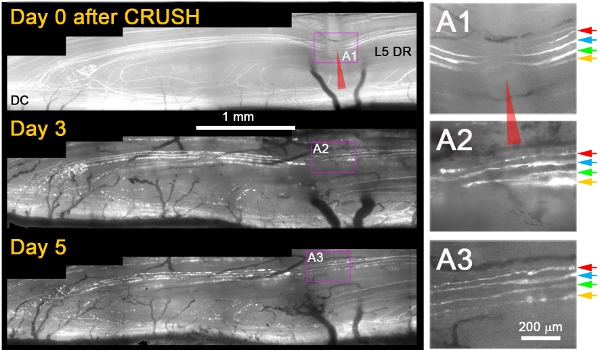
Рисунок 1: Повторная съемка L5 DR + YFP аксонов в месте спинной раздавить корень в течение 5 дней. Медиальной части L5 корень был разгромлен (красная стрелка) и отображается на 0-й, 3 и 5 после давки. Области раздавить усиливается в правой панели (А1-А3).

Рисунок 2:. Повторная съемка аксонов прибыл в DREZ в течение 20 дней после L5 раздавить корень 4-й день, три аксонов (цветные стрелки) прибыл в DREZ. Кончики этих аксонов остаются в том же месте и имеют похожий внешний вид на последующих сессиях изображений на 7, 9, 13, 15 и 20. Позиции кончика аксона относительно других советов аксонов и достопримечательностей (звездочки) были использованы для определения аксон моторики между изображениями сессий.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Изображений DR регенерации непосредственно в живых мышей является особенно сложным, поскольку он требует существенных спинного ламинэктомии для контроля роста аксонов на большой площади следуют несколько инвазивных хирургических и обезболивающие процедуры в последующих сессиях из?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарим д-р Алан Тесслер для комментариев и редакционных помощь. Эта работа была поддержана NIH NS062320.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| H-линия thy1 YFP (2-4 месяцев, либо секс) | Jackson Laboratory (Bar Harbor, ME) | 003782 | |
| Ксилазин (AnaSed инъекции, стерильный раствор) | Ллойд Laboratories, (Шенандоа, LA) | 4811 | 8 мг / кг |
| Кетамин (инъекции кетамина гидрохлорид, USP) | Hospira, Inc (Лейк-Форест, Иллинойс) | 2051 | 120 мг / кг |
| Бупренорфин (Buprenex для инъекций) (0,05 мг / кг) | Reckitt Benckiser Pharmaceuticals Inc (Richmond, VA) | 7571 | |
| Малый машинок для стрижки волос животных | Остер Professional, (McMinnville, TN) | 76059-030 | |
| Лосьон Удаление волос | Церкви & Dwight Co (Princeton, NJ) | НАИР с Детское масло | |
| Марлевые губки | Fisher Scientific, (Питтсбург, Пенсильвания) | 22-362-173 | |
| Хлопковые тампоны | Fisher Scientific, (Питтсбург, Пенсильвания) | 14-960-3-й квартал | |
| 1 мл шприцев | Becton, Диксон и компании Франклин озер, NJ) | 309602 | |
| Подкожный (Sub-Q) иглы, 26ga. | Becton, Диксон и Компания (Франклин озер, NJ) | 305115 | |
| Весна ножницы и щипцы | Инструменты изобразительных наук, (Foster City, CA) | ||
| 2,5-мм изогнутые rongeurs | Инструменты изобразительных наук, (Foster City, CA) | 16221-14 | |
| Лактата Рингера инъекций USP | B. Braun медицинской Inc, (Ирвин, Калифорния) | BBR-L7502 | |
| Стерильный физиологический раствор | APP Pharmaceuticals, (Шаумбург, Иллинойс) | 918610 | |
| Тонкие синтетические мембраны матрицы (Biobrane) | Bertek Pharmaceuticals, (Morgantown, WV) | 62794-096-251 | |
| Искусственные оболочки | Гор Предотвращение MVP Dura Substitute, и WL Gore Associates, (Флагстафф, Аризона) | 1MVP40 | |
| 5-0 швов шелка | Ethicon, Inc (Сомервилл, Нью-Джерси) | K-580 | |
| Рана клипы | Perfect - Ets Бруно, (Burnea, Франция) | A75 | |
| Флуоресцентные стереомикроскопа | Leica Microsystems (Wetzlar, Германия) | MZ16 | |
| ПЗС-камера | Хамамацу (Бриджуотер, Нью-Джерси) | ORCA-Rx2 | |
| Регулятор температуры | Всемирный точных приборов (Сарасота, Флорида) | ATC 1000 | |
| Метаморф программного обеспечения | Molecular Devices, (Саннивейл, Калифорния) | ||
| Photoshop | Adobe Systems, San Jose, CA |
Ссылки
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Lichtman, J. W., Sanes, J. R. Watching the neuromuscular junction. J Neurocytol. 32, 767-775 (2003).
- Bishop, D. L., Misgeld, T., Walsh, M. K., Gan, W. B., Lichtman, J. W. Axon branch removal at developing synapses by axosome shedding. Neuron. 44, 651-661 (2004).
- Balice-Gordon, R. J., Lichtman, J. W. in vivo visualization of the growth of pre- and postsynaptic elements of neuromuscular junctions in the mouse. J Neurosci. 10, 894-908 (1990).
- Trachtenberg, J. T. Long-term in vivo imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420, 788-794 (2002).
- Pan, F., Gan, W. B. Two-photon imaging of dendritic spine development in the mouse cortex. Dev Neurobiol. 68, 771-778 (2008).
- Grutzendler, J., Gan, W. B. Two-photon imaging of synaptic plasticity and pathology in the living mouse brain. NeuroRx. 3, 489-496 (2006).
- Kerschensteiner, M., Schwab, M. E., Lichtman, J. W., Misgeld, T. in vivo imaging of axonal degeneration and regeneration in the injured spinal cord. Nat Med. 11, 572-577 (2005).
- Misgeld, T., Nikic, I., Kerschensteiner, M. in vivo imaging of single axons in the mouse spinal cord. Nat Protoc. 2, 263-268 (2007).
- Davalos, D. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169, 1-7 (2008).
- Maio, D. D. i in vivo imaging of dorsal root regeneration: Rapid immobilization and presynaptic differentiation at the CNS/PNS border. Journal of Neuroscience. 31, 4569-4582 (2011).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены