需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
实时成像背根轴突后根切断术
摘要
一个在体内成像监测初级感觉神经轴突,背根粉碎后的协议描述。该程序利用宽视场荧光显微镜和thy1 - YFP转基因小鼠,并允许超过4厘米的期票,与中枢神经系统的接口轴突的相互作用反复轴突再生的成像。
摘要
根脊髓受伤受伤的初级感觉神经轴突无法再生进入脊髓,导致慢性疼痛和永久的感觉丧失。到脊髓的背根(DR)的轴突再生,防止背根进入区(DREZ),CNS和PNS之间的接口。我们理解的分子和细胞活动,防止再生DREZ,是不完整的部分,因为已经从事后分析,推导出了复杂的变化与神经损伤有关。细胞的动态过程,如轴突再生,是最好的研究与技术,捕捉每一个活生生的动物的多个观测的实时事件。我们体内连续监测神经元的能力已大大增加,由于在光学和转基因小鼠的革命性的创新。 thy1 GFP转基因小鼠的几行,在神经细胞亚群的基因在不同的荧光色标记,允许单个神经元 在体内1成像。这些老鼠已经广泛使用在体内的肌肉2-4和大脑5-7成像,到生理机制提供了新颖的,不可能解决静态分析的见解。最近才开始的生活脊髓中的神经元的成像研究。李奇曼和他的同事们第一次证明了跟踪受伤的背柱(DC)的轴突, 宽视场显微镜8,9了其可行性。多光子深深定位的直流轴突在体内成像,小胶质细胞和血管也已经完成 10 。在过去的几年中,我们已率先应用在活体成像监测的DR采用宽视场显微镜和H thy1 - YFP小鼠轴突再生。这些研究,使我们以一个新颖的假说为什么DR轴突再生防止脊髓内的11。
在H线thy1 - YFP的小鼠,不同的YFP +轴突是表面上的位置,可以同时监控几个轴突。我们已经了解到,博士轴突到达在DREZ更好的成像比在脊髓型颈椎病,腰。在本报告中,我们描述了,我们已经找到有用的,以确保成功的长期和反复轴突再生DR成像的几种策略。这些措施包括消除重复插管和呼吸中断的方法,最大限度地减少手术相关的压力和瘢痕形成,并获得稳定的图像分辨率高,没有光毒性。
研究方案
1。显微镜设置和成像准备
- 我们的成像成立了Leica MZ16较快的快门和MetaMorph软件控制冷却的CCD相机的荧光体视显微镜。
- 准备一个恒温控制加热垫,并调整到32.5 ° C,以保持动物的体温期间和手术后的输出。
- 暖无菌林格氏液,或到32.5 ° C,在提前在手术过程中脊髓灌溉的人工脑脊液(学联)。
- 甲苯噻嗪(8毫克/公斤),氯胺酮(120毫克/公斤)的鸡尾酒腹腔注射麻醉动物。
- 剃须与小动物快船队的上背部和传播的一个小水滴在剃光面积脱毛乳液与棉拭子。几分钟后,删除应用的乳液,使用70%乙醇浸泡纱布海绵。
2。椎板切除手术暴露L5背根
- 将加热的(32.5 ° C)垫的动物,并用70%乙醇浸泡棉签消毒皮肤。
- 在明亮的体视显微镜视场照明,执行正中切口(2 - 3厘米),背部皮肤。如果有必要,使用棉拭子止血。
- 反映脊髓肌肉公开基础腰椎。
- 揭露右路半椎板使用小rongeurs的L3 - S1脊髓段。 4-6腰椎和骶脊髓段部分椎板切除暴露创建卸下背右髋关节的髂骨水平L5椎体部分(L5背根神经节的位置)到L2椎体(2 rostrally到最后一根肋骨,椎骨尾鳍)。与温暖的无菌林格氏液灌注腔。
- 支持垫(轧棉纱布)上的位置,拉平脊椎骨的动物。使用回缩挂钩的暴露面积扩大。
- 此时(约30分钟后,第一次腹腔注射麻醉,应皮下注射的一种补充(0.5X),以保持动物完全麻醉。此外,麻醉气体(2-4%0.5L/min氧气异氟醚),可用于重复麻醉成像会议期间超过1小时。
3。根切断术/背根粉碎
- 切换到荧光激发想像YFP的标记(+)轴突。
- 使用一个Sub - Q(26ga.)针的尖端,执行一个小切口覆L5背根(DR)的硬脑膜。多次与林格氏液灌注,和干净的棉拭子轻轻。
- 确定被压扁的网站,并插入罚款镊子的一侧(杜蒙#5)subdurally。
- 轻轻地但坚决关闭镊子,控股10秒L5根内侧部分,然后轻轻松开镊子。
- 生理溶液反复冲洗干净的棉签拭子轻轻。
4。图像采集和运算程序
- 获取多个图像整个暴露面积,包括粉碎站点前,右后粉碎在低和高放大倍率的DREZ。
- 图像采集单一快照或多个数据流的10至20帧,在30个收购 - 40毫秒的曝光时间。对焦的图像,然后选定,并概述蒙太奇以后使用Photoshop创建。
- 为了最大限度地减少疤痕形成,紧紧申请了一块薄合成基质膜(Biobrane),其次是人工硬脑膜,暴露脊髓上。可以肯定的裁片以适应恰恰暴露脊髓窗口,使它们附着在脊髓。
- 用无菌5-0缝线关闭肌肉和关闭伤口剪辑正中切口。
- 注入林格氏液(0.3至0.5毫升皮下注射),和管理丁丙诺啡术后镇痛(0.05毫克/公斤)皮下注射,每2天12小时。
- 保持一个加热垫(34 ° -35℃),直至收回的动物。
5。重复成像
- 麻醉动物和删除的伤口剪辑和缝合。
- 取出人工硬脑膜和薄合成基质膜的补丁,并保持在无菌林格氏液管供以后重复使用。
- 轻轻地取出任何一个Sub - Q的弯针和细镊子尖端积累的结缔组织瘢痕。与温暖的林格氏液灌注经常。
- 重新暴露手术视野,包括粉碎站点和DREZ,搬迁YFP +前几届会议成像轴突,重复第4节中描述的程序。
6。代表性的成果:
我们观察到,而他们没有一个横断损伤后再生,几乎所有YFP +的网站通过轴突增长粉碎后3天伤(图1)11。通常情况下,粉碎后的第二天,我们观察到死亡的回近端残端神经轴突变性和碎片/相同轴突远端粉碎,这证实,轴突已经适当损坏变性(例如,图1; 3和第5天) 。另外还有几个标准适用明确区分,也难幸免,或已经从伤病中恢复的轴突再生的轴突。这些包括以下内容:(1)再生轴突显示一个的的YFP的非荧光部分扩张+的粉碎网站由于近端和远端变性(对比的未标记的差距缩小由于荧光细胞质加气站的粉碎网站轴突如果轴突存活的损伤);(2)再生轴突薄得多,明亮的荧光,更比幸存下来的损伤的轴突起伏;(3)再生突起更薄,更昏暗比轴突退化的荧光片段的荧光,通过他们延长;(4)对比尚存或幸免轴突再生轴突停止在DREZ;(5)对比尚存或幸免轴突再生轴突不会出现Ranvier节点。图1显示了四个后立即粉碎肤浅YFP +轴突(A1彩色箭头)。粉碎后3天,所有四个轴突延长一个单一的神经突起的生长,通过粉碎网站(A2)。五天后粉碎,突起保持稳定,并没有从这些或其他的近端轴突(A3)的额外增长。
再生突起,越过粉碎网站通过一个退化的轴突(即,endoneurial管)更厚和更明亮的的荧光片段拉长,并早在4天到达的DREZ粉碎后(约3mm / 2 天 ) 11。重复这些轴突和他们的技巧两个星期(图2)每两三天成像透露,他们并没有增长向前或收回,但仍然不动。唯一显着的变化是肿胀的提示和一些轴突的轴。因此,这些意见的DREZ表现出惊人的快速和慢性的再生轴突的固定。
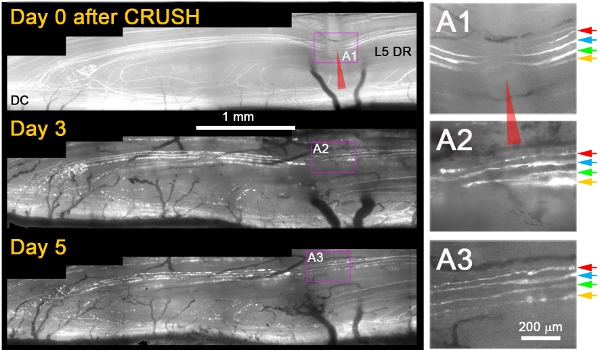
图1:重复成像L5 DR YFP的轴突在背根粉碎网站超过5天。被粉碎的L5根内侧部分(红色箭头)和天0,3,粉碎后5的影像。在右面板(A1 - A3的)的区域被放大的美眉。

图2:轴突重复成像在抵达DREZ L5根粉碎后超过20天的每天4,三个轴突(彩色箭头)抵达的DREZ 。这些轴突的尖端保持在相同的位置,并在随后的成像会议上7天,9,13,15和 20类似的外观。轴突尖端相对其他轴突提示和标志性建筑(星号)的位置被用来确定轴突成像会话之间的蠕动。
Access restricted. Please log in or start a trial to view this content.
讨论
成像DR直接在活老鼠再生,是特别具有挑战性的,因为它需要大量的背椎板切除,监察多个微创手术和麻醉的程序,在随后的成像会话广域轴突的生长。几种策略帮助克服这些挑战。首先,成功的成像要求减少麻醉和出血时间,降低小鼠的死亡率(约25%),并通过细致的术后护理。死亡率也减少了使用,允许快速的摄像头的速度快速采集多个图像,无需插管或呼吸中断设置。上外露的电源线防止...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有利益冲突的声明。
致谢
我们感谢阿兰泰斯勒博士评论和社论帮助。这项工作是由NIH NS062320支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
|---|---|---|---|
| H线thy1 - YFP(2-4个月左右,雌雄不限) | 杰克逊实验室(酒吧港,ME) | 003782 | |
| 甲苯噻嗪(AnaSed注射剂,无菌溶液) | 劳埃德的实验室,(雪兰,LA) | 4811 | 8毫克/公斤 |
| 氯胺酮(盐酸氯胺酮注射液,USP) | Hospira公司,公司(森林湖,IL) | 2051 | 120毫克/公斤 |
| 丁丙诺啡(Buprenex注射)(0.05毫克/公斤) | Reckitt Benckiser的制药公司(里士满,弗吉尼亚州) | 7571 | |
| 小动物电推剪 | 奥斯特专业(麦克明维尔,TN) | 76059-030 | |
| 脱毛乳液 | 教会德怀特合作(普林斯顿,新泽西州) | NAIR与婴儿油 | |
| 纱布海绵 | 费舍尔科学,(宾夕法尼亚州匹兹堡) | 22-362-173 | |
| 棉拭子 | 费舍尔科学,(宾夕法尼亚州匹兹堡) | 14 - 960 - 3Q | |
| 1毫升的注射器 | 流式细胞,迪克森和公司,新泽西州富兰克林湖) | 309602 | |
| 皮下(子Q)的针头,26ga。 | 流式细胞,迪克森公司(新泽西州富兰克林湖,) | 305115 | |
| 剪刀和镊子春 | 精细的科学工具,(福斯特城,加利福尼亚) | ||
| 2.5毫米的弧形rongeurs | 精细的科学工具,(福斯特城,加利福尼亚) | 16221-14 | |
| 乳酸钠林格注射药典 | 贝朗医疗公司(加利福尼亚州欧文) | BBR - L7502 | |
| 无菌生理盐水溶液 | APP制药(Schaumburg的IL) | 918610 | |
| 薄膜合成的基质膜(Biobrane) | Bertek制药(摩根,西弗吉尼亚州) | 62794-096-251 | |
| 人工硬脑膜 | 戈尔排除MVP杜拉替补,戈尔和联营公司(弗拉格斯塔夫,AZ) | 1MVP40 | |
| 5-0丝线缝合 | 爱惜康公司(新泽西州萨默维尔,) | K - 580 | |
| 伤口剪辑 | 完美 - ETS布鲁诺(Burnea,法国) | A75 | |
| 荧光体视显微镜 | 徕卡显微系统,(韦茨拉尔,德国) | MZ16 | |
| CCD相机 | 滨松市(新泽西州Bridgewater的) | ORCA - RX2 | |
| 温度控制器 | 世界精密仪器公司(佛罗里达州萨拉索塔) | 空管1000 | |
| MetaMorph软件 | 分子器件,(加利福尼亚州桑尼维尔,) | ||
| Photoshop中 | Adobe系统公司,加利福尼亚州圣何塞, |
参考文献
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Lichtman, J. W., Sanes, J. R. Watching the neuromuscular junction. J Neurocytol. 32, 767-775 (2003).
- Bishop, D. L., Misgeld, T., Walsh, M. K., Gan, W. B., Lichtman, J. W. Axon branch removal at developing synapses by axosome shedding. Neuron. 44, 651-661 (2004).
- Balice-Gordon, R. J., Lichtman, J. W. in vivo visualization of the growth of pre- and postsynaptic elements of neuromuscular junctions in the mouse. J Neurosci. 10, 894-908 (1990).
- Trachtenberg, J. T. Long-term in vivo imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420, 788-794 (2002).
- Pan, F., Gan, W. B. Two-photon imaging of dendritic spine development in the mouse cortex. Dev Neurobiol. 68, 771-778 (2008).
- Grutzendler, J., Gan, W. B. Two-photon imaging of synaptic plasticity and pathology in the living mouse brain. NeuroRx. 3, 489-496 (2006).
- Kerschensteiner, M., Schwab, M. E., Lichtman, J. W., Misgeld, T. in vivo imaging of axonal degeneration and regeneration in the injured spinal cord. Nat Med. 11, 572-577 (2005).
- Misgeld, T., Nikic, I., Kerschensteiner, M. in vivo imaging of single axons in the mouse spinal cord. Nat Protoc. 2, 263-268 (2007).
- Davalos, D. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169, 1-7 (2008).
- Maio, D. D. i in vivo imaging of dorsal root regeneration: Rapid immobilization and presynaptic differentiation at the CNS/PNS border. Journal of Neuroscience. 31, 4569-4582 (2011).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。