A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
إنشاء ثنائي الأبعاد ركائز منقوشة على الحبس البروتين والخلايا
In This Article
Summary
الذات تجميعها monolayers (صواريخ سام) التي تشكلت من سلسلة طويلة thiols ألكان على الذهب توفير ركائز محددة جيدا لتشكيل أنماط البروتين والحبس الخلية. الطباعة Microcontact من hexadecanethiol باستخدام (PDMS) ختم polydimethylsiloxane تليها الردم مع غليكول منتهية ألكان ثيول مونومر تنتج نمطا حيث البروتين وخلايا كثف فقط لمنطقة hexadecanethiol ختمها.
Abstract
الطباعة Microcontact يوفر السريع ، والأسلوب استنساخه للغاية لخلق نمط من ركائز محددة جيدا. 1 بينما يمكن استخدام الطباعة microcontact الطباعة مباشرة على عدد كبير من الجزيئات ، بما في ذلك البروتينات والحمض النووي 2 و 3 و silanes (4) وتشكيل الذات المجمعة monolayers (صواريخ سام) من سلسلة طويلة thiols ألكان على الذهب يوفر وسيلة بسيطة لحصر البروتينات والخلايا التي تحتوي على أنماط محددة لاصقة ومقاومة المناطق. ويمكن استخدام هذا الحبس الاحتياطي للسيطرة على مورفولوجيا الخلايا ومفيدة لدراسة مجموعة متنوعة من الأسئلة في البروتين وبيولوجيا الخلية. هنا ، نحن تصف طريقة عامة لخلق أنماط البروتين واضحة المعالم للدراسات الخلوية 5 تنطوي هذه العملية على ثلاث خطوات : إنتاج رئيسية منقوشة به ضوئيه ، وخلق طابع PDMS ، وmicrocontact الطباعة من الذهب الركيزة المغلفة. منقوشة مرة واحدة ، وهذه ركائز ثقافة الخلية قادرة على حصر البروتينات و / أو الخلايا (الخلايا الأولية أو خطوط الخلية) لهذا النمط.
استخدام الكيمياء الذاتي أحادي الطبقة تجميع يسمح لمراقبة دقيقة فوق مناطق منقوشة لاصقة بروتين / خلية والمناطق غير لاصقة ، هذا لا يمكن تحقيقه باستخدام ختم المباشر البروتين. Hexadecanethiol ، وسلسلة طويلة ثيول ألكان المستخدمة في الطباعة microcontact الخطوة ، وتنتج سطح مسعور أن تمتز بسهولة البروتين من الحل. وجلايكول منتهية ثيول ، وتستخدم لردم المناطق غير المطبوعة من الركيزة ، ويخلق أحادي الطبقة التي هي مقاومة للامتصاص البروتين وبالتالي نمو الخلية. 6 تنتج هذه مونومرات ثيول monolayers منظم جدا أن تحدد بدقة مناطق الركيزة التي يمكن أن تدعم الامتزاز البروتين ونمو الخلية. ونتيجة لذلك ، وهذه الركائز هي مفيدة لطائفة واسعة من التطبيقات من دراسة السلوك بين الخلايا من 7 إلى خلق الالكترونيات الدقيقة 8
بينما تم استخدام أنواع أخرى من الكيمياء المونولاير للدراسات ثقافة الخلية ، بما في ذلك العمل من مجموعتنا trichlorosilanes به لخلق أنماط مباشرة على ركائز الزجاج ، 9 monolayers منقوشة تشكلت من thiols ألكان على الذهب هي على التوالي إلى الأمام للاستعداد. وعلاوة على ذلك ، وتستخدم لإعداد مونومرات المونولاير متاحة تجاريا ، ومستقرة ، ولا تتطلب معالجة أو تخزين تحت جو خامل. يمكن أن يعد من ركائز منقوشة thiols ألكان كما يمكن إعادة تدويرها وإعادة استخدامها مرات عدة ، والحفاظ على الحبس الخلية. 10
Protocol
1. التحضير للماجستير منقوشة (الشكل 1)
- مركز رقاقة السيليكون على المغطي الجانبية وشطف الرقاقة مع الأسيتون خلال الخطوة الأولى من البرنامج تدور دورة اثنين في الجدول 1. سوف تتبخر خلال الأسيتون الخطوة الثانية من البرنامج تدور ترك نظيفة ، ورقاقة جافة.
- تطبيق ما يقرب من 1 مل AZ9245 مقاومة للضوء / في (في قطر) على رقاقة وتدور معطف التي تستخدم الشروط الموضحة في الجدول رقم 1.
- لينة خبز الرقاقة مقاومة للضوء المغلفة على 110 درجة مئوية لمدة 2 متر باستخدام موقد عالية التوحيد.
- Photopattern الركيزة باستخدام نظام ضوئيه المباشر والكتابة أو نظام اليجنر قناع وقناع المناسبة. ويمكن شراء الأقنعة من عدد من المصادر التجارية. بالإضافة إلى ذلك ، يمكن استخدام الورق الشفاف المطبوعة بالحبر ماصة للأشعة فوق البنفسجية ، لشقة مسجلة بصري ، لإنتاج أنماط مع ميزات كبيرة.
- تطوير رقاقة منقوشة في مطور 01:02 400K : شبه الموصلات الصف منزوع الأيونات الماء لمدة 1 ق 45 م مع الإثارة لطيف. شطف جيدا مع أشباه الموصلات والماء منزوع الأيونات الصف الجاف مع دفق من النيتروجين (N 2) الغاز. يمكن التحقق من نمط التنمية باستخدام المجهر مع فلتر الأشعة فوق البنفسجية. إذا لم يتم تطويره بالكامل النمط ، ويمكن إرجاعها إلى الرقاقة حل النامية لوقت إضافي.
ملاحظة : للحصول على أفضل النتائج ، يجب أن يتم photopatterning في بيئة غرف الأبحاث.
2. إعداد قسائم PDMS (الشكل 2)
- إعداد 10:01 بواسطة الراتنج الوزن : خليط من 182 تصليب Sylgard (PDMS) ، وتغطي بالكامل الرئيسي (رقاقة photopatterned) مع الخليط في طبق بتري المتاح.
- دي الغاز PDMS الرئيسية المغطاة في فراغ حتى لا dessicator فقاعات مرئية والسماح للقضاء على شفاء في الفرن على درجة مئوية لمدة 1.5 ساعة 65 قبل المعالجة ، من المهم التأكد من أن الرئيسي هو في الجزء السفلي من الطبق لأنه قد تطفو على السطح خلال خطوة فصل الغاز.
- قطع PDMS ختم الخروج من الماجستير وتقليم إلى الحجم المناسب. تخزين الطوابع في وعاء مغطى (الجانب ميزة متابعة) لحمايته من الغبار والحطام.
3. إعداد الركيزة الذهب منقوشة (الشكل 3)
- إعداد 25 ملم لا. 1 coverslips الزجاجية المستديرة لترسب المعادن بمعاملتها مع البلازما الأكسجين لمدة 10 متر. شطف مرتين مع الماء منزوع الأيونات MΩ 18.2 تليها مرتين مع الإيثانول والتجفيف مع تيار من غاز 2 N بين كل خطوة.
- باستخدام نظام متعدد جيب ترسب شعاع الإلكترون ، تليها الودائع 50 التيتانيوم بواسطة الذهب 150. لا تنفيس المبخر بين ترسب طبقة طبقة التيتانيوم والذهب. بدلا من ذلك ، يمكن شراء الذهب المطلي coverslips من مجموعة متنوعة من الموردين ، ومع ذلك ، فمن المهم أن يتم إعداد الطبقات المعدنية بنسبة شعاع الإلكترون التبخر والتبخر لا الحرارية. إذا تم شراؤها من مصدر خارجي ، قد يكون تنظيف ركائز الذهب الأكسدة البلازما أو "سمكة البيرانا" (7:03 اضرب H 2 SO 4 : 30 ٪ H 2 O 2) 11 قبل الاستخدام.
ملاحظة : "سمكة البيرانا" الحل هو انفجار في وجود مركبات عضوية.
- إعداد الحل ختم و 10 ملم في hexadecanethiol الايثانول المطلق ، والحل الردم ، 1 ملم غليكول منتهية ثيول في الإيثانول المطلق.
- شطف الطابع مع الإيثانول ويجف تماما مع غاز 2 N. تطبيق ختم حل لقطرة قطرة حتى ختم PDMS مغلفة بشكل كامل. جافة تماما مع الطابع غاز 2 N. انتقل إلى 5A 5B أو عند الاقتضاء على أساس ملامح الطابع PDMS.
- اضغط برفق على الركيزة ختم الذهب والسماح للأحادي الطبقة لمدة 15 ثانية. النموذج
- مكان الركيزة الذهب في طبق بتري تحتوي على 18.2 ماء منزوع الأيونات MΩ ، وضمان الغارقة الركيزة. اضغط برفق على الركيزة ختم الذهب والسماح للأحادي الطبقة لمدة 15 ثانية. النموذج
- شطف الركيزة ختمها مرتين مع الإيثانول وتجفيف الغاز مع N 2 بعد كل شطف ومكان الركيزة في طبق بتري.
- تغطية الركيزة مع حل الردم وختم الطبق مع parafilm لمنع التبخر.
- السماح لأحادي الطبقة الخلفية لتكوين في الظلام لمدة 12-14 ساعة.
- إزالة ساترة منقوشة من الحل الردم وشطف مرتين مع الإيثانول ، تجفيف الغاز مع N 2 بعد كل شطف.
4. تطبيق البروتين وخلايا منقوشة إلى الركيزة
- التخزين المؤقت وضع ساترة منقوشة في طبق بتري أو خلية صغيرة غرفة الثقافة ، وتغطي مع 500 ميكرولتر إلى 1 مل من الفوسفات في Dulbecco المالحة (DPBS). يجب أن تغطي كامل DPBS الركيزة خلال حضانة البروتين لضمان التغطية حتى البروتين.
- إضافة محلول البروتين إلى مزيج DPBS والحل عن طريق الأنابيبمرات عدة تينغ. احتضان المخلوط مع البروتين الركيزة عند 37 درجة مئوية لمدة ساعة 1 تركيزات النهائية لlaminin فبرونيكتين وعادة ما تكون 12 ميكروغرام / مل و 20 ميكروغرام / مل على التوالي. يمكن أن يكون المسمى مع بروتين فلوري أمين صبغ رد الفعل للسماح التصور نمط سهلة. ومع ذلك ، ينبغي أن تكون مختلطة من البروتين المسمى مع بروتين 01:01 غير المسماة ووضع العلامات البروتين يمكن أن تتداخل مع نشاط بيولوجي.
- بعد مرور فترة الحضانة ، وشطف جيدا مع الركيزة DPBS (4 - 5X) لإزالة البروتين غير منضم ، مع الحرص على عدم جفاف أو جعله ركيزة من خلال واجهة الهواء والماء. بعد يشطف الثلاثة الأولى ، إضافة ما يقرب من 500 ميكرولتر من اكتمال نمو الخلايا وسائل الاعلام للحفاظ على ركيزة الرطب.
- استبدال وسائط النمو المستخدمة لشطف الركيزة مع وسائل الإعلام الجديدة.
- وفصل عدد الخلايا للطلاء على الركيزة. ويمكن استخدام الخلايا إما فصلها الأولية ، مثل الخلايا العصبية قرن آمون ، أو خطوط الخلية خلده ، مثل CHO - K1 الخلايا.
- لوحة فصل الخلايا على الركيزة. عادة ما تستخدم 30-200 خلايا / مم 2.
5. ممثل النتائج :
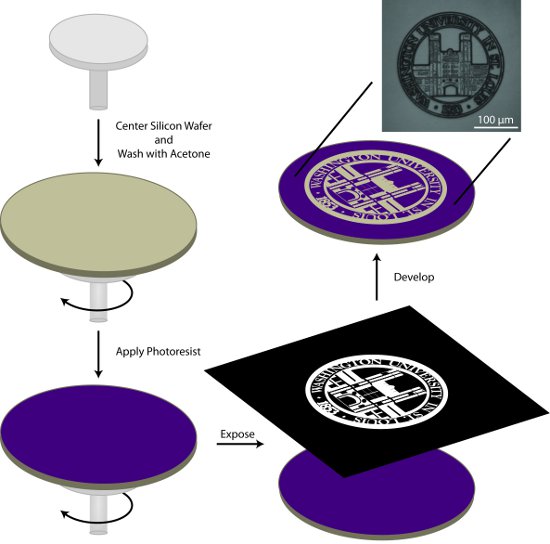
الشكل 1. التخطيطي العام لإعداد الطباعة بصفائح معدة ضوئيا على درجة الماجستير من منقوشة. في هذه العملية ، يتم تنظيف رقاقة السيليكون مع الأسيتون ، ومغطاة مقاومة للضوء ، ويتعرضون لنمط من الفائدة ، ويتم تطوير هذا النمط.

الشكل 2. التخطيطي العام لإعداد ختم PDMS. في هذه العملية ، يتم تغطية الرئيسي منقوشة مع Sylgard (10:1 الراتنج : تصليب) ، دي بالغاز في مجفف فراغ ، الشفاء في الفرن عند 60 درجة مئوية ، وخفض لحجم.
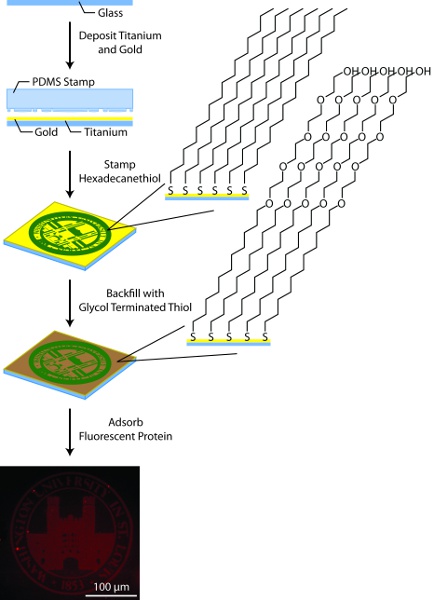
الشكل 3. التخطيطي العام لتنميط الركيزة. في هذه العملية ، هي ركائز الزجاج المطلي مع التيتانيوم (50A) والذهب (150A) باستخدام شعاع الالكترون المبخر ، منقوشة بواسطة hexadecanethiol الطباعة باستخدام microcontact طابع PDMS ، مع ردم thiols غليكول ألكان إنهاؤها ، والمغلفة مع البروتين المسمى fluorescently.

الشكل 4. منقوشة الرئيسي (A) وختم PDMS (B) التي أعدت باستخدام أساليب وصفها. الحانات هي مقياس 100μm.
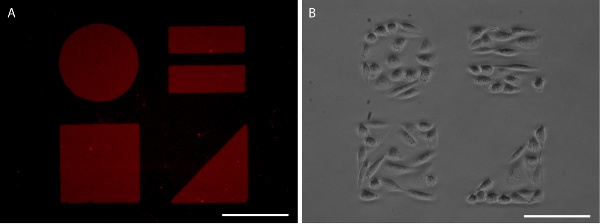
تصور الشكل 5. صواريخ سام منقوشة مع AlexaFluor 647 فبرونيكتين المسمى (أ) و CHO - K1 الحبس الخلية (B). أشرطة النطاق هي 100 ميكرون.
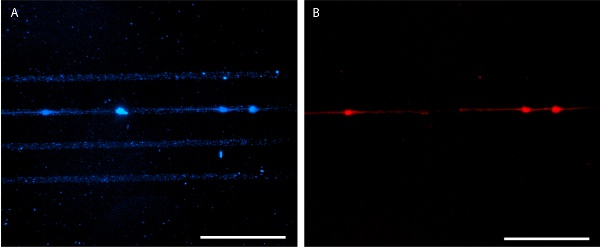
الشكل 6. منقوشة laminin المصنف مع الخلايا العصبية في قرن آمون الماوس E18 4 أيام في المختبر. يستخدم AlexaFluor 350 مترافق المضادة للأجسام المضادة للlaminin التصور نمط (A) والملون الخلايا العصبية الماوس E18 الحصين مع الأحمر MitoTracker 580 (B). أشرطة النطاق هي 100 ميكرون.
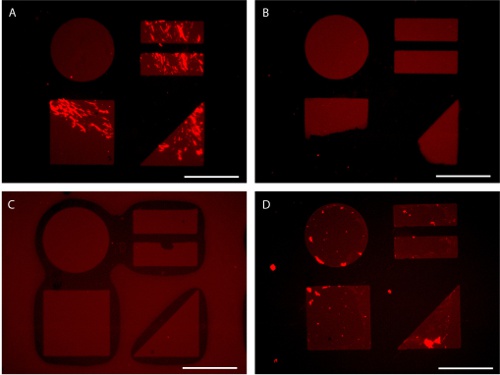
الشكل 7. المزالق المحتملة في إعداد تصور نمط الركيزة التي AlexaFluor 647 - مترافق فبرونيكتين الامتزاز. (أ) يؤدي الاختلاط غير كافية لامتصاص البروتين متفاوتة. (ب) التطبيق غير المتكافئ للضغط خلال ختم يؤدي إلى نقل باتن جزئية. يمكن (C) الضغط المفرط أثناء ختم تؤدي إلى طابع الانهيار. (D) يمكن أن يؤدي التعرض لسطح منقوشة على واجهة الماء والهواء أثناء الشطف نتيجة امتصاص البروتين في الخلفية. أشرطة النطاق هي 100 ميكرون.

الشكل 8. الزخرفة الغارقة يمكن أن تنتج أنماط مع الميزات الصغيرة التي يصعب الطباعة عن طريق الطباعة microcontact التقليدية في الهواء. صور (A) و (ب) وتظهر مناطق مختلفة من نفس النمط ، وطبع مع الطابع PDMS نفسه في الهواء (A) أو ماء منزوع الأيونات (B). وتعتبر خطوط الدعم 10μm على نطاق والتي تحيط نمط (المضافة للمساعدة في منع انهيار ختم) في الفقرة (أ) ، ومع ذلك ، فإن ميزات أصغر نقطة كما هو مبين في الفقرة (ب) ألا ينظر هي. هذا يدل على أن الطباعة في الهواء يعمل بشكل جيد للحصول على أكبر الميزات ، ولكن الطباعة في المياه قد تكون ضرورية لأنماط مع أصغر الميزات. أشرطة مقياس هي 20 ميكرومتر.
| دورة | معدل التسارع (دورة في الدقيقة / ثانية) | نهائي السرعة (دورة في الدقيقة) | الوقت (ق) |
| 1 | 500 | 1000 | 5 |
| 2 | 3800 | 3800 | 30 |
الجدول 1.تستغرق دورة البرنامج تدور المستخدمة لإنشاء 4.5 ميكرون طلاء سميكة من AZ9245 على رقاقة السيليكون.
لإعداد الطوابع PDMS لتشكيل ركائز منقوشة ، على درجة الماجستير في مقاومة للضوء هي ملفقة الأول (الشكلان 1 و 4A). الرئيسي هو معكوس من الطوابع ، والتي تم إنشاؤها باستخدام إما نظام الطباعة الحجرية والكتابة المباشرة أو اليجنر قناع. عندما يتم استخدام مقاوم الضوء الإيجابي ، مثل AZ9245 ، لإنتاج رئيسية ، يتعرض الرقاقة مقاومة للضوء المغلفة مع نفس النمط الذي سيظهر على الركيزة النهائية. في حين أنه ليس من الممكن دائما ، فقد أفيد أن نسبة الارتفاع المثالي (حجم ميزة لمقاومة سمك) للسادة الختم PDMS هو 1:2. 13 لقد وجدنا أن من نسب 1:40 ممكنة ، تبعا لطبيعة من هذا النمط. وصف AZ9245 رقائق السليكون مغلفة في ظل الظروف هنا تعطي مقاومة للضوء مع سماكة 4.5 ميكرون. لقد وجدنا أنه يمكن استخدام هذا السمك لAZ9245 لإنتاج سادة PDMS مع ميزات تتراوح بين> 100 ميكرون إلى 2 ميكرون.
ويلقي الطوابع PDMS من 182 Sylgard (أو Sylgard 184) باستخدام الرئيسي مصنوعة من مقاومة للضوء (الشكل 2). ويمكن استخدام سادة مقاوم الضوء عدة مرات لإنشاء عدة نسخ من الطابع نفسه. بعد تصلب في PDMS ، تتم إزالة الطوابع من سيد باستخدام شفرة حلاقة والطابع الناتجة يمكن تصور تحت المجهر عن طريق وضع ختم الجانب ميزة لأسفل على زجاج ساترة (الشكل 4B)
الصحيح في النتائج ختم حاد ، من الواضح أن نمط البروتين يمكن تصور بتطبيق البروتين fluorescently المسمى (أرقام 3 و 5). بدلا من ذلك ، قد يتم استخدام المناعية لتصور نمط البروتين بعد تثبيت الخلية (الشكل 6). يقتصر نمو الخلايا بشكل جيد للنمط البروتين لكل من خطوط الخلايا والخلايا الأولية خلد (الأرقام 5 و 6).
في حين أن يتقن هذه التقنية بسهولة ، قد تنشأ مشاكل مشتركة عدة. يمكن للتطبيق من دون خلط البروتين كافية من البروتين الحل يتركز في DPBS يؤدي إلى أنماط متفاوتة من البروتين (7A الشكل). ويمكن أن يؤدي إلى سوء ختم نقل نمط انهيار جزئي أو ختم (الشكل 7B - C). بالإضافة إلى ذلك ، كشف الركيزة المزخرفة التي تحتوي على البروتين كثف إلى الهواء يمكن أن يسبب عرقلة المونولاير المقاومة انخفضت في الخلفية (الشكل 7D). أنماط تتألف من الميزات الصغيرة جدا (<5 ميكرون) ، ونسب عالية وغالبا ما تتطلب استخدام الطباعة microcontact المغمورة. في هذا الماء (3.5b) الإجراء يستخدم كحاجز لمنع hexadecanethiol من إيداع على الركيزة خارج نمط الشكل (8) (14).
Access restricted. Please log in or start a trial to view this content.
Discussion
ويمكن لعدد من القضايا التي تنشأ في إنتاج معدني من أتقن استخدامها لخلق طابع PDMS. ناقص نتائج رقاقة مقاومة المغلفة في أنماط ضبابية وغير واضحة والتعرض المفرط لنتائج رقاقة مقاومة مغلف بالمطاط في ملامح الموسع أو مفقودة. بشكل عام ، والماجستير مع أحجام ميزة كبيرة (> 10 ميكرون)...
Access restricted. Please log in or start a trial to view this content.
Disclosures
الإعلان عن أي تضارب في المصالح.
Acknowledgements
نود أن نعترف المجموعة بأكملها مورير في جامعة واشنطن التي جعلت المعرفة الجماعية هذا البروتوكول ممكن. يتم توفير التمويل اللازم لهذا العمل من قبل المعهد الوطني للصحة العقلية (1R01MH085495).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| اسم كاشف | شركة | فهرس العدد | تعليقات (اختياري) |
|---|---|---|---|
| رقاقة السيليكون | رقاقة إسترد خدمات | 2 بوصة | |
| تدور المغطي / طبق ساخن | البيرة العلوم | أوروبا الوسطى والشرقية 200CB سبين ، خبز النظام | |
| AZ9245 الواقي الضوئي | ميس الجبل كيميكال كومباني | 105880034-1160 | |
| مباشرة والكتابة نظام ضوئيه | ميكروتك SRL | LW325 LaserWriter النظام | |
| قناع أليجنر | HTG | 3HR | |
| من الالف الى الياء 400K المطور | ميس الجبل كيميكال كومباني | 105880018-1160 | |
| Sylgard سيليكون إلاستومر 182 كيت | داو كورننغ | ||
| 25 ملم لا. 1 coverslips الزجاجية المستديرة | VWR | 16004-310 | |
| البلازما المؤكسد | مساعد مختبر | فيمتو | |
| قطع قميص التيتانيوم | أدرج | 99.95 ٪ نقية | |
| حبيبات الذهب | قميص إنكوربوريتد | 99.999 ٪ نقية | |
| شعاع الإلكترون المبخر | كورت J. Lesker | PVD 75 ترسب طبقة رقيقة النظام | مع شعاع الإلكترون التبعي |
| Hexadecanethiol | Aesar ألفا | A11362 | |
| 1 - mercaptoundec - 11 - YL) رباعي (ethyleneglycol) | سيغما الدريتش | 674508 | |
| الإيثانول | Pharmco - aaper | 111000200 | 200 دليلا ، مطلقة |
| Parafilm | VWR | 52858-000 | |
| DPBS | VWR | 4500-434 | دون الكالسيوم والمغنيسيوم |
| أنا الماوس Laminin | VWR | 95036-762 | |
| بلازما الإنسان [فيبرونكتين] | Invitrogen | 33016-015 | |
| AlexaFluor ® 647 حمض الكربوكسيلية ، succinimidyl استر | Invitrogen | A - 20006 | |
| MitoTracker الأحمر 580 | Invitrogen | M22425 | |
| AlexaFluor ® 350 حمض الكربوكسيلية ، succinimidyl استر | Invitrogen | A - 10168 | |
| الأضداد المضادة للlaminin | فيشر العلمية | AB2034MI |
References
- Wilbur, J., Kumar, A., Biebuyck, H., Kim, E., Whitesides, G. Microcontact printing of self-assembled monolayers: Applications in microfabrication. Nanotechnology. 7, 452-457 (1996).
- Chang, J., Brewer, G., Wheeler, B. A modified microstamping technique enhances polylysine transfer and neuronal cell patterning. Biomaterials. 24, 2863-2870 (2003).
- Lange, S., Benes, V., Kern, D., Horber, J., Bernard, A. Microcontact printing of DNA molecules. Analytical Chemistry. , 1641-1647 (2004).
- Xia, Y., Mrksich, M., Kim, E., Whitesides, G. Microcontact printing of octadecylsiloxane on the surface of silicon dioxide and its application in microfabrication. J. Am. Chem. Soc. , 9576-9577 (1995).
- Mrksich, M., Dike, L., Tien, J., Ingber, D., Whitesides, G. Using microcontact printing to pattern the attachment of mammalian cells to self-assembled monolayers of alkanethiolates on transparent films of gold and silver. Experimental Cell Research. , 305-313 (1997).
- Prime, K. L., Whitesides, G. M. Adsorption of proteins onto surfaces containing end-attached oligo(ethylene oxide) - a model system using self-assembled monolayers. J. Am. Chem. Soc. 115, 10714-10721 (1993).
- Raghavan, S., Desai, R., Kwon, Y., Mrksich, M., Chen, C. Micropatterned Dynamically Adhesive Substrates for Cell Migration. Langmuir. , 17733-17738 (2010).
- Rogers, J., Bao, Z., Baldwin, K., Dodabalapur, A., Crone, B., Raju, V. R., Kuck, V., Katz, H., Amundson, K., Ewing, J. Paper-like electronic displays: Large-area rubber-stamped plastic sheets of electronics and microencapsulated electrophoretic inks. Proc Natl Acad Sci U S A. 98, 4835-4840 (2001).
- Yanker, D., Maurer, J. Direct printing of trichlorosilanes on glass for selective protein adsorption and cell growth. Molecular Biosystems. 4, 502-504 (2008).
- Johnson, D., Maurer, J. Recycling and reusing patterned self-assembled monolayers for cell culture. Chemical Communications. , 520-522 (2011).
- Herne, T., Tarlov, M. Characterization of DNA probes immobilized on gold surfaces. J. Am. Chem. Soc. , 8916-8920 (1997).
- Hanson, E., Schwartz, J., Nickel, B., Koch, N., Danisman, M. Bonding self-assembled, compact organophosphonate monolayers to the native oxide surface of silicon. J. Am. Chem. Soc. , 16074-16080 (2003).
- Johannes, M., Cole, D., Clark, R. Atomic force microscope based nanofabrication of master pattern molds for use in soft lithography. Applied Physics Letters. , (2007).
- Bessueille, F., Pla-Roca, M., Mills, C. A., Martinez, E., Samitier, J., Errachid, A. Submerged microcontact printing (SμCP): An unconventional printing technique of thiols using high aspect ratio, elastomeric stamps. Langmuir. , 12060-12063 (2005).
- Xia, Y., Whitesides, G. Extending microcontact printing as a microlithographic technique. Langmuir. , 2059-2067 (1997).
- Biasco, A., Pisignano, D., Krebs, B., Pompa, P. P., Persano, L., Cingolani, R., Rinaldi, R. Conformation of microcontact-printed proteins by atomic force miroscopy molecular sizing. Langmuir. , 5154-5158 (2005).
- Shen, K., Qi, J., Kam, L. C. Microcontact printing of proteins for cell biology. J Vis Exp. (22), e1065-e1065 (2008).
- Piner, R., Zhu, J., Xu, F., Hong, S., Mirkin, C. "Dip-pen" nanolithography. Science. 283, 661-663 (1999).
- Ryan, D., Parviz, B. A., Linder, V., Semetey, V., Sia, S. K., Su, J., Mrksich, M., Whitesides, G. M. Patterning multiple aligned self-assembled monolayers using light. Langmuir. , 9080-9088 (2004).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved