É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Criando Two-Dimensional Substratos modelado para Confinamento de proteína e celular
Neste Artigo
Resumo
Monocamadas auto-organizadas (SAMs) formado a partir de tióis de cadeia longa alcano em ouro proporcionar bem-definida substratos para a formação de padrões de proteínas e confinamento celular. Microcontact impressão de hexadecanethiol usando um carimbo de polidimetilsiloxano (PDMS), seguido pelo preenchimento com um glicol terminada alcano tiol monômero produz um padrão onde proteínas e células absorvem apenas para a região carimbada hexadecanethiol.
Resumo
Impressão microcontact fornece um método rápido e altamente reprodutível para a criação de substratos bem definidos padronizada. Microcontact 1 Durante a impressão pode ser empregada para imprimir diretamente um grande número de moléculas, incluindo proteínas, DNA 2, 3 e silanos, 4 a formação de auto- monocamadas (SAMs) de tióis de cadeia longa alcano em ouro fornece uma maneira simples para confinar proteínas e células para padrões específicos contendo regiões adesivo e resistente. Esse confinamento pode ser usado para controlar a morfologia das células e é útil para examinar uma variedade de questões em proteínas e biologia celular. Aqui, descrevemos um método geral para a criação de padrões bem definidos de proteínas para estudos celulares 5 Esse processo envolve três etapas:. Produção de um mestre modelado usando fotolitografia, a criação de um selo de PDMS, e microcontact impressão de um ouro substrato revestido. Uma vez modelada, estes substratos de cultura de células são capazes de proteínas confinar e / ou células (pilhas ou linhas de células) para o padrão.
O uso de auto-montagem química monocamada permite o controle preciso sobre o padrão regiões proteína / células adesivas e não adesivas regiões, o que não pode ser conseguido usando stamping proteína direta. Hexadecanethiol, a longa cadeia de tiol alcano utilizado na etapa de impressão microcontact, produz uma superfície hidrofóbica que prontamente adsorve proteína de solução. O glicol terminada tiol, utilizado para preenchimento das regiões não-impressos do substrato, cria uma monocamada que é resistente a adsorção de proteínas e, portanto, de crescimento celular. 6 Estes monômeros tiol produzir monocamadas altamente estruturado que definir com precisão as regiões do substrato que pode suportar adsorção de proteínas eo crescimento celular. Como resultado, estes substratos são úteis para uma ampla variedade de aplicações, desde o estudo do comportamento intercelular 7 para a criação de microeletrônica. 8
Enquanto outros tipos de química monocamada têm sido utilizados para estudos de cultura de células, incluindo o trabalho do nosso grupo usando trichlorosilanes para criar padrões diretamente sobre substratos de vidro, 9 monocamadas padrão formado a partir de tióis alcano em ouro são straight-forward para se preparar. Além disso, os monômeros usados para a preparação monocamada estão disponíveis comercialmente, estável, e não necessitam de armazenamento ou manipulação sob atmosfera inerte. Substratos padronizados preparados a partir de tióis alcano também pode ser reciclado e reutilizado várias vezes, mantendo confinamento na cela 10.
Protocolo
1. Preparação do Mestre modelado (Figura 1)
- Centro de wafer de silício sobre o spin-aplicador e lave o wafer com acetona durante a etapa inicial do programa de rotação de dois ciclos na Tabela 1. A acetona evapora durante a segunda etapa do programa de spin deixando um wafer, limpo e seco.
- Aplicar cerca de 1 mL fotorresiste AZ9245 / in (em diâmetro) para a bolacha e spin-coat usando as condições descritas na Tabela 1.
- Soft-cozer a bolacha fotorresiste revestido a 110 ° C por 2 m usando uma placa de alta uniformidade.
- Photopattern o substrato utilizando um sistema de fotolitografia direto escrever ou um sistema de alinhador de máscara e uma máscara apropriada. Máscaras podem ser adquiridas a partir de um número de fontes comerciais. Além disso, transparências impressas com tinta absorvente UV, gravada para um apartamento óptica, pode ser usado para produzir padrões com características de grande porte.
- Desenvolver o wafer estampados em 1:2 desenvolvedor 400K: semi-condutores de água deionizada para a grade 1 m 45 s, com agitação suave. Lavar cuidadosamente com semi-condutores de água de grau deionizada e seque com uma corrente de azoto (N 2) de gás. Desenvolvimento padrão pode ser verificada com um microscópio com um filtro UV. Se o padrão não está totalmente desenvolvido, o wafer pode ser devolvido para a solução de desenvolvimento para o tempo adicional.
Nota: Para melhores resultados, photopatterning devem ser realizadas em um ambiente de sala limpa.
2. Preparação de PDMS Stamp (Figura 2)
- Preparar uma resina 10:01 por peso: mistura endurecedor de Sylgard 182 (PDMS) e cobrir completamente o mestre (wafer photopatterned) com a mistura em uma placa de Petri descartável.
- De-gás PDMS coberto mestre em um exsicador de vácuo até que não haja bolhas são visíveis e permitir que o selo para a cura em estufa a 65 ° C por 1,5 h. Antes de curar, é importante certificar-se o mestre está no fundo do prato, pois pode subir à superfície durante a etapa de desgaseificação.
- Corte o PDMS erradicar do mestre e ornamento para o tamanho apropriado. Armazenar o selo em um recipiente coberto (lado apresentam-se) para protegê-lo de poeira e detritos.
3. Preparação do substrato de ouro modelado (Figura 3)
- Prepare 25 milímetros no. 1 rodada lamínulas de vidro para a deposição de metal, tratando-as com plasma de oxigênio para 10 m. Enxágüe duas vezes com 18,2 de água deionizada mohms seguido por duas vezes com etanol, secagem com uma corrente de gás N 2 entre cada etapa.
- Usando um bolso multi-sistema de deposição por feixe de elétrons, depósito de 50 Å de titânio seguido por 150 de ouro Å. Não ventilação do evaporador entre deposição da camada de titânio e camada de ouro. Alternativamente, revestidas de ouro lamelas podem ser adquiridos a partir de uma variedade de fornecedores, no entanto, é importante que as camadas de metal são preparados por evaporação por feixe de elétrons e evaporação térmica não. Se comprado de uma fonte externa, substratos de ouro pode ser limpa por oxidação plasma ou "piranha" (7:3 Conc H 2 SO 4:. 30% H 2 O 2) 11 antes de usar.
Nota: "Piranha" solução é explosiva na presença de compostos orgânicos.
- Prepare a solução stamping, 10 hexadecanethiol mM em etanol absoluto ea solução de aterro, 1 mM glicol terminada tiol em etanol absoluto.
- Lavar o selo com etanol e seque bem com gás N 2. Aplicar solução para carimbar o selo gotas PDMS até totalmente revestido. Seque o selo cuidadosamente com gás N 2. Proceder a 5a e 5b conforme o caso com base nas características do selo PDMS.
- Pressione suavemente o selo sobre o substrato de ouro e permitir que a monocamada para formar por 15 s.
- Coloque o substrato de ouro em uma placa de Petri contendo 18,2 de água deionizada mohms, garantindo o substrato está submerso. Pressione suavemente o selo sobre o substrato de ouro e permitir que a monocamada para formar por 15 s.
- Lavar o substrato carimbada duas vezes com etanol, secagem com gás N 2 após cada lavagem e coloque o substrato em uma placa de Petri.
- Cobrir o substrato com solução de aterro e selar o prato com parafilme para evitar a evaporação.
- Permitir que a monocamada de fundo para formar no escuro por 12-14 h.
- Retirar as lamelas padronizada a partir da solução de enchimento e enxaguar duas vezes com etanol, secagem com gás N 2 após cada lavagem.
4. Aplicação de proteínas e células para o substrato Patterned
- Coloque a lamela estampados em uma pequena placa de Petri ou câmara de cultura de células e cobrir com 500 mL a 1 mL de fosfato de Dulbecco Buffered Saline (DPBS). O DPBS deve cobrir completamente o substrato durante a incubação de proteína para garantir uma cobertura de proteína.
- Adicionar uma solução concentrada de proteínas para o DPBS e misturar a solução por pipeting várias vezes. Incubar a mistura de proteína com o substrato a 37 ° C por 1 h. Concentrações finais de laminina e fibronectina são tipicamente 12 mcg / mL e 20 mcg / ml, respectivamente. Proteínas podem ser rotulados com um corante reativo de amina fluorescentes para permitir a visualização padrão fácil. No entanto, a proteína com a etiqueta deve ser misturado com proteína unlabeled 01:01 a rotulagem de proteínas pode interferir com a atividade biológica.
- Após a incubação, lavar abundantemente com o substrato DPBS (4-5x) para remover proteína desacoplado, tomando cuidado para não secar o substrato ou levá-lo através da interface ar-água. Após as três primeiras lavagens, adicionar aproximadamente 500 mL de meio de crescimento de células completo para manter um substrato molhado.
- Substituir o meio de crescimento usado para lavar o substrato com a mídia fresco.
- Dissociar e contagem de células para revestimento sobre o substrato. Ou células dissociadas primários, como os neurônios do hipocampo, ou linhagens de células imortalizadas, como células CHO-K1, pode ser utilizado.
- Células placa dissociado sobre o substrato. Tipicamente 30 a 200 células / mm 2 são utilizados.
5. Resultados representativos:
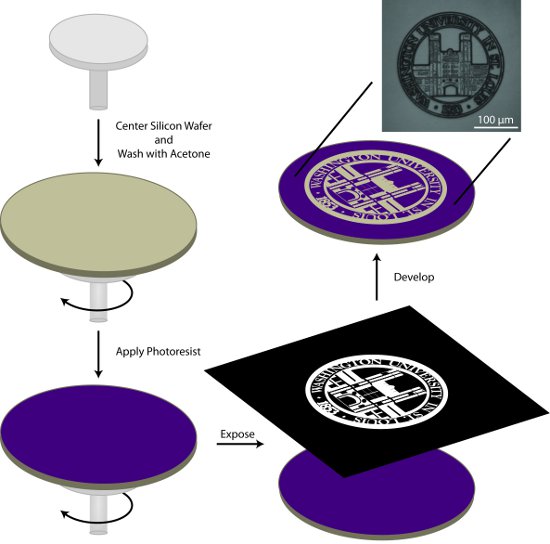
Figura 1. Esquemática gerais para a preparação de um mestre de fotolitografia padrão. Neste processo, uma bolacha de silício é limpa com acetona, revestidas com fotorresiste, expostos ao padrão de interesse, eo padrão é desenvolvido.

Figura 2. Gerais esquemático para PDMS preparação selo. Neste processo, o mestre padronizada é coberto com Sylgard (10:1 resina: endurecedor), de-gaseados num exsicador de vácuo, curada em estufa a 60 ° C e cortados.
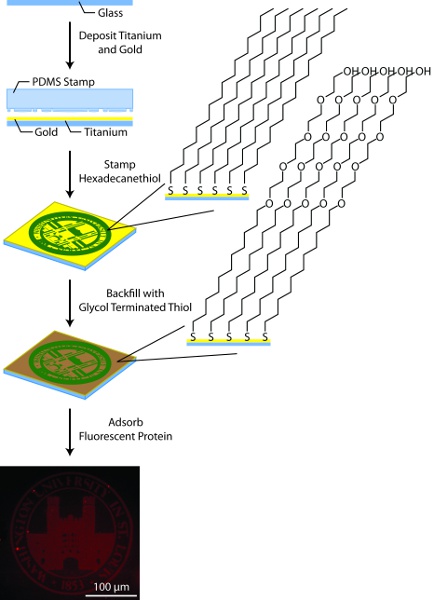
Figura 3. Esquemática Geral de padronização substrato. Neste processo, substratos de vidro são revestidas com titânio (50A) e ouro (150A), utilizando um evaporador feixe de elétrons, modelado por hexadecanethiol microcontact impressão usando um carimbo de PDMS, backfilled com tióis glicol terminado alcano, e revestido com proteína fluorescente-rotulados.

Figura 4. Patterned master (A) e PDMS selo (B) preparado usando os métodos descritos. Barras de escala são 100μm.
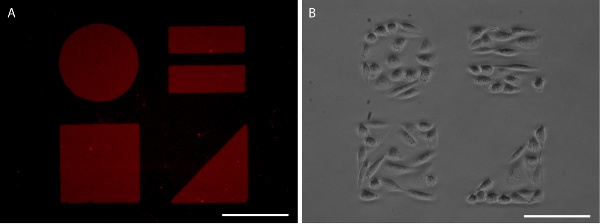
SAMs Figura 5. Patterned visualizado com AlexaFluor 647-rotulados fibronectina (A) e CHO-K1 confinamento celular (B). Barras de escala são 100 mm.
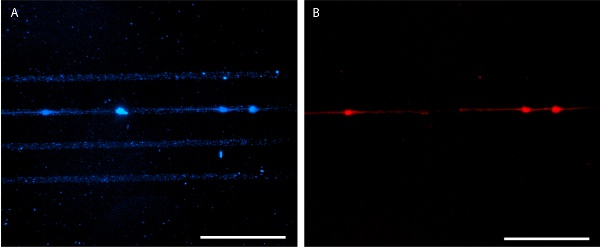
Figura 6. Patterned laminina semeados com neurônios de rato E18 hipocampo menos 4 dias in vitro. AlexaFluor 350-conjugados de anticorpos anti-laminina é utilizado para a visualização padrão (A) e E18 neurônios do hipocampo do rato estão manchadas com MitoTracker Red 580 (B). Barras de escala são 100 mm.
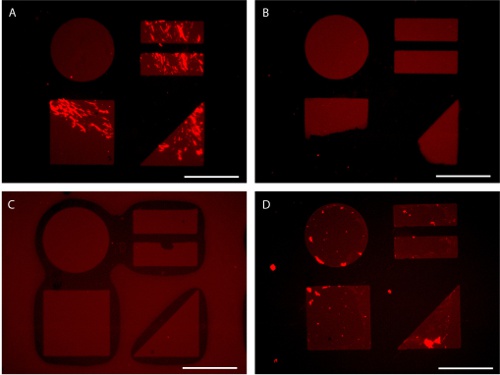
Figura 7. Armadilhas potenciais no preparo do substrato padrão visualizado por AlexaFluor 647-conjugados fibronectina adsorção. (A) insuficiente leva a mistura irregular adsorção de proteínas. (B) aplicação irregular de pressão durante stamping leva à transferência parcial patten. (C) A pressão excessiva durante a estampagem pode levar ao colapso do selo. (D) de exposição da superfície padronizada para a interface ar-água durante a lavagem pode resultar em fundo adsorção de proteínas. Barras de escala são 100 mm.

Figura 8. Padronização submerso pode produzir padrões com características pequenas que são difíceis de impressão, impressão convencional microcontact no ar. Imagens (A) e (B) mostram diferentes regiões do mesmo padrão, impressas com o selo PDMS mesmo no ar (A) ou água deionizada (B). Linhas de 10μm de largura de apoio que cercam o padrão (adicionado para ajudar a evitar o colapso de selo) são vistos em (A), no entanto, as características menores dot como mostrado em (B) não são vistos. Isso demonstra que a impressão no ar funciona bem para os recursos maiores, mas a impressão em água pode ser necessário para os padrões com recursos menores. Barras de escala são 20 mM.
| Ciclo | Taxa de aceleração (rpm / s) | Velocidade final (rpm) | Tempo (s) |
| 1 | 500 | 1000 | 5 |
| 2 | 3800 | 3800 | 30 |
Tabela 1.Dois ciclos do programa de rotação usado para criar uma camada grossa de 4,5 mM AZ9245 em um wafer de silício.
Para preparar selos PDMS para a formação de padrões substratos, um mestre em fotorresiste é o primeiro fabricadas (Figuras 1 e 4A). O mestre é o inverso do selo e é criado usando um sistema de litografia e gravação direta ou um alinhador de máscara. Quando um fotorresiste positivo, como AZ9245, é usado para a produção de mestre, o wafer resistir revestido é exposto à luz com o mesmo padrão que aparecerá sobre o substrato final. Embora nem sempre é possível, tem sido relatado que a proporção ideal (tamanho característica de resistir a espessura) para PDMS mestres selo é 1:2. 13 Descobrimos que proporções de 1:40 são possíveis, dependendo da natureza do padrão. AZ9245 wafers de silício revestido nas condições descritas aqui dar fotorresiste com uma espessura nominal de 4,5 mM. Nós descobrimos que essa espessura de AZ9245 pode ser usado para produzir mestres PDMS com recursos que variam de> 100 mm até 2 micra.
Selos PDMS são lançados a partir Sylgard 182 (ou Sylgard 184) usando o mestre fabricados a partir de fotorresiste (Figura 2). Mestres fotorresiste pode ser usado várias vezes para criar muitas cópias do mesmo selo. Após o endurecimento do PDMS, selos são removidos do mestre utilizando uma lâmina de barbear eo carimbo resultantes podem ser visualizadas em um microscópio, colocando recursos adicionais no selo para baixo sobre uma lamela de vidro (Figura 4B)
Adequada resultados stamping em uma afiada padrão de proteínas, claro que pode ser visualizado através da aplicação de proteína fluorescente etiquetado (Figuras 3 e 5). Alternativamente, imuno-histoquímica pode ser usado para visualizar o padrão de proteínas após a fixação das células (Figura 6). Crescimento celular é bem limitada ao padrão de proteínas para ambas as linhas de células imortalizadas e pilhas (Figuras 5 e 6).
Embora esta técnica é facilmente dominado, vários problemas comuns podem surgir. A aplicação da proteína sem mistura suficiente da solução de proteína concentrada no DPBS pode levar a padrões de proteínas desigual (Figura 7A). Stamping impróprio pode levar à transferência de padrões colapso parcial ou selo (Figura 7B-C). Além disso, expondo o substrato padronizado contendo proteínas adsorvidas ao ar podem prejudicar o monocamada causando diminuição da resistência no fundo (Figura 7D). Padrões composto de características muito pequenos (<5 mm) e alta razão de aspecto muitas vezes requerem o uso da impressão microcontact submersas. Neste procedimento de água (3.5b) é usado como uma barreira para evitar hexadecanethiol de depósito sobre o substrato fora do padrão (Figura 8). 14
Access restricted. Please log in or start a trial to view this content.
Discussão
Uma série de questões podem surgir na produção litográfica do mestre utilizado para PDMS criação de selo. Subexposição dos resultados resistir revestido wafer nos padrões nebulosas e indistintas e superexposição dos resultados resistir revestido wafer em recursos alargada ou faltando. Em geral, os mestres com tamanhos recurso de grande porte (> 10 mm) são relativamente fáceis de desenvolver padrões e, ao mesmo tempo mestres com recursos menores podem exigir extensa otimização de parâmetros photopatt...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Gostaríamos de agradecer ao grupo todo Maurer da Universidade de Washington, cujo conhecimento coletivo fez possível este protocolo. Financiamento para este trabalho é fornecido pelo Instituto Nacional de Saúde Mental (1R01MH085495).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| Pastilha de silício | Wafer Reclaim Serviços | 2 polegadas | |
| Spin-coater / prato quente | Brewer Ciência | Cee 200CB Spin-Bake Sistema | |
| AZ9245 Photoresist | Mays Chemical Company | 105880034-1160 | |
| Direto escrever sistema de fotolitografia | Microtech srl | LW325 Sistema LaserWriter | |
| Alinhador de máscara | HTG | 3h | |
| AZ Desenvolvedor 400K | Mays Chemical Company | 105880018-1160 | |
| Sylgard Kit de elastômero de silicone 182 | Dow Corning | ||
| 25 milímetros no. 1 rodada lamínulas de vidro | VWR | 16004-310 | |
| Oxidizer Plasma | Diener | Femto | |
| Titânio peças Kamis | Incorporado | 99,95% puro | |
| Pellets de ouro | Kamis Incorporated | 99,999% puro | |
| Feixe de elétrons do evaporador | Kurt J. Lesker | 75 sistema de deposição PVD Thin Film | com feixe de elétrons acessório |
| Hexadecanethiol | Alfa Aesar | A11362 | |
| 1-mercaptoundec-11-il) tetra (etilenoglicol) | Sigma Aldrich | 674508 | |
| Etanol | Pharmco-aaper | 111000200 | 200 prova, absoluta |
| Parafilm | VWR | 52858-000 | |
| DPBS | VWR | 4500-434 | Sem cálcio e magnésio |
| Rato laminina I | VWR | 95036-762 | |
| A fibronectina de plasma humano | Invitrogen | 33016-015 | |
| AlexaFluor ® 647 ácido carboxílico, éster succinimidyl | Invitrogen | A-20006 | |
| MitoTracker Red 580 | Invitrogen | M22425 | |
| AlexaFluor ® 350 ácido carboxílico, éster succinimidyl | Invitrogen | A-10168 | |
| Anticorpo anti-laminina | Fisher Scientific | AB2034MI |
Referências
- Wilbur, J., Kumar, A., Biebuyck, H., Kim, E., Whitesides, G. Microcontact printing of self-assembled monolayers: Applications in microfabrication. Nanotechnology. 7, 452-457 (1996).
- Chang, J., Brewer, G., Wheeler, B. A modified microstamping technique enhances polylysine transfer and neuronal cell patterning. Biomaterials. 24, 2863-2870 (2003).
- Lange, S., Benes, V., Kern, D., Horber, J., Bernard, A. Microcontact printing of DNA molecules. Analytical Chemistry. , 1641-1647 (2004).
- Xia, Y., Mrksich, M., Kim, E., Whitesides, G. Microcontact printing of octadecylsiloxane on the surface of silicon dioxide and its application in microfabrication. J. Am. Chem. Soc. , 9576-9577 (1995).
- Mrksich, M., Dike, L., Tien, J., Ingber, D., Whitesides, G. Using microcontact printing to pattern the attachment of mammalian cells to self-assembled monolayers of alkanethiolates on transparent films of gold and silver. Experimental Cell Research. , 305-313 (1997).
- Prime, K. L., Whitesides, G. M. Adsorption of proteins onto surfaces containing end-attached oligo(ethylene oxide) - a model system using self-assembled monolayers. J. Am. Chem. Soc. 115, 10714-10721 (1993).
- Raghavan, S., Desai, R., Kwon, Y., Mrksich, M., Chen, C. Micropatterned Dynamically Adhesive Substrates for Cell Migration. Langmuir. , 17733-17738 (2010).
- Rogers, J., Bao, Z., Baldwin, K., Dodabalapur, A., Crone, B., Raju, V. R., Kuck, V., Katz, H., Amundson, K., Ewing, J. Paper-like electronic displays: Large-area rubber-stamped plastic sheets of electronics and microencapsulated electrophoretic inks. Proc Natl Acad Sci U S A. 98, 4835-4840 (2001).
- Yanker, D., Maurer, J. Direct printing of trichlorosilanes on glass for selective protein adsorption and cell growth. Molecular Biosystems. 4, 502-504 (2008).
- Johnson, D., Maurer, J. Recycling and reusing patterned self-assembled monolayers for cell culture. Chemical Communications. , 520-522 (2011).
- Herne, T., Tarlov, M. Characterization of DNA probes immobilized on gold surfaces. J. Am. Chem. Soc. , 8916-8920 (1997).
- Hanson, E., Schwartz, J., Nickel, B., Koch, N., Danisman, M. Bonding self-assembled, compact organophosphonate monolayers to the native oxide surface of silicon. J. Am. Chem. Soc. , 16074-16080 (2003).
- Johannes, M., Cole, D., Clark, R. Atomic force microscope based nanofabrication of master pattern molds for use in soft lithography. Applied Physics Letters. , (2007).
- Bessueille, F., Pla-Roca, M., Mills, C. A., Martinez, E., Samitier, J., Errachid, A. Submerged microcontact printing (SμCP): An unconventional printing technique of thiols using high aspect ratio, elastomeric stamps. Langmuir. , 12060-12063 (2005).
- Xia, Y., Whitesides, G. Extending microcontact printing as a microlithographic technique. Langmuir. , 2059-2067 (1997).
- Biasco, A., Pisignano, D., Krebs, B., Pompa, P. P., Persano, L., Cingolani, R., Rinaldi, R. Conformation of microcontact-printed proteins by atomic force miroscopy molecular sizing. Langmuir. , 5154-5158 (2005).
- Shen, K., Qi, J., Kam, L. C. Microcontact printing of proteins for cell biology. J Vis Exp. (22), e1065-e1065 (2008).
- Piner, R., Zhu, J., Xu, F., Hong, S., Mirkin, C. "Dip-pen" nanolithography. Science. 283, 661-663 (1999).
- Ryan, D., Parviz, B. A., Linder, V., Semetey, V., Sia, S. K., Su, J., Mrksich, M., Whitesides, G. M. Patterning multiple aligned self-assembled monolayers using light. Langmuir. , 9080-9088 (2004).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados