A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יצירת דו מימדי מצעים Patterned עבור החזקת חלבון ו-Cell
In This Article
Summary
עצמית התאספו monolayers (Sams) נוצר זמן alkane thiols על שרשרת זהב לספק מוגדרים היטב מצעים ליצירת דפוסי חלבון תא הכליאה. הדפסה Microcontact של hexadecanethiol באמצעות חותמת (PDMS) polydimethylsiloxane ואחריו למלא את משבצות עם גליקול, הסתיים alkane תיאול מונומר מייצר דפוס שבו חלבונים בתאים לספוג רק לאזור hexadecanethiol חותמת.
Abstract
הדפסה Microcontact מספק שיטה מהירה, לשעתקו מאוד ליצירת מוגדרים היטב מצעים בדוגמת. 1 בזמן ההדפסה microcontact יכול להיות מועסק ישירות להדפיס מספר גדול של מולקולות, כולל חלבונים, DNA 2, 3 ו silanes, 4 היווצרות עצמית , התאספו monolayers (Sams) מ ארוך alkane thiols על שרשרת זהב מספק דרך פשוטה להגביל חלבונים בתאים דפוסים מסוימים המכיל אזורים דבק עמיד. ריתוק זה יכול לשמש כדי לשלוט מורפולוגיה תאים שימושי לבחינת מגוון של שאלות בחלבון ביולוגיה של התא. כאן אנו מתארים שיטה כללית ליצירת מוגדרים היטב דפוסי חלבון ללימודי הסלולר 5 תהליך זה כולל שלושה שלבים:. הייצור של מאסטר בדוגמת באמצעות photolithography, יצירת בול PDMS, ו microcontact הדפסה של זהב מצופה המצע. בדוגמת פעם, אלה תרבות מצעים תאים המסוגלים חלבונים כליאת ו / או תאים (תאים ראשוניים או שורות תאים) לדפוס.
השימוש כימיה עצמית התאספו monolayer מאפשר שליטה מדויקת את החלבון / תא אזורים בדוגמת דבק ולא דבק אזורים; זו לא יכולה להיות מושגת באמצעות הטבעה חלבון ישיר. Hexadecanethiol, בשרשרת ארוכה alkane תיאול בשימוש בשלב ההדפסה microcontact, מייצרת משטח הידרופובי כי בקלות adsorbs חלבון מן הפתרון. גליקול, הסתיים תיאול, המשמש למלא את משבצות הלא מודפס אזורים של המצע, יוצר monolayer כי הוא עמיד חלבון ספיחה של התא ולכן הצמיחה. 6 אלה מונומרים תיאול לייצר monolayers מובנים מאוד שדווקא להגדיר אזורים של המצע שיכולים לתמוך חלבון ספיחה וצמיחה התא. כתוצאה מכך, מצעים אלה הם שימושיים עבור מגוון רחב של יישומים ממחקר של התנהגות אינטר 7 ליצירת המיקרואלקטרוניקה. 8
בעוד סוגים אחרים של כימיה monolayer שימשו לימודי תרבות התא, כולל עבודה מהקבוצה שלנו באמצעות trichlorosilanes ליצור דפוסים ישירות על מצעים זכוכית, 9 monolayers בדוגמת נוצר thiols alkane על זהב הם ישר קדימה להכין. יתר על כן, מונומרים משמש להכנת monolayer זמינים מסחרית, יציבה, ואינם דורשים טיפול או אחסון תחת אווירה אינרטי. מצעים בדוגמת שהוכן thiols alkane ניתן למחזר ולעשות בהם שימוש חוזר מספר פעמים, תוך שמירה על תא הכליאה 10.
Protocol
1. הכנת המאסטר Patterned (איור 1)
- המרכז פרוסות סיליקון על coater הכביסה, לשטוף את רקיק עם אצטון במהלך השלב הראשוני של תוכנית שתי מחזור ספין בטבלה 1. אצטון יתאדה במהלך השלב השני של התוכנית ספין להשאיר רקיק נקייה ויבשה.
- החל בערך 1 מ"ל AZ9245 photoresist / ב (בקוטר) כדי רקיק ועל ספין מעיל באמצעות התנאים שתוארו בטבלה 1.
- רכים לאפות את רקיק photoresist מצופה ב 110 מעלות מ '2 באמצעות פלטה חשמלית אחידות גבוהה.
- Photopattern את המצע או באמצעות מערכת ישיר לכתוב photolithography או aligner מסכת המערכת מסכה המתאימה. מסכות ניתן לרכוש ממספר מקורות מסחריים. בנוסף, שקפים מודפסים בדיו סופג קרינת UV, מודבק שטוח אופטי, ניתן להשתמש כדי לייצר דפוסים עם תכונות גדולות.
- פיתוח רקיק בדוגמת מפתח 400K ב 01:02: כיתה מוליכים למחצה מים deionized עבור 1 מ 45 s עם תסיסה עדינה. לשטוף ביסודיות עם מים מוליכים למחצה כיתה deionized ויבש עם זרם של חנקן (N 2) גז. פיתוח תבנית ניתן לבדוק באמצעות מיקרוסקופ עם פילטר UV. אם התבנית אינה מפותחת, רקיק ניתן להחזיר את הפתרון בפיתוח בפעם נוספת.
הערה: לקבלת התוצאות הטובות ביותר, photopatterning צריך להתבצע cleanroom בסביבה.
2. הכנת PDMS בול (איור 2)
- הכן 10:01 על ידי שרף משקל: תערובת של hardener Sylgard 182 (PDMS) ו מכסות לחלוטין את המאסטר (רקיק photopatterned) עם התערובת בצלחת פטרי הפנויה.
- De-הגז PDMS מכוסה שני dessicator ואקום עד בועות לא נראים ולאפשר הבול לרפא בתנור על 65 מעלות צלזיוס למשך 1.5 ח לפני ריפוי, חשוב לוודא המאסטר הוא בתחתית המנה כפי שהוא עשוי לעלות אל פני השטח במהלך שלב דה בגז.
- חותכים את PDMS בול מתוך המאסטר וקוצצים לגודל המתאים. חנות בולים במיכל מכוסה (צד תכונה למעלה) כדי להגן עליו מפני אבק ופסולת.
3. הכנת המצע זהב Patterned (איור 3)
- הכן 25 מ"מ לא. 1 כוס coverslips עגול בתצהיר מתכת ידי התייחסות אליהם פלזמה חמצן עבור 10 מ ' לשטוף עם מים פעמיים 18.2 deionized MΩ ואחריו פעמיים עם אתנול, ייבוש עם זרם של גז 2 N בין כל שלב.
- באמצעות כיס רב אלומת אלקטרונים במערכת בתצהיר, בעקבות הפקדת 50 טיטניום ידי זהב 150. אל האוורור המאייד בין בתצהיר של שכבת טיטניום שכבת זהב. לחילופין, מצופה זהב coverslips ניתן לרכוש ממגוון רחב של ספקים, עם זאת, חשוב כי שכבות המתכת מוכנים על ידי אידוי קרן אלקטרונים והתאיידות לא תרמית. אם נרכשו ממקור חיצוני, מצעים זהב ניתן לנקות על ידי חמצון פלזמה או "Piranha" (07:03 קונצרט כלשהו H 2 SO 4:. 30% H 2 O 2), 11 לפני השימוש.
הערה: "Piranha" הפתרון הוא נפץ בנוכחותם של תרכובות אורגניות.
- הכן את הפתרון ביול, 10 hexadecanethiol מ"מ אתנול מוחלט, והפתרון למלא את משבצות, 1 mM גליקול, הסתיים תיאול באתנול מוחלט.
- שוטפים את חותמת עם אתנול יבש ביסודיות עם הגז N 2. החל ביול פתרון dropwise חותמת PDMS עד מצופה לחלוטין. יבש ביסודיות עם חותמת הגז N 2. המשך 5a או 5b כנדרש על פי התכונות של הבול PDMS.
- לחץ בעדינות את החותמת על גבי מצע הזהב לאפשר monolayer כדי ליצור עבור 15 s.
- מניחים את המצע זהב לתוך צלחת פטרי המכילה 18.2 מים deionized MΩ, להבטיח את המצע הוא שקוע. לחץ בעדינות את החותמת על גבי מצע הזהב לאפשר monolayer כדי ליצור עבור 15 s.
- יש לשטוף את המצע חותמת פעמיים עם אתנול, ייבוש בגז 2 N אחרי כל לשטוף את המקום המצע בצלחת פטרי.
- מכסים את המצע למלא את משבצות עם פתרון חותם את המנה עם parafilm על מנת למנוע אידוי.
- אפשר monolayer הרקע טופס בחושך במשך 12-14 ח
- הסר את coverslip בדוגמת מפתרון למלא את משבצות ולשטוף פעמיים עם אתנול, ייבוש בגז 2 N אחרי כל שטיפה.
4. מריחת חלבון תאים למצע Patterned
- מניחים את coverslip בדוגמת בצלחת פטרי קטנה או התרבות תא תא ומכסים μL 500-1 מ"ל של פוספט של Dulbecco שנאגרו מלוחים (DPBS). DPBS חייבת לכסות לחלוטין את המצע במהלך הדגירה חלבון כדי להבטיח כיסוי גם חלבון.
- הוספת פתרון מרוכז של חלבון על DPBS ומערבבים את הפתרון על ידי צינורהטבעת מספר פעמים. דגירה את תערובת החלבונים עם המצע על 37 מעלות צלזיוס למשך 1 ח ריכוזים הסופי עבור laminin ו פיברונקטין הם בדרך כלל 12 מיקרוגרם / מ"ל ו - 20 מיקרוגרם / מ"ל, בהתאמה. חלבון יכול להיות מתויג עם צבע אמין פלורסנט תגובתי על מנת לאפשר ראיה דפוס קל. עם זאת, חלבון הנקרא צריכה להיות מעורבת 01:01 עם חלבון ללא תווית תיוג כמו חלבון יכול להפריע הפעילות הביולוגית.
- לאחר דגירה, לשטוף את המצע ביסודיות עם DPBS (4-5x) כדי להסיר חלבון מאוגד, נזהרת שלא לייבש את המצע או להעבירה דרך ממשק האוויר והמים. לאחר שלוש שטיפות הראשונה, להוסיף כ 500 μL של התקשורת צמיחה להשלים התא כדי לשמור על מצע רטוב.
- החלף את המדיה צמיחה בשימוש כדי לשטוף את המצע עם מדיה חדשה.
- לנתק לספור תאים ציפוי על גבי המצע. תאים או העיקרי ניתק, כגון נוירונים בהיפוקמפוס, או שורות תאים הנציח, כגון CHO-K1 תאים, יכול להיות מנוצל.
- פלייט תאים על גבי מצע מנותק. בדרך כלל 30-200 תאים / מ"מ 2 משמשים.
5. נציג תוצאות:
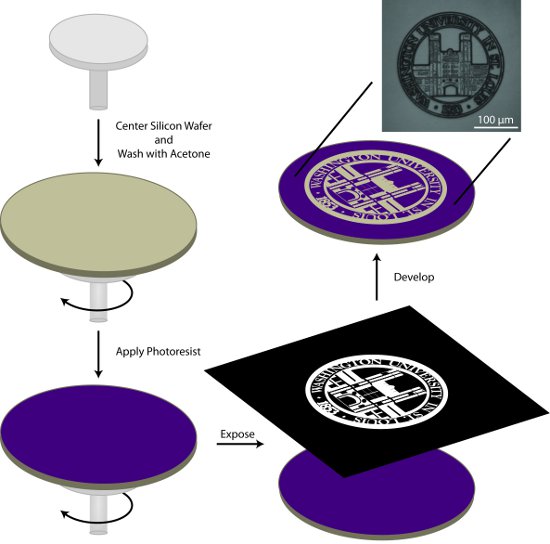
באיור 1. סכמטית כללי להכנת photolithographic של אמן בדוגמת. בתהליך זה, פרוסות סיליקון הוא לנקות עם אצטון, מצופה photoresist, נחשף דפוס של עניין, ואת תבנית מפותחת.

איור 2. הכללי סכמטית להכנת חותמת PDMS. בתהליך זה, המתאר בדוגמת מכוסה Sylgard (10:01 שרף: hardener), דה בגז בתוך תא ייבוש ואקום, נרפא בתנור ב 60 ° C, לחתוך לגודל.
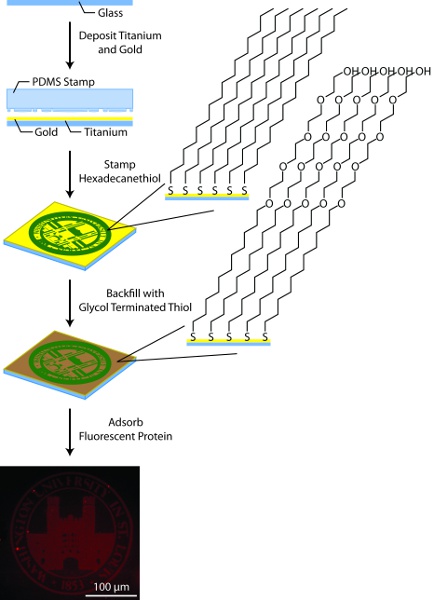
איור 3. סכמטית הכללי דפוסים המצע. בתהליך זה, מצעים זכוכית מצופה טיטניום (50Å) וזהב (150Å) באמצעות המאייד אלומת אלקטרונים, בדוגמת ידי hexadecanethiol microcontact הדפסה באמצעות חותמת PDMS, backfilled עם thiols גליקול הסתיים alkane, ומצופה חלבון fluorescently שכותרתו.

איור 4. Patterned אב (א) ו PDMS בול (ב) מוכן בשיטות שתוארו. ברים סולם הם 100μm.
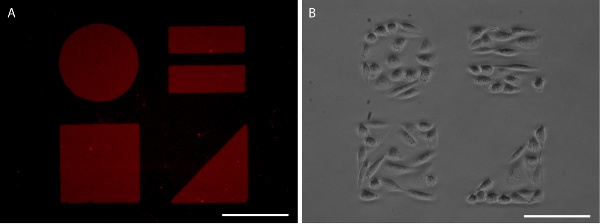
איור 5. סאמס Patterned דמיינו עם AlexaFluor 647 שכותרתו פיברונקטין (א) ו CHO-K1 הכליאה תא (B). ברים הם סולם 100 מיקרומטר.
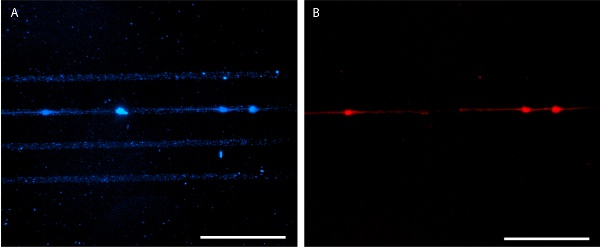
איור 6. Patterned laminin seeded עם E18 נוירונים בהיפוקמפוס העכבר על 4 ימים במבחנה. AlexaFluor 350-מצומדות אנטי laminin הנוגדן משמש להדמיה דפוס (א) ו E18 נוירונים בהיפוקמפוס העכבר מגואלות MitoTracker האדום 580 (ב). ברים הם סולם 100 מיקרומטר.
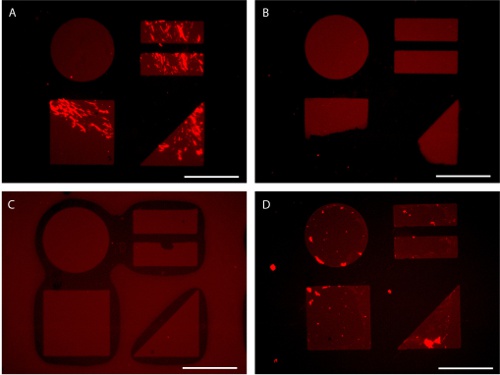
איור 7. בעיות פוטנציאליות כהכנה המצע בדוגמת דמיינו ידי AlexaFluor 647-מצומדות פיברונקטין ספיחה. (א) מוביל ערבוב מספיק לחלבון ספיחה אחידה. (ב) בקשה לא אחידה של לחץ במהלך הטבעה מוביל להעברת פאטן חלקית. (ג) יתר לחץ במהלך הטבעה יכול להוביל חותמת קריסה. (ד) חשיפה של פני השטח בדוגמת לממשק מים באוויר במהלך השטיפה עלולה לגרום חלבון רקע ספיחה. ברים הם סולם 100 מיקרומטר.

איור 8. דפוסים שקוע יכול לייצר דפוסי קטן עם תכונות שקשה ההדפסה על ידי הדפסה microcontact קונבנציונאלי באוויר. תמונות (א) ו - (ב) להראות באזורים שונים של אותו דפוס, מודפס עם חותמת PDMS אותו באוויר (א) או מים deionized (B). 10μm רחב קווי תמיכה המקיפים את התבנית (נוסף כדי למנוע התמוטטות חותמת) נראים (A), לעומת זאת, תכונות נקודה קטן יותר כפי שמוצג (ב) לא נתפסים. זה מוכיח כי דפוס באוויר עובד היטב עבור תכונות גדולים יותר, אך הדפסה במים עשוי להיות נחוץ עבור דפוסים עם תכונות יותר. ברים סולם הם 20 מיקרומטר.
| מחזור | האצת קצב (סל"ד / s) | מהירות סופית (סל"ד) | זמן (s) |
| 1 | 500 | 1000 | 5 |
| 2 | 3800 | 3800 | 30 |
טבלה 1.שני מחזור תוכנית ספין השתמשו כדי ליצור ציפוי עבה של 4.5 מיקרומטר AZ9245 על פרוסות סיליקון.
כדי להכין חותמות PDMS להקמת בדוגמת מצעים, שני photoresist הוא מפוברק הראשונה (איורים 1 ו - 4 א). האדון הוא ההופכי של חותמת, והוא נוצר באמצעות מערכת או ישיר לכתוב ליתוגרפיה או aligner המסכה. כאשר photoresist חיוביים, כגון AZ9245, משמש לייצור אב, רקיק להתנגד מצופה נחשף לאור עם אותו דפוס שיופיע על פני המצע הסופי. אמנם זה לא תמיד אפשרי, זה כבר דווח כי יחס אידיאלי (גודל תכונה להתנגד עובי) על אדונים חותמת PDMS היא 01:02. 13 מצאנו כי היבט ratios של 01:40 הם אפשריים, בהתאם לאופי דפוס. AZ9245 פרוסות סיליקון מצופה בתנאים שתוארו כאן לתת photoresist בעובי נומינלי של 4.5 מיקרומטר. מצאנו כי זה עובי AZ9245 ניתן להשתמש כדי לייצר אדונים PDMS עם תכונות, החל> 100 מיקרומטר עד 2 מיקרומטר.
בולים PDMS נוצקו מתוך Sylgard 182 (או 184 Sylgard) באמצעות האב מפוברק בין photoresist (איור 2). אדונים photoresist ניתן להשתמש מספר פעמים כדי ליצור עותקים רבים של בול אותו דבר. לאחר התקשות PDMS, בולים יוסרו מן האדון באמצעות סכין גילוח ואת חותמת וכתוצאה מכך ניתן דמיינו תחת מיקרוסקופ על ידי הצבת תכונה בצד חותמת על coverslip זכוכית (איור 4B)
תוצאות ביול פרופר בדפוס, חד חלבון ברור כי ניתן דמיינו ידי יישום של חלבון שכותרתו fluorescently (איורים 3 ו -5). לחלופין, אימונוהיסטוכימיה ניתן להשתמש כדי להמחיש את דפוס החלבון לאחר קיבוע תא (איור 6). צמיחת תאים מוגבל גם לדפוס חלבון הן שורות תאים ו הנציח תאים ראשוניים (איורים 5, 6).
בעוד טכניקה זו היא לשלוט בקלות, כמה בעיות נפוצות שעלולות להתעורר. היישום של חלבון ללא ערבוב מספקת פתרון החלבון מרוכזים DPBS יכול להוביל דפוסי חלבון אחידים (7 א 'איור). ביול לא נכון עלול להוביל להעברת דפוס חלקי או התמוטטות בול (איור 7 ב-C). בנוסף, לחשוף את המצע בדוגמת המכילים חלבון adsorbed לאוויר יכולים לשבש את monolayer גרימת התנגדות ירד ברקע (איור 7D). דפוסי מורכבת תכונות מאוד קטנה (<5 מיקרומטר) ו היבט ratios גבוהה לעתים קרובות דורשים שימוש הדפסה microcontact שקוע. במים הליך זה (3.5b) משמש כמחסום למניעת hexadecanethiol מהפקדת על מצע החיצוני של התבנית (איור 8). 14
Access restricted. Please log in or start a trial to view this content.
Discussion
מספר בעיות עלולות להתעורר בהפקת ליתוגרפיות של האמן משמש ליצירת חותמת PDMS. Underexposure של להתנגד מצופה תוצאות רקיק בדפוסי מעורפל ולא ברור וגם חשיפה של להתנגד מצופה תוצאות רקיק תכונות מוגדלים או חסר. באופן כללי, עם אדונים גדלים תכונה גדולה (> 10 מיקרומטר) קל יחסית לפתח דפוס, ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
ברצוננו להכיר את כל הקבוצה מאורר באוניברסיטת וושינגטון, אשר הידע הקולקטיבי הפך פרוטוקול זה אפשרי. מימון עבור עבודה זו מסופקת על ידי המכון הלאומי לבריאות הנפש (1R01MH085495).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | הערות (אופציונלי) |
|---|---|---|---|
| פרוסות הסיליקון | ופלה לתבוע שירותים | 2 אינטש | |
| ספין coater / פלטה | ברואר המדע | Cee 200CB ספין אופים מערכת | |
| AZ9245 photoresist | מייז כימיקלים | 105880034-1160 | |
| ישיר לכתוב photolithography מערכת | Microtech srl | LW325 LaserWriter מערכת | |
| מסכת Aligner | HTG | 3HR | |
| AZ מפתחים 400K | מייז כימיקלים | 105880018-1160 | |
| Sylgard סיליקון 182 אלסטומר Kit | Dow Corning | ||
| לא 25 מ"מ. 1 כוס coverslips עגול | VWR | 16004-310 | |
| פלזמה מחמצן | דינר | Femto | |
| טיטניום חתיכות Kamis | Incorporated | 99.95% טהור | |
| כדורי זהב | Kamis Incorporated | 99.999% טהור | |
| אלומת אלקטרונים המאייד | קורט ג'Lesker | PVD 75 סרט דק הפקדת מערכת | עם אביזר קרן אלקטרונים |
| Hexadecanethiol | אלפא Aesar | A11362 | |
| 1-mercaptoundec-11-י.ל.) טטרה (ethyleneglycol) | סיגמא אולדריץ | 674508 | |
| אתנול | Pharmco-aaper | 111000200 | 200 הוכחה מוחלטת |
| Parafilm | VWR | 52858-000 | |
| DPBS | VWR | 4500-434 | ללא סידן ומגנזיום |
| עכבר Laminin אני | VWR | 95036-762 | |
| האדם פלזמה פיברונקטין | Invitrogen | 33016-015 | |
| AlexaFluor ® 647 חומצה carboxylic, succinimidyl אסתר | Invitrogen | A-20006 | |
| MitoTracker האדום 580 | Invitrogen | M22425 | |
| AlexaFluor ® 350 חומצה carboxylic, אסתר succinimidyl | Invitrogen | A-10168 | |
| Anti-laminin נוגדן | פישר סיינטיפיק | AB2034MI |
References
- Wilbur, J., Kumar, A., Biebuyck, H., Kim, E., Whitesides, G. Microcontact printing of self-assembled monolayers: Applications in microfabrication. Nanotechnology. 7, 452-457 (1996).
- Chang, J., Brewer, G., Wheeler, B. A modified microstamping technique enhances polylysine transfer and neuronal cell patterning. Biomaterials. 24, 2863-2870 (2003).
- Lange, S., Benes, V., Kern, D., Horber, J., Bernard, A. Microcontact printing of DNA molecules. Analytical Chemistry. , 1641-1647 (2004).
- Xia, Y., Mrksich, M., Kim, E., Whitesides, G. Microcontact printing of octadecylsiloxane on the surface of silicon dioxide and its application in microfabrication. J. Am. Chem. Soc. , 9576-9577 (1995).
- Mrksich, M., Dike, L., Tien, J., Ingber, D., Whitesides, G. Using microcontact printing to pattern the attachment of mammalian cells to self-assembled monolayers of alkanethiolates on transparent films of gold and silver. Experimental Cell Research. , 305-313 (1997).
- Prime, K. L., Whitesides, G. M. Adsorption of proteins onto surfaces containing end-attached oligo(ethylene oxide) - a model system using self-assembled monolayers. J. Am. Chem. Soc. 115, 10714-10721 (1993).
- Raghavan, S., Desai, R., Kwon, Y., Mrksich, M., Chen, C. Micropatterned Dynamically Adhesive Substrates for Cell Migration. Langmuir. , 17733-17738 (2010).
- Rogers, J., Bao, Z., Baldwin, K., Dodabalapur, A., Crone, B., Raju, V. R., Kuck, V., Katz, H., Amundson, K., Ewing, J. Paper-like electronic displays: Large-area rubber-stamped plastic sheets of electronics and microencapsulated electrophoretic inks. Proc Natl Acad Sci U S A. 98, 4835-4840 (2001).
- Yanker, D., Maurer, J. Direct printing of trichlorosilanes on glass for selective protein adsorption and cell growth. Molecular Biosystems. 4, 502-504 (2008).
- Johnson, D., Maurer, J. Recycling and reusing patterned self-assembled monolayers for cell culture. Chemical Communications. , 520-522 (2011).
- Herne, T., Tarlov, M. Characterization of DNA probes immobilized on gold surfaces. J. Am. Chem. Soc. , 8916-8920 (1997).
- Hanson, E., Schwartz, J., Nickel, B., Koch, N., Danisman, M. Bonding self-assembled, compact organophosphonate monolayers to the native oxide surface of silicon. J. Am. Chem. Soc. , 16074-16080 (2003).
- Johannes, M., Cole, D., Clark, R. Atomic force microscope based nanofabrication of master pattern molds for use in soft lithography. Applied Physics Letters. , (2007).
- Bessueille, F., Pla-Roca, M., Mills, C. A., Martinez, E., Samitier, J., Errachid, A. Submerged microcontact printing (SμCP): An unconventional printing technique of thiols using high aspect ratio, elastomeric stamps. Langmuir. , 12060-12063 (2005).
- Xia, Y., Whitesides, G. Extending microcontact printing as a microlithographic technique. Langmuir. , 2059-2067 (1997).
- Biasco, A., Pisignano, D., Krebs, B., Pompa, P. P., Persano, L., Cingolani, R., Rinaldi, R. Conformation of microcontact-printed proteins by atomic force miroscopy molecular sizing. Langmuir. , 5154-5158 (2005).
- Shen, K., Qi, J., Kam, L. C. Microcontact printing of proteins for cell biology. J Vis Exp. (22), e1065-e1065 (2008).
- Piner, R., Zhu, J., Xu, F., Hong, S., Mirkin, C. "Dip-pen" nanolithography. Science. 283, 661-663 (1999).
- Ryan, D., Parviz, B. A., Linder, V., Semetey, V., Sia, S. K., Su, J., Mrksich, M., Whitesides, G. M. Patterning multiple aligned self-assembled monolayers using light. Langmuir. , 9080-9088 (2004).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved