A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نظم الدورية الثقافة خلية خلية للثقافة الإنسان : خلايا الأرومة الغاذية الإنسان نموذجا
* These authors contributed equally
In This Article
Summary
التقليدية ، واثنين من خلية ثقافة تقنيات الأبعاد غالبا ما تؤدي إلى تغيير الخصائص فيما يتعلق علامات التمايز ، السيتوكينات وعوامل النمو. ثلاثي الأبعاد ثقافة خلية في نظام خلية ثقافة الدورية (المراكز المناخية الإقليمية) استعادت التعبير عن كثير من هذه العوامل كما هو موضح هنا مع خط الأرومة الغاذية extravillous الخلية.
Abstract
The field of human trophoblast research aids in understanding the complex environment established during placentation. Due to the nature of these studies, human in vivo experimentation is impossible. A combination of primary cultures, explant cultures and trophoblast cell lines1 support our understanding of invasion of the uterine wall2 and remodeling of uterine spiral arteries3,4 by extravillous trophoblast cells (EVTs), which is required for successful establishment of pregnancy. Despite the wealth of knowledge gleaned from such models, it is accepted that in vitro cell culture models using EVT-like cell lines display altered cellular properties when compared to their in vivo counterparts5,6. Cells cultured in the rotating cell culture system (RCCS) display morphological, phenotypic, and functional properties of EVT-like cell lines that more closely mimic differentiating in utero EVTs, with increased expression of genes mediating invasion (e.g. matrix metalloproteinases (MMPs)) and trophoblast differentiation7,8,9. The Saint Georges Hospital Placental cell Line-4 (SGHPL-4) (kindly donated by Dr. Guy Whitley and Dr. Judith Cartwright) is an EVT-like cell line that was used for testing in the RCCS.
The design of the RCCS culture vessel is based on the principle that organs and tissues function in a three-dimensional (3-D) environment. Due to the dynamic culture conditions in the vessel, including conditions of physiologically relevant shear, cells grown in three dimensions form aggregates based on natural cellular affinities and differentiate into organotypic tissue-like assemblies10,11,12 . The maintenance of a fluid orbit provides a low-shear, low-turbulence environment similar to conditions found in vivo. Sedimentation of the cultured cells is countered by adjusting the rotation speed of the RCCS to ensure a constant free-fall of cells. Gas exchange occurs through a permeable hydrophobic membrane located on the back of the bioreactor. Like their parental tissue in vivo, RCCS-grown cells are able to respond to chemical and molecular gradients in three dimensions (i.e. at their apical, basal, and lateral surfaces) because they are cultured on the surface of porous microcarrier beads. When grown as two-dimensional monolayers on impermeable surfaces like plastic, cells are deprived of this important communication at their basal surface. Consequently, the spatial constraints imposed by the environment profoundly affect how cells sense and decode signals from the surrounding microenvironment, thus implying an important role for the 3-D milieu13.
We have used the RCCS to engineer biologically meaningful 3-D models of various human epithelial tissues7,14,15,16. Indeed, many previous reports have demonstrated that cells cultured in the RCCS can assume physiologically relevant phenotypes that have not been possible with other models10,17-21. In summary, culture in the RCCS represents an easy, reproducible, high-throughput platform that provides large numbers of differentiated cells that are amenable to a variety of experimental manipulations. In the following protocol, using EVTs as an example, we clearly describe the steps required to three-dimensionally culture adherent cells in the RCCS.
Protocol
1. الكولاجين الخرزة التحضير
- قبل EVTs التحميل لمدة 3 - D خلية ثقافة ، ويحتاج المرء لتحضير حبات microcarrier Cytodex - 3 :
- تزن خارج القدر المناسب من Cytodex - 3 حبات المطلوبة لهذه التجربة. ويتم تكييف هذا البروتوكول للسفينة 10ML المراكز المناخية الإقليمية ، والتي هي بحاجة 0.05g من الخرز. لسفينة 50ml المراكز المناخية الإقليمية ، وفقا لمقياس. في أنبوب 50mL autoclavable المخروطية ، مزيج من 250 ملغ Cytodex - 3 حبات مع الفوسفات Dulbecco 12mL مخزنة الحل (DPBS). وهذا المبلغ غير كاف بالنسبة للسفن المراكز المناخية الإقليمية 5.
- ضمان وجود كمية كافية في أنبوب مخروطي الشكل ، وهذه العملية ستؤدي في الأوتوكلاف التبخر. قبعة فضفاضة الأنبوب والأوتوكلاف لمدة 10 دقيقة في 110 درجة مئوية.
- إزالة أنبوب مخروطي الشكل عند الانتهاء من دورة الأوتوكلاف والسماح للحل Cytodex - 3 حبة لتبرد.
- بعد أنبوب مخروطي الشكل ويتم تبريده الى درجة حرارة الغرفة ، واستخدام تقنية معقمة لتحقيق الحجم الكلي ل12.5mL 1X به موانئ دبيBS.
- قبعة وتخزين أعد Cytodex - 3 حبات في درجة حرارة الغرفة. السماح للالخرز على استعداد لتنتفخ وتبرد لدرجة حرارة الغرفة قبل استخدامها. سيتم إعداد أعلاه Cytodex - 3 حبات توفير خمس سفن 10ML المراكز المناخية الإقليمية. وقد لاحظنا أن التخزين الموسعة Cytodex - 3 حبات في درجة حرارة الغرفة سوف تؤدي إلى تراجع الأداء ، كما سيؤدي إلى زعزعة الاستقرار الكولاجين بعد شهر واحد تقريبا. Cytodex - 3 حبات يتراوح حجمها 133-215 ميكرون.
2. إعداد وسائل الاعلام
تحضير 1L من المراكز المناخية الإقليمية الأمثل GTSF - 2 وسائل الاعلام (مقتبس من 22) ، الذي يتكون من 40 ٪ MEM ألفا ، بالإضافة إلى ملاحق و 60 ٪ L - 15 ليبوفيتز وسائل الاعلام (مقتبس من 22). أولا ، إعداد 400mL في إجمالي حجم ألفا MEM تستكمل مع :
21.2mM بيكربونات الصوديوم
0.06 ٪ ببتون
0.7mM الفركتوز
1.4mM الجالاكتوز
5.6mM الجلوكوز
1 ٪ HEPES
1 ٪ L - الجلوتامين
0.5 ٪ ITS
10 ٪ FBS- لإعداد محلول المخزون من ITS ، تذوب في 5mL العقيمة O 2 H يحمض أعدها إضافة حمض الخليك الجليدي (حوالي 0.05mL). دوامة حل ، اتبع مع الماء المعقم 45mL.
- تزن ما يكفي من L - 15 ليبوفيتش لمسحوق 600ml المتوسط عن طريق إذابة الأنسجة في الثقافة O. الصف 2 H
- جلب المتوسطة الحجم الكلي للثقافة الخلية ل1L مع المتوسط L - 15 ليبوفيتز. فلتر تعقيم وتخزين عند 4 في الظلام درجة مئوية. إضافة 1 ٪ البنسلين ، الستربتوميسين فردي لكل قسامة من الوسيلة المستخدمة.
- وقد تم العديد من وسائل الاعلام الصيغ الأخرى من وسائل الاعلام - 2 GTSF اختبرت بنجاح في المراكز المناخية الإقليمية. يجب المختبرات الفردية التي تقرر لنفسها المتوسط هو الأمثل ليتم تنفيذ التجربة.
3. الخلايا والحضانة الخرزة
- نشر EVTs لconfluency 80 ٪ ~ ، ويعرض للتريبسين العد باستخدام الممارسات المقبولة ثقافة الخلية.
- تعليق 1x10 6 EVTs في 4mL الدافئةاد وسائل الإعلام.
- المزيج بلطف على استعداد Cytodex - 3 حبات. باستخدام تقنيات معقمة ، إزالة 2.5mL من الخرز إعدادها باستخدام تلميح واسعة ، 10ML ماصة المصلية ونقل إلى أنبوب مخروطي 15mL غير المستخدمة. علما أنه قد تكون هناك خسارة صغيرة من الخرز والتي يعلقونها على ماصة.
- السماح لل- 3 حبات Cytodex لتسوية في الجزء السفلي من الأنبوب. بعد الترسيب ، واستخدام pipettor لإزالة الطبقة العليا من دون إزعاج DPBS حبات Cytodex - 3.
- مزيج 1x10 6 EVTs أعدت في وسائل الإعلام مع حبات Cytodex - 3 المعدة.
- احتضان الخليط خلية حبة في درجة حرارة الغرفة لمدة 30 دقيقة. المزيج بلطف دوريا. احتضان لمزيد من 30 دقيقة عند 37 درجة مئوية و 5 ٪ CO 2. المزيج بلطف دوريا.
4. تحميل RWV
- في مجلس الوزراء تدفق الصفحي ، إزالة المراكز المناخية الإقليمية 10ML من التعبئة والتغليف ووضعه في العقيمة ، لوحة الثقافة 6 - جيدا لتحقيق الاستقرار. الرجوع إلى الشكل (1) رسم تخطيطي لتسمية المنسق المقيمCS.
- إزالة سدادة كبيرة من الميناء.
- جعل إجمالي حجم الخليط خلية حبة لاحتضان 10ML تحسنت مع وسائل الاعلام.
- تحميل خلية / حبة الخليط في المراكز المناخية الإقليمية ، من خلال ميناء كبير. وينبغي إمالة المراكز المناخية الإقليمية في زاوية 45 درجة (كبير يصل الميناء) عند تحميل للمساعدة في إزالة فقاعات الهواء المحتملة. منع تراكم الضغط الايجابي عن طريق ملء السفن ببطء ولكن بثبات.
- استبدال سدادة في ميناء كبير.
- إزالة بيستونز من 3 مل الحقن والمحاقن مكان فارغ على المنافذ الصغيرة. إضافة 1 - 3mL من وسائل الإعلام إلى كل حقنة. فتح ببطء الصمامات اثنين. استبدال المحاقن بيستونز على المحاقن بلطف. إضافة وسائط من الحقنة حتى تتم إزالة كافة الفقاعات من داخل الغرفة.
- التقط المراكز المناخية الإقليمية والاستفادة من الجانب بلطف حين تناوب في أمامك للتحقق من الفقاعات. إذا كان هناك أي فقاعات ، ويجب اخراجهم من الغرفة ، وفقاعات الهواء سوف تتداخل مع تشكيل سالمجاميع و الخلايا وإدخال قوى القص. إزالة الفقاعات من خلال تناوب المراكز المناخية الإقليمية حتى فقاعات تحت ميناء صغير. ثم ادفع برفق لأسفل على حقنة في الجانب المقابل لإجبار فقاعات في الميناء والخروج من القاعة.
- إغلاق ميناء واحد من الجانبين. ادفع برفق لأسفل على مكبس الحقنة أخرى لإدخال كمية صغيرة من الضغط الإيجابي في السفينة ، والذي يمنع من تشكيل فقاعات. إغلاق صمام الثانية.
- تحميل المراكز المناخية الإقليمية على الدوار. بدء الدوران في 19rpm في 37 درجة مئوية حاضنة 2 CO.
5. تغيير وسائل الإعلام
- تغيير وسائل الاعلام كل يوم على مدى الأيام الثلاثة الأولى ، ثم بعد ذلك كل يوم.
- إيقاف الدوار وإزالة المراكز المناخية الإقليمية. سحب المكابس لخلق بعض الشفط ، إزالة المحاقن من كل ميناء صغير ووضع المراكز المناخية الإقليمية على زاوية بحيث الخرز تسوية المقابل من ميناء كبير.
- بعد الخرز وقد استقر كل شيء ، فتح أحد الصمامات الصغيرة والسماح لوسائل الإعلام في التدفق من المراكز المناخية الإقليمية وداخل حاوية النفايات. إزالة 2 / 3 من وسائل الإعلام بهذه الطريقة. يجب التأكد من عدم إزعاج الخرز وعدم تجاهل أي المجاميع.
- إغلاق صمام الصغيرة وفتح ميناء كبير. إضافة وسائل الإعلام مرة أخرى إلى المراكز المناخية الإقليمية من خلال ميناء كبير. استبدال سدادة في ميناء كبير.
- كرر الخطوات من 4،6-4،9.
- كما المجاميع الزيادة في الحجم ، وتحتاج إلى زيادة سرعة دوران للاحتفاظ بها في تعليق العمل في جميع الأوقات ، من الناحية المثالية في نمط الدورة الدموية الصغيرة في السرعة المثلى. عموما ، وزيادة السرعة بين 0،3-0،7 بعد كل دورة في الدقيقة التغذية مرة واحدة في المجاميع تبدأ في النمو بشكل ملحوظ.
6. نشر جمع خلايا
- إزالة المراكز المناخية الإقليمية من الدوار. إزالة المحاقن من كل ميناء صغير ووضع المراكز المناخية الإقليمية على زاوية بحيث يمكن تسوية الخرز العكس من ميناء كبير.
- بعد الخرز وقد استقر كل شيء ، فتح أحد الصمامات الصغيرة والسماح لوسائل الإعلام لتتدفقمن المراكز المناخية الإقليمية وداخل حاوية النفايات. إزالة 1 / 3 من وسائل الإعلام بهذه الطريقة.
- إغلاق صمام الصغيرة وفتح ميناء كبير. بلطف دوامة السفينة لتفريق التجمعات مرة أخرى إلى الحل. الخليط السائل في أنبوب فارغ 50ml العقيمة المخروطية. السماح للمجاميع التي جمعت لتستقر في أنبوب مخروطي طاف به قبل أن يغسل جيدا وعاء الثقافة لتحقيق أقصى قدر من الانتعاش من الركام. ويمكن استخدام المجاميع عن المقايسات المصب على الفور ، مثل التدفق الخلوي ، المقايسات الغزو المناعي وغيرها.
7. ممثل النتائج
ويظهر مثال EVT تشبه الخلايا (خلية SGHPL - 4 الأرومة الغاذية خط) التي تزرع في المراكز المناخية الإقليمية على Cytodex - 3 حبات في الشكل 2. خط خلية EVT مثل يعرض توقعات بتمديد بعيدا عن الكتلة الرئيسية ، وربط على كتل المجاورة. مغطاة بالكامل العديد من الخرز مع خلايا التكاثر. إزالة مرة واحدة من المراكز المناخية الإقليمية وجيش التحرير الشعبى الصينىتيد على المصفوفة خارج الخلية ، وEVT مثل 3 - D غزو الخلايا المزروعة بقوة و / أو ترحيل (الشكل 3). RT - PCR البيانات تؤكد على التعبير زيادة MMPs ينظر في المجاميع 3 - D بدلا من الثقافة التقليدية monolayers الخلية (الشكل 4). ومن المثير للاهتمام ، هي أيضا upregulated الجينات لا ترتبط مع الغزو في المراكز المناخية الإقليمية (الجدول 1) و قد تساعد في تحديد مجالات مثل تفاعلات المناعية مع trophoblasts غزو الخلايا.
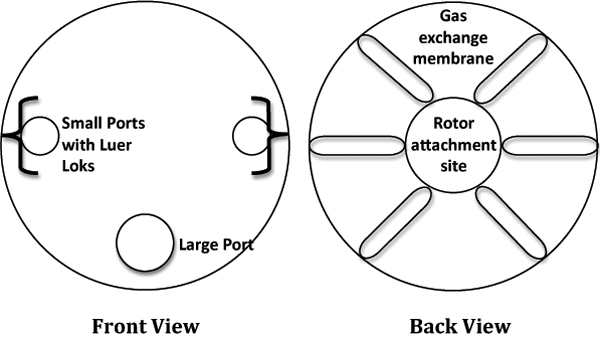
الشكل 1. تصوير أفلام كارتون لنظام خلية الثقافة الدوارة (المراكز المناخية الإقليمية).

الشكل 2. المرحلة مجهرية على النقيض من إجمالي النمو ممثل بعد 5 أيام في المراكز المناخية الإقليمية. تشير الأسهم إلى غزو الخلايا و* يدل على حبات microcarrier Cytodex - 3.

كانت جزءا لا يتجزأ من الرقم 3. المجاميع المراكز المناخية الإقليمية يزرع في المواد الهلامية الليفين. ولوحظ من خلال غزو الجل الليفين في أقرب وقت (أ) تضمين بعد الليفين 24 ساعة و (ب) واصلت خلال 48 ساعة. تشير الأسهم الخلايا الغازية ويدل على Cytodex * 3 حبات microcarrier (بتصرف ، بإذن من المرجع 7).

نشر الرقم 4. zymogram الجيلاتين المقارن المونولاير والمراكز المناخية الإقليمية SGHPL - 4 - EVT مثل الخلايا. ويفرز أشكالا المؤيدة ونشطة من MMP - 2 و MMP - 9 من الأرومة الغاذية المراكز المناخية الإقليمية الخلايا المزروعة (بتصرف ، بإذن من المرجع 7).

الجدول 1. ملخص النتائج ميكروأري من خلايا - 4 SGHPL نمت في المراكز المناخية الإقليمية (بتصرف ، بإذن من المرجع 7).
- الحث طية في المجاميع 3 - D على النحو التالي : تطبيع 3 - D الجينات القيمة / الجين monlayer تطبيع القيمة.
- يشير الجينات التي كانت أقل من الحد من الكشف في monolayers.
Discussion
ثقافة تقنية المعروضة هنا يقدم المحققون مع الخلايا EVT مثل الغازية للغاية. وقد تم الآن من المسلم به أن فقدان التمايز يحدث في monolayers بسبب تثبيط الاستجابات الخلوية لمنبهات الكيميائية والجزيئية في ثلاثة أبعاد (سطوح الخلايا القمي ، القاعدية ، والجانبية) 10،13. هذا الأسل...
Disclosures
ليس لدينا شيء في الكشف عنها.
Acknowledgements
وأيد هذا العمل من قبل المعاهد الوطنية الأميركية للصحة منح HD051998 # المعاهد الوطنية للصحة / معاهد الصحة القومية (لCAM).
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف | شركة | فهرس العدد | تعليقات |
| Cytodex الخرز microcarrier | سيغما الدريخ | C3275 | |
| نظام التناوب الثقافة الخلية (المراكز المناخية الإقليمية) | Synthecon | المراكز المناخية الإقليمية - D | ويشمل العرض الدوار قاعدة السلطة ، و 4 وحدات للتصرف المراكز المناخية الإقليمية |
| وحدات المراكز المناخية الإقليمية يعاد | Synthecon | الاتصال Synthecon | |
| 3ml حقنة غيض Luer لوك | دينار بحريني | 309585 | |
| 10ML اسعة طرف المصلية ماصة | دينار بحريني | 357504 | |
| MEM ألفا | Invitrogen | 12561-072 | |
| L - 15 ليبوفيتش المتوسطة ، ومسحوق | Invitrogen | 41300-039 | |
| H 2 O ، الذيفان الداخلي مجانا | الصياد | MT - 25 - 055 - CM | |
| بيكربونات الصوديوم | سيغما الدريخ | S - 7795 | |
| الببتون مادة تنشأ عن البروتينات | فيشر العلمية | BP1420 - 100 | |
| سكر الفاكهة | سيغما الدريخ | F3510 - 100 | |
| الجالاكتوز | سيغما الدريخ | G5388 - 100 | |
| جلوكوز | سيغما الدريخ | G7528 - 250 | |
| HEPES | Invitrogen | 15630-080 | |
| L - الجلوتامين | Invitrogen | 25030 | |
| الانسولين ترانسفيرين - زيلونيت الصوديوم (ITS) | سيغما الدريخ | I1884 | |
| FBS | Invitrogen | 10437 | |
| البنسلين الستربتوميسين | Invitrogen | 15140 |
References
- Knofler, M. Critical growth factors and signalling pathways controlling human trophoblast invasion. Int. J. Dev. Biol. 54, 269-269 (2010).
- Cartwright, J. E. Remodelling at the maternal-fetal interface: relevance to human pregnancy disorders. Reproduction. 140, 803-803 (2010).
- Harris, L. K. IFPA Gabor Than Award lecture: Transformation of the spiral arteries in human pregnancy: key events in the remodelling timeline. Placenta. 32, S154-S154 (2011).
- Whitley, G. S., Cartwright, J. E. Trophoblast-mediated spiral artery remodelling: a role for apoptosis. J. Anat. 215, 21-21 (2009).
- Apps, R. Genome-wide expression profile of first trimester villous and extravillous human trophoblast cells. Placenta. 32, 33-33 (2011).
- Bilban, M. Trophoblast invasion: assessment of cellular models using gene expression signatures. Placenta. 31, 989-989 (2010).
- LaMarca, H. L. Three-dimensional growth of extravillous cytotrophoblasts promotes differentiation and invasion. Placenta. 26, 709-709 (2005).
- Jovanovic, M., Stefanoska, I., Radojcic, L., Vicovac, L. Interleukin-8 (CXCL8) stimulates trophoblast cell migration and invasion by increasing levels of matrix metalloproteinase (MMP)2 and MMP9 and integrins alpha5 and beta1. Reproduction. 139, 789-789 (2010).
- Husslein, H. Expression, regulation and functional characterization of matrix metalloproteinase-3 of human trophoblast. Placenta. 30, 284-284 (2009).
- Barrila, J. Organotypic 3D cell culture models: using the rotating wall vessel to study host-pathogen interactions. Nat. Rev. Microbiol. 8, 791-791 (2010).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. Am. J. Physiol. Renal. Physiol. 281, 12-12 (2001).
- Unsworth, B. R., Lelkes, P. I. Growing tissues in microgravity. Nat. Med. 4, 901-901 (1998).
- Schmeichel, K. L., Bissell, M. J. Modeling tissue-specific signaling and organ function in three dimensions. J. Cell. Sci. 116, 2377-2377 (2003).
- Bentrup, H. ?. ?. n. e. r. z. u., K, . Three-dimensional organotypic models of human colonic epithelium to study the early stages of enteric salmonellosis. Microbes. Infect. 8, 1813-1813 (2006).
- Carterson, A. J. A549 lung epithelial cells grown as three-dimensional aggregates: alternative tissue culture model for Pseudomonas aeruginosa pathogenesis. Infect. Immun. 73, 1129-1129 (2005).
- Myers, T. A. Closing the phenotypic gap between transformed neuronal cell lines in culture and untransformed neurons. J. Neurosci. Methods. 174, 31-31 (2008).
- Hjelm, B. E. Development and characterization of a three-dimensional organotypic human vaginal epithelial cell model. Biol. Reprod. 82, 617-617 (2010).
- Straub, T. M. In vitro cell culture infectivity assay for human noroviruses. Emerg. Infect. Dis. 13, 396-396 (2007).
- Nickerson, C. A. Three-dimensional tissue assemblies: novel models for the study of Salmonella enterica serovar Typhimurium pathogenesis. Infect. Immun. 69, 7106-7106 (2001).
- Carvalho, H. M., Teel, L. D., Goping, G., O'Brien, A. D. A three-dimensional tissue culture model for the study of attach and efface lesion formation by enteropathogenic and enterohaemorrhagic Escherichia coli. Cell. Microbiol. 7, 1771-1771 (2005).
- Sainz, B., TenCate, V., Uprichard, S. L. Three-dimensional Huh7 cell culture system for the study of Hepatitis C virus infection. Virol. J. 6, 103-103 (2009).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- GE Healthcare. Microcarrier Cell Culture - Principles and Methods. Handbooks. , (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved