需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
旋转的人类细胞培养的细胞培养系统:作为一种模式的滋养细胞
* 这些作者具有相同的贡献
摘要
传统的,二维细胞培养技术,往往导致与分化标志物,细胞因子和生长因子的改变的特点。旋转细胞培养系统的三维细胞培养(农村信用社)重新建立许多因素的表达,绒毛外滋养细胞系。
摘要
人类滋养细胞研究领域的艾滋病在认识复杂的环境中建立在胎盘。由于这些研究的性质, 人体内实验是不可能的。一个小学文化,外植体培养和滋养层细胞系的组合,支持我们的绒毛外滋养细胞(EVTs),这是怀孕的成功建立所必需的入侵的子宫壁和子宫螺旋动脉重塑3,4的理解。尽管从这种模型中收集的知识财富,它是接受,使用类似的EVT -细胞株在体外细胞培养模型显示改变细胞特性相比,其在体内的同行5,6时。培养细胞在旋转细胞培养系统(农村信用社)显示的EVT样细胞株的形态,表型和功能特性,更加紧密地模仿u的区别人Tero EVTs,调解入侵(如基质金属蛋白酶(MMPs))和滋养层细胞分化7,8,9的基因表达增加。圣乔治医院的胎盘细胞株- 4(SGHPL 4)(请盖伊惠特利博士和博士朱迪思卡特赖特捐赠)是一个EVT样细胞系,用于在农村信用社的测试。
农村信用社培养容器的设计是基于对器官和组织的原则,即在一个三维(3 - D)环境功能。由于在船只动态的文化条件,包括有关生理剪切条件,细胞生长在三个方面形成聚集基于自然细胞亲和力和分化成器官组织的集会10,11,12。维护流体轨道提供了一个低剪切,低动荡的环境相似,在体内发现的条件。培养细胞沉淀是通过调整旋转反驳加快农村信用社,以确保细胞恒定的自由落体。气体交换发生通过透水疏水膜生物反应器的背面。像他们的父母在体内的组织,能够应对在三个层面(即在其顶端,基底和横向表面),因为他们培养的多孔微载体珠表面上化学和分子梯度力场的细胞生长。像塑料防渗表面的二维膜生长时,细胞被剥夺了这一重要的沟通,在其基底表面。因此,空间限制的环境所施加深刻影响细胞如何从周围的微环境意识和解码信号, 从而暗示13的3 - D环境的重要作用。
我们已经使用了农村信用社工程师7,14,15,16各种人类上皮组织的生物学意义的3 - D模型。事实上,许多以前的报告中有DEMonstrated农村信用社培养细胞可以承担有关生理尚未10,17-21其他机型可能表型。总之,在农村信用社的文化代表了一种简单,重现性好,高通量平台,提供大量分化的细胞,适合各种实验操作。在下面的协议,作为一个例子使用EVTs,我们清楚地说明需要三个维度文化的贴壁细胞在农村信用社的步骤。
研究方案
1。胶原珠的制备
- 在此之前的3 - D细胞培养加载EVTs,需要准备的Cytodex - 3微载体珠:
- 称取适量的实验所需的Cytodex - 3珠。该协议是适应农村信用社的10毫升船只,其中珠0.05克需要。对于一个50毫升农村信用社的船只,相应的规模。在一个50毫升的高压灭菌的锥形管,混合磷酸12mL贝科250毫克Cytodex - 3珠缓冲液(DPBS)。这一数额是足够5个农村信用社的船只。
- 确保有足够的量是锥形管中,反应釜过程将导致蒸发。松散帽管和高压灭菌10分钟,在110 ° C。
- 拆下的反应釜周期完成锥管和冷却Cytodex - 3珠的解决方案。
- 锥形管冷却至室温后,使用无菌技术,使总体积为12.5mL 1X的DP学士学位。
- 第储存在室温下准备Cytodex - 3珠。允许准备珠膨胀和冷却到室温,使用前。 Cytodex - 3珠子上面的准备,将提供五个10毫升农村信用社的船只。我们观察Cytodex - 3珠在室温下长期储存会导致性能的降低,胶原蛋白会破坏后约一个月。 Cytodex - 3珠的尺寸范围从133-215微米。
2。媒体准备
优化GTSF - 2媒体(改编来自22个 ),其中40%的MEM ALPHA组成,加上补充和60%的L - 15 Leibovitz的媒体(改编22日 )农村信用社准备1L。首先,准备在纪念阿尔法辅以总量400ML:
21.2mM碳酸氢钠
0.06%,蛋白胨
0.7mm的果糖
1.4mm的半乳糖
5.6mM葡萄糖
1%的HEPES
1%L -谷氨酰胺
0.5%
10%F学士- 为了准备其原液 ,溶于5毫升无菌酸化H 2冰醋酸(约0.05mL),除了准备Ø 。旋流解散,请用45mL无菌水。
- 称取中等600毫升足够的L - 15 Leibovitz的粉末溶解在组织文化品位H 2 O
- 使细胞培养液中的L - 15 Leibovitz的培养基总体积至1L。过滤,消毒,并保存于4 ° C黑暗环境中。添加1%青霉素,链霉素单独使用每个中等等分。
- GTSF - 2媒体以外的许多媒体配方已成功地在农村信用社进行测试。个别实验室必须自己决定,正在执行的试验介质是最佳。
3。细胞和珠孵化
- 传播EVTs〜80%汇合,trypsinize和计数用公认的细胞培养方法。
- 暂停在温暖的4ML 1 × 10 6 EVTs版媒体。
- 轻轻混合编写的Cytodex - 3珠。使用无菌技术,消除了使用广泛的一角,10ml血清移液管中,并转移到一个未使用的15ML的锥形管的准备珠2.5毫升。请注意,有可能是一个小的损失珠由于它们附着于移液器。
- 允许Cytodex - 3珠,收于管底。经过沉淀,使用移液器删除,而不会干扰Cytodex - 3珠的DPBS的顶层。
- 混合准备Cytodex - 3珠准备EVTs媒体1 × 10 6。
- 细胞珠的混合物在室温下孵育30分钟。定期轻轻混匀。为进一步孵育30分钟,在37 ° C和5%CO 2 。定期轻轻混匀。
4。载入的RWV
- 在层流柜,从包装中取出一个10ML农村信用社和地方稳定在无菌6孔培养板。请参考图1为标记的RC图政务司司长。
- 删除从港口大塞。
- 把孵化细胞珠的混合物总量与温暖媒体10ML。
- 通过大港口,装载到农村信用社的细胞/珠混合物。农村信用社应倾斜45 °角(大港口最多)加载时,以帮助消除潜在的气泡。防止填充船只缓慢而稳定地积聚的正压力。
- 更换大型港口塞。
- 取出3毫升注射器的活塞,并将其放置到小港口的空注射器。添加到每个注射器媒体1 - 3ml的。慢慢打开两个阀门。更换注射器轻轻注射器活塞。添加从一个注射器,直到所有的气泡从内室中删除的媒体。
- 拿起农村信用社,并同时旋转它在你的面前检查气泡,轻轻敲击一边。如果有任何气泡,你必须让他们的商会,气泡会干扰形成ØF细胞聚集和引进的剪切力。旋转的农村信用社,直到气泡下的小口,取出泡沫。然后轻轻地往下推对面注射器,强行进入的端口和出室气泡。
- 关闭一个侧面端口。其他注射器活塞轻轻推下来的船只,防止形成气泡引入少量的正压。关闭第二个阀门。
- 转子装到农村信用社。在37℃CO 2培养箱,在19rpm开始旋转。
5。更改媒体
- 更改媒体隔日的前三天,然后以后每天。
- 关闭转子和消除农村信用社。拉活塞,创造出一些吸,去除注射器从每个小口,放在农村信用社的角度,使珠解决大型港口对面。
- 珠后一切都解决了,打开一个小阀门允许媒体流农村信用社,并成为一个废物容器。在这种方式中删除媒体的2 / 3。可以肯定的,不打扰珠,不放弃任何聚合。
- 关闭小阀门,并打开大港口。加回农村信用社通过大型港口的媒体。更换大型港口塞。
- 重复步骤4.6 - 4.9。
- 由于总量增加的大小,你需要增加转速,保持他们在任何时候都处于悬浮状态,在一个小的循环模式的理想在最佳的速度。一般来说,每次喂奶后增加0.3-0.7 RPM之间的速度,一旦聚合开始日益明显。
6。收集传播细胞
- 农村信用社从转子取出。从每个小口取出注射器和地方对农村信用社的角度,使珠子可能定居的大型港口对面。
- 珠后一切都解决了,打开一个小阀门,并允许媒体都流出来了农村信用社和成一个废物容器。在这种方式中删除媒体的1 / 3。
- 关闭小阀门,并打开大港口。轻轻摇动船只驱散聚集成溶液。空的液体混合物进入无菌50ml的锥形管。允许收集聚集在锥形管,使用前上清彻底清洗的培养容器,最大限度地聚集恢复解决。聚合,可立即用于下游分析,如流式细胞仪检测,入侵检测,免疫和其他。
7。代表性的成果
生长在Cytodex - 3珠农村信用社的EVT样细胞(SGHPL - 4滋养细胞系)的一个例子是如图2所示。 EVT -样细胞株显示预测远离主要集群扩展和附加到邻近的集群。许多珠子完全覆盖与传播细胞。一旦从农村信用社和解放军泰德外基质,EVT般的3 - D细胞生长大举入侵和/或迁移(图3)。 RT - PCR检测数据证实了在3 - D聚集,而不是传统的细胞培养单层(图4),基质金属蛋白酶的表达增加。有趣的是,不与入侵相关的基因也上调农村信用社(见表 1),并可能在划定侵略滋养细胞免疫的相互作用等方面的援助。
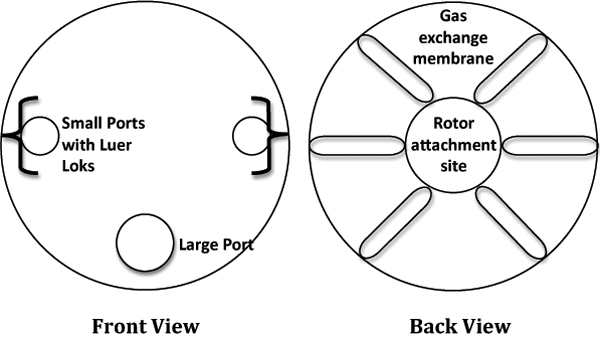
图1。卡通描绘的旋转细胞培养系统(农村信用社)。

图2。期后5天在农村信用社的增长代表总的对比显微照片。箭头指示侵入细胞和*表示Cytodex - 3微载体珠。
图3。农村信用社生长聚合,嵌入在纤维蛋白凝胶。通过纤维蛋白凝胶的入侵(一)24小时后的纤维蛋白嵌入的早期观察,(二)继续通过48小时。箭头指示侵入细胞和*表示Cytodex - 3微载体珠(改编许可,从编号7)。

图4明胶酶谱的比较单层和农村信用社。传播SGHPL - 4的EVT样细胞。亲和活性形式的MMP - 2和MMP - 9分泌的农村信用社生长的滋养细胞(改编许可编号7)。

表1。SGHPL - 4细胞生长在农村信用社(改编许可编号7)芯片结果的摘要。
- 折叠诱导的3 - D总量计算如下:正常化的3 - D基因值/归monlayer基因值。
- 表示低于检测限制在单层的基因。
讨论
这里介绍的文化技术提供具有高度侵袭性的EVT样细胞的调查。如今,它已被公认,由于抑制细胞反应,化学和分子线索的三个层面(心尖,基底和横向细胞表面 )10,13在单层发生分化的损失。这种技术反映在子宫内指出入侵的EVT细胞的特点。由于程序模仿传统的单层组织培养的时间动力学,但提供了差异表达的细胞,比较分析可能被雇用。在实验中使用的细胞团可收获,在任?...
披露声明
我们什么都没有透露。
致谢
这项工作是由美国国立卫生授予NIH / NICHD的HD051998(CAM)的机构的支持。
材料
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | 评论 |
| Cytodex微载体珠 | Sigma - Aldrich公司 | C3275 | |
| 旋转细胞培养系统(农村信用社) | Synthecon | 农村信用社- D | 包括转子基地,电源供应器,4个单位一次性农村信用社 |
| 农村信用社一次性单位 | Synthecon | 联系Synthecon | |
| 3毫升鲁尔锁提示注射器 | 屋宇署 | 309585 | |
| 10毫升宽提示血清移液器 | 屋宇署 | 357504 | |
| 纪念阿尔法 | Invitrogen公司 | 12561-072 | |
| Leibovitz的L - 15的介质,粉末 | Invitrogen公司 | 41300-039 | |
| H 2 O,内毒素 | 费舍尔 | MT - 25 - 055 - CM | |
| 碳酸氢钠 | Sigma - Aldrich公司 | S - 7795 | |
| 蛋白胨 | Fisher Scientific则 | BP1420 - 100 | |
| 果糖 | Sigma - Aldrich公司 | F3510 - 100 | |
| 半乳糖 | Sigma - Aldrich公司 | G5388 - 100 | |
| 血糖 | Sigma - Aldrich公司 | G7528 - 250 | |
| HEPES | Invitrogen公司 | 15630-080 | |
| L -谷氨酰胺 | Invitrogen公司 | 25030 | |
| 胰岛素转亚硒酸钠(ITS)的 | Sigma - Aldrich公司 | I1884 | |
| 胎牛血清 | Invitrogen公司 | 10437 | |
| 青霉素链霉素 | Invitrogen公司 | 15140 |
参考文献
- Knofler, M. Critical growth factors and signalling pathways controlling human trophoblast invasion. Int. J. Dev. Biol. 54, 269-269 (2010).
- Cartwright, J. E. Remodelling at the maternal-fetal interface: relevance to human pregnancy disorders. Reproduction. 140, 803-803 (2010).
- Harris, L. K. IFPA Gabor Than Award lecture: Transformation of the spiral arteries in human pregnancy: key events in the remodelling timeline. Placenta. 32, S154-S154 (2011).
- Whitley, G. S., Cartwright, J. E. Trophoblast-mediated spiral artery remodelling: a role for apoptosis. J. Anat. 215, 21-21 (2009).
- Apps, R. Genome-wide expression profile of first trimester villous and extravillous human trophoblast cells. Placenta. 32, 33-33 (2011).
- Bilban, M. Trophoblast invasion: assessment of cellular models using gene expression signatures. Placenta. 31, 989-989 (2010).
- LaMarca, H. L. Three-dimensional growth of extravillous cytotrophoblasts promotes differentiation and invasion. Placenta. 26, 709-709 (2005).
- Jovanovic, M., Stefanoska, I., Radojcic, L., Vicovac, L. Interleukin-8 (CXCL8) stimulates trophoblast cell migration and invasion by increasing levels of matrix metalloproteinase (MMP)2 and MMP9 and integrins alpha5 and beta1. Reproduction. 139, 789-789 (2010).
- Husslein, H. Expression, regulation and functional characterization of matrix metalloproteinase-3 of human trophoblast. Placenta. 30, 284-284 (2009).
- Barrila, J. Organotypic 3D cell culture models: using the rotating wall vessel to study host-pathogen interactions. Nat. Rev. Microbiol. 8, 791-791 (2010).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. Am. J. Physiol. Renal. Physiol. 281, 12-12 (2001).
- Unsworth, B. R., Lelkes, P. I. Growing tissues in microgravity. Nat. Med. 4, 901-901 (1998).
- Schmeichel, K. L., Bissell, M. J. Modeling tissue-specific signaling and organ function in three dimensions. J. Cell. Sci. 116, 2377-2377 (2003).
- Bentrup, H. ?. ?. n. e. r. z. u., K, . Three-dimensional organotypic models of human colonic epithelium to study the early stages of enteric salmonellosis. Microbes. Infect. 8, 1813-1813 (2006).
- Carterson, A. J. A549 lung epithelial cells grown as three-dimensional aggregates: alternative tissue culture model for Pseudomonas aeruginosa pathogenesis. Infect. Immun. 73, 1129-1129 (2005).
- Myers, T. A. Closing the phenotypic gap between transformed neuronal cell lines in culture and untransformed neurons. J. Neurosci. Methods. 174, 31-31 (2008).
- Hjelm, B. E. Development and characterization of a three-dimensional organotypic human vaginal epithelial cell model. Biol. Reprod. 82, 617-617 (2010).
- Straub, T. M. In vitro cell culture infectivity assay for human noroviruses. Emerg. Infect. Dis. 13, 396-396 (2007).
- Nickerson, C. A. Three-dimensional tissue assemblies: novel models for the study of Salmonella enterica serovar Typhimurium pathogenesis. Infect. Immun. 69, 7106-7106 (2001).
- Carvalho, H. M., Teel, L. D., Goping, G., O'Brien, A. D. A three-dimensional tissue culture model for the study of attach and efface lesion formation by enteropathogenic and enterohaemorrhagic Escherichia coli. Cell. Microbiol. 7, 1771-1771 (2005).
- Sainz, B., TenCate, V., Uprichard, S. L. Three-dimensional Huh7 cell culture system for the study of Hepatitis C virus infection. Virol. J. 6, 103-103 (2009).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- GE Healthcare. Microcarrier Cell Culture - Principles and Methods. Handbooks. , (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。