Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İnsan Hücre Kültürü Döner Hücre Kültür Sistemleri: Bir Model Olarak İnsan trofoblast Hücreleri
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Geleneksel iki boyutlu hücre kültür teknikleri genellikle farklılaşma belirteçleri, sitokinler ve büyüme faktörleri açısından değişmiş özellikleri. Extravillous trofoblast hücre hattı ile burada gösterildiği gibi dönen hücre kültür sistemi Üç boyutlu hücre kültürü (RCC), bu faktörlerin çoğunun ifade yeniden kurar.
Özet
Insan trofoblast araştırma alanında plasenta sırasında kurulan karmaşık bir ortamda anlama yardımcı olur. Bu çalışmalar doğası gereği, in vivo deney insan mümkün değildir. Primer kültürlerinde, eksplant kültürler ve trofoblast hücre hatları 1 bir arada rahim duvarına 2 işgali ve gebelik başarılı bir şekilde kurulması için gerekli olan extravillous trofoblast hücreleri (EVTs), rahim spiral arterler 3,4 remodeling anlayışımızı desteklemektedir. Bu modellerin toplanan bilginin zenginlik rağmen, in vivo meslektaşları 5,6 ile kıyaslandığında EVT gibi hücre hatları kullanılarak in vitro hücre kültür modelleri hücresel özellikleri değişmiş ekran kabul edilir. Dönen hücre kültür sistemi (RCC) kültür hücreler u daha yakından ayırt taklit EVT hücre hatları gibi, morfolojik, fenotipik ve fonksiyonel özellikleri görüntülerişgali (örneğin matriks metalloproteinazların (MMP)) ve trofoblast farklılaşma 7,8,9 aracılık genlerin artmış ekspresyonu ile Tero EVTs. Saint Georges Hastanesi Plasental hücre Line-4 (SGHPL 4) (nazik Dr Guy Whitley ve Dr. Judith Cartwright tarafından bağışlanan) RCC test etmek için kullanılan bir EVT gibi hücre hattı.
RCC kültür geminin tasarımı, organ ve dokuların üç boyutlu (3-D) bir ortamda işlev olduğu ilkesine dayanmaktadır. Fizyolojik ilgili kayma koşulları da dahil olmak üzere, üç boyutlu olarak yetişen gemi dinamik kültür koşulları, hücreler nedeniyle doğal hücresel yakınlık temelinde bir araya toplanırlar ve doku gibi meclisleri Organotipik 10,11,12 farklılaşırlar. In vivo koşullara benzer bir düşük kesme, düşük türbülans ortamında bir sıvı yörüngesinin bakım sağlar. Kültürlü hücrelerinin Sedimantasyon dönme ayarlayarak karşıhücrelerin sürekli bir serbest düşüş sağlamak için RCC hızı. Gaz değişimi biyoreaktör arkasında bulunan geçirgen bir hidrofobik zarından oluşur. Ebeveyn in vivo doku gibi, RCC yetiştirilen hücreler, gözenekli microcarrier boncuk yüzey kültüre, çünkü üç boyutlu (yani, apikal, bazal ve lateral yüzeylerde), kimyasal ve moleküler gradyanlar yanıt vermek mümkün. Plastik gibi geçirimsiz yüzeylerde iki boyutlu mono tabakaları gibi büyüdüğü zaman, hücreler bazal yüzeyindeki bu önemli iletişim yoksun. Sonuç olarak, çevreye dayattığı mekansal kısıtlamalar derinden, böylece 3-D ortam 13 için önemli bir rol ima hücreleri çevreleyen mikroçevresinin duygusu ve decode sinyalleri nasıl etkileyecek.
Biz, çeşitli insan epitel dokuların 7,14,15,16 biyolojik olarak anlamlı bir 3-D modellerin mühendisi RCC kullandık . Gerçekten de, çok daha önceki raporlarda demRCC kültür hücreleri diğer modelleri 10,17-21 mümkün olmayan fizyolojik ilgili fenotipleri varsayabiliriz hücre dizilerindeki ardışık. Özet olarak, RCC kültür farklılaşmış hücrelerin çeşitli deneysel manipülasyon için uygun olan çok sayıda sağlayan kolay, tekrarlanabilir, yüksek verimli bir platformu temsil eder. Aşağıdaki protokol, bir örnek olarak EVTs kullanarak, açıkça RCC üç boyutlu kültür yapışık hücreleri için gerekli adımları tanımlamak.
Protokol
1. Kollajen Boncuk Preparation
- 3-boyutlu hücre kültürü için yükleme EVTs önce, bir Cytodex-3 microcarrier boncuk hazırlamak gerekir:
- Deney için gerekli Cytodex-3 boncuk uygun miktarda tartılır. Bu protokol, boncuk 0.05g gerekli olan 10ml RCC gemi için uyarlanmıştır. 50ml RCC bir gemi için, buna göre ölçekli. 50ml otoklavlanabilir konik tüp 12ml Dulbecco'nun fosfat, 250 mg Cytodex-3 boncuklar bir arada çözüm (DPBS) tamponlu. Bu miktar 5 RCC gemiler için yeterli olacaktır.
- Otoklav süreci buharlaşma sonucu olarak yeterli hacmi, konik tüp içinde bulunur olun. Gevşek 110 tüp ve 10 dakika otoklav kapağı ° C
- Otoklav döngüsü bitiminde konik tüp çıkarın ve Cytodex-3 boncuk çözüm soğumasını bekleyin.
- Konik tüp oda sıcaklığına kadar soğuduktan sonra, 1X DP ile toplam hacmi 12.5mL getirmek için steril tekniği kullanmakBS.
- Cap ve oda sıcaklığında hazırlanan Cytodex-3 boncuk saklamak. Hazırlanan boncuklar kullanmadan önce oda sıcaklığına kadar şişer ve serinlemek için izin verin. Yukarıdaki hazırlık Cytodex-3 boncuk, beş 10ml RCC gemiler için sağlayacaktır. Biz yaklaşık bir ay sonra kollajen istikrarsızlaştırmak Cytodex-3 boncuk oda sıcaklığında uzun depolama, performans azalması neden olacağını gözlemledik. 133-215 mikron boyutunda Cytodex-3 boncuk aralığı.
2. Medya Hazırlık
Artı takviyeleri ve% 60 L-15 Leibovitz medya (22 uyarlanmıştır),% 40 MEM alfa-2 oluşur GTSF medya (22 uyarlanmıştır), optimize edilmiş RCC 1L hazırlayın. Birincisi, MEM alfa ile desteklenmiş toplam hacmi 400ml hazırlamak:
21.2mM sodyum bikarbonat
% 0,06 Peptonlu
0.7mm Fruktoz
1.4mm Galaktoz
5.6mM Glikoz
1% Hepes
% 1 L-glutamin
% 0.5 'DA
% 10 FBS- ITS bir stok solüsyonu hazırlamak için, buzul asetik asit ilavesi (yaklaşık 0.05mL) tarafından hazırlanan 5 ml'lik steril asitlendirilmiş H 2 O çözülür. Çözmek için Swirl 45mL steril su ile izleyin.
- Doku kültürü notu H 2 O çözme orta 600ml için yeterince L-15 Leibovitz tozu tartılır
- L-15 Leibovitz orta hücre kültür ortamı ile 1L toplam hacim kazandırın. Filtre sterilize ve 4 saklamak ° C karanlıkta. Kullanılan orta her kısım için ayrı ayrı% 1 Penisilin-Streptomisin ekleyin.
- GTSF-2 medya daha başka birçok medya formülasyonları RCC başarıyla test edilmiştir. Bireysel laboratuvarlarda deney yapıldığı için en uygun olan orta kendileri için karar vermelisiniz.
3. Hücreler ve Boncuk Kuluçka
- ~ 80% confluency EVTs yayma, trypsinize ve kabul edilen hücre kültürü uygulamaları kullanarak saymak.
- Ilık 4ml 1x10 6 EVTs Askıya Almaed medya.
- Hazırlanan Cytodex-3 boncuk hafifçe karıştırın. Steril teknikleri kullanarak, geniş bir ucu, 10 ml serolojik pipet ve kullanılmayan bir 15 mL konik tüp transfer kullanılarak hazırlanan boncuk 2.5ml çıkarın. Pipet eklemek gibi küçük bir boncuk kaybı olabileceğini unutmayın.
- Cytodex-3 boncuk tüp alt yerleşmek için izin verin. Sedimantasyon sonra Cytodex-3 boncuk bozmadan DPBS en üst tabakasını kaldırmak için bir pipet kullanın.
- Hazırlanan Cytodex-3 boncuk ile medya 1x10 6 hazırlanan EVTs karıştırın.
- Hücre-boncuk karışımı oda sıcaklığında 30 dakika inkübe edin. Periyodik yavaşça karıştırın. 37 ° C ve% 5 CO 2 'de bir 30 dakika daha inkübe. Periyodik yavaşça karıştırın.
4. RWV yükleme
- Laminer akış kabini, ambalaj, 10 ml RCC kaldırmak ve istikrarı için steril, 6 gözlü bir kültür plakasına yerleştirin. RC etiketli diyagram Şekil 1 bakınCS.
- Limandan büyük stoper çıkarın.
- Kuluçka hücre-boncuk karışımı toplam hacmi 10 ml ile ısındı medya getirin.
- Hücre / boncuk-karışımı büyük bir bağlantı noktası üzerinden RCC içine yükleyin. RCC az eğik olmalıdır 45 ° açılı (büyük port) olası hava kabarcıklarının alınması yardım yüklerken. Geminin yavaş yavaş ve sürekli doldurarak pozitif basınç oluşturmak önleyin.
- Büyük liman stoper değiştirin.
- 3 ml şırınga pistonları çıkarın ve küçük liman üzerine boş bir şırınga yerde. 1-3ml her şırınga medya ekleyin. Yavaş yavaş iki vanalarının açık. Yavaşça şırınga şırınga pistonları değiştirin. Tüm kabarcıklar iç odasının kaldırılana kadar bir şırınga medya ekleyin.
- RCC Pick up ve kabarcıkları kontrol etmek için önünüzde dönerken yan hafifçe dokunun. Hava kabarcıkları oluşumu o engel olacak şekilde, herhangi bir kabarcıkları varsa, oda onları almak gerekirf hücre agrega ve kesme kuvvetleri tanıtmak. RCC kabarcıkları küçük liman altında olana kadar döndürerek kabarcıklarını çıkarın. Sonra yavaşça liman ve odanın içine ya da dışına baloncuklar zorlamak için, karşı tarafında şırınga aşağı doğru itin.
- Bir tarafı bağlantı noktasını kapat. Şekillendirme kabarcıkları önler gemi, içine küçük bir miktar pozitif basınç tanıtmak için diğer şırınga pistonu yavaşça aşağı doğru itin. İkinci vanasını kapatın.
- RCC rotor üzerine yerleştirin. 37 ° C CO 2 inkübatör 19rpm dönme başlayın.
5. Medya değiştirme
- Sonra her gün daha sonra, ilk üç gün boyunca her gün bir ortam.
- Rotor kapatın ve RCC kaldırmak. Pistonlar, bazı emme oluşturmak, her bir küçük liman şırınga kaldırmak ve boncuklar, büyük bir liman tersi yerleşmek böylece bir açı RCC yere kadar çekin.
- Boncuk yapıldıktan sonra, küçük vanaların birini açmak veRCC medya ve bir atık kabı içine akmasına izin verin. Bu şekilde 2 / 3 'medya çıkarın. Boncuk rahatsız değil ve herhangi bir agrega atmayın emin olun.
- Küçük bir kapak kapatın ve büyük bir liman açmak. Medyanın büyük bir bağlantı noktası üzerinden RCC içine ekleyin. Büyük liman stoper değiştirin.
- 4.9 - 4.6 adımları tekrarlayın.
- Agrega boyutu arttıkça, dönme hızını artırmak için en uygun hızda küçük bir dolaşım deseni, ideal olarak, her zaman süspansiyon onları tutmak için gerekir. Genel olarak, agrega, gözle görülür bir şekilde büyüyen başladıktan sonra her emzirmeden sonra 0,3-0,7 rpm arasında hız artışı.
6. Toplama Hücreler yayılma
- Rotor RCC çıkarın. Her bir küçük liman şırınga çıkarın ve RCC, boncuklar, büyük bir liman ters yerleşmek böylece bir açıyla yerleştirin.
- Boncuk yapıldıktan sonra, küçük vanaların açık ve medya dışarı akmasına izinRCC ve bir atık kabı içine. Bu şekilde 1 / 3 medya çıkarın.
- Küçük bir kapak kapatın ve büyük bir liman açmak. Yavaşça girdap gemi çözüm içine agrega dağıtmak için. Boş steril bir 50ml konik tüp içine sıvı karışımı. Toplanan büyüklükler agrega kurtarma en üst düzeye çıkarmak için kültür damarı iyice yıkamak için supernatant kullanmadan önce konik tüp yerleşmek için izin verin. Büyüklükler, akış sitometri, istila testleri, immunofloresan ve diğerleri gibi hemen aşağı deneyleri için kullanılan olabilir.
7. Temsilcisi Sonuçlar
RCC Cytodex-3 boncuk üzerinde yetiştirilen EVT benzeri hücreler (trofoblast hücre hattı SGHPL-4) bir örneği Şekil 2'de gösterilmiştir. EVT hücre hattı gibi ana küme uzak uzanan ve komşu kümeler takılarak projeksiyonları görüntüler. Birçok boncuk tamamen propaganda hücreleri ile kaplıdır. Bir kez RCC ve pla kaldırıldıted bir ekstrasellüler matriks, EVT gibi 3-D yetiştirilen hücreler, agresif ve / veya göç (Şekil 3) işgal . RT-PCR veriler geleneksel hücre kültürü mono tabakaları (Şekil 4) karşı 3-D agrega görülen MMP'lerin artmış ekspresyonu onaylar. İlginçtir ki, işgali ile ilişkili olmayan genlerin de RCC upregüle (Tablo 1) ve işgalci trofoblast hücreleri ile bağışıklık etkileşimler gibi alanlarda tasvir yardımcı olabilir.
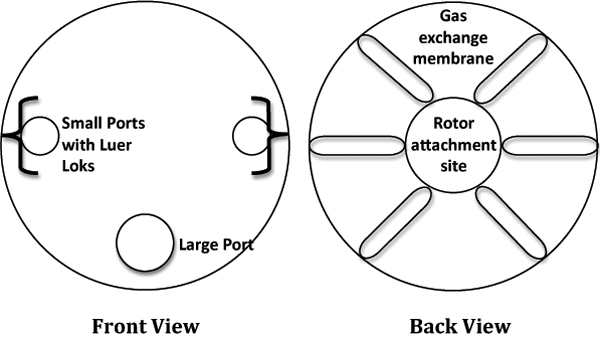
Şekil 1. Döner Hücre Kültürü Sistemi (RCC) Karikatür tasviri.

Şekil 2, 5 gün büyüme bir RCC sonra bir temsilci toplam faz kontrast mikrografı . Oklar işgalci hücreleri gösterir ve * Cytodex-3 microcarrier boncuk gösterir.

Şekil 3 RCC Yetiştirilen agrega fibrin jel gömüldü. Fibrin jel ile Invasion, (A) 24 saat sonrası fibrin gömme gibi erken olarak görülen ve (B) 48 saat boyunca devam edildi. Oklar işgalci hücreleri gösterir * Cytodex-3 microcarrier boncuk (Ref izni ile uyarlanmıştır. 7) ifade eder.

Şekil 4, tek tabaka ve RCC Karşılaştırmalı jelatin zymogram SGHPL-4 EVT-benzeri hücreler yayılır . Pro-MMP-2 ve MMP-9 ve aktif formları RCC yetiştirilen trofoblast hücreleri (Ref 7 izni ile uyarlanmıştır) tarafından salgılanan.

Tablo 1 bir RCC yetiştirilen SGHPL-4 hücreleri (Ref 7 izni ile uyarlanmıştır) mikroarray sonuçları özeti.
- 3-D agrega Katlama indüksiyon aşağıdaki gibi hesaplanır.
- Mono tabakaları algılama sınırının altında genler gösterir.
Tartışmalar
Burada sunulan kültür tekniği son derece invaziv EVT-benzeri hücreler ile araştırmacılar sağlar. Şimdi farklılaşma kaybı hücresel yanıtları, üç boyutlu (apikal, bazal ve lateral hücre yüzeylerinde) 10,13 kimyasal ve moleküler ipuçları inhibisyonu nedeniyle mono tabakaları oluşur kabul edilmiştir . Bu teknik EVT hücreleri istila in utero not özelliklerini yansıtır. Prosedür geleneksel tek tabakalı doku kültürü zaman kinetiği taklit eder, ancak diferansiyel ifadesi il...
Açıklamalar
Biz ifşa etmek başka bir şey var.
Teşekkürler
Bu çalışma, ABD Ulusal Sağlık hibe NIH / NICHD # HD051998 (CAM) Enstitüleri tarafından da desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifi Adı | Şirket | Katalog numarası | Yorumlar |
| Cytodex microcarrier boncuklar | Sigma-Aldrich | C3275 | |
| Döner Hücre Kültürü Sistemi (RCC) | Synthecon | RCC-D | Rotor tabanı, güç kaynağı, 4 tek RCC birimleri içerir |
| RCC Disposable Üniteleri | Synthecon | İletişim Synthecon | |
| 3ml Luer-Lock ucu şırınga | BD | 309585 | |
| 10ml geniş ucu serolojik pipet | BD | 357504 | |
| MEM Alpha | Invitrogen | 12561-072 | |
| Leibovitz L-15 orta, toz | Invitrogen | 41300-039 | |
| H 2 O, Endotoksin ücretsiz | Balıkçı | MT-25-055-CM | |
| Sodyum bikarbonat | Sigma-Aldrich | S-7795 | |
| Pepton | Fisher Scientific | BP1420-100 | |
| Fruktoz | Sigma-Aldrich | F3510-100 | |
| Galaktoz | Sigma-Aldrich | G5388-100 | |
| Glikoz | Sigma-Aldrich | G7528-250 | |
| Hepes | Invitrogen | 15630-080 | |
| L-Glutamine | Invitrogen | 25030 | |
| İnsülin-Transferrin-sodyum selenit (ITS) | Sigma-Aldrich | I1884 | |
| FBS | Invitrogen | 10437 | |
| Penisilin-Streptomisin | Invitrogen | 15140 |
Referanslar
- Knofler, M. Critical growth factors and signalling pathways controlling human trophoblast invasion. Int. J. Dev. Biol. 54, 269-269 (2010).
- Cartwright, J. E. Remodelling at the maternal-fetal interface: relevance to human pregnancy disorders. Reproduction. 140, 803-803 (2010).
- Harris, L. K. IFPA Gabor Than Award lecture: Transformation of the spiral arteries in human pregnancy: key events in the remodelling timeline. Placenta. 32, S154-S154 (2011).
- Whitley, G. S., Cartwright, J. E. Trophoblast-mediated spiral artery remodelling: a role for apoptosis. J. Anat. 215, 21-21 (2009).
- Apps, R. Genome-wide expression profile of first trimester villous and extravillous human trophoblast cells. Placenta. 32, 33-33 (2011).
- Bilban, M. Trophoblast invasion: assessment of cellular models using gene expression signatures. Placenta. 31, 989-989 (2010).
- LaMarca, H. L. Three-dimensional growth of extravillous cytotrophoblasts promotes differentiation and invasion. Placenta. 26, 709-709 (2005).
- Jovanovic, M., Stefanoska, I., Radojcic, L., Vicovac, L. Interleukin-8 (CXCL8) stimulates trophoblast cell migration and invasion by increasing levels of matrix metalloproteinase (MMP)2 and MMP9 and integrins alpha5 and beta1. Reproduction. 139, 789-789 (2010).
- Husslein, H. Expression, regulation and functional characterization of matrix metalloproteinase-3 of human trophoblast. Placenta. 30, 284-284 (2009).
- Barrila, J. Organotypic 3D cell culture models: using the rotating wall vessel to study host-pathogen interactions. Nat. Rev. Microbiol. 8, 791-791 (2010).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. Am. J. Physiol. Renal. Physiol. 281, 12-12 (2001).
- Unsworth, B. R., Lelkes, P. I. Growing tissues in microgravity. Nat. Med. 4, 901-901 (1998).
- Schmeichel, K. L., Bissell, M. J. Modeling tissue-specific signaling and organ function in three dimensions. J. Cell. Sci. 116, 2377-2377 (2003).
- Bentrup, H. ?. ?. n. e. r. z. u., K, . Three-dimensional organotypic models of human colonic epithelium to study the early stages of enteric salmonellosis. Microbes. Infect. 8, 1813-1813 (2006).
- Carterson, A. J. A549 lung epithelial cells grown as three-dimensional aggregates: alternative tissue culture model for Pseudomonas aeruginosa pathogenesis. Infect. Immun. 73, 1129-1129 (2005).
- Myers, T. A. Closing the phenotypic gap between transformed neuronal cell lines in culture and untransformed neurons. J. Neurosci. Methods. 174, 31-31 (2008).
- Hjelm, B. E. Development and characterization of a three-dimensional organotypic human vaginal epithelial cell model. Biol. Reprod. 82, 617-617 (2010).
- Straub, T. M. In vitro cell culture infectivity assay for human noroviruses. Emerg. Infect. Dis. 13, 396-396 (2007).
- Nickerson, C. A. Three-dimensional tissue assemblies: novel models for the study of Salmonella enterica serovar Typhimurium pathogenesis. Infect. Immun. 69, 7106-7106 (2001).
- Carvalho, H. M., Teel, L. D., Goping, G., O'Brien, A. D. A three-dimensional tissue culture model for the study of attach and efface lesion formation by enteropathogenic and enterohaemorrhagic Escherichia coli. Cell. Microbiol. 7, 1771-1771 (2005).
- Sainz, B., TenCate, V., Uprichard, S. L. Three-dimensional Huh7 cell culture system for the study of Hepatitis C virus infection. Virol. J. 6, 103-103 (2009).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- GE Healthcare. Microcarrier Cell Culture - Principles and Methods. Handbooks. , (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır