このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト細胞培養のための回転細胞培養システム:モデルとしてのヒト栄養膜細胞
* これらの著者は同等に貢献しました
要約
伝統的な、二次元細胞培養技術は、しばしば、分化マーカー、サイトカインおよび増殖因子に関する変更特性になる。 extravillous栄養膜細胞株を以下に示すように回転する細胞培養系における三次元細胞培養(RCCS)は、これらの要因の多くの表現を再確立します。
要約
人間の栄養膜研究の分野では、胎盤形成の間に確立された複雑な環境を理解する上で役立ちます。これらの研究の性質上、in vivoの実験で 、人間は不可能です。初代培養、外植培養と栄養膜細胞株1の組み合わせは、子宮壁2の侵略と妊娠の成功確立のために必要とされるextravillous栄養膜細胞(EVTs)による子宮螺旋動脈3,4の改造の我々の理解をサポートしています。このようなモデルから収集した豊富な知識にもかかわらず、それは彼らのin vivoでの対応で 5,6と比較した場合、EVTのような細胞株を用いた in vitro細胞培養モデルにおいて細胞のプロパティを変更し表示することが受け入れられている。回転細胞培養システム(RCCS)で培養した細胞は、より密接にUで差別化を模倣することEVTのような細胞株の、形態学的表現型、および機能的特性を表示する侵略(例:マトリックスメタロプロテアーゼ(MMP))と栄養膜の分化7,8,9を仲介する遺伝子の発現増加とテロササナEVTs、。サンジョルジュ病院胎盤細胞ライン- 4(SGHPL - 4)(親切に先生ガイウィットリーと博士ジュディスカートライトによる寄贈)RCCSでテストするために使用されたEVT様細胞株です。
RCCSの培養容器のデザインは、臓器および組織の3次元(3 - D)の環境で機能するという原則に基づいている。生理学的に適切なせん断の条件を含む容器内の動的な培養条件、のために、三次元的に培養した細胞は、天然の細胞の親和性に基づいて、凝集体を形成し、アセンブリ10,11,12器官のような組織に分化する。流体の軌道の維持は、 生体内に存在する条件と同様の低せん断、低乱流の環境を提供します。培養細胞の沈降は、回転を調整することによって打ち消された細胞の一定の自由落下を確実にするためにRCCSの速度。ガス交換は、バイオリアクターの背面に透過性の疎水性膜を介して行われます。それらが多孔質マイクロキャリアビーズの表面上で培養されているため、 生体内での彼らの親の組織と同様に、RCCSに成長した細胞は三次元(それらの、頂端基底、および側面即ち)で化学と分子勾配に対応することができます。プラスチックのような不浸透性の表面上の2次元単層として増殖させた場合、細胞はその基底面では、この重要なコミュニケーションを奪われている。そのため、環境によって課された空間の制約が深くこうして3次元環境13の重要な役割を示唆し、周囲の微小環境からどのように細胞の感覚とデコード信号に影響を与えます。
我々は、7,14,15,16、様々な人間の上皮組織の生物学的に意味のある3 - Dモデルを設計するRCCSを使用している。実際、多くの過去の報告では、DEMデータを持っているRCCSで培養された細胞は、他のモデル10,17-21では実現されていない生理学的に関連する表現型を担うことができることonstrated。要約すると、RCCSの文化は、実験操作の様々な従順な分化した細胞を大量に提供する簡単に、再現性、高スループットのプラットフォームを表します。次のプロトコルでは、例としてEVTsを使用して、我々ははっきりとRCCSに3次元的に培養接着細胞に必要な手順を説明します。
プロトコル
1。コラーゲンビーズの調製
- 前の3次元細胞培養のためのロードEVTsに、一つはCytodex 3マイクロキャリアビーズを準備する必要があります。
- 実験に必要なCytodex - 3ビーズの適切な量を秤量。このプロトコルは、ビーズの0.05グラムが必要とされる、10ミリリットルRCCSの容器に適合されている。 50ミリリットルRCCSの容器の場合、スケールは調整する。 50mLのオートクレーブ可能な円錐管で、12mLダルベッコのリン酸との混合250mgのCytodex - 3ビーズが溶液(DPBS)をバッファ。この金額は、5 RCCS船で十分です。
- オートクレーブ処理が蒸発につながるように十分なボリュームが、円錐管に存在していることを確認します。大まかに110℃で10分間チューブ、オートクレーブを締めくくる℃に
- オートクレーブサイクルの完了時にコニカルチューブを外し、Cytodex - 3ビーズ溶液を冷却することができます。
- コニカルチューブは室温に冷却した後、1X DPを使用して12.5mLに総量をもたらすために無菌テクニックを使用してBS。
- キャップと室温で作製Cytodex - 3ビーズを格納する。準備ビーズが膨潤し、使用前に室温に冷却してください。 Cytodex - 3ビーズの上記製剤は、5つの10mLのRCCSの船のために提供します。我々は、コラーゲンが約1ヶ月後に不安定になるように室温でCytodex - 3ビーズの拡張ストレージは、パフォーマンスの低下につながることを観察した。 133から215μmからサイズのCytodex - 3ビーズの範囲。
2。メディアの準備
プラスサプリメント、60%L - 15リーボビッツのメディア(22から適応)、40%MEMアルファで構成されてGTSF - 2メディアを(22から適応)、最適化されたRCCSの1Lを準備します。最初に、補充したMEMアルファの合計量で400mlの準備:
21.2mM重炭酸ナトリウム
0.06%ペプトン
0.7mmのフルクトース
1.4mmのガラクトース
5.6mMグルコース
1%HEPES
1%L -グルタミン
0.5パーセントのITS
10%のFBS- ITSのストック溶液を準備するには、氷酢酸(約0.05mL)を添加することによって準備さ5mLの滅菌酸性化したH 2 Oに溶解する。解散する渦巻、45mL滅菌水で従ってください。
- 組織培養グレードH 2 Oに溶解して十分なL - 15培地の600ミリリットルのためのリーボビッツの粉体を秤量
- L - 15リーボビッツの培地を1Lに細胞培養液の合計量をもたらす。フィルター滅菌し、4℃で保存して暗所で。使用した培地の各アリコートに個別に1%ペニシリン - ストレプトマイシンを追加。
- GTSF - 2メディア以外の多くのメディアの配合に成功RCCSでテストされています。個々の研究室では実験が行われてのために最適である培地自分で決定する必要があります。
3。細胞とビーズインキュベーション
- 〜80%コンフルエントにEVTsを伝播、トリプシンおよび認められた細胞培養のプラクティスを使用して数える。
- 暖かいの4mlの中の1 × 10 6 EVTsを一時停止EDメディア。
- ゆっくりと準備Cytodex - 3ビーズをミックス。無菌テクニックを使用して、幅広い先端、10mLの血清ピペットおよび未使用の15mlのコニカルチューブへの転送を使用して、準備したビーズの2.5mLを削除します。彼らはピペットにアタッチするときにビーズの小さな損失があるかもしれないことに注意してください。
- Cytodex - 3ビーズをチューブの底に沈殿することができます。沈降した後、Cytodex - 3ビーズを乱すことなくDPBSの最上層を除去するピペッターを使用してください。
- 準備Cytodex - 3ビーズをメディアで1 × 10 6準備EVTsを混ぜる。
- 30分間室温で細胞ビーズ混合物をインキュベートする。定期的に穏やかに混合する。 37℃、5%CO 2でさらに30分間インキュベートする。定期的に穏やかに混合する。
4。 RWVのロード
- 層流キャビネットでは、パッケージから10mLのRCCSを削除し、安定性のための滅菌、6ウェル培養プレートに入れてください。 RCのラベルが付いた図については図1を参照してくださいCS。
- 港から大型ストッパーを外します。
- 温めたメディアと10mLのためにインキュベート細胞ビーズ混合物の合計量をもたらす。
- 大規模なポートを介してRCCSに細胞/ビーズ混合物をロードする。潜在的な気泡の除去を助けるためにロードするときRCCS(最大大きいポート)45 °の角度で傾斜させることが必要。ゆっくりと着実に容器を充填することにより、正圧のビルドアップを防ぐ。
- 大規模なポートでストッパーを交換してください。
- 3 mLシリンジからピストンを外し、小さな港に空の注射器を置きます。各シリンジへのメディアの1 - 3ML追加。ゆっくりと2つの弁を開く。静かにシリンジで注射器のピストンを交換してください。すべての気泡が内側のチャンバーから除去されるまで1シリンジからメディアを追加します。
- RCCSをピックアップし、気泡を確認するために、目の前でそれを回転させながらそっと側をタップします。 いずれかの気泡がある場合は空気の気泡が形成Oを妨害するため、お客様は、チャンバーからそれらを得る必要がありますfは、セルの集合体と剪断力を紹介。気泡が小さいポートの下になるまで、RCCSを回転させて気泡を取り除きます。その後そっとチャンバーのポートと外に泡を強制的に反対側に注射器を押し下げます。
- 片側のポートを閉じます。ゆっくりと形成される気泡を防ぐ容器、中に正圧の少量を導入する他の注射器のピストンを押し下げます。第二バルブを閉じます。
- ローターにRCCSをロードします。 37℃CO 2インキュベーターで19rpmで回転を開始します。
5。メディアを変更する
- 毎日その後も、最初の3日間は一日おきにメディアを変更します。
- ローターの電源を切り、RCCSを取り外します。 、いくつかの吸引を作成し、各小ポートからシリンジを削除し、ビーズが大きいポートの反対を解決するような角度でRCCSを配置するピストンを引き上げます。
- ビーズは、すべて決着した後に、小弁の1つを開き、メディアは、RCCの、廃棄物の容器に流出することができます。この方法でメディアの2 / 3を取り外します。ビーズを邪魔しないため、任意の集合体を破棄しないようにしてください。
- 小さなバルブを閉じて、大規模なポートを開きます。バック大きいポートを介してRCCSにメディアを追加します。大規模なポートでストッパーを交換してください。
- 4.9 - 手順4.6を繰り返します。
- 凝集体のサイズが大きくなるに従い、お客様は最適な速度で小さな循環パターンに理想的に、常時懸濁液中にそれらを保つために回転速度を増加する必要があります。凝集体が目に見えて成長し始めると、一般的に、それぞれの給餌後に0.3から0.7 rpmの間に速度が向上します。
6。伝播細胞を収集
- ローターからRCCSを削除します。それぞれの小さなポートからシリンジを取り外し、ビーズが大きいポートの反対側の沈殿ができるように角度でRCCSを置きます。
- ビーズは、すべて決着した後に、小弁の1つを開いて、メディアが流出することができますRCCSの、廃棄物の容器に。この方法でメディアの1 / 3を取り外します。
- 小さなバルブを閉じて、大規模なポートを開きます。優しくスワール容器をバックソリューションに集約して分散させる。滅菌50ミリリットルコニカルチューブに空の液体混合物。収集された凝集体は完全に凝集体の回復を最大化するために培養容器を洗浄するために上清を使用する前に、コニカルチューブに定住することができます。集計は、このようなフローサイトメトリー、浸潤アッセイ、免疫蛍光などとして、すぐにダウンストリームアッセイに用いることができる。
7。代表的な結果
Cytodex - 3ビーズでRCCSで育ったEVT様細胞(SGHPL - 4栄養膜細胞株)の例を図2に示されています。 EVTのような細胞株は、離れてメインクラスタから拡張し、近隣のクラスタに接続する突起が表示されます。ビーズの多くは、完全に伝播する細胞で覆われている。一度RCCSとPLAから削除Tedは、細胞外マトリックスに、EVT -のような3次元培養した細胞は積極的におよび/ または移動を(図3)に侵入。 RT - PCRのデータは、従来の細胞培養単層(図4)とは対照的に、3次元凝集体に見られるようにMMPの発現増加を確認する。興味深いことに、侵略に関連付けられていない遺伝子もRCCSにアップレギュレートされている(表1)とトロホブラストの細胞に侵入すると免疫の相互作用などの分野を線引きで助けることができる。
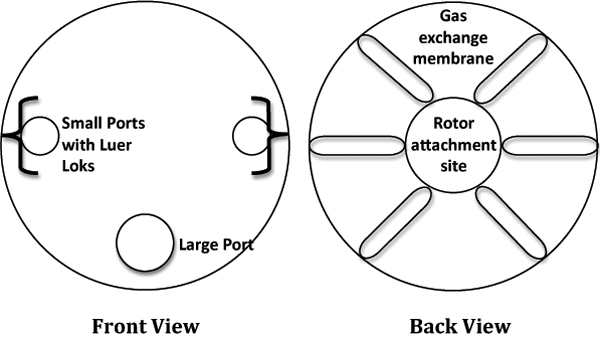
図1。回転細胞培養システム(RCCS)の漫画の描写。

図2。RCCSの5日間の成長後の代表的な集合体の位相コントラスト顕微鏡写真。矢印は浸潤細胞を示し、*はCytodex 3マイクロキャリアビーズを表します。

図3。RCCS成長凝集体は、フィブリンゲルに包埋した。フィブリンゲルを介して浸潤は(A)24時間後にフィブリンの埋め込みには早くも観察され、(B)48時間を通して継続した。矢印は浸潤細胞を示し、*はCytodex 3マイクロキャリアビーズを(参考文献から、許可を得て、脚色7)を表します。

図4単層とRCCSの比較ゼラチンザイモグラムはSGHPL - 4 EVT様細胞を伝播。 MMP - 2及びMMP - 9のプロと、アクティブなフォームは、RCCS栽培栄養膜細胞(文献[7]から、許可を得て、適応)によって分泌された。

表1。RCCSで育ったSGHPL - 4細胞(文献[7]から、許可を得て、適応)からマイクロアレイの結果のまとめ。
- 誘導倍率は、次のように計算された。
- 単分子膜における検出限界以下であったの遺伝子を示している。
ディスカッション
ここで紹介する培養技術は、高度に侵襲EVT様細胞との調査官が用意されています。それは今分化の損失が三次元(心尖部、基底、および横方向のセルの表面)10,13における化学と分子の手がかりに対する細胞応答の阻害に起因する単層で発生することが認識されている。この手法は、EVTの細胞を侵入に子宮内に記載されている特性を反映している。手順は、従来の単層組...
開示事項
我々は、開示することは何もない。
謝辞
この作品は、健康補助金NIH / NICHD#HD051998(CAMまで)の米国国立研究所によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント |
| Cytodexマイクロキャリアビーズ | シグマアルドリッチ | C3275 | |
| 回転細胞培養システム(RCCS) | Synthecon | RCCS - D | ローターベース、電源、4使い捨てRCCSユニットが含まれています |
| RCCS使い捨てユニット | Synthecon | お問い合わせSynthecon | |
| 3ミリリットルルアーロックチップシリンジ | BD | 309585 | |
| 10ミリリットルワイド先端血清用ピペット | BD | 357504 | |
| MEMアルファ | インビトロジェン | 12561-072 | |
| リーボビッツのL - 15培地、粉 | インビトロジェン | 41300-039 | |
| H 2 O、エンドトキシンフリー | フィッシャー | MT - 25 - 055 - CM | |
| 重炭酸ナトリウム | シグマアルドリッチ | S - 7795 | |
| ペプトン | フィッシャーサイエンティフィック | BP1420 - 100 | |
| 果糖 | シグマアルドリッチ | F3510 - 100 | |
| ガラクトース | シグマアルドリッチ | G5388 - 100 | |
| グルコース | シグマアルドリッチ | G7528 - 250 | |
| HEPES | インビトロジェン | 15630-080 | |
| L -グルタミン | インビトロジェン | 25030 | |
| インスリン - トランスフェリン - 亜セレン酸ナトリウム(ITS) | シグマアルドリッチ | I1884 | |
| FBS | インビトロジェン | 10437 | |
| ペニシリン - ストレプトマイシン | インビトロジェン | 15140 |
参考文献
- Knofler, M. Critical growth factors and signalling pathways controlling human trophoblast invasion. Int. J. Dev. Biol. 54, 269-269 (2010).
- Cartwright, J. E. Remodelling at the maternal-fetal interface: relevance to human pregnancy disorders. Reproduction. 140, 803-803 (2010).
- Harris, L. K. IFPA Gabor Than Award lecture: Transformation of the spiral arteries in human pregnancy: key events in the remodelling timeline. Placenta. 32, S154-S154 (2011).
- Whitley, G. S., Cartwright, J. E. Trophoblast-mediated spiral artery remodelling: a role for apoptosis. J. Anat. 215, 21-21 (2009).
- Apps, R. Genome-wide expression profile of first trimester villous and extravillous human trophoblast cells. Placenta. 32, 33-33 (2011).
- Bilban, M. Trophoblast invasion: assessment of cellular models using gene expression signatures. Placenta. 31, 989-989 (2010).
- LaMarca, H. L. Three-dimensional growth of extravillous cytotrophoblasts promotes differentiation and invasion. Placenta. 26, 709-709 (2005).
- Jovanovic, M., Stefanoska, I., Radojcic, L., Vicovac, L. Interleukin-8 (CXCL8) stimulates trophoblast cell migration and invasion by increasing levels of matrix metalloproteinase (MMP)2 and MMP9 and integrins alpha5 and beta1. Reproduction. 139, 789-789 (2010).
- Husslein, H. Expression, regulation and functional characterization of matrix metalloproteinase-3 of human trophoblast. Placenta. 30, 284-284 (2009).
- Barrila, J. Organotypic 3D cell culture models: using the rotating wall vessel to study host-pathogen interactions. Nat. Rev. Microbiol. 8, 791-791 (2010).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. Am. J. Physiol. Renal. Physiol. 281, 12-12 (2001).
- Unsworth, B. R., Lelkes, P. I. Growing tissues in microgravity. Nat. Med. 4, 901-901 (1998).
- Schmeichel, K. L., Bissell, M. J. Modeling tissue-specific signaling and organ function in three dimensions. J. Cell. Sci. 116, 2377-2377 (2003).
- Bentrup, H. ?. ?. n. e. r. z. u., K, . Three-dimensional organotypic models of human colonic epithelium to study the early stages of enteric salmonellosis. Microbes. Infect. 8, 1813-1813 (2006).
- Carterson, A. J. A549 lung epithelial cells grown as three-dimensional aggregates: alternative tissue culture model for Pseudomonas aeruginosa pathogenesis. Infect. Immun. 73, 1129-1129 (2005).
- Myers, T. A. Closing the phenotypic gap between transformed neuronal cell lines in culture and untransformed neurons. J. Neurosci. Methods. 174, 31-31 (2008).
- Hjelm, B. E. Development and characterization of a three-dimensional organotypic human vaginal epithelial cell model. Biol. Reprod. 82, 617-617 (2010).
- Straub, T. M. In vitro cell culture infectivity assay for human noroviruses. Emerg. Infect. Dis. 13, 396-396 (2007).
- Nickerson, C. A. Three-dimensional tissue assemblies: novel models for the study of Salmonella enterica serovar Typhimurium pathogenesis. Infect. Immun. 69, 7106-7106 (2001).
- Carvalho, H. M., Teel, L. D., Goping, G., O'Brien, A. D. A three-dimensional tissue culture model for the study of attach and efface lesion formation by enteropathogenic and enterohaemorrhagic Escherichia coli. Cell. Microbiol. 7, 1771-1771 (2005).
- Sainz, B., TenCate, V., Uprichard, S. L. Three-dimensional Huh7 cell culture system for the study of Hepatitis C virus infection. Virol. J. 6, 103-103 (2009).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- GE Healthcare. Microcarrier Cell Culture - Principles and Methods. Handbooks. , (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved