A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
סיבוב תרבית תאים מערכות התרבות תאים אנושיים: תאים Trophoblast האדם כמודל
* These authors contributed equally
In This Article
Summary
מסורתית, שני ממדי התרבות טכניקות תא לעיתים לגרום מאפיינים שינו לגבי סמנים בידול, ציטוקינים וגורמי גדילה. תלת ממדי התרבות תאים במערכת מסתובבת תרבית תאים (RCCS) reestablishes הביטוי של רבים מהגורמים הללו כפי שמוצג כאן עם קו trophoblast extravillous התא.
Abstract
תחום המחקר trophoblast אדם מסייע בהבנת סביבה מורכבת הוקמה במהלך placentation. בשל אופיו של מחקרים אלה, האדם ניסויים vivo הוא בלתי אפשרי. שילוב של תרבויות העיקרי, תרבויות explant ואת שורות תאים trophoblast 1 תמיכה הבנתנו הפלישה של קיר הרחם 2 שיפוץ של עורקי הרחם ספירלה 3,4 על ידי תאים trophoblast extravillous (EVTs), אשר נדרש להקמת מוצלח של ההריון. למרות עושר של ידע שלוקטו מודלים כאלה, מקובל כי בתרבות במבחנה מודלים התא באמצעות evt כמו שורות תאים להציג שינו תכונות הסלולר בהשוואה 5,6 ב עמיתיהם vivo שלהם. תאים בתרבית תאים של מערכת מסתובבת תרבות (RCCS) ולהציג מאפיינים מורפולוגיים, פנוטיפי, ופונקציונלי של evt כמו שורות תאים אשר באופן הדוק יותר לחקות הבחנה ב uטרו EVTs, עם ביטוי מוגבר של גנים המתווך הפלישה (למשל metalloproteinases מטריצה (MMPs)) והבחנה trophoblast 7,8,9. ג'ורג' הקדוש תא החולים שליה קו-4 (SGHPL-4) (תרם בעין יפה על ידי ד"ר גיא ויטלי וד"ר יהודית קרטרייט) הוא קו evt דמוי תא ששימש לבדיקות ב RCCS.
העיצוב של כלי השיט תרבות RCCS מבוסס על העיקרון כי איברים ורקמות לתפקד בסביבה (3-D) תלת מימדי. בשל תנאי התרבות דינמי הספינה, כולל תנאי גזירה רלוונטי מבחינה פיזיולוגית, התאים גדלו בשלושה ממדים בצורת אגרגטים מבוסס על זיקות הסלולר טבעי להתמיין לרקמות כמו אסיפות organotypic 10,11,12. תחזוקה של מסלול נוזל מספק נמוכה גזירה, מערבולת נמוכה בסביבה דומה לתנאים מצאו in vivo. שקיעה של תאים בתרבית הוא השיב על ידי התאמת סיבובמהירות RCCS כדי להבטיח נפילה חופשית מתמדת של תאים. גז חילופי מתרחשת דרך קרום חדיר הידרופובי הממוקם בצד האחורי של bioreactor. כמו ההורים שלהם רקמות in vivo, RCCS מבוגר תאים מסוגלים להגיב כימית והדרגות מולקולרית בשלושה ממדים (כלומר על משטחים apical, הבסיסיים, שלהם לרוחב) כי הם תרבותי על פני השטח של חרוזים microcarrier נקבובי. כאשר גדל כמו דו מימדי monolayers על משטחים בלתי חדיר כמו פלסטיק, תאים נשללת של תקשורת חשוב זה על פני השטח הבסיסי שלהם. כתוצאה מכך, המגבלות שהוטלו על ידי מרחבית בסביבה מאוד להשפיע על האופן שבו תאים תחושת אותות לפענח מתוך microenvironment שמסביב, ובכך רומז תפקיד חשוב עבור המילייה 3-D 13.
השתמשנו RCCS מהנדס משמעות ביולוגית 3-D מודלים שונים של רקמות אפיתל האנושי 7,14,15,16. ואכן, דוחות קודמים רבים demonstrated כי תאים בתרבית RCCS יכול להניח פנוטיפים רלוונטי מבחינה פיזיולוגית זה לא היה אפשרי עם דגמים אחרים 10,17-21. לסיכום, תרבות RCCS מייצגת קל, לשחזור, תפוקה גבוהה פלטפורמה המספקת כמויות גדולות של תאים מובחנים זה ניתנים מגוון רחב של מניפולציות ניסיוני. בפרוטוקול הבא, באמצעות EVTs כדוגמה, אנו בבירור לתאר את הצעדים הנדרשים כדי בתלת ממד תאים תרבות חסיד ב RCCS.
Protocol
1. קולגן הכנה ביד
- לפני EVTs טעינת לתרבות 3-D התא, צריך להכין את Cytodex-3 חרוזים microcarrier:
- תשקלי את הכמות המתאימה של Cytodex-3 חרוזים הנדרש לצורך הניסוי. פרוטוקול זה מותאם עבור כלי 10ml RCCS, שבו 0.05g חרוזים נדרשים. עבור כלי RCCS 50 מ"ל, בקנה מידה בהתאם. בתוך שפופרת 50 מ"ל חרוטי autoclavable, לערבב 250 מ"ג Cytodex-3 חרוזים עם פוספט Dulbecco 12mL שנאגרו פתרון (DPBS). סכום זה מספיק עבור 5 כלי RCCS.
- ודא נפח הולם קיים צינור חרוטי, שכן תהליך החיטוי תגרום אידוי. Loosely כובע צינור החיטוי של 10 דקות ב 110 ° C.
- הסר את צינור חרוטי בסיום המחזור החיטוי ולאפשר פתרון Cytodex-3 חרוז להתקרר.
- אחרי צינור חרוטי מתקרר לטמפרטורת החדר, השתמש בטכניקה סטרילית להביא את הנפח הכולל ל 12.5mL באמצעות 1X העקוריםBS.
- שווי ולאחסן את מוכנה Cytodex-3 חרוזים בטמפרטורת החדר. אפשר להכין חרוזים להתנפח להתקרר לטמפרטורת החדר לפני השימוש. ההכנה של מעל Cytodex-3 חרוזים יספק במשך חמש ספינות 10ml RCCS. ראינו כי אחסון ממושך Cytodex-3 חרוזים בטמפרטורת החדר תגרום הביצועים יפגעו, כמו קולגן יערער לאחר כחודש אחד. Cytodex-3 חרוזים טווח בגודל 133-215 מיקרומטר.
2. מדיה הכנה
הכן 1 ליטר של RCCS אופטימיזציה GTSF-2 המדיה (מותאם מ 22), אשר מורכב של 40% ממ אלפא, בתוספת תוספי מזון ו -60% L-15 של התקשורת ליבוביץ (מותאם מ - 22). ראשית, להכין 400mL בנפח כולל של ממ אלפא בתוספת:
סודיום ביקרבונט 21.2mM
0.06% Peptone
0.7mM פרוקטוז
1.4mM גלקטוז
5.6mM גלוקוז
1% HEPES
1% L-גלוטמין
0.5% ITS
10% FBS- כדי להכין פתרון מלאי של ITS, מתמוססים 5 מ"ל סטרילי acidified H 2 O שהוכן על ידי תוספת של חומצה אצטית קרחונית (כ 0.05mL). מערבולת לפזר, פעל עם מים סטריליים 45mL.
- מספיק לשקול את L-15 אבקה של ליבוביץ עבור 600ml של המדיום על ידי המסת ברקמות תרבות כיתה H 2 O.
- תביאו את הנפח הכולל של המדיום תרבות התא 1 ליטר עם בינוני L-15 של ליבוביץ. מסנן לעקר ולאחסן ב 4 ° C בחושך. הוסף 1% פניצילין, סטרפטומיצין בנפרד aliquot כל אחד בינוני בשימוש.
- רבים בתקשורת ניסוחים אחרים מאשר GTSF-2 התקשורת נבדקו בהצלחה RCCS. מעבדות הפרט להחליט עבור עצמם מה המדיום הוא אופטימלי עבור הניסוי מתבצע.
3. תאים דגירה ביד
- להפיץ את EVTs ל ~ 80% confluency, trypsinize ולספור באמצעות מקובל בתרבות פרקטיקות התא.
- להשעות 1x10 6 EVTs ב 4mL של חםעורך אמצעי התקשורת.
- לערבב בעדינות מוכן Cytodex-3 חרוזים. באמצעות שימוש בטכניקות סטריליות, להסיר 2.5mL חרוזים מוכן באמצעות קצה רחב, 10 מ"ל פיפטה סרולוגיות ולהעביר צינור בשימוש חרוטי 15 מ"ל. שים לב כי ייתכן שיש איבוד קטן של חרוזים כמו שהם מייחסים פיפטה.
- אפשר-3 Cytodex חרוזים להתיישב על החלק התחתון של הצינור. אחרי שקיעה, השתמש pipettor כדי להסיר את השכבה העליונה של DPBS מבלי להפריע Cytodex-3 חרוזים.
- מערבבים את 1x10 6 EVTs מוכן בתקשורת עם Cytodex-3 חרוזים מוכן.
- דגירה את תערובת תאים חרוז בטמפרטורת החדר למשך 30 דקות. מדי פעם מערבבים בעדינות. דגירה של 30 דקות נוסף ב 37 ° C ו 5% CO 2. מדי פעם מערבבים בעדינות.
4. טעינת RWV
- בארון זרימה למינרית, להסיר RCCS 10 מ"ל מן האריזה ולמקם אותו בצלחת סטרילית 6-היטב, התרבות ליציבות. עיין באיור 1 עבור תרשים שכותרתו של RCCS.
- הסר את פקק גדול מהנמל.
- תביאו את הנפח הכולל של התערובת התא חרוז דוגרים על 10 מ"ל עם התקשורת חיממה.
- טען את תא / תערובת חרוז לתוך RCCS דרך נמל גדול. RCCS צריכה להיות מוטה ב -45 מעלות זווית (עד נמל גדול) בעת טעינת לסייע סילוק בועות אוויר פוטנציאליים. למנוע הצטברות של לחץ חיובי על ידי מילוי הכלי לאט ובהתמדה.
- החלף את הפקק בנמל גדול.
- מוציאים את הבוכנות מן 3-mL מזרקים במקום מזרקים ריקים על היציאות קטן. הוסף 1-3mL של התקשורת מזרק אחד. לאט לאט לפתוח את שני שסתומים. החלפת בוכנות מזרק על מזרקים בעדינות. הוסף מדיה מזרק אחד עד שכל הבועות יוסרו מן החדר הפנימי.
- הרם את RCCS ו לטפוח בעדינות את הצד תוך סיבובו מולך כדי לבדוק בועות. אם יש בועות כל, אתה חייב להוציא אותם לתא, כמו בועות אוויר יפריע היווצרות oו אגרגטים התא להציג כוחות גזירה. הסר בועות על ידי החלפה של RCCS עד הבועות נמצאים תחת נמל קטן. ואז בעדינות על המזרק בצד הנגדי לכוח בועות ליציאת ומחוץ לתא.
- סגור מיציאה אחת בצד. דחף בעדינות על הבוכנה במזרק אחרים להציג כמות קטנה של לחץ חיובי לתוך כלי השיט, אשר מונע בועות מ טביעה. סגור שסתום השני.
- טען את RCCS על הרוטור. התחל את הסיבוב על 19rpm ב 37 ° C-CO 2 באינקובטור.
5. שינוי מדיה
- שנה את התקשורת בכל יום אחר במשך שלושת הימים הראשונים, ולאחר מכן בכל יום לאחר מכן.
- כבה את הרוטור ולהסיר את RCCS. משוך את הבוכנות עד ליצור כמה יניקה, להסיר את כל מזרקים מנמל קטן והמקום RCCS בזווית כך החרוזים להתיישב מול הנמל הגדול.
- אחרי החרוזים התיישבו כל, לפתוח את אחד השסתומים קטניםלאפשר התקשורת לזרום מתוך RCCS לתוך מיכל פסולת. הסרה של 2 / 3 של התקשורת בדרך זו. הקפידו לא להפריע חרוזים לא לבטל כל אגרגטים.
- סגור את שסתום קטן ולפתוח את נמל גדול. הוסף מדיה בחזרה RCCS דרך נמל גדול. החלף את הפקק בנמל גדול.
- חזור על שלבים 4.6-4.9.
- כמו אגרגטים הגידול בגודל, אתה צריך להגדיל את מהירות הסיבוב כדי לשמור אותם ההשעיה בכל עת, באופן אידיאלי דפוס הדם קטן במהירות האופטימלית. בדרך כלל, להגדיל את המהירות בין 0.3-0.7 סל"ד לאחר כל האכלה פעם אגרגטים מתחילים לגדול בעליל.
6. איסוף מופצות תאים
- הסר את RCCS של הרוטור. הסר את כל מזרקים מנמל קטן והמקום RCCS בזווית כך חרוזים עשויים להתיישב מול הנמל הגדול.
- אחרי החרוזים התיישבו כל, לפתוח את אחד השסתומים קטן ולאפשר התקשורת לזרום החוצהשל RCCS לתוך מיכל פסולת. הסר את 1 / 3 של התקשורת בדרך זו.
- סגור את שסתום קטן ולפתוח את נמל גדול. בעדינות מערבולת כלי לפזר את אגרגטים בחזרה פתרון. תערובת נוזלית רוקן לתוך שפופרת 50 מ"ל סטרילי חרוטי. אפשר המצרפים שנאספו להתיישב צינור חרוטי לפני השימוש supernatant ביסודיות לשטוף את כלי התרבות על מנת למקסם את ההתאוששות של אגרגטים. אגרגטים עשוי לשמש מבחני במורד מיד, כגון cytometry זרימה, מבחני הפלישה, immunofluorescence ואחרים.
7. נציג תוצאות
דוגמה evt דמויי תאים (SGHPL-4 תא קו trophoblast) גדל ב RCCS על Cytodex-3 חרוזים מוצג באיור 2. השורה evt דמוי תא מציג תחזיות הארכת הרחק באשכול הראשי הצמדת אשכולות השכנות. רבים החרוזים מכוסים לחלוטין עם תאים ומתפשטים. הוסר לאחר מן RCCS ו PLAטד על מטריצה תאית, evt כמו 3-D בתאי צמח באגרסיביות לפלוש ו / או להעביר (איור 3). RT-PCR נתונים מאשר ביטוי מוגבר של MMPs לראות 3-D אגרגטים בניגוד לתרבות המסורתית monolayers התא (איור 4). מעניין, לא גנים הקשורים הפלישה הם שהוגברו גם RCCS (לוח 1) עשויים לסייע המגדירה בתחומים כגון אינטראקציות עם מערכת החיסון פולשים לתאים trophoblasts.
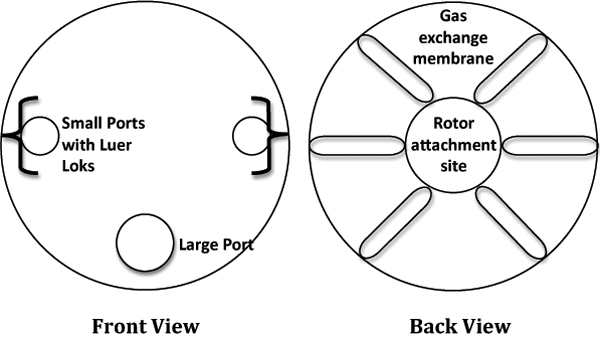
באיור 1. תיאור קריקטורה של מערכת סיבוב Cell תרבות (RCCS).

באיור 2. בניגוד שלב מיקרוסקופ המצרפי של נציג לאחר צמיחה של 5 ימים RCCS. החצים מצביעים על התאים הפולשים * מציין את Cytodex-3 חרוזים microcarrier.

באיור 3. אגרגטים RCCS מבוגרים היו משובצים ג'לים הפיברין. הפלישה באמצעות הג'ל הפיברין נצפתה מוקדם ככל הטבעה (א) שלאחר הפיברין 24 שעות (ב ') נמשכו עד 48 שעות. החצים מצביעים על התאים הפולשים * מציין את Cytodex-3 חרוזים microcarrier (עיבוד, באישור, מתוך המשחק. 7).

איור 4. Zymogram ג'לטין השוואתי של monolayer ו RCCS מופצות SGHPL-4 evt דמויי תאים. צורות Pro-ופעיל של MMP-2 ו - MMP-9 היו מופרשים על ידי התאים RCCS trophoblast גדל (עיבוד, באישור, מתוך המשחק. 7).

טבלה 1. סיכום תוצאות מ microarray SGHPL-4 התאים הגדלים RCCS (עיבוד, באישור, מתוך המשחק. 7).
- אינדוקציה מקפלים את 3-D אגרגטים היה מחושב באופן הבא: מנורמל 3-D ערך / גן ערך מנורמל monlayer גן.
- מציין גנים שהיו מתחת לגבול של גילוי monolayers.
Discussion
הטכניקה המוצגת כאן תרבות מספק החוקרים עם evt דמויי תאים פולשני מאוד. זה עתה הכיר בכך הפסד של בידול מתרחשת monolayers בשל עיכוב של תגובות כימיות הסלולר אותות מולקולריים בשלושה ממדים (משטחים התא apical, הבסיסיים, לרוחב) 10,13. טכניקה זו משקפת מאפיינים ציין ברחם על הפולשי?...
Disclosures
אין לנו שום דבר לגלות.
Acknowledgements
עבודה זו נתמכה על ידי המוסד האמריקני הלאומי לבריאות NIH מענק / NICHD # HD051998 (עד רמ"א).
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| Cytodex microcarrier חרוזים | Sigma-Aldrich | C3275 | |
| סיבוב תרבית תאים מערכת (RCCS) | Synthecon | RCCS-D | כולל בסיס הרוטור, אספקת החשמל, 4 יחידות RCCS הפנויה |
| RCCS יחידות פנויה | Synthecon | צור Synthecon | |
| 3ml Luer-Lock קצה המזרק | BD | 309585 | |
| 10 מ"ל רחב טיפ סרולוגיות פיפטה | BD | 357504 | |
| ממ אלפא | Invitrogen | 12561-072 | |
| L-15 של ליבוביץ בינוני, אבקת | Invitrogen | 41300-039 | |
| H 2 O, רעלן פנימי חינם | דיג | MT-25-055-CM | |
| סודיום ביקרבונט | Sigma-Aldrich | S-7795 | |
| Peptone | פישר סיינטיפיק | BP1420-100 | |
| פרוקטוז | Sigma-Aldrich | F3510-100 | |
| גלקטוז | Sigma-Aldrich | G5388-100 | |
| גלוקוז | Sigma-Aldrich | G7528-250 | |
| HEPES | Invitrogen | 15630-080 | |
| L-גלוטמין | Invitrogen | 25030 | |
| אינסולין transferrin-Sodium סלניום (ITS) | Sigma-Aldrich | I1884 | |
| FBS | Invitrogen | 10437 | |
| פניצילין, סטרפטומיצין | Invitrogen | 15140 |
References
- Knofler, M. Critical growth factors and signalling pathways controlling human trophoblast invasion. Int. J. Dev. Biol. 54, 269-269 (2010).
- Cartwright, J. E. Remodelling at the maternal-fetal interface: relevance to human pregnancy disorders. Reproduction. 140, 803-803 (2010).
- Harris, L. K. IFPA Gabor Than Award lecture: Transformation of the spiral arteries in human pregnancy: key events in the remodelling timeline. Placenta. 32, S154-S154 (2011).
- Whitley, G. S., Cartwright, J. E. Trophoblast-mediated spiral artery remodelling: a role for apoptosis. J. Anat. 215, 21-21 (2009).
- Apps, R. Genome-wide expression profile of first trimester villous and extravillous human trophoblast cells. Placenta. 32, 33-33 (2011).
- Bilban, M. Trophoblast invasion: assessment of cellular models using gene expression signatures. Placenta. 31, 989-989 (2010).
- LaMarca, H. L. Three-dimensional growth of extravillous cytotrophoblasts promotes differentiation and invasion. Placenta. 26, 709-709 (2005).
- Jovanovic, M., Stefanoska, I., Radojcic, L., Vicovac, L. Interleukin-8 (CXCL8) stimulates trophoblast cell migration and invasion by increasing levels of matrix metalloproteinase (MMP)2 and MMP9 and integrins alpha5 and beta1. Reproduction. 139, 789-789 (2010).
- Husslein, H. Expression, regulation and functional characterization of matrix metalloproteinase-3 of human trophoblast. Placenta. 30, 284-284 (2009).
- Barrila, J. Organotypic 3D cell culture models: using the rotating wall vessel to study host-pathogen interactions. Nat. Rev. Microbiol. 8, 791-791 (2010).
- Hammond, T. G., Hammond, J. M. Optimized suspension culture: the rotating-wall vessel. Am. J. Physiol. Renal. Physiol. 281, 12-12 (2001).
- Unsworth, B. R., Lelkes, P. I. Growing tissues in microgravity. Nat. Med. 4, 901-901 (1998).
- Schmeichel, K. L., Bissell, M. J. Modeling tissue-specific signaling and organ function in three dimensions. J. Cell. Sci. 116, 2377-2377 (2003).
- Bentrup, H. ?. ?. n. e. r. z. u., K, . Three-dimensional organotypic models of human colonic epithelium to study the early stages of enteric salmonellosis. Microbes. Infect. 8, 1813-1813 (2006).
- Carterson, A. J. A549 lung epithelial cells grown as three-dimensional aggregates: alternative tissue culture model for Pseudomonas aeruginosa pathogenesis. Infect. Immun. 73, 1129-1129 (2005).
- Myers, T. A. Closing the phenotypic gap between transformed neuronal cell lines in culture and untransformed neurons. J. Neurosci. Methods. 174, 31-31 (2008).
- Hjelm, B. E. Development and characterization of a three-dimensional organotypic human vaginal epithelial cell model. Biol. Reprod. 82, 617-617 (2010).
- Straub, T. M. In vitro cell culture infectivity assay for human noroviruses. Emerg. Infect. Dis. 13, 396-396 (2007).
- Nickerson, C. A. Three-dimensional tissue assemblies: novel models for the study of Salmonella enterica serovar Typhimurium pathogenesis. Infect. Immun. 69, 7106-7106 (2001).
- Carvalho, H. M., Teel, L. D., Goping, G., O'Brien, A. D. A three-dimensional tissue culture model for the study of attach and efface lesion formation by enteropathogenic and enterohaemorrhagic Escherichia coli. Cell. Microbiol. 7, 1771-1771 (2005).
- Sainz, B., TenCate, V., Uprichard, S. L. Three-dimensional Huh7 cell culture system for the study of Hepatitis C virus infection. Virol. J. 6, 103-103 (2009).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- Lelkes, P. I., Ramos, E., Nikolaychik, V. V., Wankowski, D. M., Unsworth, B. R., Goodwin, T. J. GTSF-2: a new, versatile cell culture medium for diverse normal and transformed mammalian cells. In Vitro Cell. Dev. Biol. Anim. 33, 344-344 (1997).
- GE Healthcare. Microcarrier Cell Culture - Principles and Methods. Handbooks. , (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved