A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
متحد البؤر التصوير الطيفي من المستقبلات النيكوتينية الموسومة Fluorescently في نوك في الفئران مع الإدارة النيكوتين المزمن
In This Article
Summary
قمنا بتطوير تقنية جديدة لتحديد كمية النيكوتين التغييرات مستقبلات أستيل داخل المناطق التحت خلوية من أنواع فرعية محددة من الخلايا العصبية الجهاز العصبي المركزي إلى فهم أفضل للآليات لإدمان النيكوتين عن طريق استخدام مزيج من الأساليب بما في ذلك وضع علامات بروتين فلوري من مستقبلات باستخدام الضربة القاضية في نهج وطيفية مبائر التصوير.
Abstract
Ligand-gated ion channels in the central nervous system (CNS) are implicated in numerous conditions with serious medical and social consequences. For instance, addiction to nicotine via tobacco smoking is a leading cause of premature death worldwide (World Health Organization) and is likely caused by an alteration of ion channel distribution in the brain1. Chronic nicotine exposure in both rodents and humans results in increased numbers of nicotinic acetylcholine receptors (nAChRs) in brain tissue1-3. Similarly, alterations in the glutamatergic GluN1 or GluA1 channels have been implicated in triggering sensitization to other addictive drugs such as cocaine, amphetamines and opiates4-6.
Consequently, the ability to map and quantify distribution and expression patterns of specific ion channels is critically important to understanding the mechanisms of addiction. The study of brain region-specific effects of individual drugs was advanced by the advent of techniques such as radioactive ligands. However, the low spatial resolution of radioactive ligand binding prevents the ability to quantify ligand-gated ion channels in specific subtypes of neurons.
Genetically encoded fluorescent reporters, such as green fluorescent protein (GFP) and its many color variants, have revolutionized the field of biology7.By genetically tagging a fluorescent reporter to an endogenous protein one can visualize proteins in vivo7-10. One advantage of fluorescently tagging proteins with a probe is the elimination of antibody use, which have issues of nonspecificity and accessibility to the target protein. We have used this strategy to fluorescently label nAChRs, which enabled the study of receptor assembly using Förster Resonance Energy Transfer (FRET) in transfected cultured cells11.More recently, we have used the knock-in approach to engineer mice with yellow fluorescent protein tagged α4 nAChR subunits (α4YFP), enabling precise quantification of the receptor ex vivo at submicrometer resolution in CNS neurons via spectral confocal microscopy12. The targeted fluorescent knock-in mutation is incorporated in the endogenous locus and under control of its native promoter, producing normal levels of expression and regulation of the receptor when compared to untagged receptors in wildtype mice. This knock-in approach can be extended to fluorescently tag other ion channels and offers a powerful approach of visualizing and quantifying receptors in the CNS.
In this paper we describe a methodology to quantify changes in nAChR expression in specific CNS neurons after exposure to chronic nicotine. Our methods include mini-osmotic pump implantation, intracardiac perfusion fixation, imaging and analysis of fluorescently tagged nicotinic receptor subunits from α4YFP knock-in mice (Fig. 1). We have optimized the fixation technique to minimize autofluorescence from fixed brain tissue.We describe in detail our imaging methodology using a spectral confocal microscope in conjunction with a linear spectral unmixing algorithm to subtract autofluoresent signal in order to accurately obtain α4YFP fluorescence signal. Finally, we show results of chronic nicotine-induced upregulation of α4YFP receptors in the medial perforant path of the hippocampus.
Protocol
1. مضخة غرس
- قبل زرع مضخة، وملء وإعداد Alzet مصغرة التناضحي مضخات (Alzet، موديل 2002، كوبرتينو، الولايات المتحدة الأمريكية) والحرص على عدم إدخال فقاعات الهواء. هذا نموذج مصغر من التناضحي المضخة حل بمعدل 0،5 ميكروليتر / ساعة لمدة 14 يوما. ضمان ظروف معقمة. وزن مضخات الفارغة والمليئة. في ختام التجربة (10 يوما بعد الزرع)، يمكن إزالة السائل المتبقية في مضخة مع المحاقن والإبر وزنه لحساب حجم ضخ.
- مضخات مع حل سيطرة تحتوي على المياه المالحة (0.9٪ وزن / حجم، Teknova، S5819، هوليستير، الولايات المتحدة الأمريكية). لإعداد حل النيكوتين، والأوراق المالية 1 م حل (-) من النيكوتين ملح طرطرات الهيدروجين (سيغما، القط # N5260) والمخفف في المياه المالحة (0.9٪ W / V) وتعقيمها من خلال تصفية من خلال مرشح 0.22 حقنة في نهاية ميكرون. وتدار من قبل ونحن النيكوتين على 0.4 و 2 مغ / كغ / ساعة (محسوبة على أساس خال من النيكوتين) لمدة 10 أيام.
- إعداد ثلاث حمامات المياه المالحة (ثلاثة10 سم المالحة ملأت أطباق بتري). مرة واحدة وقد تم شغل المضخة وتوج، ويغسل جيدا في ضخ كل حمام المالحة المتتالية لإزالة أي آثار المخدرات على الغلاف الخارجي. غمر تملأ مضخات في محلول ملحي لتخزين حتى الجراحة، والحفاظ على التحكم ومضخات المياه المالحة النيكوتين في حاويات منفصلة.
- الى تشجيع الانتعاش الصحي والحد من مخاطر العدوى بعد العمليات الجراحية، لديها استعداد لأقفاص نظيفة الانتعاش على المدى الطويل.
- على المدى القصير استرداد فورا بعد الجراحة، وإعداد قفص يحتوي على وسادة التدفئة ومصباح الحرارة.
- لدراسة آثار النيكوتين المزمنة لدينا 5-6 α4YFP متماثل تدق في الفئران (2-3 أشهر من العمر) في كل مجموعة (التحكم أو النيكوتين). والضربة القاضية في α4YFP خط الماوس تم backcrossed لمدة 10 أجيال من سلالة الماوس C57BL/6J. نتأكد من العمر والجنس من كل الفئران هي نفسها بالنسبة للدراسة والتي يتم تنفيذها كل العمليات الجراحية في نفس اليوم للحد من التقلبات. لمنع HYpothermia للفئران أثناء وبعد الجراحة، وتجهيز طاولة العمليات الجراحية مع وسادة التدفئة التي تغطيها الستارة الجراحية المعقمة.
- حمل α4YFP الضربة القاضية في الفأر مع 3 لتر / دقيقة، والأكسجين isoflurane 3٪ ومن ثم الحفاظ على التخدير عند 2.5 لتر / دقيقة، والأكسجين isoflurane 1٪. نحن نفضل التخدير isoflurane لأن على الانتهاء من عملية جراحية isoflurane مسح النظام بشكل سريع والفئران هي واعية ودقيقة المحمول داخل 2 ~. تطبق قطرات العين مباشرة (المسيل للدموع، جل، نوفارتيس) لتجنب تلف القرنية.
- وزرع مضخات تحت الجلد من خلال شق الجلد على الظهر والعنق، ويتم الضغط على المضخة caudally إلى أسفل في الجانب الظهري من الخلف. مسح المنطقة على ظهره بين الأطراف الأمامية مع الايثانول 95٪ لغير لامع والفراء. قرصة الجلد بالملقط غريف 0.8mm (أدوات العلوم الجميلة، 11050-10) وجعل 1 سم قطع الجانبي المركزية باستخدام مقص القزحية (أدوات العلوم الجميلة، 14060-10).
- لخلق مساحة للمضخة تحت الجلد، إدراج معيار مقص نمطق (أدوات العلوم الجميلة، 14101-14) في شق ودفعهم بعناية نحو نهاية الذيلية للحيوان.
- باستخدام 1.0 ملم ملقط غريف (أدوات العلوم الجميلة، 11650-10)، إزالة مضخة من المياه المالحة. عقد شق المفتوحة باستخدام ملقط وتضاف مضخة في شق مع غطاء مضخة التناضحي التي تواجه نهاية الذيلية للحيوان، ودفع المضخة إلى نهاية الذيلية.
- جرح قرصة اغلاق باستخدام ملقط 0.8mm وتطبيق كمية كافية من Vetbond (3M، القط # 1469SB) الغراء. عقد حتى يتم اغلاق الجرح.
- إزالة الحيوان من قناع isoflurane، وضخ مع مسكن، meloxicam (0.1 ملغم / كغم من المحكمة العليا)، والمكان في قفص الانتعاش على المدى القصير حتى واعية والمحمول. ثم وضع في قفص انتعاش على المدى الطويل مع libitum الغذاء والماء الإعلانية المتاحة.
2. α4YFP طرق في داخل القلب، بواسطة رذاذ تثبيت الماوس
- جعل حلول يوم واحد قبل الإجراء وترك في درجة مئوية. 4 للحد من تقلب كل الفئرانوسيتم perfused في نفس اليوم ومع نفس دفعة من الحلول.
- أداء تثبيتات نضح في منطقة جيدة التهوية. دافق من خط ضخ peristatic (Masterflex تحميل سهل، 7518-00؛ Masterflex تحكم مضخة، 60648) مع DDH 2 O.
- إضافة ~ 0.0015g من الهيبارين (سيغما، القط # H4784)، وهو مضاد للتخثر، الى 20 درجة الحموضة 7.6 مل PBS (إينفيتروجن، القط # 70011).
- تخدير α4YFP تدق في الماوس عن طريق حقن العضل خليط من الكيتامين (25 ملغم / كغم من الحيوان وايث، الصحة)، وهيدروكلوريد medatomidine (0.25 ملغم / كغم، فايزر) في عضلة الساق الخلفية ووضع على الفور الحيوان مرة أخرى في قفص وطنه.
- دبوس الحيوان إلى غطاء الستايروفوم إدراجه ضمن علبة معدنية. مسح الصدر مع الايثانول 95٪. جلد قرصة مع ملقط أدسون (أدوات العلوم الجميلة، 91106-12) وقص فتح التجويف الصدري مع مقص القزحية. المشبك القفص الصدري باستخدام مرقئ ألترا (أدوات العلوم الجميلة، 13021-12)، وفضح القلب.
- بدء ضخ PBS في 4 دقائق و / مل، وأناnsert إبرة فراشة 23G (بيكتون ديكنسون، 367253) إلى البطين الأيسر من الحيوان. قص فورا الأذين الأيمن للسماح الدم وسائل الإرواء من الفرار.
- يروي 20 مل من برنامج تلفزيوني (درجة الحموضة 7.6)، ثم 30 مل من امتصاص العرق 4٪ (7.6 درجة الحموضة، تضعف مع برنامج تلفزيوني من مخزون PFA 16٪، علوم المجهر الإلكتروني، والقط # 15710)، ثم 20ml من السكروز بنسبة 5٪ (درجة الحموضة 7.6) . وجدنا أن أكثر من تثبيت يزيد من تألق ذاتي. نضح مع السكروز 5٪ يشطف PFA المتبقية من الدماغ، مما يقلل من تألق ذاتي.
- إزالة المخ وتخزينها في السكروز 30٪ لمدة 3 أيام.
- لتجميد العقول لباجتزاء الاكليلية، قطع المخيخ بشفرة حلاقة والدماغ مكان في قالب من البلاستيك التضمين (VWR، القط # 18986-1) الجانب منقاري صعودا ويغرق في مجمع أكتوبر تركيب (نسيج تيك، القط # 4583) . تجمد في الثلج الجاف ومخزن في -20 درجة مئوية قبل التقطيع.
- أدمغة القسم (30 ميكرون سميكة) على ناظم البرد ومن ثم نقل إلى الشرائح المغلفة. تخزين المقاطع في الدماغ و-20درجة؛ C في صناديق الشريحة تحتوي على واحد كبريتات الكالسيوم اللامائية حجر. وينبغي مربع الشريحة تكون في وضع الرمز البريدي قفل كيس مختوم لتجنب الرطوبة وحرق المجمد لاحق عند تخزينها عند درجة حرارة -20 درجة مئوية.
3. التصوير nAChRs فلوري باستخدام متحد البؤر المجهري الطيفي
- ضمان الشرائح لديها الحد الأدنى من التعرض إلى أي مصدر للضوء لتقليل photobleaching.
- ساترة الشرائح قسم المخ مع وسيلة متزايدة على أن لا تمنع فلوري مضان من البروتين. لدينا نجاح جيدة مع Mowiol 4-88 (8.5 درجة الحموضة في تريس، حمض الهيدروكلوريك، والجلسرين، EMD-Calbiochem، القط # 475904)، والذي يصلب بعد بضع ساعات. تأكد من أن Mowiol equilibrates إلى درجة حرارة الغرفة قبل الانزلاق غطاء من أجل تجنب فقاعات الهواء. لا تستخدم طلاء الأظافر عندما تغطي الانزلاق لأنها سوف يطفئ YFP مضان.
- يتم الحصول على الصور باستخدام C1si نيكون الطيفية نظام مجهر متحد البؤر. تفاصيل عن طريقة التصوير مبائر الطيفية وunmixing الخطية هي توفيرد 13-15 في مكان آخر. الأساس المنطقي لاستخدام مجهر طيفي مبائر هو أن ثابت أنسجة المخ لديه تألق ذاتي متأصل. التصوير الطيفي مبائر على C1si نيكون يستخدم مجموعة واسعة من أجهزة الكشف عن 32 أنبوب مضخم للضوء أن عينة نطاق محدد من موجات الضوء المنبعث من فلوري، يتخلله مكانيا الى الاطوال الموجية المختلفة عبر صريف عنصر التشتت وكأنه موشور الأنكسار الضوء الأبيض إلى قوس قزح من الألوان 16. ويتم جمع ما هو كومة امدا من الصور - الصور التي تم جمعها في موجات مختلفة من الضوء بحيث يتم جمع لطيف الانبعاث لكل بكسل من كومة امدا من الصور. منذ YFP وتألق ذاتي الأنسجة لكل منها طيفية مميزة، ويمكن deconvolved المكدس امدا باستخدام خوارزمية unmixing خطي جبري إلى YFP منفصلة وإشارات autofluorescent (الشكل 2). وبالتالي، يمكن تحديد كمي دقيق جدا من مضان YFP حتى في الأنسجة مع مستويات كبيرة من الاتحاد الافريقيtofluorescence.
- ويمكن تعديل إعدادات مختلفة لتحسين جودة الصورة ومضان كفاءة التحصيل. سنقدم تقريرا الإعدادات التي نستخدمها عادة ولكن يمكن تعديل هذه الإعدادات وفقا لنموذج ومجهر متحد البؤر. لتحديد بدقة التغيرات في التعبير الوحيدات α4YFP مع النيكوتين مزمن علينا أن نضمن أن مستوى مقياس الرمادية شدة الاشارات من كل بكسل هي أقل من القيمة تشبع (<4095 لمدة 12 بت مقياس الرمادية). وعلاوة على ذلك، ونحن لاستيعاب الزيادة المحتملة في إشارة بسبب upregulation المستقبلة عن طريق ضبط إعدادات مبائر بحيث بكسل حوالي ثلث قيمة تشبع (~ 1300-1400) أو أقل. مرة واحدة يتم تحسين الإعدادات، يتم الاحتفاظ إعدادات متطابقة بالنسبة لجميع جلسات التصوير والعينات.
- نحن استخدام الإعدادات التالية لα4YFP التصوير باستخدام 60X خطة CFI النفط آبو VC هدف (1.40 NA، 0.13 ملم مسافة العمل): 488 نيوتن متر عند خط ليزر نقل القصوى 15٪ من ليزر الأرجون 40 ميغاواط، الطيفية للكشف عن زيادة في 220، التقط المدى الطيفي من 496،5 إلى 656،5 نانومتر نانومتر في قرار نانومتر 5، 512 × 512 بكسل على مساحة 50 × 50 ميكرون ميكرون، وحجم الثقب المتوسطة (60 بقطر ميكرومتر)، بكسل 4،08 يسكن الوقت، في المتوسط أكثر من المسح الضوئي و12 بت من مقياس الرمادية.
4. خطي unmixing من الصور الطيفية مبائر وتحليل الصور
- لأداء unmixing الطيفية خطي على صورة العينة المأخوذة مع مجهر متحد البؤر الطيفية، لا بد من الحصول على أول إشارة لطيف YFP وطائفة ومرجعية للتألق ذاتي الأنسجة.
- والمطلوب المهمة بالنسبة لأي طيف إشارة، هو الحصول على إشارة إلى ارتفاع الطيف مضان ضجيج تصوير مع خط ليزر نفسها المستخدمة في التصوير من العينات الخاصة بك. على الرغم من أن خط ليزر 514 نيوتن متر من الأرجون لديها كفاءة أعلى إثارة لإثارة YFP نفضل YFP صورة مع خط ليزر 488 نانومتر لأن هناك أفضل فصل من الانبعاثات ذروة YFP والخط 488 نانومتر أقل لikely لتشويه الذروة ويمكن للمرء الحصول على انبعاث YFP كامل الطيف بما في ذلك الارتفاع إلى الذروة. نحن YFP صورة قابلة للذوبان transfected في خط الخلية بحيث يتم الحصول على إشارة قوية YFP ويتم تخزين طيف YFP الناتجة في مكتبتنا من الأطياف المرجعية. ويمكن أيضا α4YFP Transfected خلال المعبر عنها في خطوط الخلايا يمكن استخدامها لأنها ستوفر أيضا إشارة إلى ارتفاع طيف الخلفية.
- للحصول على طيف إشارة من تألق ذاتي تألق ذاتي صورة نحن من قسم دماغ الفأر wildtype من مناطق الدماغ المختلفة التي نحن عازمون على صورة من الماوس α4YFP والحصول على أطياف يناظرها. نحن نستخدم نفس خط ليزر، 488 نانومتر، واستخدام المعلمات صورة متطابقة تقريبا، على الرغم من أننا قد يغير مكسب للكشف عن وكثافة الليزر أو إجراء التصوير المتوسط لتعظيم إشارة إلى الضجيج.
- بعد الحصول على صورة طيفية مبائر من منطقة في الدماغ من الفأرة α4YFP، ومن ثم deconvolved الصورة في YFP وautofluorإشارات escence من خلال تطبيق خوارزمية خطي unmixing الطيفي باستخدام طيف إشارة من YFP وطيف إشارة من تألق ذاتي الماوس wildtype من منطقة في الدماغ نفسه.
- ويمكن بعد ذلك في صورة غير مخلوط α4YFP يمكن فتحه في صورة برامج التحليل مثل يماغيج ( http://rsbweb.nih.gov/ij/ ) وبعد ذلك يتم حساب كثافة بكسل المتوسط للمنطقة من اهتمام. ودعا البرنامج المساعد ليماغيج "loci_tools.jar" ( http://www.loci.wisc.edu/bio-formats/imagej ) يمكن استخدامها لاستيراد نيكون ICS / هويات ملفات مبائر.
- نكرر نفس unmixing الطيفي الخطي والتحليل لwildtype الفئران في منطقة الدماغ نفسه للحصول على قيمة خلفية المتبقية.
- ثم واحد يحصل على α4YFP يعني تصحيح كثافة عن طريق طرح قيمة خلفية المتبقي (4.6) من قيمة يعني α4YFP غير المصححة (4.5).
5. ممثل النتائج
نعرض ممثل إسقاط اللون الحقيقي من كومة امدا من الصور للالعنان وسطي من ماوس α4YFP متماثلة اللواقح (الشكل 3A) التي اتخذت مع مجهر متحد البؤر الطيفية. نحن، كما يظهر للطيف الانبعاث من هذه المنطقة التي تحتوي على الخلايا العصبية من مصلحة إيجابية α4YFP من نفس الصورة مكدس امدا (الشكل 3B). ذروة الانبعاثات متميز هو واضح في نانومتر 527 ~، والذي هو ذروة الانبعاثات مضان من YFP. في المنطقة المجاورة لالعنان وسطي يظهر طيف الانبعاث التي تفتقر إلى ذروة الطيفية في 527 نانومتر، مما يدل على عدم وجود مفارز nAChR α4YFP. بعد unmixing الأطياف الخطية باستخدام أطياف مرجعية من YFP والفأر autofluoresence الدماغ مع تداخل كبير من الانبعاثات (الشكل 4)، والفصل بين YFP وإشارة autofluorescent الممكن العائد في صورة α4YFP غير مخلوط، صورة autofluorescent غير مخلوط، وقناة المتبقية. واضح توطين انفلونزا α4YFPويمكن تحديد orescence في سوما المزدحمة لهذه العنان وسطي (الشكل 4).
في α4YFP الحصين يكون موضعيا بشكل رئيسي في مسار الثاقب وسطي، ومسار tempero-ammonic وشكوة 12. هذه كلها تعصيب glutamatergic من قرن آمون. قمنا بدراسة آثار النيكوتين مزمن في التعبير α4YFP في المسار الثاقب قرن آمون (الشكل 5). أدت إدارة المزمنة من النيكوتين (2 ملغ / كغ / ساعة لمدة 10 أيام) في زيادة كبيرة (69 ± 14٪) في مضان α4YFP من الفئران المالحة مراقبة تعامل مع الفئران النيكوتين المزمنة المعالجة (P = 0.001، يلكوكسون اختبار مجموع رتبة) ( الشكل 5).
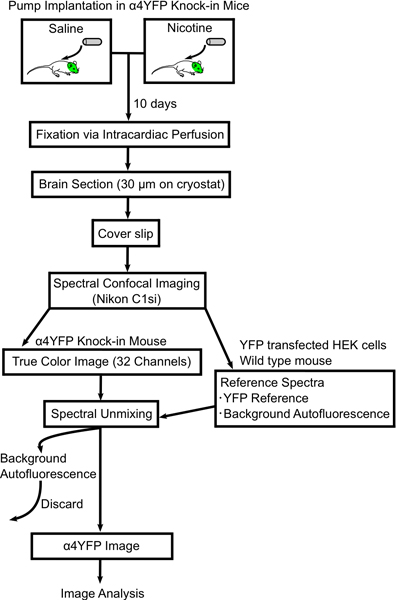
الرسم البياني رقم التدفق 1. تظهر إجراء تغييرات على الصورة في مفارز nAChR α4YFP مع النيكوتين المزمنة. تمتلئ مصغرة التناضحي مضخات المياه المالحة أو مع أي من النيكوتين وزرعها تحت الجلد في وألبهكتار؛ 4YFP الفئران متماثل. بعد 10 يوما perfused الفئران وثابتة مع بارافورمالدهيد 4٪، والعقول هي الفأر مقطوع (30 ميكرون سميكة) على الشرائح. تم تصوير المقطع في الدماغ في مجهر متحد البؤر الطيفية (نيكون C1si) وغير مخلوطة طيفيا إلى صور YFP وautofluorescent. ثم يتم تحليل هذه الصور α4YFP كذلك مع برنامج يماغيج.
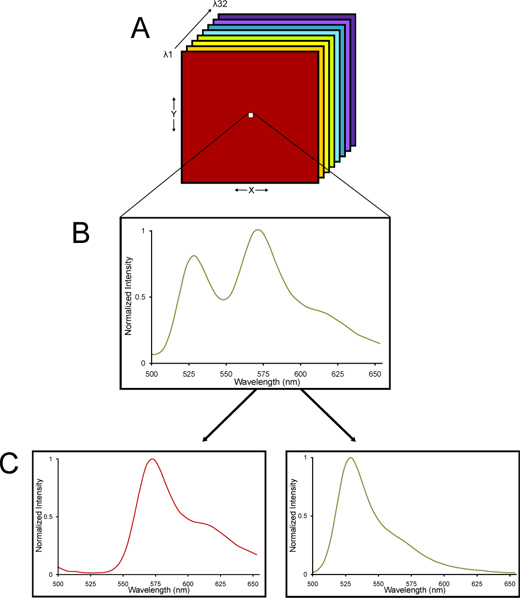
الشكل 2. رسم تخطيطي من كومة امدا تصوير من مجهر متحد البؤر الطيفية وغير مخلوطة خطيا إلى مكوناته الطيفية. (أ) التي يتم جمعها لامدا كومة من الصور. (ب) مكدس امدا يتكون من الصور التي تم جمعها في موجات مختلفة من الضوء بحيث يتم جمع لطيف الانبعاث لكل بكسل عبر مكدس بأكمله. (ج) منذ YFP وتألق ذاتي كل الأنسجة يكون طيفية مميزة، ويمكن deconvolved المكدس امدا باستخدام خوارزمية خطي جبري unmixing إلى قeparate YFP وإشارات autofluorescent. وبالتالي، يمكن تحديد كمي دقيق جدا من مضان YFP حتى في الأنسجة مع مستويات عالية من تألق ذاتي.

الشكل 3. صورة مبائر الطيفي للمنطقة في الدماغ معربا عن nAChRs α4YFP. (أ) إسقاط اللون الحقيقي من كومة امدا من الصور للالعنان وسطي من الماوس α4YFP اتخذت مع مجهر نيكون C1si مبائر الطيفية. (ب) من مؤامرات أطياف من منطقة ذات أهمية، والذي يتضمن الخلايا العصبية التي تحتوي على α4YFP (الأخضر)، ومنطقة ذات الاهتمام خارج العنان وسطي (الحمراء).
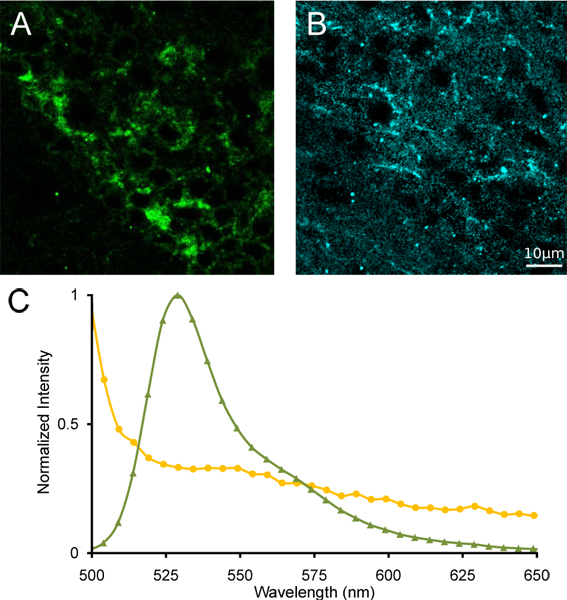
الشكل 4. unmixing الطيفية خطي من العنان وسطي. (A) صور من α4YFP غير مخلوط و (ب) بعد تألق ذاتي unmixing الطيفية خطي. (ج) إشارة أطياف YFP (الأخضر الثلاثيةزوايا)، وتألق ذاتي (الدوائر الصفراء) تستخدم لunmixing الطيفية.

الشكل 5. upregulation من α4 nAChRs في قرن آمون من α4YFP الضربة القاضية في الفئران التي تعرضت للنيكوتين المزمنة. (أ) مونتاج المغطى من مضان α4YFP من قرن آمون. في مجالين اختيار متقطع هي المواقع التقريبية على الطرف السفلي للمسار الثاقب من الحصين حيث تم إجراء تحليل لكل فأر. (ب) كانت α4YFP مضان أعلى بكثير في مسار الثاقب من الفئران التي تعرضت للنيكوتين مزمن من المياه المالحة مزمن (*، P = 0.001 رتبة يلكوكسون، اختبار المبلغ). النتائج تمثل المتوسط ± SEM من ن = 20 قياسات للفئران النيكوتين على حد سواء المالحة والمزمنة معاملة (5 لكل مجموعة الفئران المعالجة).

الشكل 6. أفضل دالتعبير epth من α4YFP بالمقارنة مع وضع العلامات الأجسام المضادة. وجهات النظر XZ متعامد من مضان α4YFP (A) والأضداد VGlut2 مع Cy5 كتسمية الثانوية (B). (C) المؤامرات التي تبدي مزيدا من شدة إشارة مضان تدهور خلال عمق لتلوين الأجسام المضادة (المربعات السوداء) بالمقارنة مع α4YFP (الدوائر المغلقة).
Discussion
استخدام مستقبلات فلوري في نموذج الفأر المغلوب في لتحديد كمية وتوطين قناة أيون معين يوفر عددا من المزايا. وعلى النقيض من البروتينات مثل الأكتين، وهو ما يعبر عنه بتواجد مطلق في جميع الخلايا، والقنوات الأيونية الموجودة في أعداد أقل بكثير، والتعبير عنها يختلف بين الأنواع الفرعية الخلايا ا...
Disclosures
ليس لدينا ما يكشف.
Acknowledgements
وأيد أنتوني Renda من قبل جامعة فيكتوريا جائزة زمالة دراسات عليا. وأيد هذا البحث من قبل العلوم الطبيعية والهندسة مجلس البحوث كندا اكتشاف غرانت، NARSAD جائزة الباحث الشاب (لRN)، ومؤسسة فيكتوريا - Myre وينيفرد سيم الصندوق، وهو مؤسسة الكندية للحصول على منحة للابتكار، والمعرفة كولومبيا البريطانية صندوق التنمية والعلوم الطبيعية والهندسة مجلس البحوث من أدوات البحث وكندا، والمنح والتهوية. نشكر جيليان مكاي، بارنز كريستينا، سوليفان ارييل ماكدونالد جينيفر ومورجادو دانيال لتربية الماوس ممتازة.
Materials
| اسم كاشف | شركة | فهرس العدد | تعليقات |
| مصغرة التناضحي مضخات | Alzet | موديل 2002 | |
| ملحي | Teknova | S5819 | |
| (-) طرطرات الهيدروجين النيكوتين ملح | سيغما | N5260 | |
| قطرات عين | شركة نوفارتيس | المسيل للدموع جل | |
| Vetbond الغراء | 3M | 1469SB | |
| هيبارين الصوديوم ملح | سيغما | H4784 | |
| 10X PBS | إينفيتروجن | 70011 | |
| الكيتامين | Wyetح صحة الحيوان | 0856-4403-01 | |
| medatomidine هيدروكلوريد | فايزر | 1950673 | |
| 23G فراشة إبرة | بيكتون ديكنسون | 367253 | |
| بارافورمالدهيد | علوم المجهر الإلكتروني | 15710 | |
| تضمين قالب من البلاستيك | VWR | 18986-1 | |
| أكتوبر مركب تركيب | الأنسجة تيك | 4583 | |
| Mowiol 4-88 | EMD-Calbiochem | 475904 | درجة الحموضة 8.5 |
References
- Perry, D. C., Davila-Garcia, M. I., Stockmeier, C. A., Kellar, K. J. Increased nicotinic receptors in brains from smokers: membrane binding and autoradiography studies. J. Pharmacol. Exp. Ther. 289, 1545-1552 (1999).
- Schwartz, R. D., Kellar, K. J. Nicotinic cholinergic receptor binding sites in the brain: regulation in vivo. Science. 220, 214-216 (1983).
- Marks, M. J., Burch, J. B., Collins, A. C. Effects of chronic nicotine infusion on tolerance development and nicotinic receptors. J. Pharmacol. Exp. Ther. 226, 817-8125 (1983).
- Carlezon, W. A. J., Nestler, E. J. Elevated levels of GluR1 in the midbrain: a trigger for sensitization to drugs of abuse. Trends Neurosci. 25, 610-615 (2002).
- Fitzgerald, L. W., Ortiz, J., Hamedani, A. G., Nestler, E. J. Drugs of abuse and stress increase the expression of GluR1 and NMDAR1 glutamate receptor subunits in the rat ventral tegmental area: common adaptations among cross-sensitizing agents. J. Neurosci. 16, 274-2782 (1996).
- Saal, D., Dong, Y., Bonci, A., Malenka, R. C. Drugs of abuse and stress trigger a common synaptic adaptation in dopamine neurons. Neuron. 37, 577-5782 (2003).
- Tsien, R. Y. The green fluorescent protein. Annu. Rev. Biochem. 67, 509-544 (1998).
- Chalfie, M., Tu, Y., Euskirchen, G., Ward, W. W., Prasher, D. C. Green fluorescent protein as a marker for gene expression. Science. 263, 802-805 (1994).
- Feng, G., Mellor, R. H., Bernstein, M., Keller-Peck, C., Nguyen, Q. T., Wallace, M. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Livet, J., Weissman, T. A., Kang, H., Draft, R. W., Lu, J., Bennis, R. A. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450, 56-62 (2007).
- Nashmi, R., Dickinson, M. E., McKinney, S., Jareb, M., Labarca, C., Fraser, S. E. Assembly of α4β2 nicotinic acetylcholine receptors assessed with functional fluorescently labeled subunits: effects of localization, trafficking, and nicotine-induced upregulation in clonal mammalian cells and in cultured midbrain neurons. J. Neurosci. 23, 11554-11567 (2003).
- Nashmi, R., Xiao, C., Deshpande, P., McKinney, S., Grady, S. R., Whiteaker, P. Chronic nicotine cell specifically upregulates functional α4* nicotinic receptors: basis for both tolerance in midbrain and enhanced long-term potentiation in perforant path. J. Neurosci. 27, 8202-8218 (2007).
- Dickinson, M. E., Bearman, G., Tilie, S., Lansford, R., Fraser, S. E. Multi-spectral imaging and linear unmixing add a whole new dimension to laser scanning fluorescence microscopy. BioTechniques. 31, 1272-1278 (2001).
- Nashmi, R., Fraser, S. E., Lester, H., Dickinson, M. E., Periasamy, A., Day, R. N. . Molecular imaging: fret microscopy and spectroscopy. , 180-192 (2005).
- Zimmermann, T., Rietdorf, J., Girod, A., Georget, V., Pepperkok, R. Spectral imaging and linear un-mixing enables improved FRET efficiency with a novel GFP2-YFP FRET pair. FEBS Lett. 531, 245-249 (2002).
- Larson, J. M. The Nikon C1si combines high spectral resolution, high sensitivity, and high acquisition speed. Cytometry A. 69, 825-8234 (2006).
- Melvin, N. R., Sutherland, R. J. Quantitative caveats of standard immunohistochemical procedures: implications for optical disector-based designs. J. Histochem. Cytochem. 58, 577-5784 (2010).
- Jones, I. W., Wonnacott, S. Why doesn't nicotinic ACh receptor immunoreactivity knock out. Trends Neurosci. 28, 343-345 (2005).
- Moser, N., Mechawar, N., Jones, I., Gochberg-Sarver, A., Orr-Urtreger, A., Plomann, M. Evaluating the suitability of nicotinic acetylcholine receptor antibodies for standard immunodetection procedures. J. Neurochem. , (2007).
- Whiteaker, P., Cooper, J. F., Salminen, O., Marks, M. J., McClure-Begley, T. D., Brown, R. W., Collins, A. C., Lindstrom, J. M. Immunolabeling demonstrates the interdependence of mouse brain a4 and b2 nicotinic acetylcholine receptor subunit expression. The Journal of Comparative Neurology. 499, 1016-1038 (2006).
- Marks, M. J., McClure-Begley, T. D., Whiteaker, P., Salminen, O., Brown, R. W. B., Cooper, J., Collins, A. C., Lindstrom, J. M. Increased nicotinic acetylcholine receptor protein underlies chronic nicotine-induced up-regulation of nicotinic agonist binding sites in mouse brain. The Journal of Pharmacology and Experimental Therapeutics. , 337-3187 (2011).
- Marks, M. J., Rowell, P. P., Cao, J. Z., Grady, S. R., McCallum, S. E., Collins, A. C. Subsets of acetylcholine-stimulated 86[Rb]+ efflux and 125[I]-epibatidine binding sites in C57BL/6 mouse brain are differentially affected by chronic nicotine treatment. Neuropharmacology. 46, 1141-1157 (2004).
- King, S. L., Caldarone, B. J., Picciotto, M. R. Beta2-subunit-containing nicotinic acetylcholine receptors are critical for dopamine-dependent locomotor activation following repeated nicotine administration. Neuropharmacology. 47, 132-139 (2004).
- Robinson, S. F., Marks, M. J., Collins, A. C. Inbred mouse strains vary in oral self-selection of nicotine. Psychopharmacology (Berl). 124, 332-339 (1996).
- Sparks, J. A., Pauly, J. R. Effects of continuous oral nicotine administration on brain nicotinic receptors and responsiveness to nicotine in C57Bl/6 mice. Psychopharmacology (Berl). , 141-145 (1999).
- Rahman, S., Zhang, J., Engleman, E. A., Corrigall, W. A. Neuroadaptive changes in the mesoaccumbens dopamine system after chronic nicotine self-administration: a microdialysis study. Neuroscience. 129, 415-4124 (2004).
- Picciotto, M. R., Zoli, M., Rimondini, R., Lena, C., Marubio, L. M., Pich, E. M. Acetylcholine receptors containing the β2 subunit are involved in the reinforcing properties of nicotine. Nature. 391, 173-177 (1998).
- Fowler, C. D., Lu, Q., Johnson, P. M., Marks, M. J., Kenny, P. J. Habenular α5 nicotinic receptor subunit signalling controls nicotine intake. Nature. 471, 597-601 (2011).
- Maskos, U., Molles, B. E., Pons, S., Besson, M., Guiard, B. P., Guilloux, J. P. Nicotine reinforcement and cognition restored by targeted expression of nicotinic receptors. Nature. 436, 103-107 (2005).
- Matta, S. G., Balfour, D. J., Benowitz, N. L., Boyd, R. T., Buccafusco, J. J., Caggiula, A. R., Craig, C. R., Collins, A. C., Damaj, M. I., Donny, E. C., Gardiner, P. S., Grady, S. R., Heberlein, U., Leonard, S. S. Guidelines on nicotine dose selection for in vivo research. Psychopharmacology. 190, 269-319 (2007).
- Lang, T., Rizzoli, S. O. Membrane protein clusters at nanoscale resolution: more than pretty pictures. Physiology (Bethesda). 25, 116-1124 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved